烟草氧化胁迫相关基因NtOSA1的克隆表达及亚细胞定位分析
2016-10-14刘继恺高永峰吴婵娟陈彩霞
刘继恺,高永峰,吴婵娟,张 林,陈彩霞
(1 西南科技大学 生命科学与工程学院,四川绵阳 621010;2 西南科技大学 核废物与环境安全国防重点实验室,四川绵阳 621010)
烟草氧化胁迫相关基因NtOSA1的克隆表达及亚细胞定位分析
刘继恺1, 2,高永峰1,吴婵娟1, 2,张 林1,陈彩霞1
(1 西南科技大学 生命科学与工程学院,四川绵阳 621010;2 西南科技大学 核废物与环境安全国防重点实验室,四川绵阳 621010)
植物类蛋白激酶Abc1家族(activity of bc1 complex)在植物生长发育及响应非生物胁迫中起着重要的作用。该研究通过将拟南芥AtOSA1蛋白氨基酸序列与烟草转录组数据进行比对,利用巢式PCR技术克隆得到1个烟草氧化胁迫相关Abc1家族基因NtOSA1,NtOSA1与拟南芥AtOSA1基因具有72.89%的一致性。NtOSA1基因开放阅读框长度为2 283 bp,编码760个氨基酸,含有典型的ABC1结构域、一个激酶结构域、叶绿体定位信号肽和两个跨膜结构域。采用实时荧光定量PCR技术,对NtOSA1基因在烟草不同组织以及氧化胁迫、盐胁迫等处理下的表达分析表明:NtOSA1基因的表达具有组织特异性,主要在叶片中表达;NtOSA1基因在H2O2和NaCl处理后表达量上升,均在处理后6 h达到最大值,分别为处理前的1.95和2.69倍。亚细胞定位结果表明,NtOSA1蛋白定位在细胞叶绿体上,与预测结果一致。研究表明,NtOSA1基因参与了烟草抗氧化胁迫和盐胁迫的响应。
烟草;氧化胁迫相关Abc1基因;基因克隆;表达特性;亚细胞定位
植物在生长发育过程中不可避免会遭遇到各种逆境胁迫,如高温、低温、干旱、重金属和盐碱等。这些逆境胁迫会使植物氧化还原代谢失衡,导致体内积累大量的活性氧,从而产生氧化胁迫。过量的活性氧能与脂质、蛋白质、DNA以及其他生物大分子发生反应,从而造成机体损伤甚至死亡[1]。
生物体内存在多种参与氧化胁迫响应的蛋白家族,比如Abc1家族,该家族是一类庞大的具有多种生物学功能的蛋白家族,广泛存在于原核和真核生物中,这类蛋白具有高度保守的ABC1结构域和蛋白激酶结构域[2]。在原核和真核生物线粒体中,Abc1-like蛋白是辅酶Q合成的重要调控因子,参与到呼吸链的电子传递和抗氧化过程[3-8]。酵母COQ8是第一个被鉴定的Abc1基因,其编码蛋白具有类分子伴侣活性,能够抑制细胞色素b mRNA翻译的缺陷以及维持线粒体呼吸链中bc1复合体的活性[9-10]。
和酵母相比,植物的Abc1-like蛋白具有更多样的功能[11-13]。拟南芥(Arabidopsisthaliana)基因组中有17个基因含有典型的ABC1结构域。第一个被研究的是ABC1At基因,该基因在拟南芥各个组织中组成型表达,其编码的线粒体蛋白与酵母ABC1蛋白有45%的相似性,且具有酵母ABC1蛋白相似的功能[14]。另外一个Abc1蛋白,AtOSA1(oxidative stress-related Abc1-like protein)虽然也和酵母ABC1具有45%的相似性,但是该蛋白定位于细胞叶绿体中,功能互补实验显示,AtOSA1蛋白不能恢复酵母abc1突变体呼吸链的活性。半定量RT-PCR结果显示,AtOSA1基因的表达受到CdCl2、H2O2和高强度光的诱导[11]。Yang等的研究显示,AtACDO1蛋白(ABC1-like kinase related to chlorophyll degradation and oxidative stress)定位于叶绿体中,在光氧化胁迫耐受和叶绿素降解过程中发挥作用[13]。拟南芥ABC1K1和ABC1K3蛋白也定位于叶绿体质体球,调控质体球异戊二烯基-脂代谢过程,在植物逆境应答和叶绿体形态建成中发挥着重要作用[15-16]。AtSIA1(salt-induced ABC1 kinase 1)与AtOSA1具有46%的相似性,同样定位于细胞叶绿体中,表型分析证明,AtSIA1和AtOSA1能够影响叶绿体中Fe的分布,调控对活性氧的产生和氧化胁迫的应答[17]。此外,王彩香等[18]克隆了一个小麦(Triticumaestivum)类ABC1基因TaABC1L,并发现该基因能够被渗透、高盐、低温胁迫以及ABA处理诱导。高清松等[19]研究发现,水稻(Oryzasativa)ABC1基因主要在叶片中表达,并且受多种非生物胁迫因素包括H2O2、ABA、低温以及高盐等的调控。
烟草(Nicotianatabacum)是分子生物学和基因工程研究的模式植物,是最有价值的科研生物材料之一。烟草抗逆胁迫应答过程中相关基因的克隆及功能的揭示一直是研究的热点,但目前关于烟草Abc1蛋白家族的功能研究还未见报道。本研究首次从烟草中克隆到了OSA1的同源基因NtOSA1,对其序列特征、组织表达特性、亚细胞定位及各种非生物胁迫响应进行了研究,为全面解析NtOSA1基因在烟草氧化胁迫和盐胁迫应答中的生物学功能提供了重要参考。
1 材料和方法
1.1 烟草材料
供试植物材料为烟草‘NC89’,实验室常规种植。
1.2 方 法
1.2.1 烟草NtOSA1基因克隆 用拟南芥AtOSA1蛋白的氨基酸序列在SGN网站(http://solgenomics.wur.nl/)进行序列比对(数据库为烟草SGN mRNA序列,程序为蛋白序列对核苷酸序列)。根据比对出的两条EST序列,SGN-E1015449和SGN-E1113121,设计外侧引物NtOSA1-F1(5′-TTCCCTTGCATGCACATACA-3′)和NtOSA1-R1(5′-TGATCTCCCAGGGTAACCAT-3′);含有SmaI和SalI酶切位点的内侧引物NtOSA1-F2(5′-CCCGGGATGGCGAGTATTTCAGCTAC-3′)和NtOSA1-R2(5′-GTCGACAGCTGTTCCTGTGATCA -3′)。提取烟草幼苗叶片总RNA,以反转录获得的cDNA第一链为模板,NtOSA1-F1和NtOSA1-R1为引物,用高保真酶PrimeSTAR HS(TaKaRa公司)进行第一轮PCR扩增。将第一轮PCR产物稀释100倍,以稀释后的DNA为模板,NtOSA1-F2和NtOSA1-R2为引物进行第二轮PCR扩增。将第二轮PCR产物回收纯化后连接至pEASY-Blunt载体(北京全式金生物公司),转化大肠杆菌(Escherchiacoli)DH5α。以大肠杆菌单克隆为模板,NtOSA1-F2和NtOSA1-R2为引物,进行菌落PCR检测,将阳性克隆送华大基因科技股份有限公司测序。
1.2.2 烟草NtOSA1基因的生物信息学分析 利用DNAMAN v6软件分析测序结果,确定NtOSA1基因的开放阅读框(ORF)序列并推导相应的氨基酸序列。利用在线软件InterPro(http://www.ebi.ac.uk/interpro/)和TMpred(http://www.ch.embnet.org/software/TMPRED_form.html)分别预测NtOSA1蛋白的功能保守结构域和跨膜结构域;利用在线软件ProtParam分析NtOSA1的氨基酸组成、分子量、等电点等理化性质;利用在线软件TargetP 1.1 Server预测NtOSA1蛋白的亚细胞定位。通过ClustalW和MEGA6.0软件相结合对32个Abc1蛋白序列进行序列比对并构建系统进化树,使用Bootstrap test检验(重复值为1 000)进化树的可靠性。
1.2.3 烟草NtOSA1基因在不同部位表达量定量检测 将野生型烟草种子播种到土里,置于光照培养室培养。培养条件为:温度25 ℃,湿度60%~70%,16 h光照/8 h黑暗。
设计NtOSA1基因qRT-PCR引物NtOSA1 rt-F(5′-TGTTCTGGTGCCTACTGGTGAC -3′)和NtOSA1rt-R(5′-AAGTTCTGCTTGTGCCATTTC-3′),以烟草NtRL2(GenBank登录号Z14081)为内参基因,引物为 NtRL2 rt-F(5′-GTAAGGGAGCGGGTTCAGTCT-3′)和NtRL2 rt-R(5′-AACGGA GCACCCCTACCTG -3′)。按照Trizol(Thermo公司)试剂盒说明书操作,分别提取野生型烟草根、茎、叶片、花和种子的总RNA,经反转录获得cDNA第一链。按RealMasterMix(天根生化科技有限公司)试剂盒说明书,在CFX96Real-Time System(Bio-Rad公司)进行qRT-PCR扩增,程序为:95 ℃预变性3 min,95 ℃变性10 s,60 ℃退火30 s,40个循环,65 ℃延伸5 s,然后以每秒0.5 ℃升至95 ℃,61个循环。数据采用2-ΔΔCt法计算。
1.2.4 烟草的胁迫处理及NtOSA1基因的表达量检测 参照Lee[20]等的方法,将烟草播种于1/2 MS固体培养基[21]上,生长2周,选取长势良好,大小一致的幼苗分别转入含10 mmol/L H2O2和200 mmol/L NaCl的1/2 MS液体培养基中,在处理的0、3、6和12 h取幼苗样品,液氮速冻后置于-80 ℃储存备用。
参照Hermand等[22]的方法,将烟草播种于定植泡沫中,用1/2 Hoagland[23]营养液培养烟草,生长30 d后,选取长势良好,大小一致的幼苗连同定植泡沫转入分别含0、30、60和100 μmol/L CdCl2的新鲜1/2 Hoagland营养液中,在处理的48 h取幼苗叶片,液氮速冻后置于-80 ℃储存备用。
提取以上处理材料的总RNA,经反转录得到cDNA第一链,以NtOSA1rt-F和NtOSA1rt-R,NtRL2 rt-F和NtRL2 rt-R为引物,按照RealMasterMix(天根生化科技有限公司)试剂盒说明书,在CFX96Real-Time System(Bio-Rad公司)进行qRT-PCR,分析NtOSA1基因的相对表达量。扩增程序为:95 ℃预变性3 min,95 ℃变性10 s,60 ℃退火30 s,40个循环,65 ℃延伸5 s,然后以每秒0.5 ℃升至95 ℃,61个循环。数据采用2-ΔΔCt法计算,DPS v7.05进行显著性分析。
1.2.5 融合表达载体的构建、烟草原生质体转化及荧光显微镜观察 原生质体转化载体pTEX-GFP含有氨苄青霉素筛选标记、CaMV35S启动子、多克隆位点和GFP基因编码区序列。
用SmaI和SalI(Thermo公司)同时双酶切测序正确的NtOSA1基因片段和pTEX-GFP载体,将完整的NtOSA1基因编码区插入到pTEX-GFP载体的多克隆位点,使NtOSA1和GFP基因融合表达,将连接产物转化大肠杆菌DH5α。以大肠杆菌单克隆为模板,NtOSA1-F2和NtOSA1-R2为引物,进行菌落PCR检测,将阳性克隆送华大基因科技股份有限公司测序。
以本生烟草(Nicotianabenthamiana)为实验材料,参照Yoo等[24]的方法制备烟草原生质体,将酶解条件改为黑暗酶解4 h。将构建好的融合表达载体pTEX-NtOSA1-GFP通过PEG介导法转化到本生烟草原生质体中,室温下(20~25)℃黑暗诱导24~48 h。利用激光扫描共聚焦荧光显微镜(卡尔蔡司公司,型号LSM710),观察NtOSA1-GFP融合蛋白的亚细胞定位情况。设定参数:GFP蛋白的激发光为488 nm,吸收光为500~525 nm;叶绿体的激发光为633 nm,吸收光为650~720 nm。

粗体表示叶绿体定位信号肽;下划线表示ABC1结构域;粗斜体表示跨膜结构域;*表示终止密码子图1 NtOSA1的cDNA序列及其推导的氨基酸序列Chloroplast targeting pre-sequences are presented in bold; Underline represents the ABC1 conserved domain; Putative trans-membrane spans are presented in bold italic; *Stop codonFig. 1 cDNA and deduced amino acid sequences of NtOSA1
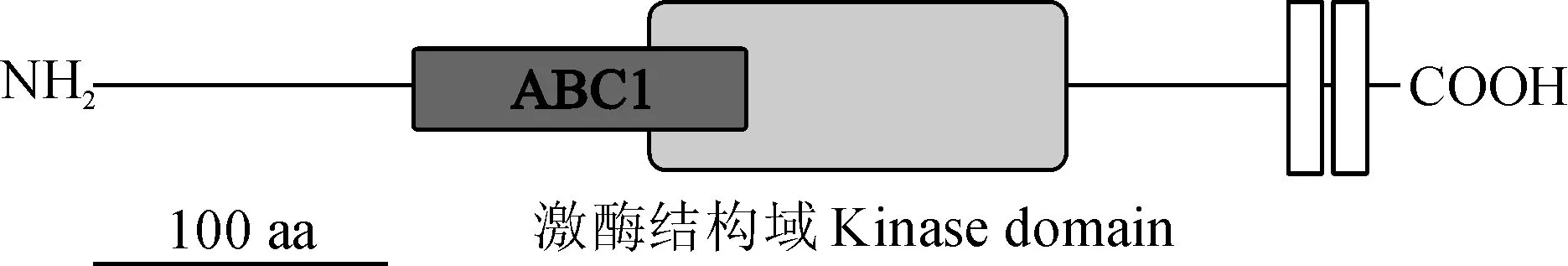
深灰色框代表ABC1结构域;浅灰色框代表激酶结构域;白色框代表跨膜结构域图2 烟草NtOSA1蛋白质结构示意图Dark gray box, ABC domain; Light gray box, kinase domain; White barrels, predicted transmembrane domainsFig. 2 Schematic representation of the NtOSA1 protein
2 结果与分析
2.1 烟草NtOSA1基因克隆及序列分析
测序结果显示,获得的片段与拟南芥AtOSA1基因核苷酸序列具有高度的一致性(72.89%),因此命名为NtOSA1(GenBank登录号KU565475)。NtOSA1基因的开放阅读框长度为2 283 bp,编码760个氨基酸。
为了解NtOSA1蛋白的生物学活性及潜在功能,利用在线软件分别对NtOSA1蛋白的理化性质和结构域进行分析和预测,结果显示:NtOSA1蛋白分子量为86.07 kD,理论等电点为8.92;在氨基酸序列的277~397具有ABC1结构域,在364~502具有激酶结构域,NtOSA1蛋白C端具有2个跨膜结构,分别位于氨基酸序列的703~721和726~743(图1、2)。将拟南芥、水稻、酵母和集胞藻4个物种的典型Abc1蛋白与NtOSA1蛋白进行序列比对,发现NtOSA1具有典型的ABC1保守结构域(图3),表明NtOSA1属于Abc1家族。

AtOSA1(At5g64940)和AtABC1(At4g01660)来自拟南芥;OsABC1(Os02g0575500)来自水稻;SynABC1(P73627)来自集胞藻;ScCOQ8(EWH18611.1)来自酵母图3 烟草NtOSA1与其他物种ABC1结构域比对AtOSA1(At5g64940)and AtABC1(At4g01660)are from Arabidopsis thaliana;OsABC1(Os02g0575500)is from Oryza sativa;SynABC1(P73627)is from Synechocystis;ScCOQ8(EWH18611.1)is from Saccharomyces cerevisiaeFig. 3 Comparison of ABC1 domain alignments among NtOSA1 and other species

节点上的数值表示Bootstrap重复1 000次的置信度图4 烟草NtOSA1与其它Abc1蛋白的系统进化树Values at nodes show the confidence level of Bootstrap replication 1 000Fig. 4 Phylogenetic tree of the alignment of NtOSA1 deduced amino acid sequence with other Abc1 proteins
2.2 烟草NtOSA1基因系统发育树构建
选取酵母、拟南芥、水稻、玉米、集胞藻等12个物种的32个Abc1蛋白序列进行多重比对,构建进化树,结果(图4)显示,NtOSA1蛋白与拟南芥AtOSA1蛋白的亲缘关系最近,一致性为76.04%;与玉米ADB13188蛋白的一致性为74.15%;与水稻Os02g0575500的一致性为73.45%。表明,NtOSA1与拟南芥、玉米和水稻的亲缘关系相对较近,而与第一个被鉴定的Abc1蛋白、酵母ScCOQ8、以及拟南芥AtABC1和人类HsCABC1的亲缘关系较远(图4)。
2.3 烟草NtOSA1基因的组织表达
利用qRT-PCR检测NtOSA1基因在烟草不同组织中的表达情况。结果显示(图5),NtOSA1基因主要在烟草叶片中表达(相对表达量是根中的137.83倍),在花中有少量表达(相对表达量是根中的10.75倍),而在根、茎和种子中的表达量很低,几乎检测不到。表明,NtOSA1基因具有组织特异表达的特征。
2.4 不同胁迫条件下烟草NtOSA1基因的表达
采用qRT-PCR检测NtOSA1基因在10 mmol/L H2O2和200 mmol/L NaCl处理后不同时间点的烟草幼苗中的表达量变化,结果显示(图6,Ⅰ),NtOSA1基因在H2O2和NaCl处理前期表达量上升,均在处理后6 h达到最大值,分别为处理前的1.95和2.69倍。在H2O2处理后12 h,NtOSA1基因表达量受到部分抑制,为处理前的0.6倍,在NaCl处理后12 h,NtOSA1基因表达量恢复到
处理前水平。
用不同质量浓度的CdCl2处理烟草水培苗,qRT-PCR结果显示(图6,Ⅱ),NtOSA1基因的表达量在不同质量浓度CdCl2处理下没有显著性差异,暗示该基因可能并不参与烟草植株体内CdCl2的应答。
2.5 烟草NtOSA1蛋白的亚细胞定位
TargetP 1.1 Server软件预测结果显示,NtOSA1蛋白N端含有一个46个氨基酸的叶绿体定位信号肽(图1),预测该蛋白定位于细胞叶绿体中,可靠性等级为1,为最高等级。用激光扫描共聚焦荧光显微镜检测NtOSA1蛋白的亚细胞定位,结果显示,NtOSA1定位于细胞叶绿体中(图7),与软件预测结果符合。

图5 烟草NtOSA1基因在不同组织中的表达Fig. 5 Expression profiles of NtOSA1 gene in different tissues of tobacco
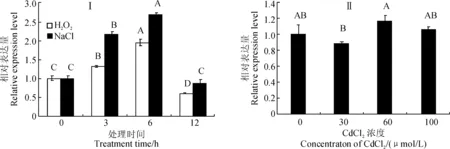
不同大写字母表示同一处理不同时间点(浓度)的显著性差异(P<0.01,LSD检验)图6 烟草NtOSA1基因对H2O2,NaCl(Ⅰ)和CdCl2(Ⅱ)的响应Different capital letters refer to significant differences among different time points(cencentration) of the same treatment (P<0.01, LSD test)Fig. 6 Expression analysis of NtOSA1 gene in response to H2O2, NaCl (Ⅰ) and CdCl2 (Ⅱ) treatment
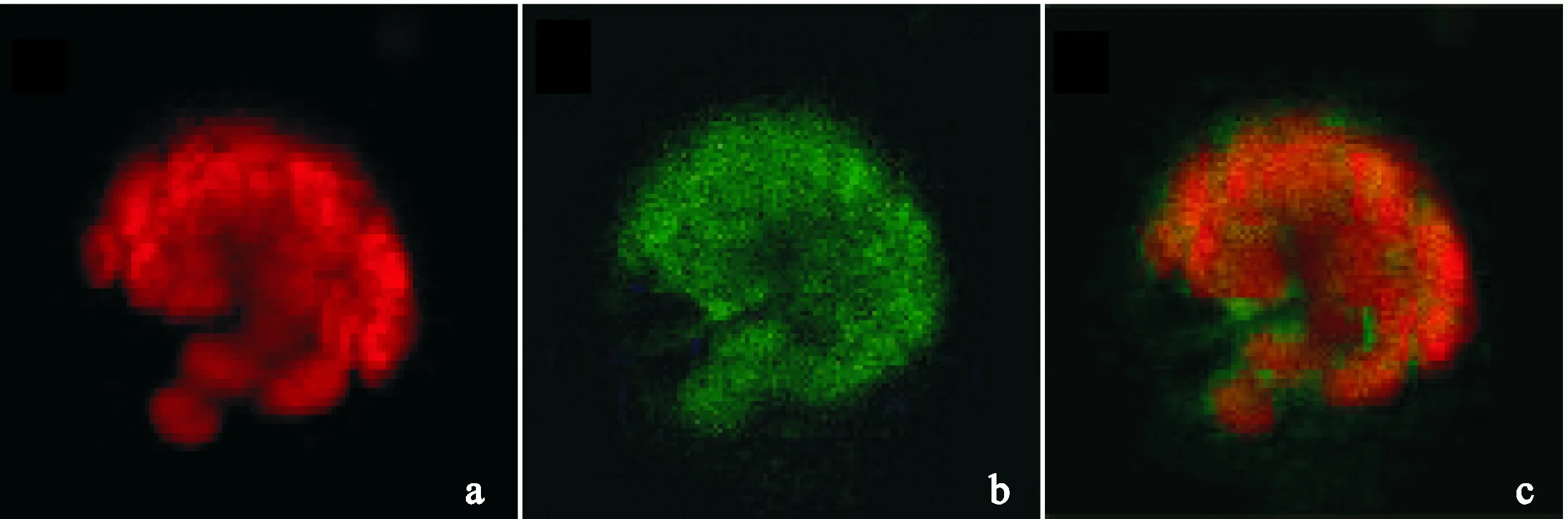
a. 叶绿体自发荧光;b. NtOSA1-GFP蛋白荧光;c. 合并图图7 NtOSA1-GFP蛋白在烟草原生质体中的荧光显微观察a. The fluorescence of chlorophyll; b. The fluorescence of NtOSA1-GFP; c. Merged imageFig. 7 Fluorescence microscope observation of NtOSA1-GFP proteins in tobacco mesophyll protoplasts
3 讨 论
Abc1家族在进化过程中演化成了两种独立的类型:一种存在于蓝藻细菌和叶绿体,比如拟南芥AtOSA1蛋白,另一种存在于线粒体,比如酵母ScCOQ8[17]。本研究克隆得到的NtOSA1基因与拟南芥AtOSA1基因同源性极高,其编码蛋白具有典型的ABC1保守结构域和激酶结构域。序列比对和系统进化树分析显示,NtOSA1与来自于拟南芥、水稻和玉米等植物的Abc1蛋白亲缘关系较近,而与酵母ScCOQ8亲缘关系较远。亚细胞定位结果显示,NtOSA1蛋白定位于烟草原生质体细胞的叶绿体中,这与AtOSA1蛋白的定位结果一致。这些结果表明,烟草NtOSA1是Abc1家族的同源基因,其编码蛋白属于Abc1家族的第一种类型,可能与AtOSA1蛋白具有相似的功能。
研究显示,AtOSA1基因主要在拟南芥的叶片中表达,其次为花中,在茎中有少量表达,在根中的表达量非常低[11]。此外,水稻ABC1基因也主要在叶片中表达[19]。本研究中,组织表达分析表明,NtOSA1基因在烟草不同组织中的表达量具有明显差异,主要在叶片中表达,其次为花、根、茎和种子,为组织特异性表达,这与拟南芥AtOSA1基因和水稻ABC1基因的表达模式相一致。由于花组织中含有绿色的萼片,并且NtOSA1蛋白定位于细胞的叶绿体中,这些结果暗示,NtOSA1基因主要在绿色组织中表达。随着基因工程技术的迅猛发展和日趋成熟,对于能够驱动外源片段在特异组织表达的启动子的需求越来越大。烟草NtOSA1基因的组织表达结果暗示,该基因的启动子是一种绿色组织特异表达启动子,因此下一步对NtOSA1基因启动子的克隆及功能研究,将会为组织特异性启动子的开发和利用提供重要的遗传资源和数据支撑。
之前的研究表明,拟南芥AtOSA1基因的表达量受到CdCl2的调控,而本研究发现,烟草NtOSA1基因的表达量在不同质量浓度CdCl2处理下没有显著差异,表明OSA1基因在不同物种中基因表达调控方式存在差异。拟南芥AtOSA1基因的突变能够导致植株对氧化胁迫的敏感度增加,本研究发现烟草NtOSA1基因在H2O2和NaCl处理后表达量上升,均在处理后6 h达到最大值,这一结果也与小麦和水稻ABC1基因的表达调控特性相一致。以上结果暗示,NtOSA1基因参与了烟草氧化胁迫和盐胁迫的应答反应,这为今后阐明烟草NtOSA1基因的生物学功能,以及通过基因工程的方法提高烟草抗逆性提供了理论基础。
[1] 赵中秋, 席梅竹. Cd对植物的氧化胁迫机理研究进展[J]. 农业环境科学学报, 2007, 26(增刊): 47-51.
ZHAO Z Q, XI M Z. Advances in research on mechanisms of Cd-induced oxidative stress in plants[J].JournalofAgro-EnvironmentScience, 2007, 26(S1): 47-51.
[2] LEONARD C J, ARAVIND L, KOONIN E V. Novel families of putative protein kinases in bacteria and archaea: evolution of the “eukaryotic” protein kinase superfamily[J].GenomeResearch, 1998, 8: 1 038-1 047.
[3] ERNSTER L, FORSMARK-ANDREE P. Ubiquinol: an endogenous antioxidant in aerobic organisms[J].ClinicalInvestigation, 1993, 71: S60-S65.
[4] MACINGA D R, COOK G M, POOLE R K,etal. Identification and characterization of aarF, a locus required for production of ubiquinone inProvidenciastuartiiandEscherichiacoliand for expression of 2’-N-acetyltransferase inP.Stuartii[J].JournalofBacteriology, 1998, 180: 128-135.
[5] POON W W, DAVIS D E, HA H T,etal. Identification ofEscherichiacoliubiB, a gene required for the first monooxygenase step in ubiquinone biosynthesis[J].JournalofBacteriology, 2000, 182: 5 139-5 146.
[6] DO T Q, HSU A Y, JONASSEN T,etal. A defect in coenzyme Q biosynthesis is responsible for the respiratory deficiency inSaccharomycescerevisiaeabc1 mutants[J].JournalofBiologicalChemistry, 2001, 276: 18 161-18 168.
[7] IIIZUMI M, ARAKAWA H, MORI T,etal. Isolation of a novel gene,CABC1, encoding a mitochondrial protein that is highly homologous to yeast activity of bc1 complex[J].CancerResearch, 2002, 62: 1 246-1 250.
[8] MOLLET J, DELAHODDE A, SERRE V,etal.CABC1 gene mutations cause ubiquinone deficiency with cerebellar ataxia and seizures[J].AmericanJournalofHumanGenetics, 2008, 82: 623-630.
[9] BOUSQUET I, DUJARDIN G, SLONIMSKI P P.ABC1, a novel yeast nuclear gene has a dual function in mitochondria: it suppresses a cytochrome b mRNA translation defect and is essential for the electron transfer in the bc1 complex[J].EMBOJournal, 1991, 10: 2 023-2 031.
[10] BRASSEUR G, TRON G, DUJARDIN G,etal. The nuclearABC1 gene is essential for the correct conformation and functioning of the cytochrome bc1 complex and the neighbouring complexes II and IV in the mitochondrial respiratory chain[J].EuropeanJournalofBiochemistry, 1997, 15: 103-111.
[11] JASINSKI M, SUDRE D, SCHANSKER G,etal. AtOSA1, a member of the Abc1-Like family, as a new factor in cadmium and oxidative stress response[J].PlantPhysiology, 2008, 147: 719-731.
[12] GAO Q S, YANG Z F, ZHOU Y,etal. Characterization of an Abc1 kinase family geneOsABC1-2 conferring enhanced tolerance to dark-induced stress in rice[J].Gene, 2012, 498: 155-163.
[13] YANG S, ZHANG Q, LI T,etal. AtSIA1, an ABC1-like kinase, regulates salt response inArabidopsis[J].Biologia, 2012, 67: 1 107-1 111.
[14] CARDAZZO B, HAMEL P, SAKAMOTO W,etal. Isolation of anArabidopsisthalianacDNA by complementation of a yeastabc1 deletion mutant deficient in complex III respiratory activity[J].Gene, 1998, 221: 117-125.
[15] LUNDQUIST P K, POLIAKOV A, GIACOMELLI L,etal. Loss of plastoglobule kinases ABC1K1 and ABC1K3 causes conditional degreening, modified prenyl-lipids, and recruitment of the jasmonic acid pathway[J].PlantCell, 2013, 25: 1 818-1 839.
[16] MARTINIS J, GLAUSER G, VALIMAREANU S,etal. A chloroplast ABC1-like kinase regulates vitamin E metabolism inArabidopsis[J].PlantPhysiology, 2013, 162: 652-662.
[17] MANARA A, DALCORSO G, LEISTER D,etal. AtSIA1 AND AtOSA1: two Abc1 proteins involved in oxidative stress responses and iron distribution within chloroplasts[J].NewPhytologist, 2014, 2: 452-465.
[18] 王彩香, 景蕊莲, 毛新国, 等. 小麦TaABC1L的克隆及表达特性分析[J]. 作物学报, 2007, 33(6): 878-884.
WANG C X, JING R L, MAO X G,etal. Cloning and expression analysis of a new stress-responsive geneTaABC1Lin wheat[J].ActaAgronomicaSinica, 2007, 33(6): 878-884
[19] 高清松, 张 丹, 徐 亮, 等. 水稻ABC1基因家族的鉴定及在非生物胁迫下的表达分析[J]. 中国水稻科学, 2011, 25(1): 1-10.
GAO Q S, ZHANG D, XU L,etal. Systematic identification of riceABC1 genes and their expression analysis under abiotic stresses[J].ChineseJournalofRiceScience, 2011, 25(1): 1-10.
[20] LEE S S, PARK H J, JUNG W Y,etal. OsaCYP21-4, a novel Golgi-resident cyclophilin, increase oxidative stress tolerance in rice[J].FrontiersinPlantScience, 2015, 6: 797.
[21] MURASHIGE T,SKOOG F. A revised medium for rapid growth and bioassays with tobacco tissue cultures[J].PhysiologiaPlantarum, 1962, 15(3): 473-497.
[22] HERMAND V, JULIO E, DORLHAC DE BORNE F,etal. Inactivation of two newly identified tobacco heavy metal ATPases leads to reduced Zn and Cd accumulation in shoots and reduced pollen germination[J].Metallomics, 2014, 6(8): 1 427-1 440.
[23] HOAGLAND D R, ARNON D I. The water-culture method for growing plants without soil[J].GalifoniaAgriculturalExperimentStationCirular, 1950, 347: 1-32.
[24] YOO S D, CHO Y H, SHEEN J.Arabidopsismesophyll protoplasts: a versatile cell system for transient gene expression analysis[J].NatureProtocols, 2007, 2: 1 565-1 575.
(编辑:宋亚珍)
Cloning, Expression Characterization and Subcellular Localization ofNtOSA1 Gene fromNicotianatabacum
LIU Jikai1, 2, GAO Yongfeng1, WU Chanjuan1, 2, ZHANG Lin1, CHEN Caixia1
(1 School of Life Science and Engineering, Southwest University of Science and Technology, Mianyang, Sichuan 621010, China; 2 Fundamental Science on Nuclear Wastes and Environmental Safety Laboratory, Southwest University of Science and Technology, Mianyang, Sichuan 621010,China)
Members of the activity of bc1 complex (Abc1) family are protein kinases that are functionally diverse proteins with multiple roles in the regulation of plant growth and development and abiotic stress tolerance. According to the amino acid sequence of AtOSA1 and the transcriptome data ofNicotianatabacum, a Abc1 like gene was isolated and designated asNtOSA1, as for the high identity with theAtOSA1 (Arabidopsisthalianaoxidative stress-related Abc1-like protein). The open reading frame (ORF) of theNtOSA1 gene is 2 283 bp which encoded a deduced protein including 760 amino acid residues. The protein sequence of NtOSA1 possesses a conserved ABC1 domain, one kinase domain, one chloroplast localization signal peptide and two transmembrane spans. The relative expression ofNtOSA1 was determined by quantitative real-time PCR (qRT-PCR). The results showed thatNtOSA1 gene was expressed particularly in leaves, but also in flowers. After treatment of H2O2and NaCl for 6 h, the expression ofNtOSA1 increased to the maximum, which was 1.95 and 2.69 folds of the control, respectively. When fused to green fluorescent protein (GFP), NtOSA1 localized to the chloroplast in tobacco protoplasts, which was consistent with the prediction results of the software TargetP 1.1 Server. These results suggested thatNtOSA1 may be involved in response to oxidative and salt stress in tobacco.
Nicotianatabacum;oxidative stress-related abc1-like protein;gene clone;expression characterization;subcellular localization
1000-4025(2016)08-1499-08
10.7606/j.issn.1000-4025.2016.08.1499
2016-04-27;修改稿收到日期:2016-06-15
国家自然科学基金(31500205);西南科技大学博士研究基金(14zx7153);西南科技大学校长机动费特殊资助(14zx1104);四川省生物质资源利用与改性工程中心项目(13zxsk02)
刘继恺(1983-),女,博士,讲师,主要从事植物分子生物学研究。E-mail:kateryan@163.com
Q785;Q786
A
