香鱼精氨酸酶II基因的cDNA克隆及其表达与鳗弧菌感染的相关性
2016-10-13丁斐斐李长红陈炯张琪
丁斐斐 李长红 陈炯 张琪
(宁波大学海洋学院 生物化学与分子生物学实验室,宁波 315211)
香鱼精氨酸酶II基因的cDNA克隆及其表达与鳗弧菌感染的相关性
丁斐斐 李长红 陈炯 张琪
(宁波大学海洋学院 生物化学与分子生物学实验室,宁波 315211)
精氨酸酶II(arginase II,Arg-II)是精氨酸酶的一种,不仅可以参与机体尿素循环,还与机体病理过程密切相关。通过香鱼(Plecoglossus altivelis)单核/巨噬细胞转录组测序获得香鱼Arg-II基因全长cDNA序列,结果表明,Arg-II基因由4 707个核苷酸组成,包含一个大的开放阅读框,编码348个氨基酸,预测分子量为38.09 kD,等电点为6.15。氨基酸序列多重比对结果显示,香鱼Arg-Ⅱ具有典型的Arg-Ⅱ结构特征,与虹鳟(Oncorhynchus mykiss)Arg-Ⅱ同源性最高,为85.3%;系统进化树分析表明,鱼类Arg-Ⅱ形成一个大簇,香鱼Arg-Ⅱ与虹鳟Arg-Ⅱ进行相关性最高。实时荧光定量PCR(quantitive real-time PCR,qRTPCR)结果显示,香鱼Arg-Ⅱ基因mRNA主要在健康香鱼肝、脑、头肾和单核/巨噬细胞中表达;鳗弧菌(Vibrio anguillarum)感染后,香鱼肝、脑、头肾和单核/巨噬细胞Arg-Ⅱ基因mRNA的表达量显著上调。综上,香鱼Arg-Ⅱ基因的表达与鳗弧菌感染紧密相关,揭示其可能在鱼类抗感染免疫应答中发挥重要作用。
香鱼;精氨酸酶II;鳗弧菌;单核/巨噬细胞;表达
精氨酸酶(arginase)是在细菌、酵母、植物、无脊椎动物和脊椎动物中普遍存在的酶。在植物和排氨动物中精氨酸酶位于线粒体,而在排尿素动物中,精氨酸酶位于细胞质。细胞质和线粒体中的精氨酸酶是同功酶,由不同的基因精氨酸酶I(arginase I,Arg-I)和精氨酸酶II(arginase II,Arg-II)编码[1]。Arg-I和Arg-II的基本功能是在机体尿素循环中将L-精氨酸水解成L-鸟氨酸和尿素,但二者在免疫系统中也有表达,并且在哺乳动物免疫系统中起着关键作用,参与炎症反应的各个阶段[2]。在巨噬细胞中,Arg-I和诱导型一氧化氮合成酶(inducible nitric oxide synthase,iNOS)参与L-精氨酸/NO代谢,分别与M1和M2型巨噬细胞表型有关,被广泛用作鉴定M1和M2型巨噬细胞的分子标记[3]。与Arg-I相比,Arg-II在巨噬细胞炎症应答中的功能相关的研究报道很少,普遍认为它具有与Arg-II相同的功能。然而,越来越多的证据表明,Arg-I和Arg-II在巨噬细胞功能调节中具有不同的作用。例如,在小鼠中,LPS可诱导巨噬细胞Arg-II mRNA的表达,但不能诱导Arg-I mRNA的表达[1]。
目前,Arg-I和Arg-II基因在虹鳟(Oncorhynchus mykiss)[4,5]和鲤鱼(Cyprinus carpio)[6]等少数硬骨鱼类中被克隆和鉴定。在虹鳟中,虹鳟幼鱼绝食6周后,肝组织精氨酸酶活性明显增加,并且Arg-II基因mRNA的表达量也明显增加,但Arg-I基因mRNA的表达量无明显变化,因此,肝组织Arg-II基因mRNA的表达量增加可能导致精氨酸酶活性增加[4];而且两个虹鳟品系感染脑粘体虫(Myxobolus cerebralis)后,T和H品系分别在感染后2 h 和8 d时Arg-II基因mRNA的表达量均显著上调[5];在鲤鱼中,环腺苷酸(cyclic adenosine mono phosphate,cAMP)刺激后头肾来源巨噬细胞中的精氨酸酶活性显著增加,而且cAMP刺激能诱导Arg-II基因mRNA的表达,但Arg-I基因mRNA的表达也不受影响[6],揭示鱼类Arg-II可能具有与哺乳动物Arg-II相似的功能。
香鱼(Plecoglossus altivelis)是东亚地区中国、日本和朝鲜等国特有的一种小型名贵经济鱼类。它体色美、味清香、肉质细腻,在国际上被誉为“淡水鱼之王”,深受消费者青睐。近年来,由于捕捞强度增大、水利设施建设以及环境污染日益严重等原因,野生香鱼已濒临灭绝。为了满足国内外市场尤其是国际市场对香鱼的需求,香鱼人工养殖在中国大陆也迅速兴起。目前,香鱼的人工养殖在沿海各省均有开展,主要集中于浙江、福建、江苏、山东、辽宁等地,养殖的香鱼大部分出口日本和欧美等发达国家,效益十分可观。然而,随着养殖规模的不断扩大,由传染性疾病引起的养殖香鱼大量死亡事件时有发生,给中国沿海地区的香鱼养殖业造成巨大损失[7]。因此,有必要从鱼类自身免疫调控入手,对其抗细菌感染的分子机制进行深入研究。本研究通过香鱼单核/巨噬细胞转录组测序,获得香鱼Arg-II基因的cDNA序列,对序列进行比对及进化关系分析,并明确其mRNA的组织表达特征,随后检测鳗弧菌感染后香鱼重要组织及单核/巨噬细胞中Arg-II基因mRNA的表达变化。
1 材料与方法
1.1 材料
健康香鱼(20-25 g)购自宁波水产大世界,规格均一、无病无伤。充气运回实验室暂养,暂养水温(20±1)℃,期间不间断充气,早晚各换水一次,不投喂饵料。
鳗弧菌分离株ayu-H080701分离自患弧菌病香鱼[7],由本实验室保存。RNAiso试剂、AMV逆转录酶、dNTPs、SYBR Premix Ex Taq 试剂盒和Ex Taq DNA 聚合酶均购自 TaKaRa 公司(日本)。Ficoll购自Invitrogen公司(上海),RPMI1640培养基、胎牛血清(FCS)购自Gibco公司(美国)。引物合成及序列测定由英维捷基贸易有限公司合成(上海)。
1.2 方法
1.2.1 香鱼Arg-II基因cDNA序列的获得及序列分析 采用Illumina HiSeq 2000测序平台对香鱼头肾来源的单核/巨噬细胞进行转录组测序,从测序结果中筛选Arg-II相关Unigenes,通过特异性引物PCR扩增cDNA和测序验证序列准确性。同源蛋白序列比对采用BLASTP 软件(http://www.ncbi.nlm.nih. gov/BLAST/);信号肽序列预测采用SignalP 4.1软件(http://www.cbs.dtu.dk/services/SignalP/);蛋白分子量大小及等电点测定采用Compute pI/Mw程序(http://web.expasy.org/compute_pi/),多重序列比对采用ClustalW软件(http://clustalw.ddbj.nig.ac.jp/);系统进化树构建采用MEGA 5.0软件[8];线粒体靶向肽预测采用MitoProt软件(http://ihg.gsf.de/ihg/mitoprot. html)。氨基酸序列多重比对及进化树构建所用序列信息详见表1。
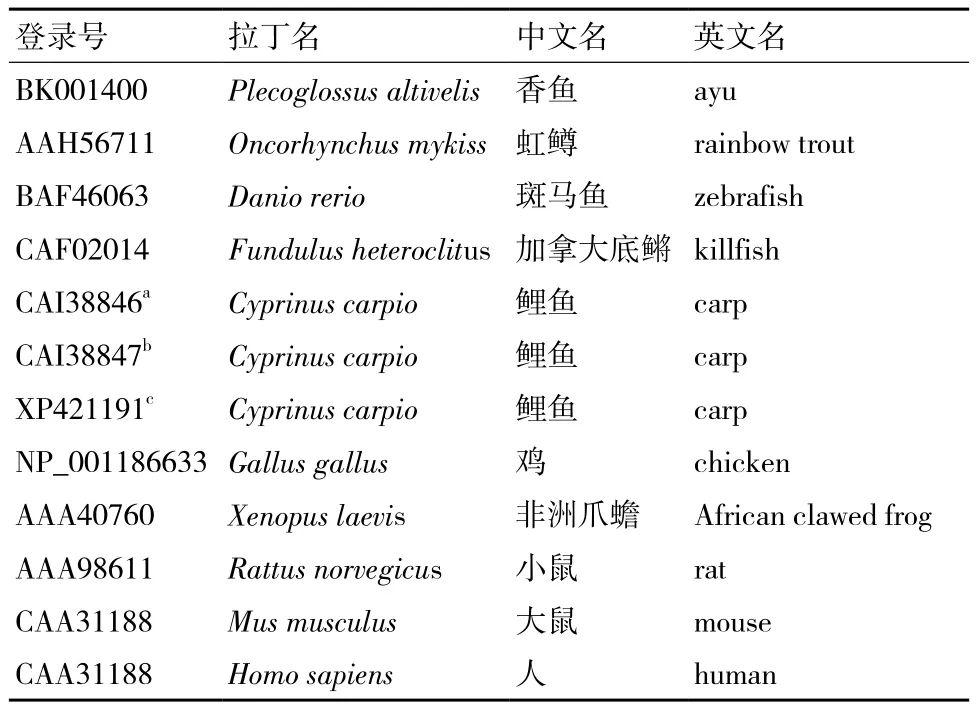
表1 氨基酸序列多重比对及进化树构建所用序列
1.2.2 样品采集
1.2.2.1 组织样品采集 香鱼暂养1周后,随机选取5尾,分别取肝、脾、肾、头肾、脑、心、鳃、肌肉和肠组织立即投入液氮保存,随后转于-70℃超低温冰箱保存,收集的组织作为健康香鱼样品。其余香鱼分为对照组和注射组用于鳗弧菌感染实验,鳗弧菌感染香鱼的实验过程及感染剂量参考杨旦阳等[9]的方法,具体步骤如下。注射组香鱼以1.0×104CFU/尾的浓度腹腔注射鳗弧菌菌悬液,对照组香鱼注射等体积的无菌生理盐水,于感染后4、8、12和24 h取肝、脾、肾、头肾、脑和肠等组织,立即投入液氮中,随后转于-70℃超低温冰箱保存。
1.2.2.2 香鱼头肾来源的单核/巨噬细胞分离培养 将香鱼麻醉,用无菌注射器从尾静脉取血,然后快速取出头肾,用无菌剪刀将头肾剪碎置尼龙网内,加入适量含2% FCS的RPMI1640培养基,用10 mL注射器活塞头轻柔研磨头肾组织,使头肾细胞通过尼龙网进入离心管中;采用Ficoll密度梯度离心法离心,弃上清,用含2% FCS的RPMI1640培养基洗涤细胞,最后将细胞重悬于含2% FCS的RPMI1640培养基中。将细胞悬液铺于直径为35 mm的细胞培养皿中,24℃过夜培养,PBS洗去非黏附细胞,然后向培养基中加入10% FCS的RPMI1640培养基。用姬姆萨染色后显微镜下观察,确定95%的黏附细胞是单核/巨噬细胞。
1.2.2.3 鳗弧菌感染香鱼单核/巨噬细胞 用PBS将鳗弧菌稀释至合适浓度,按照感染复数(multiplicity of infection,MOI)为20∶1的比例接种至香鱼单核/巨噬细胞中,对照组加入等体积的PBS,于感染后4、8、12和24 h时小心吸走培养基,PBS洗涤3次后加入1 mL RNAiso试剂,室温孵育5 min以裂解细胞,收集裂解液作为香鱼单核/巨噬细胞样品,保存于-70℃超低温冰箱备用。
1.2.2.4 香鱼Arg-II基因 mRNA的组织表达特征采用qRT-PCR测定健康香鱼不同组织中Arg-II基因 mRNA的表达特征。参考黄左安等[10]的方法进行总RNA抽提、第一链cDNA合成和qRT-PCR分析。根据香鱼ArgⅡ基因全长cDNA序列设计qRTPCR的检测引物,预期扩增片段为158 bp(表2)。以香鱼β-actin基因作为内参,预期的扩增片段长度为231 bp。以香鱼各组织第一链cDNA为模板进行qRT-PCR扩增,25 μL的扩增体系包括:ddH2O 10 μL、SYBR Premix Ex Taq(2×)缓冲液12.5 μL、正向和反向引物(10 μmol/L)各1 μL、cDNA模板0.5 μL。扩增反应在北京博奥生物芯片有限公司生产的晶芯RT-Cycler实时荧光定量PCR 仪上进行,反应条件为:94℃ 180 s(预变性,1个循环);94℃ 30 s,58℃ 30 s,72℃ 30 s(扩增段,共40个循环);94℃ 30 s,72℃ 60 s,95℃ 30 s(熔解段,1个循环)。qRT-PCR检测时每个样品重复3次,包括目的基因(Arg-II)和内参基因(β-actin)。利用相对标准曲线法2-ΔΔCt对定量结果进行计算,分析Arg-II基因mRNA的相对表达量[11]。
1.2.3 感染鳗弧菌对香鱼重要组织和单核/巨噬细胞Arg-II基因mRNA表达的影响 以鳗弧菌感染香鱼的肝、脾、肾、头肾、脑和肠等组织以及鳗弧菌体外感染的香鱼单核/巨噬细胞cDNA为模板,采用qRT-PCR技术检测Arg-II基因mRNA的表达变化。总RNA抽提、第一链cDNA合成和qRT-PCR分析见1.2.3。

表2 qRT-PCR所用引物
2 结果
2.1 香鱼Arg-II基因cDNA序列分析
转录组测序和特异引物PCR扩增测序揭示,香鱼Arg-II基因cDNA序列长4 707个核苷酸(Gen-Bank登录号:KR018612),包含一个1 047 bp的大开放阅读框架,推测编码一个由348个氨基酸组成、相对分子质量为38.09 kD的蛋白,等电点为6.15,N-末端无信号肽序列。氨基酸序列多重比对结果(图1)显示,香鱼Arg-II具有典型的Arg-II结构特征,N-末端含由41个氨基酸组成的线粒体靶向肽,分子内含4段精氨酸家族的特征性序列。
序列分析表明,香鱼Arg-II与其它鱼类Arg-II氨基酸序列同一性为81.6%-85.3%,其中与虹鳟Arg-II氨基酸序列同一性最高,达85.3%;与哺乳动物、鸟类及两栖动物Arg-II的氨基酸序列同一性仅为51.2%-63.3%。系统进化树(图2)分析揭示,哺乳动物、鸟类、两栖类和鱼类的Arg-II分别成簇,香鱼Arg-II位于鱼类Arg-II这一个大簇,且与虹鳟Arg-II进化关系最近。
2.2 健康香鱼Arg-II基因mRNA的组织表达特征
取健康香鱼心、肝、脾、体肾、头肾、鳃、脑、肠和肌肉等进行qRT-PCR检测,香鱼Arg-II基因扩增产物为158 bp,内参β-actin基因扩增产物为231 bp。结果(图3)表明,健康香鱼Arg-II基因mRNA主要在肝、脑和单核/巨噬细胞中表达,其次是头肾、肠、体肾和脾,其他组织中微弱表达。
2.3 香鱼Arg-II基因mRNA的表达与鳗弧菌感染的相关性
根据Arg-II基因在健康香鱼组织中的表达特征,选取鳗弧菌感染的香鱼肝、脑和头肾组织,以及鳗弧菌感染的体外培养的头肾来源单核/巨噬细胞,进行qRT-PCR分析。结果(图4)表明,香鱼肝组织中Arg-II基因mRNA表达量在感染4 h时开始增加,8 h时显著高于对照组,为对照组的5.2倍,12 h时略有降低,24 h时回复至对照组水平;头肾组织中Arg-II基因mRNA表达量在感染8 h和12 h时显著高于对照组,分别为对照组的1.97倍和2.38倍;脑组织中Arg-II基因mRNA的表达量在感染4 h时开始增加,12 h时显著高于对照组,为对照组的1.79倍,随后降低,24 h时与对照组无明显差异;香鱼头肾来源单核/巨噬细胞在鳗弧菌感染后,Arg-II基因mRNA的表达量逐渐增加,12 h时表达量最高,为对照组的3.1倍,24 h略有降低,但仍显著高于对照组,为对照组的2.6倍。
3 讨论
本研究通过香鱼单核/巨噬细胞转录组测序获得了Arg-II基因的全长cDNA序列。序列分析表明,预测的香鱼Arg-II蛋白氨基酸序列与其他物种Arg-II的结构相似,N-末端包含一个线粒体靶向肽。Arg-II是线粒体蛋白,需要通过N-末端线粒体靶向肽进入线粒体基质。MitoProt软件分析表明,硬骨鱼类、两栖类与哺乳动物Arg-II N-末端线粒体靶向肽的长度和序列上差异明显,但有两个共同特征,精氨酸、丙氨酸和丝氨酸等阳离子氨基酸残基含量丰富,天冬氨酸和谷氨酸等阴离子氨基酸残基含量稀少[4]。系统进化树分析表明,鱼类Arg-II独立成簇,香鱼与虹鳟Arg-II进化相关性最高。组织差异特征分析表明,Arg-II基因在健康香鱼各组织中分布广泛,其中肝、脑和单核/巨噬细胞表达量最高,这与虹鳟、鲤鱼中的研究结果较为一致[4,6]。

图1 香鱼与其他物种Arg-II全长氨基酸序列多重比对结果
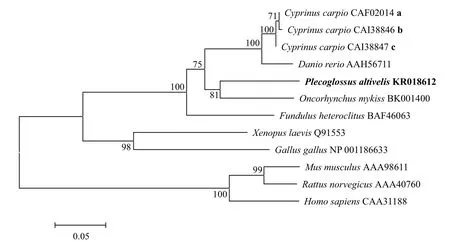
图2 基于Neighbor-Joining法构建香鱼和其他物种全长Arg-II氨基酸序列的系统进化树
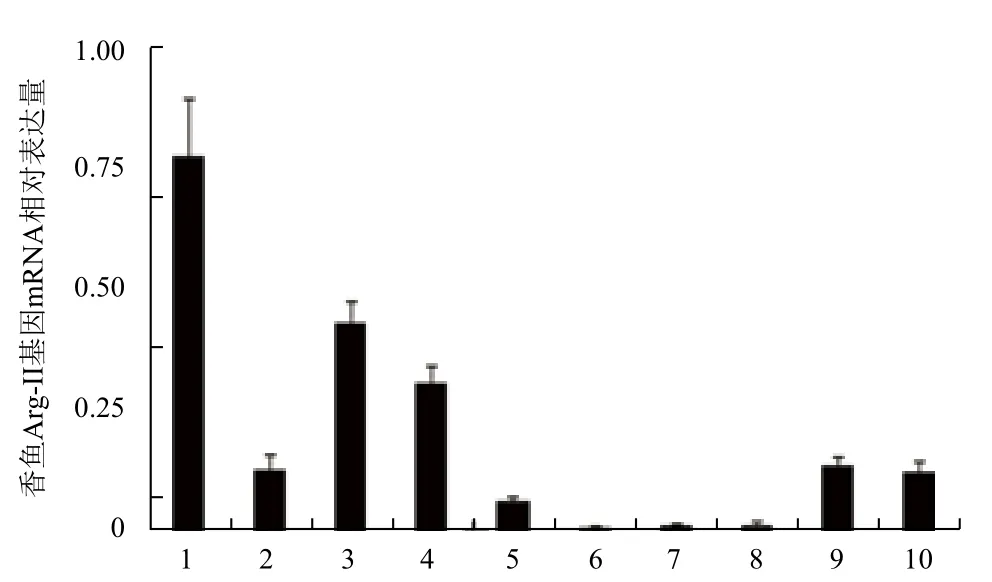
图3 健康香鱼Arg-II基因mRNA的组织表达特征
在哺乳动物中,Arg-II不仅参与机体尿素循环,还与机体病理过程密切相关。早期的研究表明,Arg-II基因是抑制巨噬细胞炎症因子表达的肝X(liver X receptor)受体的直接靶标,因此,它最初被认为具有抗炎功能[12,13]。与哺乳动物相比,硬骨鱼类Arg-II的研究报道相对较少,已有的研究揭示,Arg-II可能与鱼类免疫反应密切相关。例如,在虹鳟中,虹脑粘体虫感染后,品系T和H在感染后2 h和8 d时Arg-II基因mRNA表达量均显著增加,分别增加了4倍和2.7倍[5];在鲤鱼中,cAMP处理后,头肾来源巨噬细胞精氨酸酶活性显著增加,Arg-II基因表达量在6 h达到最大,约为对照组的16倍[6]。本研究中,鳗弧菌腹腔注射香鱼后,Arg-II mRNA表达在头肾和单核/巨噬细胞中显著上调,这与上述研究结果较为一致。同时,香鱼肝和脑中Arg-II基因表达量也在鳗弧菌感染后显著上调,揭示Arg-II与鱼类病原感染引起的免疫应答密切相关,可能通过激活巨噬细胞旁路激活途径参与免疫反应,但具体作用机制有待于进一步研究。
4 结论
香鱼Arg-II基因cDNA序列与虹鳟Arg-II序列最相似。健康香鱼中,Arg-II mRNA主要在肝、脑和单核/巨噬细胞中表达;鳗弧菌感染后,Arg-II mRNA表达量显著上调,揭示Arg-II与香鱼抗病原感染的免疫反应紧密相关。
[1]Morris SM, Kepka-Lenhart D, Chen LC. Differential regulation of arginases and inducible nitric oxide synthase in murine macrophage cells[J]. American Journal of Physiology-Endocrinology And Metabolism, 1998, 275(5):E740-E747.
[2]Munder M. Arginase:an emerging key player in the mammalian immune system[J]. British Journal of Pharmacology, 2009, 158(3):638-651.
[3]Yang Z, Ming XF. Functions of arginase isoforms in macrophage inflammatory responses:impact on cardiovascular diseases andmetabolic disorders[J]. Front Immuno, 2014, 5:533-542.
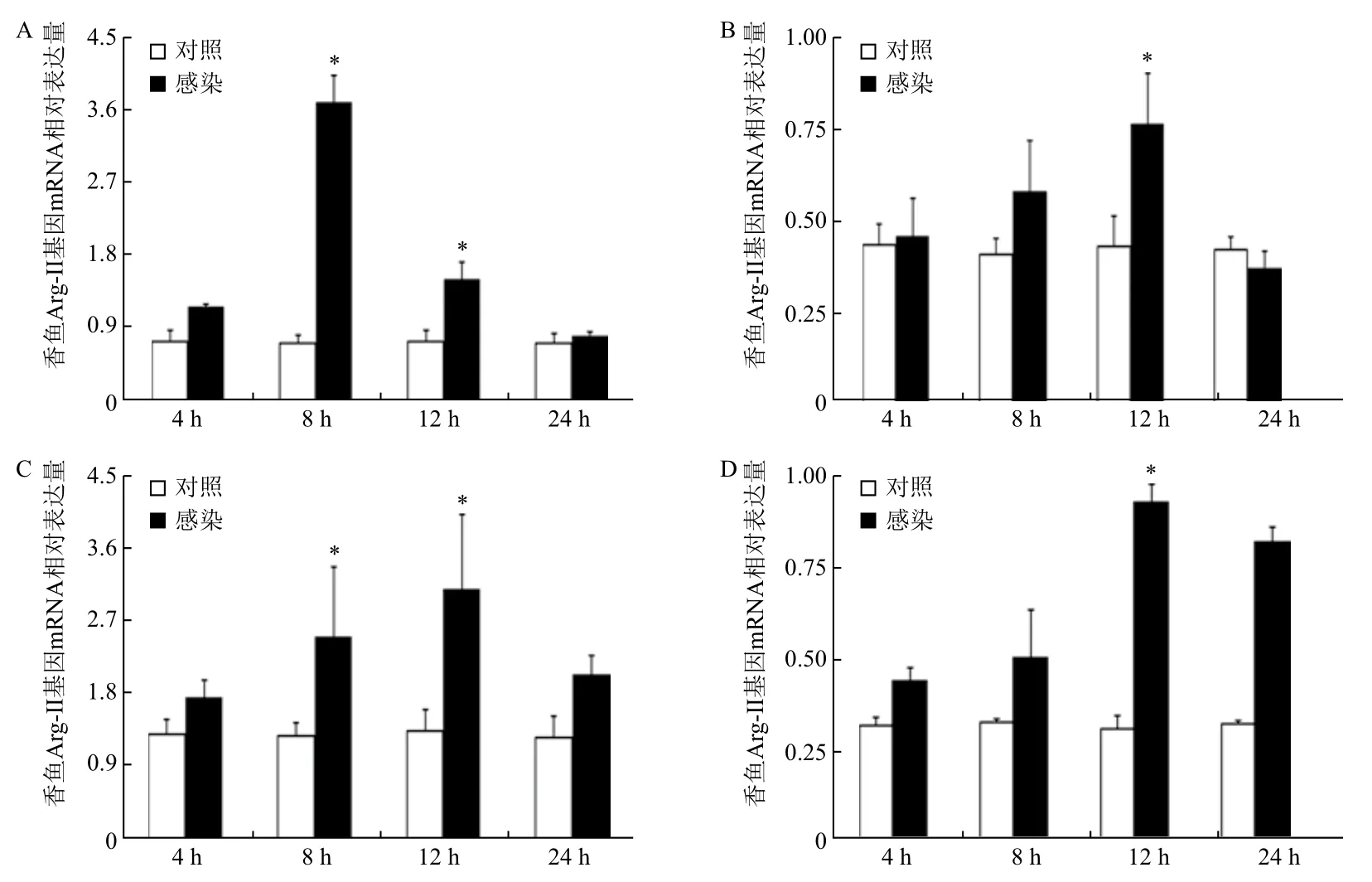
图4 鳗弧菌感染对香鱼重要组织及单核/巨噬细胞Arg-II基因mRNA表达的影响
[4]Wright PA, Campbell A, Morgan RL, et al. Dogmas and controversies in the handling of nitrogenous wastes:expression of arginase Type I and II genes in rainbow trout:influence of fasting on liver enzyme activity and mRNA levels in juveniles[J]. The Journal of Experimental Biology, 2004, 207(Pt 12):2033-2042.
[5]Severin VIC, Soliman H, El-Matbouli M. Expression of immuneregulatory genes, arginase-2 and inducible nitric oxide synthase(iNOS), in two rainbow trout(Oncorhynchus mykiss)strains following exposure to Myxobolus cerebralis[J]. Parasitology Research, 2010, 106(2):325-334.
[6]Joerink M, Savelkoul HFJ, Wiegertjes GF. Evolutionary conservation of alternative activation of macrophages:structural and functional characterization of arginase 1 and 2 in carp(Cyprinus carpio L.)[J]. Molecular Immunology, 2006, 43(8):1116-1128.
[7] 李长红, 陈炯, 史雨红, 等. 宁海地区香鱼弧菌病病原菌鉴定[J]. 微生物学报, 2009 49(7):931-937.
[8]Tamura K, Peterson D, Peterson N, et al. MEGA5:Molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance, and maximum parsimony methods[J]. Molecular Biology and Evolution, 2011, 28(10):2731-2739.
[9]杨旦阳, 陈炯, 陆新江, 等. 香鱼CCL4-like基因的克隆、序列分析及免疫相关性表达变化分析[J]. 中国细胞生物学学报,2013, 35(5):676-683.
[10]黄左安, 陈炯, 等. 香鱼凝血因子X 基因表达与鳗利斯顿氏菌感染的相关性[J]. 动物学研究, 2011, 32(5):492-498.
[11]Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J]. Methods, 2001, 25(4):402-408.
[12]Marathe C, Bradley MN, Hong C, et al. The arginase II gene is an anti-inflammatory target of liver X receptor in macrophages[J]. Journal of Biological Chemistry, 2006, 281(43):32197-32206.
[13]Ming XF, Rajapakse AG, Yepuri G, et al. Arginase II promotes macrophage inflammatory responses through mitochondrial reactive oxygen species, contributing to insulin resistance and atherogenesis[J]. Journal of the American Heart Association,2012, 1(4):e000992.
(责任编辑 李楠)
cDNA Cloning of Arginase II Gene in Ayu(Plecoglossus altivelis)and the Correlation Between Its Expression and Vibrio anguillarum Infection
DING Fei-fei LI Chang-hong CHEN Jiong ZHANG Qi
(Biochemistry and Molecular Biology Laboratory,School of Marine Sciences,Ningbo University,Ningbo 315211)
Arginase II(Arg-II)is one kind of arginases. Not only can it participates in the urea cycle, but also has close correlation with pathological process. Here, we determined the whole cDNA sequence of Arg-II gene of ayu(Plecoglossus altivelis)by de-novo transcriptome sequencing of ayu monocytes/macrophages. The results showed that the cDNA sequence of the Arg-II was 4707 nucleotides, containing a large open reading frame that encoded a protein of 348 amino acids with a deduced molecular mass of 38.09 kD and a theoretical isoelectric point(pI)of 6.15. Multiple sequence alignment of complete amino acid sequences showed that ayu Arg-II had the typical characters of Arg-II in animals. Sequence comparison showed that ayu Arg-II shared the highest amino acid sequence identity(85.3%)with that of rainbow trout(Oncorhynchus mykiss). Phylogenetic tree analysis also confirmed that fish Arg-II formed a cluster, and ayu Arg-II was most closely related to that of rainbow trout. Quantitative real-time PCR(qRT-PCR)analysis showed that the mRNA of ayu Arg-II mainly had the expression in liver, brain, head kidney and monocytes/macrophages. Upon Vibrio anguillarum infection, the mRNA expression of gene Arg-II significantly up-regulated in the liver, brain, head kidney and monocytes/macrophages. In summary, our present study revealed a tight relationship between the ayu Arg-II expression and V. anguillarum infection, suggesting that ayu Arg-II plays an important role in fish immune response against bacterial infection. This study provides a theoretical basis for studying the functions of fish Arg-II, and its molecular mechanism in regulating fish immune response to pathogens.
Plecoglossus altivelis;arginase II;Vibrio anguillarum;monocytes/macrophage;expression
10.13560/j.cnki.biotech.bull.1985.2016.02.014
2015-03-28
国家自然科学基金项目(31402333),浙江省自然科学基金项目(LQ13C190002),高等学校博士学科点专项科研基金项目(20133305120008)
丁斐斐,女,研究方向:鱼类分子免疫学;E-mail:dingfeifei14@163.com
李长红,女,研究方向:鱼类分子免疫学;E-mail:lichanghong0716@163.com
