不同紫细菌光合基因表达调控机制异同
2016-10-13邓春浩孙良昱陈坤明
邓春浩 孙良昱 陈坤明
(西北农林科技大学生命科学学院,杨凌 712100)
不同紫细菌光合基因表达调控机制异同
邓春浩 孙良昱 陈坤明
(西北农林科技大学生命科学学院,杨凌 712100)
紫细菌是一类可以进行不放氧光合作用的原核微生物,可以利用光能产生ATP并为其生长代谢提供能量。其光系统由一系列色素及蛋白组成的复合体组成,并由一系列光合基因如puc、puf、bch和crt等编码。紫细菌光合相关基因的表达主要受到外界氧化还原信号及光照的影响,然而不同紫细菌光合基因表达调控机制具有明显的多样性。以球形红细菌与沼泽红假单胞菌为重点,介绍了近年来几种光合基因表达调控系统如PpsR/CrtJ型调控蛋白、双组分磷酸化调控系统、CRP-FNR型调控蛋白等在紫细菌中的研究进展。通过系统深入分析这些调控通路在不同紫细菌中的特征及功能,发现不同菌株中类似调控通路通常具有相似功能,但又各具特点。旨为对进一步了解紫细菌光合基因表达调控机制并为其应用研究提供参考。
光合基因;球形红细菌;沼泽红假单胞菌;紫细菌
紫细菌是一类可以进行不放氧光合作用的光合微生物,种类繁多,不同种类紫细菌的光系统结构非常类似,都主要由各种色素与蛋白组成的复合体构成,存在于细菌质膜内嵌形成的细菌内膜系统(introcytoplasmic membrane,ICM)上,包括核心复合体(core-complex)和外围天线色素复合体(peripheral antennae)。光能通过外围天线色素复合体传递至核心复合体,并在光反应中心(reaction center,RC)引起电荷分离,最终将光能转化为电能[1]。紫细菌光系统由一系列光合基因所编码的蛋白和酶组成或催化合成,其中大部分基因集中在细菌基因组中,被称为光合基因簇(photosynthesis gene cluster,PGC)的区域。人们对不同种紫细菌的光合基因表达调控机制研究发现,光合基因的表达均受到光照及细胞内氧化还原状态的强烈影响,并通过一系列调控蛋白,如PpsR、PrrA(RegA)、FixJ、FnrL和 FixK等蛋白来影响puc、puf、puh、bch、crt和hem等光合基因的表达,然而在不同紫细菌类群中,这些光合基因簇表达调控的机制存在显著的不同。本研究旨在通过分析不同紫细菌光合基因表达调控方式异同,从而深入了解光合基因表达调控机制。
表1介绍了球形红细菌(Rb. sphaeroides)与沼泽红假单胞菌(Rp. palustris)光系统主要调控因子及其功能异同。
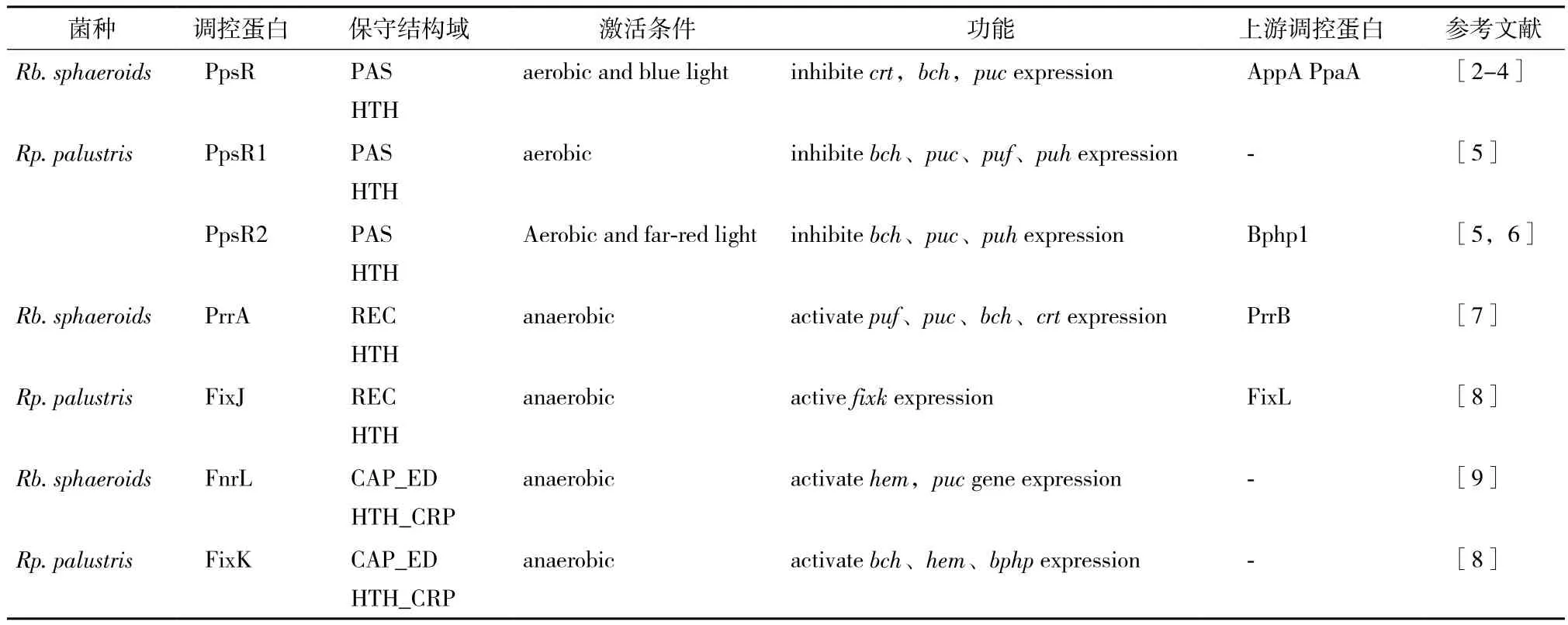
表1 Rhodobacter sphaeroides及Rhodopseudomonas palustris光系统主要调控因子及其功能异同
1 PpsR/CrtJ型调控蛋白
1.1 PpsR/CrtJ型调控蛋白的主要特征
PpsR/CrtJ是一类在紫细菌中普遍存在,并且非常重要的的调控光系统基因表达的蛋白,在不同紫细菌类群中具有相同的PAS(Per-arnt-sim)结构域和HTH(Helix-turn-helix)结构基元[5]。通过对不同紫细菌中与PpsR蛋白结合的目标序列的分析发现,PpsR一般与特定调控序列TGT-N12-ACA的回文区结合,受 PpsR调节的基因主要包括bch、crt、puc、hem等光合基因[10],然而不同紫细菌中PpsR蛋白调控基因表达的方式还有很大差异,有的菌株中只含有一种PpsR蛋白,有的菌株中含有两种PpsR蛋白,下面将分别介绍不同菌株中PpsR蛋白调控模式。其中图1比较了Rb. sphaeroides、Rb. capsulatus、Rp. palustris和Bradyrhizobium sp. ORS278中PpsR调控通路及其异同。
1.1.1 单PpsR调控模式 在Rb. sphaeroides与Rb. capsulatus中都只含有一种PpsR蛋白(Rb. capsulatus中为CrtJ),不同菌株中PpsR蛋白的序列与结构高度相似,一般含有3个半胱氨酸残基(Cys),以四聚物形式存在,通过二硫键的形成与断裂响应细胞内氧化还原状态,并通过构象变化发挥调控功能[11],其中氧化态的PpsR蛋白有比还原态更强的DNA结合活性[12],二者都发挥阻遏蛋白的特性。在Rb. sphaeroides中存在的AppA蛋白,可以与PpsR蛋白结合,从而使PpsR不能与DNA结合而丧失其阻遏蛋白活性,因此二者在球形红细菌中共同组成了阻遏-抗阻遏调控系统[13]。AppA的N末端具有FAD结合域及非共价结合的BluF,能够响应氧化还原信号与光信号,在还原态及无蓝光照射条件下可与PpsR结合;其C末端具有SCHIC(sensor containing heme instead of cobalamin)结构域,可以结合heme辅因子,能够通过该辅因子与PpsR的PAS结构域结合[13-15]。近年来,随着对AppA及PpsR蛋白晶体结构的解析,AppA与PpsR之间是如何互作的,响应氧化还原信号及光信号的分子机制也逐渐被解析[16-18],为人们进一步了解其分子调控机制并改造菌株提供了有利的支持。
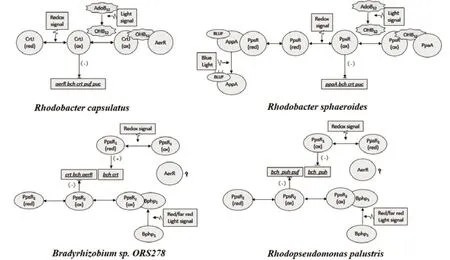
图1 Rb. sphaeroides、Rb. capsulatus、Rp. palustris和Bradyrhizobium中PpsR调控通路[13-24]
在紫细菌中广泛存在一类PpaA/AerR类蛋白(Rb. sphaeroides中被命名为PpaA,Rb. capsulatus中被命名为AerR),这类蛋白基因位置非常保守,通常位于光合基因簇中PpsR基因的上游[19]。这类蛋白没有像AppA一样的FAD及BluF功能位点,但C末端具有SCHIC结构域,也能通过heme辅因子来调控相关基因表达[19]。通过对ppaA与aerR缺失突变体研究发现,aerR突变体中puf、crtI、crtB和crtJ等光合基因表达上调,因此AerR的存在可能抑制光合基因的表达[20];而与之相反,ppaA突变体puc、crt和bch等光合基因表达下调,因此PpaA
可能促进光合基因表达[21]。然而,最近有研究发现,AerR在光照条件下通过结合B12辅因子,能够与PpsR蛋白结合,从而使PpsR丧失阻遏蛋白活性,激活相关光合基因表达,因此二者也能够组成阻遏-抗阻遏调控系统[22]。AerR的抗阻遏活性主要依赖于B12的状态,在光照条件下,B12可以从腺苷钴胺素(AdoB12)转换为羟基钴胺素(OHB12),而OHB12可以促使AerR与CrtJ的结合[22]。对于aerR缺失突变体中光合基因表达的下调,可能是由于AerR与PpsR基因是联锁表达的,aerR缺失突变使ppsR表达也下调,从而使光合基因在缺乏阻遏蛋白情况下表达上调,进而造成AerR抑制光合基因表达的假象[22]。
1.1.2 双PpsR调控模式 与前两种紫细菌不同,Rp. palustris和Bradyrhizobium sp. ORS278含有两种类型的PpsR蛋白,即PpsR1和PpsR2。两种紫细菌PpsR蛋白的氨基酸序列相似性较高,在Bradyrhizobium sp. ORS278中,PpsR调控蛋白主要调控bch、crt和cycA基因[23],而在Rp. palustris中,PpsR主要调节crt、bch和puc等基因的转录[5]。目前,Bradyrhizobium sp. ORS278中PpsR蛋白的功能最先得到研究。Bradyrhizobium sp. ORS278的PpsR1可以通过分子间的二硫键来响应氧化还原信号,在还原态以四聚物形式存在,氧化态以八聚物形式存在,其中还原态的四聚PpsR1可以与crt、bch等光合基因启动子区的目标序列结合,执行转录激活作用[23];而其PpsR2蛋白没有半胱氨酸残基,不能识别氧化还原信号,但是可以通过细菌光敏色素(bacteriophytochrome,BphP)响应远红光信号,被远红光激活的BphP可以解除PpsR2对crt、bch及ppsr1等光合相关基因的抑制[23]。由于高度的序列相似性,最初Rp. palustris的两个PpsR蛋白也被认为与Bradyrhizobium sp. ORS278的PpsRs有相似的功能[23],然而Braatsch等[5,6]通过对Rp. palustris CGA009的ppsR1突变体的研究发现,Rp. palustris的PpsR1在有氧条件下执行转录抑制功能;其PpsR2由于含有半胱氨酸残基,不仅能通过RpBphP响应远红光信号而激活基因转录;同时,该PpsR2也可通过半胱氨酸残基响应氧化还原信号。研究发现,Rp. palustris的PpsR2通过RpBphP1响应光信号,RpBphP1包含一个识别光信号的PCD结构域(input photosensory core domain,PCD)和一个传递信号的OTD结构域(output transducing domain,OTD),其中OTD结构域包含PAS/PAC结构,RpBphP1通过与RpPpsR2形成复合物来传递远红光信号[24]。在Rp. palustris和Bradyrhizobium sp. ORS278中也存在PpaA基因,然而其蛋白功能是否与Rb. sphaeroides与Rb. capsulatus中PpaA及AerR功能相似,还未见更多报道。
1.2 不同紫细菌中PpsR调控通路的异同
由于PpsR型调控通路是紫细菌中调控光合基因表达的最重要的调控通路之一,并且为近年来研究热点,在许多紫细菌中均有较为深入的研究,对该通路中不同类型的调控蛋白按照其结构与功能分类,可以更清楚看到该调控通路的特点。PpsR/CrtJ型调控蛋白所属调控通路中,Rb. sphaeroides含有两个调节PpsR功能的调控蛋白AppA及PpaA,而Rb. capsulatus的PpsR/CrtJ上游调控蛋白仅有与PpaA同源的AerR;Bradyrhizobium sp. ORS278与Rp. palustris都含有两种PpsR蛋白,其中Bradyrhizobium sp. ORS278的PpsR1执行转录激活功能,而Rp. palustris的PpsR1却执行转录抑制功能。同时,这些调控蛋白在不同紫细菌中也存在一些共性特点:所有菌株中的PpsR蛋白都结合相似的TGT-N12-ACA回文区序列;Bradyrhizobium sp. ORS278与Rp. palustris的PpsR2同源,二者都通过Bphp受到光信号的调控;Rb. sphaeroides与Rb. capsulatus的AppA、PpaA及AerR都具有SCHIC结构域,并通过heme类辅因子与PpsR结合组成各种阻遏-抗阻遏系统。
2 双组分磷酸化调控系统
2.1 双组分磷酸化调控系统的主要特征
在Rb. sphaeroides与Rb. capsulatus中各自存在一套调控光合相关基因表达的双组分磷酸化调控系统,分别为PrrB/A与RegB/A调控系统,二者调控功能相似。外界信号通过一个膜定位的具有组氨酸激酶活性的跨膜蛋白PrrB(RegB),将胞内另一个转录调控蛋白PrrA(RegA)磷酸化激活后影响一系列基因的转录,膜定位蛋白通常包含N末端的跨膜结构域及C末端组氨酸激酶结构域,胞内蛋白通常包含一个N末端的REC结构域(signal receiver domain)及C末端的HTH结构域。在Rp. palustris中同样存在类似的双组分磷酸化调控系统,人们主要研究了两种与类似的与Rb. sphaeroides及Rb. capsulatus类似的调控系统,即RegS/R与FixL/J。
2.2 不同紫细菌中双组分磷酸化调控系统功能异同
在Rb. sphaeroides与Rb. capsulatus中,该系统通过响应氧化还原信号,除调控固氮相关基因的表达外,还能够调控puf、puc、bch和crt等光合基因的转录[25]。现有研究表明,PrrA/B(RegA/B)双组分系统主要通过以下几种可能的机制来识别氧化还原信号:Rb. capsulatus的RegB可以通过265位的Cys残基来响应氧化还原信号,氧化态下通过形成分子间二硫键,促使分子变为无激酶活性的四聚体继而阻断下游通路[26];Swem等[27]发现Rb. capsulatus的RegB的跨膜区含有辅酶Q结合位点,醌池(ubiquinone pool)的氧化还原状态能够调节RegB的激酶活性,氧化态的辅酶Q可以影响RegB的激酶活性继而阻断下游通路;而Kim等[28]则认为Rb. sphaeroides中PrrB的激酶活性主要受到cbb3氧化酶的调节,辅酶Q结合位点对于PrrB的激酶活性并没有影响,cbb3氧化酶作为氧化还原信号受体,调节PrrB的磷酸酶及磷酸激酶活性平衡,还原态下使PrrB表现出激酶活性继而激活下游通路[29]。近年来研究表明PrrC对于cbb3氧化酶铜中心的装配密切相关,PrrC蛋白与PrrB/A系统密切相关的蛋白[30,31],其基因位置相邻,然而对于氧化还原信号影响PrrB(RegB)激酶活性的具体机制仍未阐明。还原条件下,具有激酶活性的PrrB(RegB)可以磷酸化激活PrrA(RegA),而PrrA(RegA)通过识别特异性序列5'-GCTGGCGCGANNTATANNCGAC-3'而定位其所调控的基因。PrrA(RegA)对不同基因的调控方式也有所不同:可以直接与转录抑制因子PpsR(CrtJ)竞争bchC的启动子区,并通过与RNA聚合酶互作而增加基因转录起始效率[32];可通过与其他蛋白(FnrL、CbbR和NtrYX等)协同作用增强相关基因转录[33-36];可通过与gpx(RSP2389)起始密码子下游作用位点结合并抑制该基因转录[37];而亚精胺及DNA拓扑结构对PrrA与目的位点结合有重要影响,亚精胺可以提高光合基因转录效率,DNA的负超螺旋也有助于PrrA促进基因转录[7]。
Rp. palustris中的RegS/R双组分调控系统是Rp. palustris中与PrrA/B亲缘关系最近的双组分调控系统,其中RegR与PrrA的相似性高达72%。但是通过突变体研究发现,RegS/R不参与光合自养、光合异养及固氮条件下的相关基因表达,只影响了吸氢酶的活性[38]。然而Rp. palustris中的另一套双组分调控系统FixL/J,与PrrB/A亲缘关系较远,但可以参与光合基因调控。通过结构域分析可以发现FixL比PrrB多两个PAS结构域,这导致二者接受氧化还原信号的机制可能不一样。FixJ在厌氧条件下可以激活另外一个与光合基因调控相关的正调控蛋白FixK基因的转录,fixL/J突变体不能很好地在厌氧光照下生长[8]。然而在Rp. palustris中,氧化还原信号是如何传递给FixL的,有关FixJ对其他基因的调控作用,是否还有其他双组分调控系统调控光合基因表达都还有待进一步研究。
3 CRP-FNR型调控蛋白
3.1 CRP-FNR型调控蛋白的主要特征
紫细菌中还存在一类参与光合基因表达调控的CRP-FNR 型调控蛋白,该蛋白可以结合cNMP,以其含有的4Fe-4S簇响应氧化还原信号,并可以通过与DNA的结合来调控相关基因的表达[39],现有研究表明不同菌株中的CRP-FNR型调控蛋白主要调控启动子区具有保守的FNR调控序列(TTGAT-N4-ATCAA)的基因[8,9]。
3.2 不同CRP-FNR型调控蛋白功能异同
在Rb. sphaeroides中调控光合基因的CRP-FNR型调控蛋白为FnrL。在低氧分压下,还原态的FnrL能结合并激活具有保守FNR调控序列的光合相关基因,如puc、hemA、hemF、hemZ和bchE等[9,40]。FnrL是Rb. sphaeroides的一个关键调控因子,其fnrL突变体不能在光照条件下生长,不能在黑暗厌氧条件下利用DMSO作为电子传递受体[9],也不能形成正常的内膜系统[41]。Rb. sphaeroides中FnrL蛋白经常与其他蛋白共同调控基因表达,如puc基因启动子区的FNR调控序列与其IHF调控区域有重合;hemA上游双启动子也受到PrrA及FnrL的共同调节[40]。Rb. capsulatus的FnrL蛋白与Rb. sphaeroides的亲缘关系最高,但是二者的功能有很大的差异。Rb. capsulatus的fnrL突变使菌株不能在黑暗厌氧条件下利用DMSO,但是对菌株厌氧与有氧条件下的光合生长没有影响,也不影响细胞内膜系统的形成[41];对Rb. capsulatus的hem启动子的深入分析发现,hemE在半好氧条件下能够被FnrL明显激活,而hemB的表达则受到FnrL蛋白的抑制,但FnrL对其他hem基因表达的影响则非常微弱[42]。
在Rp. palustris中存在多种CRP-FNR家族蛋白(图2),其中AadR与FixK两种蛋白与Rb. sphaeroides与Rb. capsulatus的FnrL相似性最高。研究发现AadR主要参与苯酸盐代谢,但不参与光合基因表达调控[43]。而FixK的功能则与Rb. sphaeroides的FnrL类似,识别相似的调控序列,都调控电子传递及光系统相关基因的表达[8]。FixK可以通过直接或者间接的方式与基因上游特异调控序列结合而调节基因转录,在厌氧或微氧条件下,FixL可以激活fixK表达,FixK接着可以激活一系列基因如bch、hem、cooNOQP及pioABC等的表达[8,44]。

图2 Rp. palustris中CRP-FNR型调控蛋白系统发育分析
4 SPB调控因子
SPB是Rb. sphaeroides中的一个调节蛋白,包含一个C端的K-box和N端负责DNA结合的H-NS结构,能识别puf和puc操纵子的操纵区,在强光照射下抑制puf和puc的转录,因此又叫作高光抑制因子[45]。SPB缺失突变使菌株在光照条件下Bchl表达上调,同时也可提高菌株的产氢效率[46]。SPB蛋白不能响应氧化还原信号,也不包含能识别光信号的基团。2007年,Shimada等[47]通过免疫共沉淀技术,分离得到了一个与SPB相互作用的蛋白SIP,SIP同样属于H-NS家族的蛋白,但有关强光信号传递给SPB的具体机制,仍然没有阐明。在Rb. capsulatus中存在一个可以响应光信号并具有H-NS结构的蛋白——HvrA[48],但是与SPB不同的是HvrA蛋白负责在低光照下激活puf和puh的转录,hvrA缺失菌株表现出在中低光照下光合效率下降[48]。与SPB一样,HvrA蛋白响应光照的机理仍未阐明。
在Rp. palustris中细菌光敏色素RpBphP2与RpBphP3可以响应光照强度信号,继而调控光合基因表达[49],但是在Rp. palustris中未发现H-NS家族蛋白,对于Rb. sphaeroides和Rb. capsulatus中是否存在类似的调控蛋白还有待进一步研究。
5 非编码小RNA(small-noncoding RNA)调控
非编码小RNA广泛参与微生物细胞代谢、应激反应等生理过程,近些年来受到人们广泛重视。2009年,Borghoff等[50]用高浓度氧气处理Rb. sphaeroides菌株后,通过高通量测序及Northern blot技术,获得了20个响应氧化还原状态的非编码小RNA。随后作者所在课题组选取其中一个仅在Rb. sphaeroides中特异存在的非编码小RNA-PcrZ,通过一系列研究发现pcrZ在厌氧条件下被PrrA激活转录形成小RNA-PcrZ,而PcrZ可以通过互补配对的形式与puc、bch等基因结合而抑制光合基因表达[51]。在这个调控模式里,PcrZ还可与转录激活因子PrrA竞争性结合目的基因,从而实现对基因表达的精细调节。
在Rp. palustris中,2012年,Hirakawa等[52]通过RNAseq技术得到了一系列反义RNA,并鉴定出其中一个反义RNA具有调节群体信号感应受体表达的功能。然而,目前关于小RNA调控Rp. palustris光系统方面的研究,尚未见更多报道。
6 结语
紫细菌光合基因表达调控是一个非常复杂的网络,除本文中详细对比的几种调控通路及其所含的调控蛋白外,还有很多调控蛋白参与光合基因表达调控。例如,Rb. sphaeroides中的外膜蛋白TspO参与AppA-PpsR调控系统中氧化还原信号向AppA的传递[53];Rb. sphaeroides与Rb. capsulatus中存在的硫氧还原蛋白可通过调节DNA促旋酶的活性,改变DNA的超螺旋状态,继而影响光合基因表达[54];紫细菌中还普遍存在一类细菌光敏色素(bacteriophytochrome,Bphp),可以通过响应光信号而调节光合基因表达[55];而另外一类向光素依赖蛋白(phototropin-related proteins)也可通过响应光信号调控光合基因表达[55]。但是这些调控蛋白及其所属调控通路中,光信号及氧化还原信号是如何传递的,下游调控蛋白是如何识别并调控基因的,不同紫细菌中是否具有相似的调控模式,都还有待进一步研究。
值得注意的是,即使氨基酸序列最为相近的蛋白,其突变体在不同紫细菌中可能具有不同的表型;相似性较低的蛋白,其突变体在不同紫细菌中也表现出相似的功能。例如,Rp. palustris中与PrrA/B(RegA/B)最为相似的RegS/R调控系统,并不参与光系统形成,而后来发现的FixL/J调控通路却参与光合系统相关基因调控;Rb. sphaeroides与Rb. capsulatus的FnrL相似性很高,但其突变体却表现出不同的表型,相似性较低的Rp. palustris的FixK与Rb. sphaeroides的FnrL之间,在功能上却最为相近,都具有相似的调控序列及调控机制。不同紫细菌光合基因表达调控模式都有其共性及特性,而通过对不同类群紫细菌光合基因表达调控机制相似性研究,有助于人们进一步深入了解紫细菌光合基因表达调控机制,并在其他类型光合细菌中发现类似的调控通路。
[1]Roszak AW, Howard TD, Southall J, et al. Crystal structure of the RC-LH1 core complex from Rhodopseudomonas palustris[J]. Science, 2003, 302(5652):1969-1972.
[2]Penfold RJ, Pemberton JM. Sequencing, chromosomal inactivation,and functional expression in Escherichia coli of ppsR, a gene which represses carotenoid and bacteriochlorophyll synthesis in Rhodobacter sphaeroides[J]. J Bacteriol, 1994, 176(10):2869-2876.
[3] Gomelsky M, Kaplan S. Genetic evidence that PpsR from Rhodobacter sphaeroides 2.4.1 functions as a repressor of puc and bchF expression[J]. J Bacteriol, 1995, 177(6):1634-1637.
[4]Gomelsky M, Kaplan S. AppA, a redox regulator of photosystem formation in Rhodobacter sphaeroides 2.4.1, is a flavoprotein. Identification of a novel fad binding domain[J]. J Biol Chem,1998, 273(52):35319-35325.
[5]Braatsch S, Bernstein JR, Lessner F, et al. Rhodopseudomonas palustris CGA009 has two functional ppsR genes, each of which encodes a repressor of photosynthesis gene expression[J]. Biochemistry, 2006, 45(48):14441-14451.
[6]Braatsch S, Johnson JA, Noll K, et al. The O2-responsive repressor PpsR2 but not PpsR1 transduces a light signal sensed by the BphP1 phytochrome in Rhodopseudomonas palustris CGA009[J]. FEMS Microbiol Lett, 2007, 272(1):60-64.
[7]Eraso JM, Kaplan S. Regulation of gene expression by PrrA in Rhodobacter sphaeroides 2.4.1:role of polyamines and DNA topology[J]. J Bacteriol, 2009, 191(13):4341-4352.
[8]Rey FE, Harwood CS. FixK, a global regulator of microaerobic growth, controls photosynthesis in Rhodopseudomonas palustris[J]. Mol Microbiol, 2010, 75(4):1007-1020.
[9]Zeilstra-Ryalls JH, Kaplan S. Aerobic and anaerobic regulation in Rhodobacter sphaeroides 2.4.1:the role of the fnrL gene[J]. J Bacteriol, 1995, 177(22):6422-6431.
[10] Elsen S, Jaubert M, Pignol D, et al. PpsR:a multifaceted regulator of photosynthesis gene expression in purple bacteria[J]. Mol Microbiol, 2005, 57(1):17-26.
[11] Choudhary M, Kaplan S. DNA sequence analysis of the photosynthesis region of Rhodobacter sphaeroides 2.4.1[J]. Nucleic Acids Res, 2000, 28(4):862-867.
[12]Masuda S, Bauer CE. AppA is a blue light photoreceptor that antirepresses photosynthesis gene expression in Rhodobacter sphaeroides[J]. Cell, 2002, 110(5):613-623.
[13]赵志平. 紫细菌光合机构及光合作用基因的表达调控[J].微生物学通报, 2008, 35(5):830-835.
[14]Han Y, Meyer MH, Keusgen M, et al. A haem cofactor is required for redox and light signalling by the AppA protein of Rhodobacter sphaeroides[J]. Mol Microbiol, 2007, 64(4):1090-1104.
[15]Yin L, Dragnea V, Bauer CE. PpsR, a regulator of heme and bacteriochlorophyll biosynthesis, is a heme-sensing protein[J]. J Biol Chem, 2012, 287(17):13850-13858.
[16]Pandey R, Flockerzi D, Hauser Marcus JB, et al. Modeling the Light- and Redox-Dependent Interaction of PpsR/AppA in Rhodobacter sphaeroides[J]. Biophys J, 2011, 100(10):2347-2355.
[17]Winkler A, Heintz U, Lindner R, et al. A ternary AppA-PpsR-DNA complex mediates light regulation of photosynthesis-related gene expression[J]. Nat Struct Mol Biol, 2013, 20(7):859-867.
[18]Heintz U, Meinhart A, Winkler A. Multi-PAS domain-mediatedprotein oligomerization of PpsR from Rhodobacter sphaeroides[J]. Acta Crystallogr D Biol Crystallogr, 2014, 70(Pt 3):863-876.
[19]Moskvin OV, Gilles-Gonzalez MA, Gomelsky M. The PpaA/AerR regulators of photosynthesis gene expression from anoxygenic phototrophic proteobacteria contain heme-binding SCHIC domains[J]. J Bacteriol, 2010, 192(19):5253-5256.
[20]Dong C, Elsen S, Swem LR, et al. AerR, a second aerobic repressor of photosynthesis gene expression in Rhodobacter capsulatus[J]. J Bacteriol, 2002, 184(10):2805-2814.
[21]Gomelsky L, Sram J, Moskvin OV, et al. Identification and in vivo characterization of PpaA, a regulator of photosystem formation in Rhodobacter sphaeroides[J]. Microbiology, 2003, 149(Pt 2):377-388.
[22]Cheng Z, Li K, Hammad LA, et al. Vitamin B12 regulates photosystem gene expression via the CrtJ antirepressor AerR in Rhodobacter capsulatus[J]. Mol Microbiol, 2014, 91(4):649-664.
[23]Jaubert M, Zappa S, Fardoux J, et al. Light and redox control of photosynthesis gene expression in Bradyrhizobium:dual roles of two PpsR[J]. J Biol Chem, 2004, 279(43):44407-44416.
[24]Bellini D, Papiz MZ. Structure of a bacteriophytochrome and light-stimulated protomer swapping with a gene repressor[J]. Structure, 2012, 20(8):1436-1446.
[25]Willett J, Smart JL, Bauer CE. RegA control of bacteriochlorophyll and carotenoid synthesis in Rhodobacter capsulatus[J]. J Bacteriol, 2007, 189(21):7765-7773.
[26]Swem LR, Kraft BJ, Swem DL, et al. Signal transduction by the global regulator RegB is mediated by a redox-active cysteine[J]. EMBO J, 2003, 22(18):4699-4708.
[27]Swem LR, Gong X, Yu CA, et al. Identification of a ubiquinonebinding site that affects autophosphorylation of the sensor kinase RegB[J]. J Biol Chem, 2006, 281(10):6768-6775.
[28]Kim YJ, Ko IJ, Lee JM, et al. Dominant role of the cbb3 oxidase in regulation of photosynthesis gene expression through the PrrBA system in Rhodobacter sphaeroides 2.4.1[J]. J Bacteriol, 2007,189(15):5617-5625.
[29]Oh JI, Ko IJ, Kaplan S. Reconstitution of the Rhodobacter sphaeroides cbb3-PrrBA signal transduction pathway in vitro[J]. Biochemistry, 2004, 43(24):7915-7923.
[30]Badrick AC, Hamilton AJ, Bernhardt PV, et al. PrrC, a Sco homologue from Rhodobacter sphaeroides, possesses thiol-disulfide oxidoreductase activity[J]. FEBS Lett, 2007, 581(24):4663-4667.
[31] Thompson AK, Gray J, Liu A, et al. The roles of Rhodobacter sphaeroides copper chaperones PCu(A)C and Sco(PrrC)in the assembly of the copper centers of the aa(3)-type and the cbb(3)-type cytochrome c oxidases[J]. Biochim Biophys Acta,2012, 1817(6):955-964.
[32]Bowman WC, Du S, Bauer CE, et al. In vitro activation and repression of photosynthesis gene transcription in Rhodobacter capsulatus[J]. Mol Microbiol, 1999, 33(2):429-437.
[33]Ranson-Olson B, Jones DF, Donohue TJ, et al. In vitro and in vivo analysis of the role of PrrA in Rhodobacter sphaeroides 2.4.1 hemA gene expression[J]. J Bacteriol, 2006, 188(9):3208-3218.
[34]Dangel AW, Tabita FR. Protein-protein interactions between CbbR and RegA(PrrA), transcriptional regulators of the cbb operons of Rhodobacter sphaeroides[J]. Mol Microbiol, 2009, 71(3):717-729.
[35]Dangel AW, Luther A, Tabita FR. Amino acid residues of RegA important for interactions with the CbbR-DNA complex of Rhodobacter sphaeroides[J]. J Bacteriol, 2014, 196(17):3179-3190.
[36]Carrica Mdel C, Fernandez I, Sieira R, et al. The two-component systems PrrBA and NtrYX co-ordinately regulate the adaptation of Brucella abortus to an oxygen-limited environment[J]. Mol Microbiol, 2013, 88(2):222-233.
[37]Eraso JM, Roh JH, Zeng X, et al. Role of the global transcriptional regulator PrrA in Rhodobacter sphaeroides 2.4.1:combined transcriptome and proteome analysis[J]. J Bacteriol, 2008, 190(14):4831-4848.
[38]Rey FE, Oda Y, Harwood CS. Regulation of uptake hydrogenase and effects of hydrogen utilization on gene expression in Rhodopseudomonas palustris[J]. J Bacteriol, 2006, 188(17):6143-6152.
[39]Ouchane S, Picaud M, Therizols P, et al. Global regulation of photosynthesis and respiration by FnrL:the first two targets in the tetrapyrrole pathway[J]. J Biol Chem, 2007, 282(10):7690-7699.
[40]Ranson-Olson B, Zeilstra-Ryalls JH. Regulation of the Rhodobacter sphaeroides 2.4.1 hemA gene by PrrA and FnrL[J]. J Bacteriol,2008, 190(20):6769-6778.
[41]Fedotova Y, Zeilstra-Ryalls J. Analysis of the role of PrrA,PpsR, and FnrL in intracytoplasmic membrane differentiation of Rhodobacter sphaeroides 2.4.1 using transmission electron microscopy[J]. Photosynth Res, 2014, 119(3):283-290.
[42]Smart JL, Willett JW, Bauer CE. Regulation of hem gene expression in Rhodobacter capsulatus by redox and photosystem regulators RegA, CrtJ, FnrL, and AerR[J]. J Mol Biol, 2004, 342(4):1171-1186.
[43]Dispensa M, Thomas CT, Kim MK, et al. Anaerobic growth of Rhodopseudomonas palustris on 4-hydroxybenzoate is dependent on AadR, a member of the cyclic AMP receptor protein family of transcriptional regulators[J]. J Bacteriol, 1992, 174(18):5803-5813.
[44]Bose A, Newman DK. Regulation of the phototrophic iron oxidation(pio)genes in Rhodopseudomonas palustris TIE-1 is mediated by the global regulator, FixK[J]. Mol Microbiol, 2011, 79(1):63-75.
[45]Nishimura K, Shimada H, Hatanaka S, et al. Growth, pigmentation,and expression of the puf and puc operons in a light-respondingrepressor(SPB)-disrupted Rhodobacter sphaeroides[J]. Plant Cell Physiol, 1998, 39(4):411-417.
[46]Wang X, Yang H, Zhang Y, et al. Remarkable enhancement on hydrogen production performance of Rhodobacter sphaeroides by disrupting spbA and hupSL genes[J]. International Journal of Hydrogen Energy, 2014, 39(27):14633-14641.
[47]Shimada H, Ishida K, Machiya Y, et al. Isolation of SIP, a protein that interacts with SPB, a possible transcriptional regulatory factor in Rhodobacter sphaeroides[J]. Plant Cell Physiol, 2007, 48(10):1504-1508.
[48]Buggy JJ, Sganga MW, Bauer CE. Characterization of a lightresponding trans-activator responsible for differentially controlling reaction center and light-harvesting-I gene expression in Rhodobacter capsulatus[J]. J Bacteriol, 1994, 176(22):6936-6943.
[49] Fixen KR, Baker AW, Stojkovic EA, et al. Apo-bacteriophytochromes modulate bacterial photosynthesis in response to low light[J]. Proc Natl Acad Sci USA, 2014, 111(2):E237-244.
[50] Berghoff BA, Glaeser J, Sharma CM, et al. Photooxidative stressinduced and abundant small RNAs in Rhodobacter sphaeroides[J]. Mol Microbiol, 2009, 74(6):1497-1512.
[51] Mank NN, Berghoff BA, Hermanns YN, et al. Regulation of bacterial photosynthesis genes by the small noncoding RNA PcrZ[J]. Proc Natl Acad Sci USA, 2012, 109(40):16306-16311.
[52] Hirakawa H, Harwood CS, Pechter KB, et al. Antisense RNA that affects Rhodopseudomonas palustris quorum-sensing signal receptor expression[J]. Proc Natl Acad Sci USA, 2012, 109(30):12141-12146.
[53]Zeng X, Kaplan S. TspO as a modulator of the repressor/antirepressor(PpsR/AppA)regulatory system in Rhodobacter sphaeroides 2.4.1[J]. J Bacteriol, 2001, 183(21):6355-6364.
[54]Li K, Pasternak C, Hartig E, et al. Thioredoxin can influence gene expression by affecting gyrase activity[J]. Nucleic Acids Res,2004, 32(15):4563-4575.
[55]Evans K, Georgiou T, Hillon T, et al. The purple phototrophic bacteria[M]. Springer Netherlands, 2009:799-809.
(责任编辑 狄艳红)
Differences in Regulation of Photosynthetic Gene Expression Between Different Purple Bacteria
DENG Chun-hao SUN Liang-yu CHEN Kun-ming
(College of Life Sciencess,Northwest A&F University,Yangling 712100)
The purple bacteria are prokaryotes that can proceed photosynthesis without oxygen release. They use light energy to produce ATP for their own growth and metabolism. The photosystem of a purple bacterium consists of a series of complex of pigments and proteins encoded by photosynthetic genes like puc, puf, puh, bch, crt and so on. The expressions of their photosynthetic genes mainly are influenced by light and external redox signals;however, the expression and regulation mode of photosynthetic genes are greatly different between different kinds of purple bacteria. This review introduces the research advances on several expression and regulation systems of photosynthetic genes, such as PpsR/CrtJ like regulator, two-component phosphorylation regulation system and CRP-FNR like regulator in purple bacteria while focusing on Rhodobacter sphaeroides and Rhodopseudomonas palustris. The results from the functional and characteristic analysis of the regulation mechanism in different purple bacteria suggest that, each regulation system existing in different bacterial strain shows similar functions but with somewhat unique characteristics. This study gives us further insights for understanding the mechanisms of expression and regulation of photosynthetic genes in the purple bacteria, and provides important
for application of these purple bacteria in the future.
photosynthetic genes;Rhodobacter sphaeroides;Rhodopseudomonas palustris;purple bacteria
10.13560/j.cnki.biotech.bull.1985.2016.02.005
2015-04-22
教育部新世纪优秀人才支持计划项目(NCET-11-0440),教育部留学回国人员科研启动费
邓春浩,男,硕士,研究方向:细胞生物学;E-mail:dchdr@163.com
陈坤明,男,博士,研究方向:植物细胞逆境分子生理与调控,光合作用与生物能源;E-mail:kunmingchen@nwsuaf.edu.cn
