5-Aza-CdR对低氧NG108-15细胞的影响机制研究
2016-10-11张柱霞孙明英杨洁姜树原闫少春邵国
张柱霞 孙明英 杨洁 姜树原 闫少春 邵国
(包头医学院中心实验室生物医学研究中心,包头 014010)
5-Aza-CdR对低氧NG108-15细胞的影响机制研究
张柱霞 孙明英 杨洁 姜树原 闫少春 邵国
(包头医学院中心实验室生物医学研究中心,包头 014010)
通过使用DNA甲基转移酶(DNA methyltransferases,DNMTs)抑制剂5-氮-2'脱氧胞苷(5-aza-2'deoxycytidine,5-Aza-CdR)和低氧干预神经细胞系NG108-15,旨为揭示5-Aza-CdR、低氧、低氧预适应对NG108-15细胞增殖和细胞周期影响的相关机制。利用5-Aza-CdR(10.0 μmol/L)孵育NG108-15细胞后进行低氧与低氧预适应处理;使用倒置显微镜观察细胞形态的变化;通过RTCA分析细胞增殖指数;收集细胞后使用流式细胞仪检测各组细胞周期和细胞凋亡的变化情况;利用Real-time PCR检测甲基转移酶DNMTs和细胞周期相关基因在mRNA水平的表达变化情况。结果表明,5-Aza-CdR和低氧抑制NG108-15细胞增殖,促进细胞早期和晚期凋亡,低氧预适应促进细胞的增殖。然而,5-Aza-CdR处理后再低氧与低氧预适应,DNMTs和细胞相关周期基因的mRNA转录增加(P<0.05)。10.0 μmol/L的5-Aza-CdR联合低氧处理抑制细胞的增殖,低氧预适应对细胞的增殖有促进作用。
NG108-15细胞;5-氮-2'脱氧胞苷;低氧;低氧预适应
低氧预适应(Hypoxic preconditioning)是指一次或多次短暂、非致死性低氧刺激后,可以增强机体对致死性缺血/低氧的耐受性,是一种细胞内源性保护机制的启动[1]。据流行病学研究显示临床上各种心血管疾病都与缺血/低氧有着密切的联系[2],但是低氧预适应的应用却研究甚少。前期的实验研究显示低氧预适应影响DNA的甲基化,DNA甲基化是表观遗传学中很重要的研究方向,对DNA进行甲基化修饰的酶是甲基转移酶(DNA methyltransferases,DNMT),已发现了3种有催化活性的转移酶[3]:DNMT1、DNMT3A和DNMT3B。
核苷酸类似物5-Aza-CdR[4]作为去甲基化的试剂,以其抑制DNMTs而广泛应用于表观遗传学的研究[5]。由于DNA甲基化在正常细胞的周期中有重要作用,5-Aza-CdR对细胞的周期、分化和死亡产生影响[6]。5-Aza-CdR在肿瘤的治疗方面有广泛的应用[7],因其可掺入DNA中抑制DNA的复制。其在神经发育和分化,突触可塑性、学习记忆,以及维持神经元的生存等相关基因的表达方面具有重要作用[8]。
NG108-15细胞系由Bernd Hamprecht 于1971年建立,目前已在国内不少实验室传代和利用,并将其作为生物模型[9]和药物作用靶点进行研究[10]。NG108-15细胞作为神经细胞模型,由于其细胞膜上存在多种离子通道和受体[11],在神经生物学相关研究领域是一种优良的模型,并得到广泛地应用。5-Aza-CdR对肿瘤细胞系细胞周期的影响已有报道[12-15],但其对神经细胞周期的影响尚未见报道。因此,本研究利用小鼠神经细胞系NG108-15为实验材料,通过研究5-Aza-CdR和低氧预适应对细胞的影响,旨为在体内研究5-Aza-CdR对神经系统的影响奠定基础。
1 材料与方法
1.1 材料
细胞 NG108-15细胞购于上海细胞所。
Dulbecco,s Modified Eagle Medium(GIBCO 公司);5-Aza-CdR(Sigma 公司);TRIzol(TaKaRa公司);superscript III(Invitrogen 公司);2 X real-time PCR Mix(南京凯基);其余试剂为国产试剂。CO2培养箱(Therom);三气培养箱(Therom);xCELLigence DP系统(艾森生物公司提供);流式细胞仪(BD FACSCantoTMⅡ)。Real-time PCR仪(ABI公司7900-HT)。
1.2 方法
1.2.1 细胞培养及5-Aza-CdR的配制 NG108-15细胞于含10%新生牛血清的Dulbecco,s Modified Eagle Medium培养基,37℃、CO2体积分数为5%的培养箱内培养。5-Aza-CdR粉末溶于PBS中配成浓度为1.0 mmol/L 的贮存液,过滤后-20℃保存。
1.2.2 NG108-15细胞的5-Aza-CdR和低氧处理 当细胞达到指数生长期时进行实验,实验分为4组:C组(空白组)、H组(低氧组)、Ha组(10 μmol/L 5-Aza-CdR+低氧组)、HP(低氧预适应组)。低氧预适应组条件:低氧(1%O2/5% CO2/94% N2)30 min和常氧(21% O2/5% CO2/75%N2)30 min交替进行,共4个循环,然后低氧8 h,复氧8 h;低氧组是直接低氧刺激8 h,然后复氧8 h。收集细胞。
1.2.3 RTCA测定细胞的增殖 NG108-15细胞株在进行细胞毒性实验前一天进行细胞传代,当细胞融合度在60%-80%之间,从培养箱中取出细胞,悬浮细胞,调整细胞浓度达8×104个/mL。E-plate置于仪器检测台上测试培养基的基线。上室孔中加入细胞悬液,室温放置30 min。测定24 h内细胞贴壁生长情况。10 μmol/L的5-Aza-CdR药物处理,24 h后,3个E-plate分别进行不同条件的处理,对照、低氧、低氧预适应处理。实时检测细胞增值指数。
1.2.4 NG108-15细胞流式测定凋亡和周期 收集细胞悬液,用PBS缓冲液洗3遍,加入预冷的70%的乙醇固定1 h,用3 mL PBS在流式管中洗一遍,用1 mL PI染色4℃避光反应30 min。测定细胞周期的变化。
预冷的PBS洗细胞悬液3遍,用1 mL的Binding buffer悬浮细胞,转移100 μl到流式管中,染色,涡旋震荡,室温避光放置15 min,补加400μL的Binding buffer。测定细胞凋亡的变化。
1.2.5 Real-time PCR检测DNMT各亚型在转录水平的表达变化 TRIzol法提取各组细胞的总RNA,Nondrop 2000微量分光光度计检测总RNA的纯度和含量。使用的superscript III试剂盒(Invitrogen公司)逆转录总RNA成为cDNA,于-20℃保存。引物由Invitrogen公司合成(表1)。
Real-time PCR:Real-time PCR的条件与先前发表文章相同[7]。Real-time检测中CCND1、CCND2和DNMTs的CT值通过β-actin的CT值均一化,即ΔCT= CT目标基因-CTbeta-actin,而DNMTs mRNA相对丰度值以ΔΔCT值(DD value)表示,ΔΔCT=2-ΔCT。
1.2.6 统计学处理 用SPSS 10.0数据统计软件ANOVA和Tukey对组间数据进行处理和分析,数值以±s表示。P<0.05为差异有统计学意义。

表 1 引物序列
2 结果
2.1 倒置显微镜观察细胞形态图
NG108-15细胞分别进行C、H、Ha、HP四种不同的处理,24 h后倒置显微镜下观察它们的形态变化情况。图1可以看出,C组细胞呈现上皮性贴壁生长,细胞呈多角形,形状不规则,轮廓清楚,细胞间结构紧密,细胞生长旺盛(图1-C);H组有少部分细胞形态出现了皱缩,多角形态趋于规则,细胞密度降低,细胞间接触变松,部分细胞体积缩小,胞核固缩,染色质凝集成块状,折光性及贴壁能力减弱,增殖减慢,细胞存活数减少,生长状态变差(图-H);Ha和HP组细胞形态较H组有一定程度的好转,不过HP组表现比较明显,表明低氧预适应可以很明显增强细胞的耐受性。

图1 不同处理下的细胞显微形态图(100×)
2.2 RTCA监测加入5-Aza-CdR前后低氧预适应细胞增值变化情况。
上一阶段实验已经证明5-Aza-CdR对细胞的抑制浓度为10 μmol/L[2]。通过RTCA(实时定量细胞动态监测)分析C、H、Ha和HP组对细胞增殖的作用,如图2所示。与C组相比,H组和Ha组都抑制了细胞的增殖(P≤0.05,n=6),HP促进细胞的增殖(P≤0.05,n=6)。与H组相比,Ha组进一步抑制了细胞的增殖(P≤0.05,n=6),可见低氧和5-Aza-CdR都抑制细胞的增殖,而低氧预适应对细胞增殖有一定的促进作用。

图2 RTCA测定NG108-15细胞在不同情况下的增长指数
2.3 5-aza-CdR对低氧预适应处理的NG108-15细胞周期和凋亡的影响
10.0 μmol/L的5-Aza-CdR处理24 h后,进行低氧、低氧预适应处理,24 h后,使用流式细胞仪测定C、H、Ha、HP组细胞的周期和凋亡变化情况(图3),单纯的低氧很明显的促进了细胞的早期和晚期凋亡,低氧预适应对细胞凋亡有抑制作用。加入5-Aza-CdR后再低氧,与对照组相比促进细胞的凋亡,但没有直接低氧组表现明显。细胞周期变化不是很显著,但是可以观察到5-Aza-CdR联合低氧组细胞G2期表达增加(图4)。
2.4 5-Aza-CdR对低氧预适应处理的NG108-15细胞甲基转移酶和细胞相关周期基因的影响
收集细胞,提取RNA,反转录为cDNA。使用Real-time PCR检测它们的表达变化情况(图5)。以mRNA/beta-actin mRNA的相对丰度表示,H组较C组,其DNMT1、DNMT3A和DNMT3B mRNA表达显著降低(0.1619±0.1157 VS 0.584 9±1.121 3, 1.433 7±1.027 2 VS 6.323 5±8.637 0,0.272 6±0.2265 VS 0.910 2±1.499 1);HP组较H组其DNMT1、DNMT-3A和DNMT3B mRNA表达显著升高(1.297 6 ±1.347 1 VS 0.161 9±0.115 7,4.397 1±3.776 2 VS 1.433 7±1.027 2和0.781 2±0.778 5 VS 0.272 6±0.226 5,P≤0.05,n=9);Ha组较H组其DNMT1、DNMT3A和DNMT3B mRNA表达显著升高(1.5236±1.9031 VS 0.161 9±0.115 7,18.690 2±19.326 3 VS 1.433 7±1.027 2和2.122 3±2.364 3 VS 0.272 6±0.226 5,P≤0.05,n=9),低氧很明显地抑制了甲基转移酶的地转录水平。低氧预适应和加入5-Aza-CdR后低氧同样会提高甲基转移酶转录水平,且表现为统计学意义。
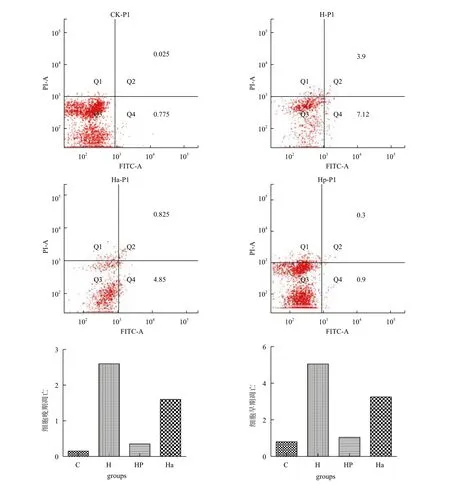
图3 5-Aza-CdR对低氧预适应的神经细胞NG108-15凋亡的影响

图4 流式测定NG108-15细胞周期情况

图5 甲基转移酶DNMTs和细胞周期相关基因在空白组、低氧预适应组和加入5-Aza-CdR后低氧预适应处理组的RNA转录水平的表达情况
细胞周期相关基因,以mRNA/beta-actin mRNA的相对丰度表示(图5),H组较C组,其CCND1和CCND2 mRNA表达显著降低(0.429 7±0.641 9 VS 0.696 6±0.906 4,0.169 2±0.170 2 VS 0.417 1± 0.674 4),HP组较H组其CCND1和CCND2 mRNA表达显著升高(0.565 4±0.581 8 VS 0.429 7±0.641 9P≤0.05,n=9,0.524 0±0.468 2 VS 0.169 2±0.170 2),Ha组较H组其CCND1和CCND2 mRNA表达显著升高(0.646 5±0.738 6 VS 0.429 7±0.641 9 P≤0.05,n=9,1.305 5±1.280 0 VS 0.169 2±0.170 2),低氧很明显的抑制了细胞周期相关基因地转录水平。低氧预适应和加入5-Aza-CdR后低氧同样会提高转录水平,且表现为统计学意义。
3 讨论
本实验利用细胞模型进行研究5-Aza-CdR和低氧预适应对细胞的影响。细胞形态学的变化告诉我们,5-Aza-CdR和低氧处理都会使细胞的形态、伸展性、贴壁性变差,而低氧预适应处理细胞则会使它们都有所好转。RTCA细胞增值曲线显示,5-Aza-CdR和低氧抑制细胞的分裂增殖,低氧预适应很明显地促进分裂增殖,其增殖速度甚至超过了空白对照。我们猜测低氧和5-Aza-CdR抑制了细胞内部的某种生长、分裂因子,使细胞的生长增殖信号传递受到抑制,表现为低氧和5-Aza-CdR处理后细胞的生长增殖受到抑制,而低氧预适应促进细胞的生长增殖,为在临床上抑制肿瘤和促进正常细胞的增殖提供了理论指导。因此我们可以通过使用一定浓度的5-Aza-CdR和一定程度的低氧来抑制肿瘤细胞的生长,而同样可以通过采用低氧预适应的方法来预防或治疗临床上由于缺血缺氧造成的各种疾病,使症状得到一定程度的改善。
细胞凋亡结果提示我们,加入5-Aza-CdR后再进行低氧处理促进早期细胞的凋亡,但是对晚期细胞的凋亡促进作用不是很明显,直接低氧处理对细胞早期和晚期凋亡都有很明显的促进作用。而低氧预适应对细胞的早期、晚期凋亡都表现为明显的抑制作用。实时定量PCR结果显示低氧抑制甲基转移酶和细胞周期相关基因的转录水平,而加入5-Aza-CdR或是低氧预适应处理后,它们的转录水平都提高,且都有显著性的统计学差异。
文献报道5-Aza-CdR对DNMT1有抑制作用[15,16],这与5-Aza-CdR对小鼠神经细胞NG108-15的作用相似,同时看到低氧抑制了甲基转移酶的转录,但是在低氧后加入5-Aza-CdR后却很大程度的促进了甲基转移酶的转录水平。这与低氧预适应有相同的表达。5-Aza-CdR处理的细胞再进行低氧处理后,却进一步抑制了细胞增殖。猜测5-Aza-CdR配合低氧提高甲基转移酶的活性,DNA的甲基化表达增加,能关闭某些基因的活性,从而达到抑制肿瘤的目的。同样这种处理使细胞周期相关基因表达提高,使细胞阻滞在G2期。低氧预适应对细胞增殖具有促进作用,提高低氧条件下的耐受性。
5-Aza-CdR联合低氧和低氧预适应条件下,DNMTs和细胞周期相关基因有相同的表达水平,但是前者表现为抑制细胞增殖,而后者却表现为促进细胞增殖作用。可见5-Aza-CdR联合低氧对细胞的抑制作用还有其它的途径。而且报道DNA甲基化以突触可塑性的机制在大脑中参与学习记忆[17-20],但是其具体机制尚不清楚。这两个问题需要我们更深一步的探索。
4 结论
低氧抑制细胞的增殖,5-Aza-CdR联合低氧抑制细胞的增殖但是对DNMTs和细胞周期相关基因的表达却有促进作用。低氧预适应对DNMTs和细胞周期相关基因的表达却有促进作用,同时促进细胞的增殖。
[1]吕国蔚, 崔秀玉, 赵兰峰, 等. 低氧预适应的脑机制[J]. 中国应用生理学杂志, 2004(1):99-104.
[2]Li S, Zhang Y, Shao G, et al. Hypoxic preconditioning stimulates angiogenesis in ischemic penumbra after acute cerebral infarction[J]. Neural Regen Res, 2013, 8(31):2895-2903.
[3]Shao G, Zhang R, Zhang S, et al. Splice variants DNMT3B4 and DNMT3B7 overexpression inhibit cell proliferation in 293A cell line[J]. In Vitro Cell Dev Biol Anim, 2013, 49(5):386-394.
[4]Desjobert C, El Mai M, Gérard-Hirne T, et al. Combined analysis of DNA methylation and cell cycle in cancer cells[J]. Epigenetics,2015, 1(10):1-10.
[5]Fruhwald MC, Plass C. Global and gene-specific methylation patterns in cancer:aspects of tumor biology and clinical potential[J]. Mol Genet Metab, 2002, 75(1):1-16.
[6]Al-Salihi M, Yu M, Burnett DM, et al. The depletion of DNA methyltransferase-1 and the epigenetic effects of 5-aza-2’deoxycytidine(decitabine)are differentially regulated by cell cycle progression[J]. Epigenetics, 2011, 6(8):1021-1028.
[7]Glasspool RM, Brown R, Gore ME, et al. A randomised, phase IItrial of the DNA-hypomethylating agent 5-aza-2’-deoxycytidine(decitabine)in combination with carboplatin vs carboplatin alone in patients with recurrent, partially platinum-sensitive ovarian cancer[J]. Br J Cancer, 2014, 110(8):1923-1929.
[8]Levenson JM, Roth TL, Lubin FD, et al. Evidence that DNA(cytosine-5)methyltransferase regulates synaptic plasticity in the hippocampus[J]. J Biol Chem, 2006, 281(23):15763-15773.
[9]Campanha HM, Carvalho F, Schlosser PM. Active and peripheral anionic sites of acetylcholinesterase have differential modulation effects on cell proliferation, adhesion and neuritogenesis in the NG108-15 cell line[J]. Toxicol Lett, 2014, 230(2):122.
[10]Brown DA, Higashida H. Voltage-and calcium-activated potassium currents in mouse neuroblastoma x rat glioma hybrid cells[J]. J Physiol, 1988, 397:149-165.
[11]Kaushal N, Robson MJ, Rosen A, et al. Neuroprotective targets through which 6-acetyl-3-(4-(4-(4-fluorophenyl)piperazin-1-yl)butyl)benzo[d]oxazol-2(3H)-one(SN79), a sigma receptor ligand, mitigates the effects of methamphetamine in vitro[J]. Eur J Pharmacol, 2014, 724:193-203.
[12]陈天, 陈克平, 陈昭烈. Vero细胞无血清培养技术的研究与应用[J]. 生物技术通讯, 2009(3):417-421.
[13] Sun P. Contact inhibition against senescence[J]. Oncotarget,2014, 5(17):7212-7213.
[14]Camley BA, Zhang Y, Zhao Y, et al. Polarity mechanisms such as contact inhibition of locomotion regulate persistent rotational motion of mammalian cells on micropatterns[J]. Proc Natl Acad Sci USA, 2014, 111(41):14770-14775.
[15]Leontieva OV, Demidenko ZN, Blagosklonny MV. Contact inhibition and high cell density deactivate the mammalian target of rapamycin pathway, thus suppressing the senescence program[J]. Proc Natl Acad Sci USA, 2014, 111(24):8832-8837.
[16]Azechi T, Sato F, Sudo R, et al. 5-aza-2’-Deoxycytidine, a DNA methyltransferase inhibitor, facilitates the inorganic phosphorusinduced mineralization of vascular smooth muscle cells[J]. J Atheroscler Thromb, 2014, 21(5):463-476.
[17] Maslov AY, Lee M, Gundry M, et al. 5-aza-2’-deoxycytidineinduced genome rearrangements are mediated by DNMT1[J]. Oncogene, 2012, 31(50):5172-5179.
[18]Morris MJ, Monteggia LM. Role of DNA methylation and the DNA methyltransferases in learning and memory[J]. Dialogues Clin Neurosci, 2014, 16(3):359-371.
[19]Morris MJ, Adachi M, Na ES, et al. Selective role for DNMT3a in learning and memory[J]. Neurobiol Learn Mem, 2014, 115:30-37.
[20]Massart R, Freyburger M, Suderman M, et al. The genome-wide landscape of DNA methylation and hydroxymethylation in response to sleep deprivation impacts on synaptic plasticity genes[J]. Transl Psychiatry, 2014, 4:e347.
(责任编辑李楠)
The Affecting Mechanism of 5-aza-2'-deoxycytidine on the NG108-15 Cells in Hypoxia
ZHANG Zhu-xia SUN Ming-ying YANG Jie JIANG Shu-yan YAN Shao-chun SHAO Guo
(Biomedical Research Center of Center Laboratory,Baotou Medical College,Baotou 014010)
The aim of this study is to explore the mechanisms of 5-aza-2'deoxycytidine(5-Aza-CdR)and/or hypoxia and/or hypoxic preconditioning on the proliferation and cycle of NG108-15 cells while using the inhibitor(5-Aza-CdR)of DNA methyltransferases(DNMTs)to interfere the nerve cell line NG108-15. The 10.0 μmol/L 5-Aza-CdR was added to cell culture medium, and then cells were treated in hypoxia and/or hypoxic preconditioning. The cell morphology was observed under inverted microscope. The proliferation of NG108-15 was measured using the RTCA. The cell apoptosis and cell cycle were analyzed through flow cytometry analysis. The mRNA levels of DNMTs and cell cycleassociated gene were analyzed by real-time PCR. 5-Aza-CdR and hypoxia inhibited NG108-15 cells proliferation, promoted cell early and late apoptosis, and hypoxic preconditioning promoted cell proliferation. However, as cells were treated by hypoxic or hypoxic preconditioning after the cell treated with 5-Aza-CdR, DNMTs and mRNA transcription of cell cycle-associated genes increased. Conclusively, the jointed treatment of 10.0 μM 5-Aza-CdR with hypoxic inhibited the proliferation of nerve cell line NG108-15, and hypoxic preconditioning had a promoting effect on the cell proliferation.
NG108-15 cell line;5-aza-2'-deoxycytidine;hypoxic;hypoxic preconditioning
10.13560/j.cnki.biotech.bull.1985.2016.01.034
2015-03-16
国家自然科学基金项目(81460283),内蒙古自然科学基金项目(2014MS0810),自治区研究生科研创新项目[S201410127(Y02)]
张柱霞,女,硕士研究生,研究方向:生物化学和分子生物学,E-mail:836796250@qq.com;孙明英同为本文第一作者
邵国,男,博士,教授,研究方向:低氧神经保护;E-mail:shootshao@163.com
