复合红景天苷支架材料对大鼠骨髓间充质干细胞的影响
2016-10-11王九娜向大伟唐俊杰李根赵玲秦文赵红斌
王九娜 向大伟 唐俊杰 李根 赵玲 秦文 赵红斌
(兰州军区兰州总医院骨科研究所,兰州 730050)
复合红景天苷支架材料对大鼠骨髓间充质干细胞的影响
王九娜 向大伟 唐俊杰 李根 赵玲 秦文 赵红斌
(兰州军区兰州总医院骨科研究所,兰州 730050)
探讨复合红景天苷微球的胶原蛋白材料支架对大鼠骨髓间充质干细胞的影响及作用。将红景天苷制作成微球复合到胶原蛋白中,扫描电镜观察材料支架的表征,接种大鼠骨髓间充质干细胞后扫描电镜观察细胞与材料的黏附性,CCK-8法测细胞在材料上的增殖情况,HE染色检测细胞在材料上的增殖及形态,S100免疫荧光化学法检测干细胞向神经细胞的分化情况。结果显示,细胞接种到材料上,在材料上黏附并生长。同种材料,随着时间的延长,材料上的细胞显著增殖(P <0.05)。神经细胞标志性蛋白S100表达为阳性。复合红景天苷微球的胶原蛋白具有良好的生物相容性,红景天苷微球不影响细胞在材料上的增殖,且可有效诱导大鼠间充质干细胞向神经细胞分化。
红景天苷;胶原蛋白;材料支架;骨髓间充质干细胞
随着组织工程学的发展,天然高分子生物材料及人工合成高分子材料日益受到人们的重视。胶原蛋白作为一种天然高分子生物材料,已被证实可以用作组织工程支架。胶原蛋白是细胞外基质的主要成分,是构成动物机体的重要功能物质。胶原蛋白是动物体内含量最高的结构蛋白,占动物体内总蛋白量的25%-33%[1],其中以结缔组织最多,富含脯氨酸、甘氨酸和羟脯氨酸,能与各种细胞结合并构成性能各异的组织,可形成细胞外支架,维持组织和器官形态的完整性,对细胞、组织乃至器官行使正常功能并对外伤修复有重大影响。胶原蛋白的种类很多,一般皮肤和骨骼中的是Ⅰ型胶原蛋白。胶原分子链上含有大量的亲水基团,与水结合的能力很强。近年来,胶原蛋白已广泛应用于营养保健品、化妆品、生物肥料等领域,而且在医药工业和医学临床的研究和应用中发挥着巨大作用,同时在药物释放等方面存在着巨大的发展潜力。
红景天苷(Salidroside)是景天科红景天属红景天的主要有效成分。红景天为多年生草本植物,主要生长在海拔1 600-4 000米的高寒、干燥、缺氧、强紫外线照射、昼夜温差大的地区,具有极强的环境适应能力和生命力。红景天具有很多药理作用,包括抗病毒活性[2]、抗癌性[3]、保肝药[4]、治疗糖尿病[5]以及抗氧化作用[6]。近些年,大量体外研究[7-9]表明红景天苷具有神经营养及保护神经的作用。国内外学者一直致力于对红景天苷的研究。我们课题组亦对红景天苷进行过相关研究报道[10,11]。
本研究以胶原蛋白为支架材料,并复合红景天苷微球,探讨与大鼠骨髓间充质干细胞(Bone marrow mesenchymal stem cells,BMSCs)的相互作用。
1 材料与方法
1.1 材料
1.1.1 主要试剂 红景天苷(中国食品药品检定研究院,纯度为99.8%),壳聚糖(浙江金壳生物化学有限公司),司盘80(广州市西陆化工有限公司),京尼平(和光纯药工业株式会社,日本),DMEM-F12培养基(Gibcol公司,美国),胎牛血清(杭州四季青公司),DAPI(Sigma公司,美国),FITC标记的羊抗兔二抗(Abcam公司,美国),S100(兔抗,Abcam公司,美国),胰酶(Gibcol公司,美国),CCK-8(Sigma公司,美国)。
1.1.2 主要仪器 低速离心机(LD4-2A,北京医用离心机厂),37℃烘箱(HH·B11·360-BS-II,上海跃进医疗器械厂),冷冻干燥机(LGJ,军事医学科学院实验仪器厂),恒温振荡器(ZD-85,江苏金坛市医疗仪器厂),扫描电子显微镜(JSM-5600,日本电子光学公司),电子天平(AE200,上海威足医疗仪器厂),酶标仪(ABI7300,美国应用生物系统公司),37℃ CO2培养箱(HF90/HF240,SMART CELL),荧光倒置显微镜(日本Olympus公司)。
1.1.3 实验动物 清洁级雌性Wistar大鼠,体重200±15 g,由兰州军区兰州总医院动物实验科提供,符合国家实验动物检疫标准。
1.2 方法
1.2.1 红景天苷微球的制备 采用乳液法制备红景天苷微球。将250 mg壳聚糖溶于10 mL 2%的乙酸溶液,20 mg红景天苷溶于1 mL水中,二者混合均匀,制成水液。将100 mL液体石蜡与2 mL司盘80置于锥形瓶中,放在磁力搅拌器上搅拌(450 r/min)。水液装入分液漏斗后对准搅拌中心,使水液滴下,被打散成均匀的微球,约每30-40 s滴一滴。待水液滴完后,再逐滴加入5% 三聚磷酸钠25 mL,持续搅拌至形成稳定的微球颗粒。静置1 h,弃上清,2 000 r/min离心30 min,弃上清,分别用石油醚和异丙醇洗涤3次,弃上清后,-20℃冰箱过夜,真空冷冻干燥机冻干12 h,密闭封装。
1.2.2 材料的制备 将自制胶原蛋白(从猪皮中提取)或复合了红景天苷微球的胶原蛋白(每40 g胶原蛋白中加入30 mg红景天苷微球)装入到10 mL的注射器中,注入到24孔板中,盖上盖子,其间防止出现气泡,置于-20℃冰箱里过夜,真空冷冻干燥机里冻干72 h,得到空白材料和加药材料。将每个圆柱体材料分割成4个,用1%京尼平37℃交联30min,每10 min翻转1次,无水乙醇浸泡5 min,蒸馏水洗3遍,10 min/次,-20℃冰箱里过夜,真空冷冻干燥机冻干24 h,60Coγ射线灭菌法灭菌,自封袋分装并密封常温保存备用。
1.2.3 细胞的提取与培养 取雌性Wistar大鼠1只,体重200±15 g,脱颈处死,体积分数75%乙醇消毒10 min,在超净工作台里取其后腿的股骨及胫骨,去掉肌肉,分别用剪刀剪去一端,完全培养基(含体积分数10%肽牛血清)冲洗骨髓腔至其发白,细胞筛过滤,得到分散单个核细胞,37℃ 5%CO2培养箱里培养,隔日换液,培养得到贴壁细胞。流式细胞法鉴定提取细胞为骨髓间充质干细胞。取第4代细胞用于实验。
1.2.4 细胞在支架材料上的黏附 材料经过60Coγ射线灭菌法灭菌后,无菌环境下,将空白材料和加药材料各取一块,放入培养皿中,加入4 mL 0.01mol/L PBS浸泡,37℃ CO2培养箱过夜。取第4代BMSCs,待生长至80%融合,弃原液,用0.01 mol/L PBS洗2遍,0.25%的胰酶消化30 s左右,完全培养基终止消化,用枪轻轻吹打,混合均匀,调整细胞密度为2×109个/L,每块材料接种2 mL,置于37℃ CO2培养箱培养5 h,补加完全培养基至4 mL,37℃ CO2培养箱培养,隔日换液。
细胞与材料共培养3 d后将材料取出,2.5%戊二醛固定。材料固定24 h后,弃戊二醛,0.01 mol/L PBS洗2遍,10 min/次,丙酮-醋酸异戊酯(1∶1)作用10 min,弃丙酮-醋酸异戊酯后,醋酸异戊酯作用30 min,无水乙醇洗3次,30 min/次。将材料置于-20℃冰箱冷冻过夜,冷冻干燥机冻干48 h,制样,喷金,扫描电镜进行观察。
1.2.5 CCK-8法测细胞在材料上的增殖 材料经过60Coγ射线灭菌法灭菌后,无菌环境下剪成3 mm×3 mm×1 mm的长方体状,放入96孔板,分成8组。第1组为空白材料+完全培养基,第2组为加药材料+完全培养基,第3组为空白材料+完全培养基+红景天苷(药物终浓度为100 μg/mL),第4组为完全培养基,第5-8组为第1-4组对应的加细胞组,每组25孔。加细胞组每孔接BMSCs约2×104个,置37℃ CO2培养箱培养,隔日换液。细胞与材料共培养24 h,每组取5个孔,将待测孔的材料转移到新孔,加100 μL完全培养基,无细胞组原液吸去,加100 μL完全培养基,各待测孔加入CCK-8 10 μL,37℃ 5% CO2培养箱孵育3 h,将各孔的液体转移至另一96孔板中,酶标仪测450 nm处的吸光值。细胞与材料共培养48 h,72 h,5 d,7 d,同样的方法,每组取5个孔测450 nm处的吸光值。
1.2.6 细胞-支架材料复合培养 材料经过60Coγ射线灭菌法灭菌后,无菌环境下将材料裁成长方体状(13 mm×5 mm×2 mm),放入12孔板,分为3组:(1)空白材料组+完全培养基;(2)加药材料组+完全培养基;(3)空白材料+完全培养基+红景天苷(药物终浓度为100 μg/mL)。每组接种大鼠BMSCs约2×105个,置于37℃ 5% CO2培养箱中培养。
细胞与材料共培养7 d及14 d时,3组材料各取出一个,10%福尔马林固定。固定7 d后,将材料取出,用自动脱水机进行脱水,常规石蜡包埋并切片,进行HE染色、S100免疫荧光化学染色。
1.2.7 免疫荧光化学染色 石蜡切片经常规脱蜡,0.01% tritonX-100作用10 min,0.02 mol/L PBS 洗3次,每次3 min;3% H2O2作用10 min,0.02 mol/L PBS 洗3次,每次3 min;5% BSA封闭20 min,弃多余封闭液,滴加S100(1∶200稀释)一抗,湿盒4℃过夜,0.02mol/L PBS 洗,每次5 min;加入FITC标记的羊抗兔二抗(1∶1 000稀释),37℃湿盒避光作用30 min,0.02 mol/L PBS洗3次,5 μg/mL DAPI室温避光染核10 min,0.02 mol/L PBS洗3次,每次5 min,50%甘油磷酸缓冲液封片,荧光显微镜下观察并拍照。
1.3 统计分析
采用统计软件Spass17.0进行单因素方差分析,数据以±s表示,P <0.05具有统计学意义。
2 结果
2.1 材料的表征
扫描电镜结果(图1)显示,材料呈海绵多孔状,相互连通,交织成网状,孔隙约为50-150 μm。纯胶原蛋白材料表面相对光滑,复合红景天苷微球材料可见到嵌入于材料中的红景天苷微球。
2.2 细胞在材料上的黏附性
材料与细胞共培养3 d后,扫描电镜结果(图2)显示,细胞较均匀地贴附在材料表面,细胞核大小均一,细胞在材料上黏附并生长,材料与细胞具有良好的生物相容性。
2.3 细胞在材料上的增殖
CCK-8法测细胞增殖结果见表1。细胞接种到材料上,同种材料,随着时间,材料上的细胞显著增殖(P <0.05)。同一时间,接种到材料上的细胞增殖与单纯的细胞增殖相比有显著差异(P <0.05)。复合红景天苷微球材料细胞的增殖与空白材料或在培养基里直接加入红景天苷组无显著差异(P >0.05)。
2.4 HE染色
细胞与材料共培养7 d,14 d HE染色结果见图3,7 d时可见细胞在材料表面黏附,生长和增殖。细胞呈梭形,形态良好,大小均一。14 d与7 d相比较,材料上的细胞明显增多。该结果提示细胞可以在材料上黏附、生长并增殖,材料与细胞具有良好的生物相容性。
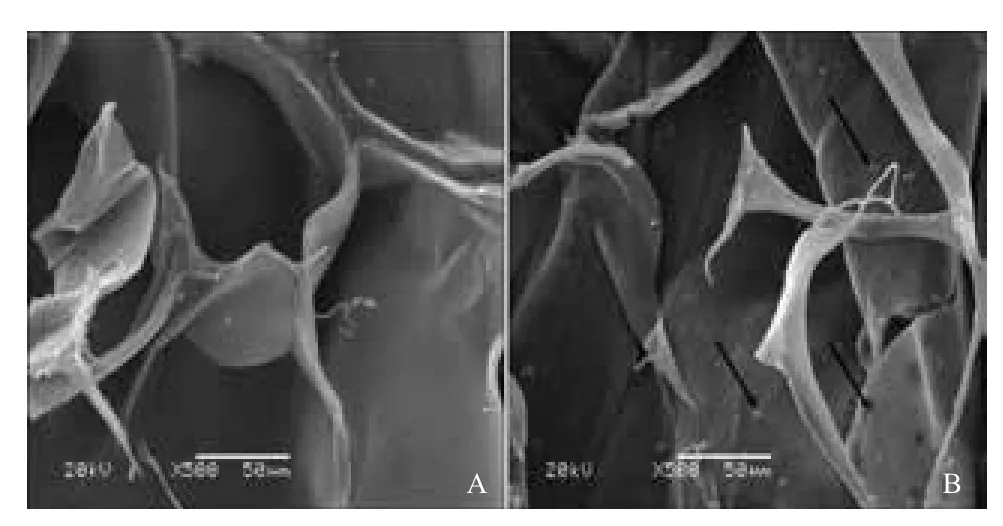
图 1 芯层材料的扫描电镜

图2 材料接种细胞3d后扫描电镜
表1 细胞在不同材料上的增殖(±s)

表1 细胞在不同材料上的增殖(±s)
注:同一种材料a表示P <0.05 vs其他组,同一时间b表示P <0.05 vs其他组
类别24 h48 h72 h5 d7 d空白材料组0.37±0.010.47±0.02a0.901±0.03a1.28±0.03a1.95±0.05a复合红景天苷微球组0.36±0.010.47±0.01a0.89±0.01a1.30±0.01a1.94±0.05a空白材料+红景天苷组0.33±0.010.47±0.01a0.90±0.03a1.30±0.02a2.02±0.08a细胞组0.87±0.04b1.21±0.03ab2.15±0.05ab2.70±0.12ab3.23±0.06ab
2.5 S100免疫荧光化学染色
S100免疫荧光化学染色见图4,结果显示空白材料组S100表达为阴性,复合红景天苷微球材料组与空白材料+红景天苷组S100表达为均阳性。14 d与7 d相比较,材料上S100表达的阳性细胞明显增多。该结果显示,胶原蛋白复合红景天苷微球能有效的诱导BMSCs向神经细胞转化并增殖。
3 讨论
作为细胞外基质的主要成分,胶原蛋白常常被用作组织工程支架材料。用胶原蛋白制作的支架材料呈海绵多孔状,孔隙之间相互连通,交织成网状,有利于细胞的黏附。但胶原蛋白力学性能差,易降解,本研究用1%的京尼平将材料进行交联,改变了胶原蛋白的力学性能。姜东林等[12]发现经京尼平交联后,胶原蛋白具有更好的力学性能、生物相容性及更低的生物降解速率,且不影响细胞在材料上的增殖。我们此前也进行过相关研究报道[13]。
BMSCs是存在于骨髓中的一种干细胞,在体外可以诱导分化为成骨细胞、脂肪细胞、肌肉细胞和软骨细胞等中胚层来源的细胞,还可跨胚层分化为具有神经元或胶质细胞表型的细胞。BMSCs不仅取材方便,不存在伦理道德问题,而且在体外容易培养,增殖速度快,不会出现免疫排斥反应[14]。在胶原蛋白材料支架上三维培养细胞与二维培养细胞相比较,同一时间,细胞的增殖有显著差异,说明支架材料对细胞的增殖有影响。但在胶原蛋白中复合红景天苷微球材料组与胶原蛋白材料组相比,同一时间,细胞的增殖无显著差异,红景天苷不影响大鼠BMSCs在材料上的增殖。这与白海等[15]的报道红景天苷可影响BMSCs增殖,一定浓度下的红景天苷可促进BMSCs增殖不一致。范东艳等[16]研究发现,10 μg/mL红景天苷可促进BMSCs增殖分化,又不影响细胞增殖分化等生物学特性。林海泓等[17]研究证明红景天苷对hMSCs有明显促进增殖的作用,对其的分化影响不明显。但这些研究报道均是对细胞进行二维培养,本研究是对细胞进行材料支架上培养,且复合了红景天苷微球,微球发挥了一个缓释的效果。但不同的培养是否会对细胞的增殖产生影响有待进一步研究。

图 3 不同材料接种细胞7 d及14 d HE染色

图4 不同材料接种细胞7 d及14 d S100免疫荧光化学染色
传统中药丹参、川芎嗪、黄芩甙等传统中药制剂[18-20]可诱导 BMSCs 向神经样细胞分化。S100免疫荧光化学染色结果显示,复合红景天苷微球材料组和空白材料+红景天苷组中,神经标志性蛋白S100表达为阳性,该结果表明复合红景天苷微球的胶原蛋白可有效诱导大鼠BMSCs向神经细胞分化。姜红[21],李云玲[22-24]等均对BMSCs向神经细胞分化作过研究报道。张维烨等[25]用红景天苷药物血清诱导从新生Wistar大鼠中获得的神经干细胞,发现红景天苷药物血清可以促进神经干细胞向神经元方向分化,并促进神经元细胞生长发育。也有研究证明红景天苷能够抑制神经细胞凋亡,从而对损伤的神经细胞起到保护作用[26]。将红景天苷用于神经修复,发展前景十分广阔。
4 结论
复合红景天苷微球的胶原蛋白支架材料具有良好的生物相容性。红景天苷微球复合到胶原蛋白中,发挥了良好的缓释作用且可有效诱导大鼠间充质干细胞向神经细胞分化。
[1] 王学川, 宗奕珊, 等. 胶原蛋白的改性原理及其应用研究进展[J]. 陕西科技大学学报:自然科学版, 2013, 31(5):28-34.
[2] Wang H, Ding Y, Zhou J, et al. The in vitro and in vivo antiviral effects of salidroside from Rhodiola rosea L. against coxsackievirus B3[J]. Phytomedicine, 2009, 16(2):146-155.
[3] Hu X, Lin S, Yu D, et al. A preliminary study:the anti-proliferation effect of salidroside on different human cancer cell lines[J]. Cell Biology and Toxicology, 2010, 26(6):499-507.
[4] Ouyang J, Gao Z, Ren Z, et al. Synergistic effects of rMSCs and salidroside on the experimental hepatic fibrosis[J]. Die Pharmazie-An International Journal of Pharmaceutical Sciences,2010, 65(8):607-613.
[5] Li HB, Ge Yk, Zheng XX, et al. Salidroside stimulated glucose uptake in skeletal muscle cells by activating AMP-activated protein kinase[J]. European Journal of Pharmacology, 2008, 588(2):165-169.
[6] Qian EW, Ge DT, Kong SK. Salidroside promotes erythropoiesis and protects erythroblasts against oxidative stress by up-regulating glutathione peroxidase and thioredoxin[J]. Journal of Ethnopharmacology, 2011, 133(2):308-314.
[7] Zhang L, Yu H, et al. Protective effects of salidroside on hyd-rogen peroxide-induced apoptosis in SH-SY5Y human neuroblastoma cells[J]. European Journal of Pharmacology, 2007, 564(1):18-25.
[8] Chen X, Liu J, Gu X, Ding F. Salidroside attenuates glutamateinduced apoptotic cell death in primary cultured hippocampal neurons of rats[J]. Brain Research, 2008, 1238:189-198.
[9] Li QY, Wang HM, Wang ZQ, et al. Salidroside attenuates hypoxiainduced abnormal processing of amyloid precursor protein by decreasing BACE1 expression in SH-SY5Y cells[J]. Neuroscience Letters, 2010, 481(3):154-158.
[10] 张全伟, 赵兴绪, 赵红斌, 等. 红景天苷体外诱导大鼠骨髓间充质干细胞分化为神经元样细胞[J]. 中国组织工程研究,2012, 16(14):2496-2504.
[11] 陈亚男. 红景天苷通过 ERK1/2 和 PI_3K/AKT/mTOR 信号通路介导小鼠骨髓间充质干细胞向神经元样细胞定向分化的研究[D]. 兰州:兰州大学, 2014.
[12] 姜东林, 杨骏宇, 姜升阳, 等. 京尼平交联 L-赖氨酸修饰胶原蛋白支架的性能和生物相容性[J]. 生物医学工程学杂志,2014, 31(4):816-821.
[13] 王九娜, 赵兴绪, 唐俊杰, 等. 胶原蛋白与黏土混合材料的性能研究[J]. 中国组织工程研究, 2014, 18(47):7573-7578.
[14] Pittenger MF. When the body can’t heal itself[J]. Nature,2001, 414(6859):132-132.
[15] 白海, 王存邦, 等. 红景天苷对骨髓间充质干细胞增殖的影响[J]. 中国实验血液学杂志, 2014, 22(4):1072-1077.
[16] 范东艳, 刘永华, 王苹, 等. 红景天苷对 BMSC 生物学特性影响[J]. 西藏大学学报, 2012,(2):32-35.
[17] 林海泓, 朱军, 施海明, 等. 红景天苷对人骨髓间充质干细胞增殖, 分泌的影响[C]. 第八次全国中西医结合心血管病学术会议论文集, 2007.
[18] 王勇, 陆长青, 王凡. 丹参诱导大鼠骨髓间充质干细胞向神经样细胞分化[J]. 解剖学杂志, 2007, 30(2):207-210.
[19] 梁峰, 马洁华, 杨丽娜. 川芎嗪联合创伤性脑组织匀浆液诱导骨髓间充质干细胞向神经样细胞分化[J]. 中国组织工程研究与临床康复, 2011, 15(23):4299-4302.
[20] 赵汉宁, 董晓先, 董伟华, 等. 黄芩甙诱导骨髓间充质干细胞分化为神经元样细胞的实验研究[J]. 现代中西医结合杂志,2005, 14(5):576-578.
[21] 姜红. 成年小鼠骨髓间充质干细胞培养及体外诱导分化为神经元样细胞[D]. 沈阳:中国医科大学, 2003.
[22] 李云玲, 陈笛, 等. 成人骨髓间充质干细胞分化为神经元样细胞的体外研究[J]. 第三军医大学学报, 2003, 25(11):941-943.
[23] 羊明智, 彭立军, 胡文凯. 甲钴胺体外诱导大鼠骨髓间充质干细胞向神经元样细胞分化[J]. 中国组织工程研究, 2013, 17(32):5741-5748.
[24] 张明, 赵红斌, 荔志云, 等. 红景天苷对大鼠 BMSCs 向胆碱能神经细胞分化的影响[J]. 中国修复重建外科杂志, 2012, 26(2):158-165.
[25] 张维烨, 程桂芹, 等. 红景天苷对新生大鼠海马区神经干细胞分化的研究[J]. 解剖科学进展, 2008, 14(2):205-208.
[26] Zhang W, Zhu L, Niu F, et al. Protective effects of salidroside on injury induced by hypoxia/hypoglycemia in cultured neurons[J]. China journal of Chinese Materia Medica, 2004, 29(5):459-462.
(责任编辑李楠)
The Effect of Scaffold Combined with Salidroside on Rat Bone Mesenchymal Stem Cells
WANG Jiu-na XIANG Da-wei TANG Jun-jie LI Gen ZHAO Ling QIN Wen ZHAO Hong-bin
(Institute of Orthopedics,Lanzhou General Hospital of Lanzhou Military Area,Lanzhou 730050)
The objective of this work is to investigate the effect of collagen scaffolds combined with salidroside microspheres on rat bone mesenchymal stem cells(rBMSCs). The salidroside was made into microspheres that combined into the collagen. The surface character of material was observed by scanning electron microscopy(SEM). The material was implanted with rBMSCs and observed for the cell adhesion on the material by SEM. The cell proliferation on the material was measured by CCK-8, and the cell proliferation and morphology on the material were detected by HE staining. S100 immunofluorescence was used to detect the differentiation of stem cells into nerve cells. Cells were seeded onto the scaffold, adhered and grew well on materials. While the time increased, the cells on the same material were significant proliferation(P< 0.05). The expression of nerve cell marker protein S100 was positive. Conclusively, collagen combined with salidroside microspheres had good biocompatibility, salidroside microspheres did not affect cell proliferation on the material, and it could induce effectively rBMSCs into nerve cells.
salidroside;collagen;scaffold;bone marrow mesenchymal stem cells
10.13560/j.cnki.biotech.bull.1985.2016.01.033
2015-06-16
国家自然科学基金面上项目(81470087)
王九娜,女,硕士研究生,研究方向:组织工程;E-mail:ljty2012@163.com
赵红斌,男,教授,研究方向:材料与组织工程;E-mail:zhao761032@163.com
