牦牛CAPN3基因的克隆及组织表达特异性
2016-10-11王英杰阎萍潘和平吴晓云李明霞
王英杰阎萍潘和平吴晓云李明霞
(1.西北民族大学生命科学与工程学院,兰州 730030;2.中国农业科学院兰州畜牧与兽药研究所 甘肃省牦牛繁育工程重点实验室,兰州 730050)
牦牛CAPN3基因的克隆及组织表达特异性
王英杰1,2阎萍1,2潘和平2吴晓云1,2李明霞2
(1.西北民族大学生命科学与工程学院,兰州 730030;2.中国农业科学院兰州畜牧与兽药研究所 甘肃省牦牛繁育工程重点实验室,兰州 730050)
以牦牛背最长肌为材料,采用RT-PCR法克隆了CAPN3基因的CDs区,并对其进行生物信息学分析。结果表明,牦牛CAPN3基因的CDs区长2 469 bp,编码822个氨基酸残基;生物信息学分析显示,其编码的蛋白属于非分泌表面蛋白,含有35个磷酸化位点,主要在细胞质和细胞核中发挥生物学作用。二级结构主要由α-螺旋、无规则卷曲、伸展链和β-转角组成,具有CysPc、calpain-Ⅲ和EFh家族蛋白结构域,无信号肽。牦牛CAPN3基因与黄牛、绵羊和猪在系统发育树上的距离最近。运用实时荧光定量分析CAPN3在不同组织中的表达量,CAPN3基因在牦牛的7种组织中均有表达,但在背最长肌、胰脏中的表达量较高。
牦牛;CAPN3基因;克隆;生物信息学分析;表达模式
牦牛是分布于海拔2 000 m以上,以我国青藏高原为中心及其毗邻的高山亚高山地区的牛种之一,为牧民提供奶、肉、毛、役力、染料等生产和生活必需品[1]。牦牛肉属于半野生天然绿色食品,富含蛋白质、氨基酸、铁元素以及胡萝卜素、钙等微量元素,脂肪含量低,但牦牛肉的嫩度制约着其市场的接受度,因此,影响牦牛肉嫩度的候选基因成为当今研究的热点之一。
钙蛋白酶是一种存在于细胞内的非溶酶体性的限制性蛋白水解酶,与肉的嫩度和风味等食用品质密切相关。钙蛋白酶系统基因是理想的肉质嫩度分子标记[2]。CAPN3基因作为影响肉嫩度的候选基因,其分子生物学特性和生理调控功能是近年来研究的热点之一。CAPN3(Calpain3)是最典型的组织特异性钙蛋白酶,其在骨骼肌细胞中呈现高度表达特异性[3]。Lian等[4]的研究揭示了CAPN3的mRNA水平和蛋白质水平与肉的嫩度之间存在显著相关性。鸭骨骼肌发育过程中,CAPN3基因与肌纤维类型和肌纤维的生长发育密切相关。CAPN3基因的变异影响肉的品质[5]。侯冠彧等[6]对CAPN3基因的5'区域进行SNP检测和基因型分析,初步断定该基因本座位有影响肉牛生长及牛肉嫩度的倾向。Kimberly等[7]发现CAPN3的活性影响鼠肌肉的营养。延边黄牛CAPN3在位点5 556发生G→A突变,导致该位点的脂肪酸和氨基酸含量在不同基因型之间存在差异[8]。CAPN3的活性和表达水平影响肉质嫩度,并且与肢带型肌营养不良密切相关,存在着很强的遗传效应[9-11]。CAPN3在组织中的表达具有特异性,猪CAPN3和CAST基因在背最长肌中有较高的表达量[20]。姚慧等[13]分析了CAPN1和CAST基因在牦牛不同组织中的表达差异。CAPN3基因在牦牛不同组织中表达情况尚未见报道。
本实验克隆CAPN3基因的CDs区,并进行生物信息学分析,以期为深入研究牦牛CAPN3基因的定位与表达调控奠定基础。同时采用荧光定量PCR技术,检测CAPN3基因在牦牛不同组织的表达量,为进一步揭示CAPN3基因的分子生物学功能提供理论依据。
1 材料与方法
1.1 材料
1.1.1 组织样、细菌菌株和载体 本实验选择3头成年青海省大通牦牛,屠宰后分别采集心脏、肝脏、脾脏、肺脏、肾脏、胰脏、背最长肌组织,放入液氮保存。
1.1.2 主要试剂 E.coli DH5α购于宝生物公司;pGEM-T easy克隆载体购于Promega公司。TaKaRa反转录试剂盒、Trizol试剂、LA Taq DNA聚合酶购自宝生物工程有限公司,DNA Marker DL2000、DNA纯化回收试剂盒、高纯度质粒小量提取试剂盒、SYBR Green荧光定量试剂盒购于TIANGEN公司。
1.1.3 引物的设计与合成 根据GenBank中普通牛CAPN3基因cDNA序列(登录号:149197.1)应用Primer5软件设计引物(表1),由Sangon公司合成。
1.2 方法
1.2.1 总RNA的提取 以成年牦牛背最长肌为材料,参照RNA提取试剂盒说明书提取RNA。总RNA用无菌DEPC水溶解,用琼脂糖凝胶电泳检测RNA的完整性。
1.2.2 PCR扩增与测序 RNA反转录为cDNA:反应总体系为10 μL:5×gDNA Eraser Buffer(2.0 μL),gDNA Eraser(1.0 μL),Total RNA(1.0 μL),Rrime Script RT Enzyme Mix(1.0 μL),RT Primer Mix(1.0 μL),5×RrimeScript Buffer(4.0 μL),RNase Free H2O(10 μL)。PCR反应条件为:42℃ 25 min,85℃5 s,4℃保存。
PCR扩增双链:总反应体系25 μL:LA Premix 12.5 μL,上下游引物各0.5 μL,cDNA模板1.0 μL,RNase Free H2O 10.5 μL。PCR反应条件为:94℃预变性4 min;94℃变性30 s,55℃退火40 s,72℃延伸3 min,共30个循环;72℃延伸10 min,4℃保存。PCR产物用1%的琼脂糖凝胶电泳检测。
用DNA凝胶回收试剂盒回收PCR扩增产物,连接到pGEM-T easy载体上,16℃过夜。转化E.coli DH5α感受态细胞,接种转化后的DH5α于含有Amp的LB固体培养基上,37℃培养12-16 h后,挑取阳性菌落接种于含有Amp的LB液体培养基中,37℃条件下220 r/min振荡培养8 h,对菌液进行PCR鉴定后,送至Sangon公司测序。
1.2.3 实时荧光定量PCR反应体系和条件 根据NCBI中下载的牦牛CAPN3基因(登录号:NM-174260.2)应用Primer5.0设计1对引物(表1)。实时荧光定量PCR反应体系为10 μL,SYBRI Mix 5 μL,模板cDNA 0.6 μL,上下游引物各0.2 μL,RNase Free H2O 4 μL。PCR反应程序:95℃预变性30 s;95℃变性15 s,60℃退火30 s,40个循环。
2 结果
2.1 CAPN3基因的克隆及理化性质分析
PCR产物用10 g/L的琼脂糖凝胶电泳分析,可见3条DNA片段(图1),大小分别为2 064、1 057和1 104 bp,与预期DNA片段大小一致。重组质粒测序结果(图2)表明,本研究克隆测序得到的序列为3 180 bp,通过BLAST比对确定该序列为牦牛CAPN3基因,其中开放阅读框长2 469 bp,编码822个氨基酸,起始密码子为ATG,终止密码子为TGA,CAPN3基因编码的蛋白分子量约为94.58 kD,理论等电点为5.70。含有20种基本氨基酸,其中含量最高的是Glu(7.5%),含量最低的是His(1.9%);含有带负电荷的残基122个,正电荷残基107个,酸性氨基酸为14.84%,碱性氨基酸为14.96%。
2.2 CAPN3基因编码蛋白的疏水性/亲水性预测和分析
依据氨基酸分值越低亲水性越强和分值越高疏水性越强的规律可知,牦牛CAPN3基因氨基酸序列的第491位Arg具有最低的分值-3.967,其亲水性最强;第481位Phe具有最高分值2.978,其疏水性最强。可知,整个多肽链表现为亲水性(图3)。2.3 CAPN3基因编码蛋白信号肽和跨膜区分析
(3)以幼儿发展为中心的原则:家长助教的最终目的是促进幼儿的发展,所以活动的核心应围绕幼儿的全面发展进行。

图1 牦牛CAPN3基因PCR扩增产物的电泳图
蛋白信号肽分析表明,CAPN3编码的蛋白不存在信号肽,属于非分泌蛋白。编码蛋白所有氨基酸都位于膜表面,可知其是一种表面蛋白(图4)。
2.4 CAPN3基因编码蛋白的亚细胞定位
牦牛CAPN3基因编码蛋白的亚细胞定位分析结果可知,其分布在细胞质和细胞核中的可能性为39.1%,分布在线粒体中的可能性为8.7%,分布在液泡、细胞外基质和细胞骨架的可能性为4.3%。
2.5 牦牛CAPN3基因编码蛋白结构域和蛋白质功能位点预测
用Interpro软件对CAPN3基因编码蛋白进行结构域预测,结果(图5)显示,该序列在56-426氨基酸序列之间有CysPc家族蛋白功能域,在429-583氨基酸序列之间有calpain-Ⅲ家族蛋白功能域,在697-725、727-755、792-820氨基酸序列之间有EFh家族蛋白功能域。运用Netphos软件对CAPN3基因编码蛋白分析,可知该蛋白有25个丝氨酸磷酸化位点,2个苏氨酸磷酸化位点,8个酪氨酸磷酸化位点(图6)。
2.6 CAPN3基因编码蛋白的二级结构和三级结构预测
用SOPMA服务器预测CAPN3基因编码蛋白的二级结构,结果(图7)表明,该蛋白包含35.64% α-螺旋、43.8%无规则卷曲、15.33%伸展链和5.23% β-转角。可推断α-螺旋和无规则卷曲是牦牛CAPN3编码蛋白主要的二级结构元件。采用同源建模法,结果(图8)显示,该蛋白主要由α-螺旋、无规则卷曲和β-折叠组成,与二级结构预测结果基本一致。
使用MegAlign软件进行同源性分析(图9)发现,牦牛CAPN3基因编码蛋白与其他物种CAPN3基因编码蛋白具有很高的同源性,均在90%以上。使用MEGA5.1中的NJ法构建CAPN3基因的系统发育树,结果(图10)表明,牦牛与黄牛、绵羊和猪在系统发育树种距离较近,这与动物学分类一致。

图2 牦牛CAPN3基因和编码蛋白序列

图3 牦牛CAPN3基因编码蛋白的疏水性预测

图4 牦牛CAPN3基因编码蛋白跨膜分析
2.8 CAPN3基因在不同组织中的表达水平检测
CAPN3基因在所检测牦牛的心脏、肝脏、脾脏、肺脏、肾脏、胰脏、背最长肌组织中均有表达,而背最长肌、胰脏中的表达高于其他组织(图11)。
3 讨论

图5 牦牛CAPN3基因编码蛋白结构域预测
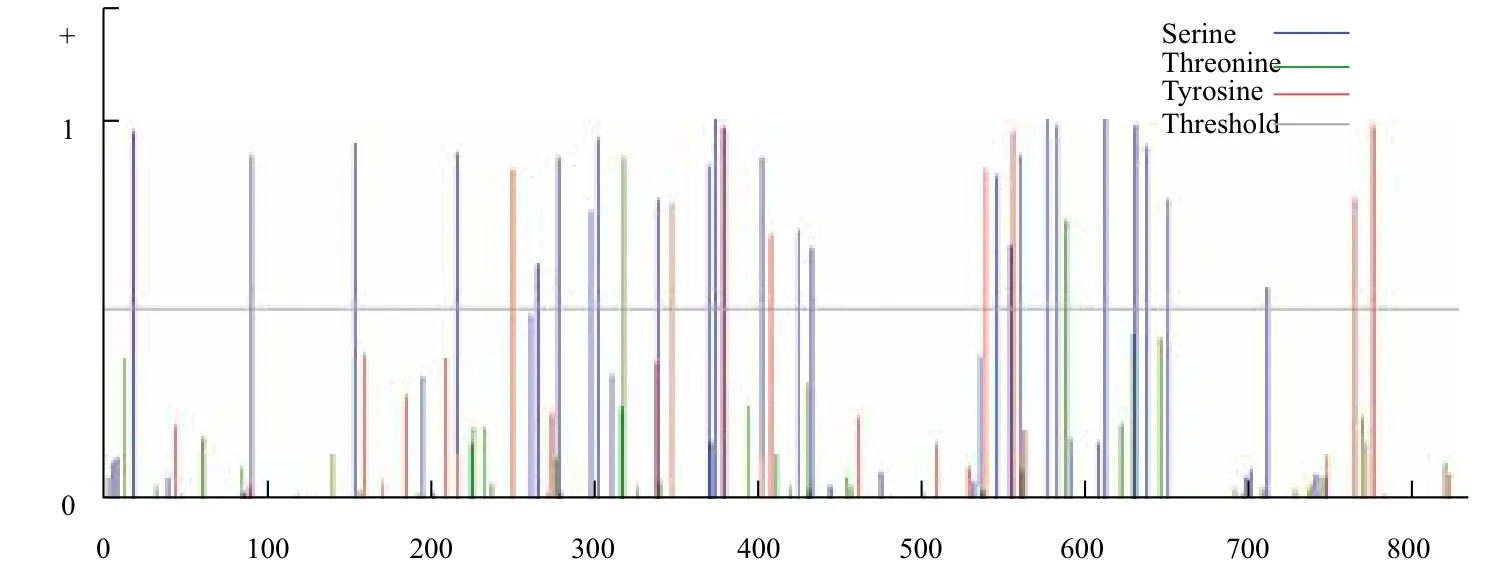
图6 牦牛CAPN3基因编码蛋白磷酸化位点预测
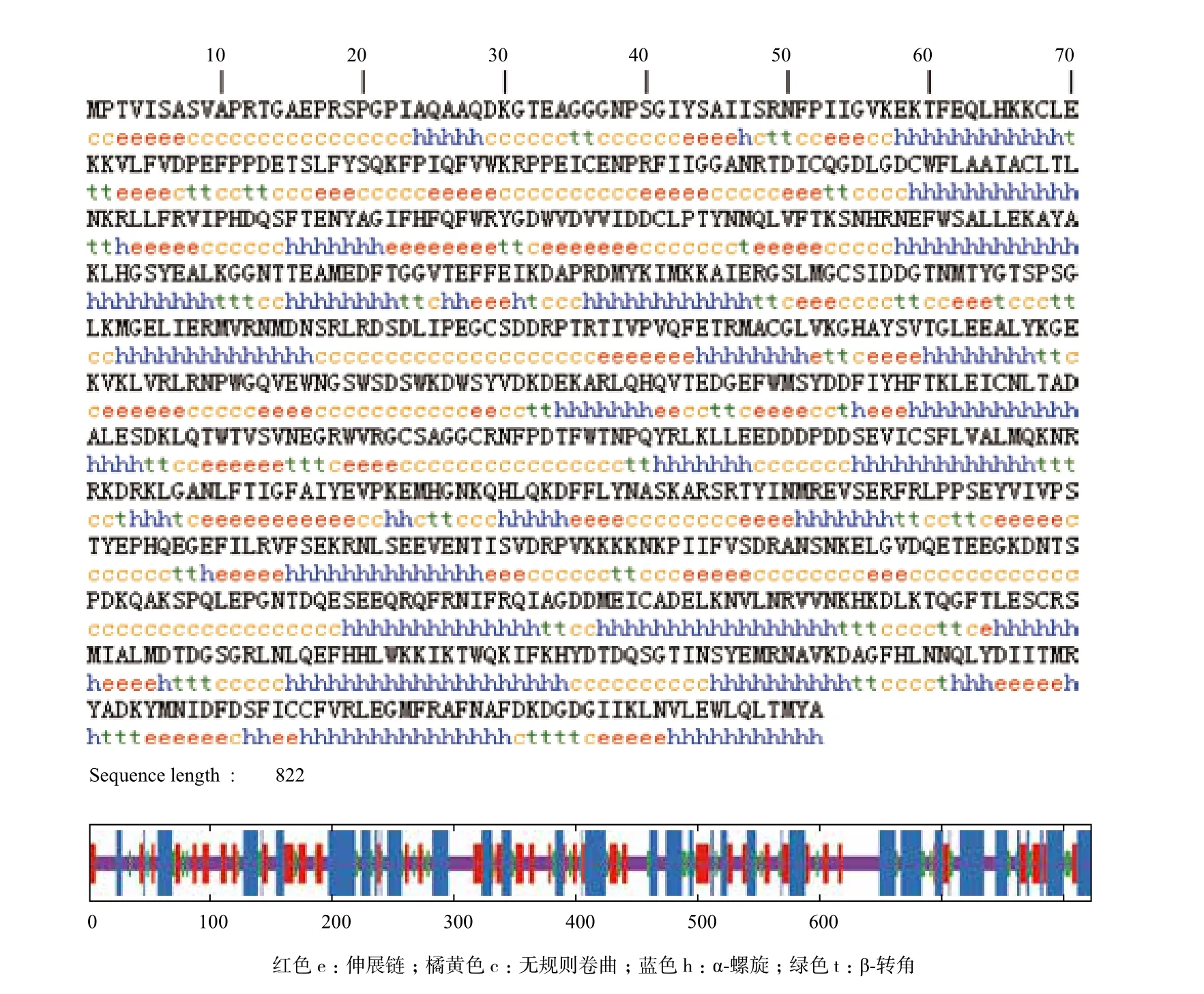
图7 牦牛CAPN3基因编码蛋白的二级结构预测

图8 牦牛CAPN3蛋白三级结构预测图
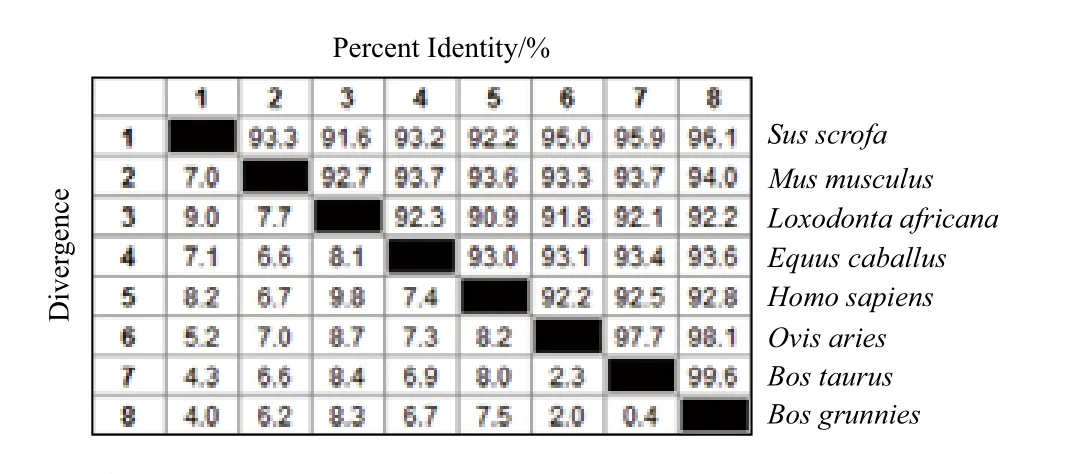
图9 不同物种CAPN3蛋白氨基酸序列同源性比较

图10 CAPN3基因的系统发育树

图11 牦牛CAPN3基因在不同组织中的表达量
CAPN3作为影响肉质性状的候选基因,近年来得到了越来越广泛的重视,CAPN3 可通过自溶降解肌联蛋白和伴肌动蛋白,在宰后肉的嫩化中扮演重要角色[6]。本研究采用RT-PCR技术,克隆获得CDs区长2 469 bp,其编码822个氨基酸,其编码的蛋白质为亲水性蛋白质,说明该蛋白为水溶性蛋白。亚细胞定位推断牦牛CAPN3基因编码蛋白可能主要在细胞质和细胞核中发挥生物学作用。磷酸化是一种重要的蛋白质翻译后修饰,蛋白磷酸化与多种生物学过程密切相关[14],该蛋白有35个磷酸化位点,可推测CAPN3在行使生理化功能前或者与其他蛋白互作时可能需要磷酸化的活化。二硫键可以使不同区域的氨基酸靠拢并形成稳定的空间拓扑结构,同时疏水氨基酸残基围绕着二硫键可形成局部疏水中心,利于形成稳定的高级结构域[15],这对CAPN3蛋白功能的发挥可以产生重要的影响。在一定的生理条件下,氨基酸序列决定了它的二级结构和空间构象。牦牛CAPN3蛋白由35.64% α-螺旋、43.8%无规则卷曲、15.33%伸展链和5.23% β-转角组成,不同的二级结构元件构成了CAPN3蛋白特定的高级结构,进而可以行使特定的生理生化功能。牦牛与黄牛、绵羊和猪在系统发育树种距离最近,这与Walder等[16]研究结果相似。
据Kinbara等[17]报道,CAPN3在成年动物中几乎只在骨骼肌中表达,而Missa等[11]用免疫印迹法分析小鼠的不同器官(骨骼肌、心脏、肝脏、子宫、肾脏、小肠和肺脏)CAPN3的表达量,发现其在骨骼肌中的表达是受限的[18]。张增荣等[19]研究山地乌骨鸡和商品鸡CAPN3基因在不同组织中的表达,发现CAPN3基因在胸肌和腿肌中的表达量最高,且CAPN3基因在10周龄商品鸡中所有组织的表达量高于10周龄的山地乌骨鸡。刘博洋等[20]研究发现草原红牛脾脏中的CAPN3基因表达量显著高于其他组织。本研究采用实时荧光定量PCR方法对牦牛不同组织中CAPN3基因表达水平差异进行检测,结果显示,CAPN3基因在所检测牦牛的心脏、肝脏、脾脏、肾脏、胰脏及背最长肌7种组织中均有表达,不同组织中表达水平不同。本研究发现所检测的牦牛的各组织中,胰脏、背最长肌中的CAPN3基因表达量显著高于其他组织。因此,背最长肌中CAPN3基因表达量显著高于其他组织,为改良牦牛肉的嫩度提供了理论依据。
4 结论
牦牛CAPN3基因的CDs区长2 469 bp,其编码822个氨基酸,其编码的蛋白质为亲水性蛋白质,说明该蛋白为水溶性蛋白。牦牛CAPN3蛋白由35.64% α-螺旋、43.8%无规则卷曲、15.33%伸展链和5.23% β-转角组成,不同的二级结构元件构成了CAPN3蛋白特定的高级结构,进而可以行使特定的生理生化功能。结果显示,所检测的牦牛的各组织中,胰脏、背最长肌中的CAPN3基因表达量显著高于其他组织。
[1]阎萍. 牦牛遗传资源保护及综合开发利用[J]. 畜牧与兽医,2005, 37(4):21-22.
[2]邱莫寒, 鲜凌瑾, 张平. 钙蛋白酶系统基因的研究进展[J].安徽农业科学, 2009, 37(28):13628-13631.
[3] Nakajima T, Fukiage C, Azuma M, et al. Different expression patterns for ubiquitous calpains and CAPN3 splice variants in monkey ocular tissues[J]. Biochimica Biophysica Acta, 2001, 15(19):55-64.
[4]Lian MA, Bekhit AED, Stevenson B, et al. Up and down regulation of longissimus tenderness parallels changes in the myofibril bound calpain 3 protein[J]. Meat Science, 2004, 67(5):433-455.
[5]朱文奇, 徐文娟, 束婧婷, 等. 鸭骨骼肌早期发育过程中钙蛋白酶3(CAPN3)基因的表达及其与肌纤维性状的关联[J]. 畜牧兽医学报, 2014, 45(3):385-390.
[6]侯冠彧, 曾鸿普, 王东劲, 等. 钙蛋白酶3(CAPN3)基因多态性与牛胴体性状的关联分析[J]. 畜牧兽医学报, 2010, 41(4):398-402.
[7]Kimberly A, Huebsche K, Christine MW. Mdmmuscular dystrophy:interactions with calpain 3 and a novel functional role for N2A domain[J]. Human Mole Genet, 2005, 19(14):2801-2811.
[8]金鑫, 张立春, 任春宇, 等. 延边黄牛CAPN3基因多态性与氨基酸含量关系研究[J]. 安徽农业科学, 2010, 38(7):3485-3487.
[9]Blzquez L, Azpitarte M, Senz A, et al. Characterization of calpain l3 transcripts in mammalian cells:expression of alternatively-spliced variants in non-muscle cell types[J]. Neurogenetics, 2008, 9(3):173-282.
[10]Geesink GH, Taylor RG, Koohmaraie M. Calpain 3/p94 is not involved in postmortem proteolysis[J]. J Anim Sci, 2005, 83(7):1646-1652.
[11]Todorva A, Georgieva B, Tournev I, et al. A large deletion and novel point mutations in the calpain 3(CAPN3)in Bulgarian LGMD2A patients[J]. Neurogenetics, 2007, 8(5):225-229.
[12]FelicioAM, Boschiero C, Balieiro JCC, et al. Identification and association of polymorphisms in CAPN1 and CAPN3 candidate genes related to performance and meat quality traits in chickens[J]. Genetics and Molecular Research, 2013, 12(1):47-482.
[13]姚慧, 陈智华, 钟金城, 等. CAPN1和CAST基因在牦牛不同组织中表达差异研究[J]. 河南农业科学, 2014, 43(3):139-140.
[14]Nascimbeni AC, Fanin MTasca E, Angelini C. Transcriptional and translational effects of intronic CAPN3 gene mutations[J]. Human Mutation, 2010, 31(9):1658-1669.
[15]Gandolfi G, Pomponio L, Ertbjerg P, et al. Investigation on CAST,CAPN1 and CAPN3 porcine gene polymorphism and expression in relation to post-mortem calpain activity in muscle and meat quality[J]. Meat Science, 2011, 88(7):694-700.
[16]Walder K, McMillan J, Lapsys N, et al. Calpain 3 gene expression in skeletal muscle is associated with body fat content and measures of insulin resistance-DRO[J]. Nature Publishing Group, 2002,26(4):442-449.
[17]Kinbara K, Sorimachi H, Ishiura S, et al. Skeletal musclespecific calpain, p94[J]. Biochem Pharmacol, 1998, 56(9):415-420.
[18]Krahn M, Lopez de Munain A, Streichenberger N, et al. CAPN3 mutations in patients with idiopathic eosinophilic myositis[J]. Ann Neurol, 2006, 59(5):905-911.
[19] 张增荣, 朱庆, 蒋小松, 等. 鸡CAPN3基因表达特异性研究[J].畜牧兽医科学, 2011, 24(5):622-624.
[20]刘博洋, 秦立红, 廉传江, 等. CAPN3基因在草原红牛不同组织中的表达差异[J]. 中国畜牧兽医, 2010, 37(10):105-107.
(责任编辑马鑫)
Cloning and Tissue-specific Expression of CAPN3 Gene in Yak
WANG Ying-jie1,2YAN Ping1,2PAN He-ping2WU Xiao-yun1,2LI Ming-xia2
(1. College of Life Science and Engineering,Northwest University for Nationalities,Lanzhou 730030;2. Key Laboratory of Yak Breeding Engineering of Gansu Province,Lanzhou Institute of Husbandry and Pharmaceutical Sciences,Chinese Academy of Agricultural Sciences,Lanzhou 730050)
Using the longissimus of yak(Bos grunniens)back as material, the CDs sequence of yak CAPN3 gene was cloned by RTPCR, and it was analyzed by bioinformatics. The results indicated that the length of CDs in yak CAPN3 gene was 2 469 bp and encoding 822 amino acid residues. Bioinformatics analysis showed that the protein encoded by CAPN3 was the non-secretory surface protein, containing 35 phosphorylation site, and mainly played a biological role in the cytoplasm and nuclei. The secondary structure was mainly composed of α-helices,random coil, extended chain and β-turn, having the structure domains of CysPc, calpain-Ⅲ and EFh families and no signal peptide. The CAPN3 of yak was the most similar with those of Bos taurus, Ovis aries and Sus scrofa in phylogenetic tree. Real-time PCR analysis revealed the expressions of CAPN3 in varied tissues. There were expressions in all 7 tissues, and they were high in the muscle and pancreas.
Bos grunniens;CAPN3 gene;cloning;bioinformatics;expression pattern
10.13560/j.cnki.biotech.bull.1985.2016.01.025
2015-04-14
西北民族大学研究生科研创新项目(ycx14165),国家科技支撑计划项目(2012BAD13B05)
王英杰,女,硕士研究生,研究方向:分子育种;E-mail:1124063095@qq.com
阎萍,女,研究员,博士生导师,研究方向:动物遗传育种;E-mail:pingyanlz@163.com
