美洲大蠊i型溶菌酶的原核表达及多克隆抗体制备
2016-10-11王赟翟素珍张春林王吉平
王赟翟素珍张春林王吉平
(1. 贵州医科大学生物与工程学院,贵阳 550004;2.贵州医科大学基础医学院,贵阳 550004)
美洲大蠊i型溶菌酶的原核表达及多克隆抗体制备
王赟1翟素珍2张春林2王吉平2
(1. 贵州医科大学生物与工程学院,贵阳 550004;2.贵州医科大学基础医学院,贵阳 550004)
旨在获得美洲大蠊i型溶菌酶PaI的原核表达蛋白,并制备鼠抗PaI多克隆抗体。PCR扩增PaI成熟肽编码序列,构建原核表达载体pET28a-PaI,诱导表达、纯化PaI-His融合蛋白,免疫Balb/c小鼠,间接ELISA法检测抗血清效价,Western blotting检测多克隆抗体的特异性。结果显示,PaI成熟肽部分的编码序列长414 bp,由137个氨基酸组成。构建的原核表达载体pET28a-PaI在大肠杆菌Rosetta(DE3)中成功表达,SDS-PAGE检测显示纯化的PaI-His融合蛋白的大小约为18 kD,间接ELISA和Western blotting分析表明免疫小鼠产生的抗血清具有较高的效价和较强的特异性。美洲大蠊溶菌酶PaI成功实现原核表达,并获得了高效价特异性多克隆抗体。
美洲大蠊;溶菌酶;原核表达;多克隆抗体
溶菌酶(Lysozyme,LYZ)是一类酶的总称,能水解细菌细胞壁的肽聚糖,水解位点是N-乙酰葡萄糖胺和N-乙酰胞壁酸之间的β-1,4糖苷键,引起细菌裂解。溶菌酶是许多生物先天性免疫系统的重要组成成分,它不仅成为蛋白质化学、酶学、结晶学、光谱学、免疫学和分子生物学的研究模型,还被证实具有抑菌防御功效,并被用作食品和药品的防腐剂[1,2]。根据结构特征、催化特征、免疫特性和来源可以将溶菌酶分成6种类型:c型溶菌酶(Chicken-type lysozyme)、g型溶菌(Goose-type lysozyme)、i型溶菌酶(Invertebrate-type lysozyme)、噬菌体溶菌酶、植物溶菌酶和细菌溶菌酶[3]。c型、g型和i型溶菌酶是动物型溶菌酶。其中,c型溶菌酶是同时存在于无脊椎动物和脊椎动物中的类型,g型溶菌酶主要存在于脊椎动物,而i型溶菌酶存在于无脊椎动物中[4]。目前,科研人员已对不同动物来源的不同溶菌酶基因和蛋白进行了广泛的研究,发现溶菌酶在动物的很多组织中广泛存在,经不同外源微生物刺激后其表达水平会发生改变[5-7]。同时,利用大肠杆菌表达系统和酵母表达系统等进行体外异源表达,获得溶菌酶进行抑菌活性研究[8,9]。
美洲大蠊属于昆虫纲蜚蠊目,其生活环境肮脏,能携带多种病原体,是人类许多传染性疾病的重要传播媒介[10]。当然,美洲大蠊能够在恶劣的环境中顽强生存,也说明它能有效抵御病原菌的感染,具有独特的免疫防御机制。在前期工作中,本课题组通过RT-PCR和RACE PCR技术,获得了美洲大蠊i型溶菌酶基因PaI(GenBank登录号:JQ754173),并对其功能活性位点等进行了分析[11]。为进一步明确该基因的功能,本研究通过扩增PaI成熟肽的编码序列,构建其原核表达载体,并进行原核表达和纯化,免疫小鼠制备多克隆抗体,旨在为进一步研究美洲大蠊i型溶菌酶的分子生物学特征及功能奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种与载体 表达菌株大肠杆菌Rosetta(DE3)及质粒pET-28a(+)、pMD18-PaI均由本校生物学教研室保存。
1.1.2 主要试剂 Hind III和BamH I限制性核酸内切酶、Taq酶、T4 DNA连接酶、DNA Marker、低分子量蛋白质Marker为宝生物工程(大连)有限公司产品;DNA凝胶回收试剂盒、质粒提取试剂盒、His-镍蛋白纯化套装为北京天恩泽基因科技有限公司产品;异丙基-β-D-硫代半乳糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG)、卡那霉素、氯霉素为北京索莱宝科技有限公司产品;兔抗His标签抗体、辣根过氧化物酶(HRP)标记羊抗兔二抗、HRP标记羊抗鼠二抗、二氨基联苯胺(DAB)/5-四甲基联苯胺(TMB)显色试剂、BCA蛋白定量试剂盒为博士德生物工程有限公司产品;引物由上海生工生物工程技术服务有限公司合成。
1.1.3 实验用动物 Balb/c小鼠购自贵州医科大学实验动物中心。
1.2 方法
1.2.1 PaI成熟肽编码序列的扩增 根据前期获得的PaI基因序列,用Primer Premier 5.0软件设计扩增成熟肽序列的上下游引物。上游引物为5'-CGGGATCCCAGCAGCAACCGAAG-3'(下划线为BamH I酶切位点);下游引物为5'-CCCAAGCTTTTACAGTGGAACG-3'(下划线为Hind III酶切位点)。以实验室构建的重组质粒pMD18-PaI为模板进行PCR扩增,该重组质粒含PaI全长编码序列。PCR扩增条件:94℃ 5 min;94℃ 1 min,56℃ 30 s,72℃1 min,30个循环;72℃ 5 min。PCR扩增产物经1%琼脂糖凝胶电泳检测后,使用琼脂糖凝胶回收试剂盒回收目的片段。
1.2.2 重组表达质粒pET28a-PaI的构建及测序 用BamH I和Hind III双酶切纯化的PaI基因片段以及pET-28a(+)载体,回收酶切产物。用T4 DNA连接酶将质粒与目的基因片段在16℃水浴连接过夜,转化大肠杆菌Rosetta(DE3)感受态细胞,挑取单菌落进行培养。经PCR初步筛选阳性克隆,再抽提重组质粒用BamH I和Hind III双酶切进一步鉴定后测序。
1.2.3 重组载体的诱导表达 将构建成功的重组工程菌接种于含卡那霉素的LB液体培养基中,37℃摇床培养至OD600≈0.6时,加入终浓度为1 mmol/L IPTG诱导4 h,按常规进行SDS-PAGE检测,分析目的蛋白表达情况。以空质粒pET-28a(+)作对照。
1.2.4 产物表达形式的鉴定 取5 mL诱导表达的菌液以8 000 r/min离心10 min收集菌体,加入细菌裂解缓冲(50 mmol/L Tris-HCl pH8.0、1 mmol/L EDTA、0.1 mol/L NaCl)悬浮菌体沉淀,反复冻融后在冰浴中超声破碎细菌,离心后分别收集上清及沉淀样品进行SDS-PAGE电泳,分析重组蛋白的表达情况。
1.2.5 包涵体的提取和纯化 重组工程菌大量诱导表达,离心收集菌体沉淀,用细菌裂解缓冲液重悬菌体,反复冻融3次,加入100 mmol/L PMSF,在冰浴中超声碎菌。破碎后离心弃上清,获得包涵体蛋白。向包涵体中加入含8 mol/L尿素的PBS缓冲液,4℃缓慢搅拌下使包涵体溶解过夜。待包涵体完全溶解后,用0.45 μm滤膜过滤,用Ni-NTA亲和层析柱按操作说明纯化溶解的包涵体蛋白。其中洗柱的结合液含5 mol/L尿素,洗脱液含200 mmol/L咪唑。
1.2.6 包涵体的复性 采用梯度透析法对纯化的变性蛋白进行复性[12]。调整亲和层析洗脱的蛋白浓度为1 mg/mL,将稀释后的变性蛋白装入预先处理的透析袋中。将透析袋依次在含6、4、3、2、1和0mol/L尿素的50 mmol/L Tris-HCl溶液及ddH2O中,分别在4℃条件下搅拌透析4 h。其中在含2 mol/L和1 mol/L尿素的Tris-HCl中均加入终浓度为0.8 mol/L的精氨酸,一定程度上抑制复性过程中蛋白的聚集。复性后的蛋白用BCA蛋白定量试剂盒测定其浓度。
1.2.7 重组融合蛋白的Western blotting分析 将纯化蛋白进行SDS-PAGE电泳,然后电转移至PVDF膜上,5%脱脂奶粉封闭液4℃封闭过夜,经TBS-T(pH7.4)漂洗后,PVDF膜转入兔抗His标签抗体(1∶1 000),低速摇床上结合1 h,TBS-T洗膜后与HRP标记羊抗兔二抗在低速摇床上结合1 h,最后DAB显色至目的条带清晰。
1.2.8 PaI多克隆抗体的制备 将纯化的重组蛋白进行动物免疫。取5-7周龄Balb/c小鼠4只,尾静脉取血作为阴性对照。初次免疫,50 μg纯化的融合蛋白与弗氏佐剂等比例混合,超声乳化后皮下和腹腔多点注射;2周后,加强免疫,PaI蛋白与不完全弗氏佐剂等量混合超声乳化后皮下和腹腔多点注射;加强免疫后2周,追加免疫,同等剂量PaI蛋白腹腔注射。追加免疫后3 d,眼球取血并分离多抗血清。
1.2.9 抗血清的效价检测及特异性分析 将纯化得到的重组PaI蛋白作为抗原包被ELISA板,用BSA封闭后,将倍比稀释的抗血清加入反应孔中,37℃孵育2 h,同时用免疫前的小鼠血清作对照。洗涤后加入HRP标记的羊抗小鼠二抗,37℃孵育1.5 h。洗涤后,加入底物TMB显色,反应20 min,加入终止液,以450 nm波长测定其光密度。Western blotting检测效价最高抗血清的特异性,方法同1.2.7。
2 结果
2.1 PaI成熟肽编码序列的扩增
以含有酶切位点的引物进行PCR扩增,扩增产物经1.0%琼脂糖凝胶电泳检测(图1),可见约430bp的特异条带大小,与预期相符。
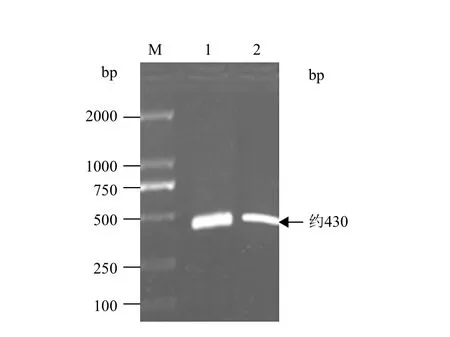
图1 美洲大蠊i型溶菌酶成熟肽基因片段PCR结果
2.2 重组表达质粒pET28a-PaI的酶切鉴定及测序
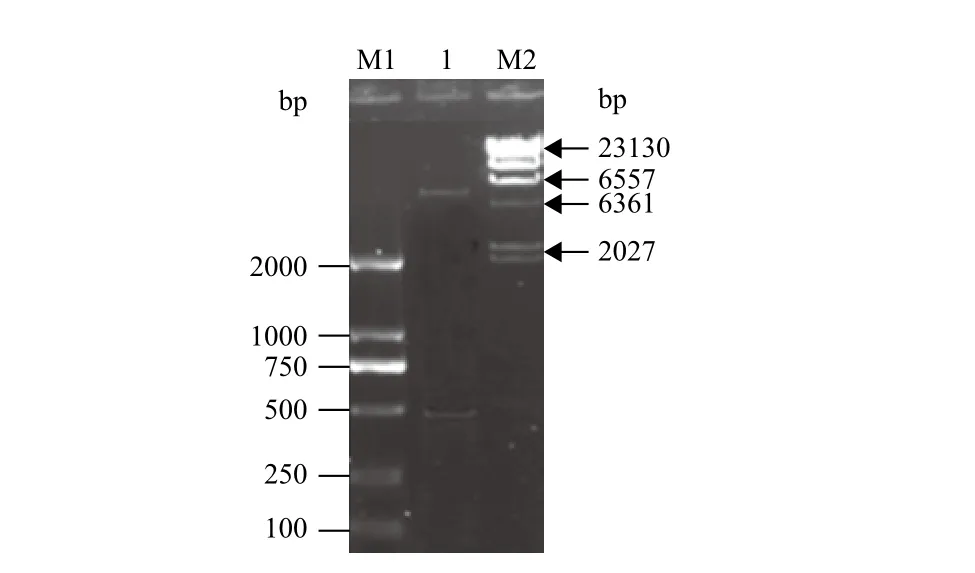
图2 pET28a-PaI重组质粒的酶切鉴定
回收的PCR产物和表达载体pET-28a(+)经BamH I和Hind III双酶切后进行连接,转化感受态细胞Rosetta(DE3),获得重组质粒pET28a-PaI。重组质粒经双酶切后得到一条约430 bp与PCR产物大小较一致的条带,在约6 000 bp处出现了与线性pET-28a(+)大小较一致的条带(图2),初步判断目的基因成功与表达载体相连。测序结果显示插入序列与课题组前期提交的PaI序列(JQ754173)完全一致,且阅读框正确,进一步证明重组表达载体构建成功。
2.3 重组质粒的诱导表达及检测
重组质粒经IPTG诱导表达后,SDS-PAGE电泳检测结果(图3)显示,诱导后的菌体总蛋白相对未诱导的菌体总蛋白在相对分子质量约18 kD处可见特异性蛋白条带,与预期大小相符。收集菌体经超声破碎后,取离心后的上清和沉淀分别进行SDSPAGE电泳,结果显示目的蛋白以包涵体形式存在。
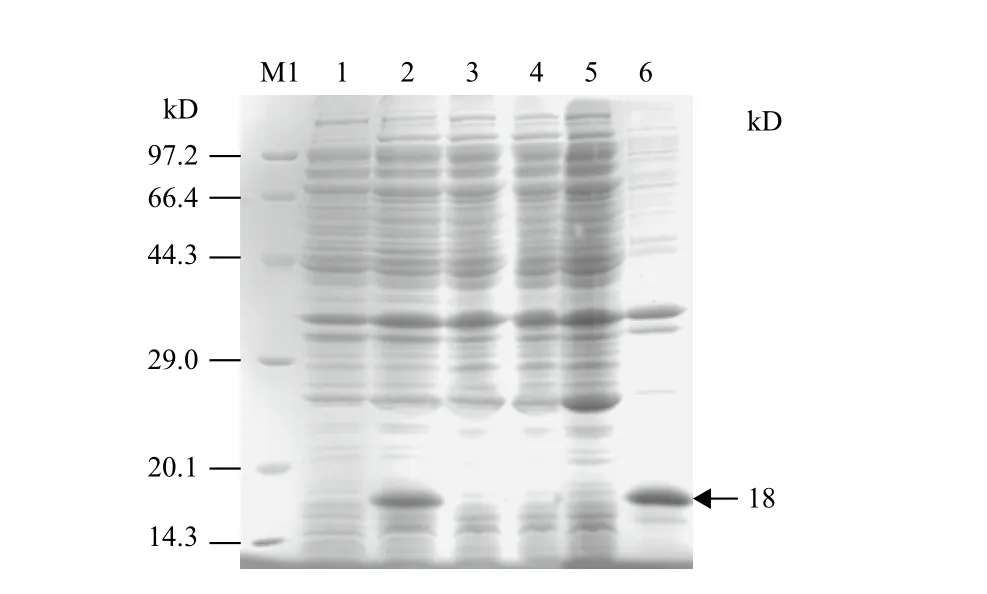
图3 SDS-PAGE分析重组蛋白的诱导表达情况
2.4 重组融合蛋白的纯化及复性
超声破碎处理诱导后的重组工程菌,离心获得包涵体,将包涵体变性后纯化并用梯度尿素复性,复性蛋白进行SDS-PAGE检测(图4),呈现一条约18 kD条带。BCA法测定蛋白浓度为1.23 mg/mL。利用抗His标签抗体进行Western blotting分析纯化和复性后的重组蛋白,同样在约18 kD处可见清晰的条带(图5),与SDS-PAGE检测结果一致。
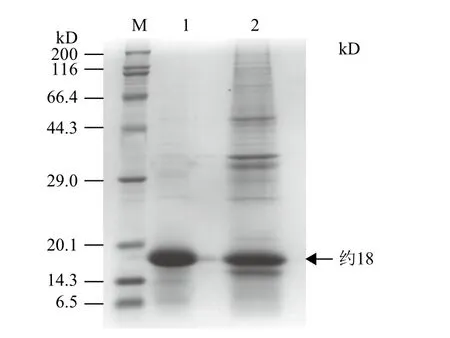
图4 SDS-PAGE分析复性的重组蛋白
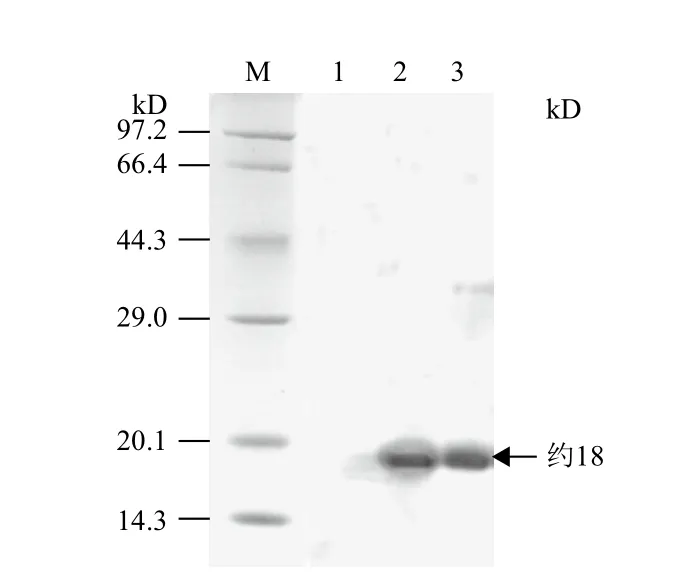
图5 重组蛋白的免疫印迹鉴定
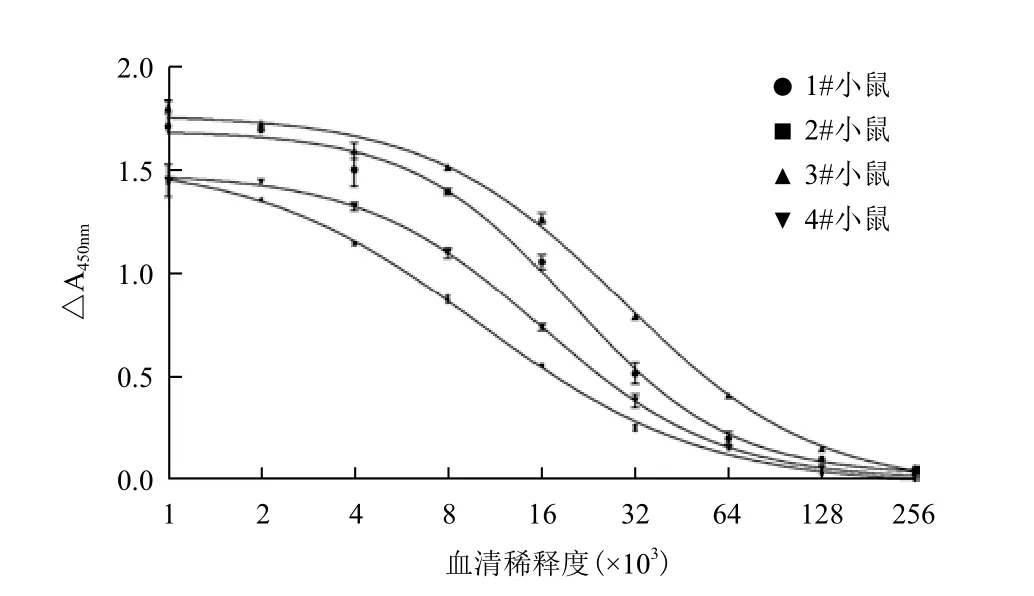
图6 抗PaI多克隆抗血清的效价
2.5 抗血清效价检测及特异性分析
将纯化复性的PaI重组蛋白共免疫4只Balb/c小鼠,获得小鼠抗PaI抗体后,用间接ELISA检测抗体效价,结果(图6)显示,免疫的4只小鼠均产生了较强的免疫反应。其中3号免疫小鼠的抗血清效价最高,超过1∶128 000,最低的2号小鼠亦达到1∶64 000以上。选择效价最高的3号免疫小鼠的抗血清进行Western blotting分析,结果(图7)表明,免疫后的抗血清可见明显的特异性免疫反应条带,而阴性对照血清在相应的位置未识别出条带。
3 讨论
昆虫具有许多免疫功能的多肽类物质,与血细胞一起组成了昆虫体内免疫功能体系。受到细菌等异物刺激后,很多昆虫均能有效诱导溶菌酶、抗菌肽、凝集素和血素等血淋巴抗菌蛋白的增加,以增强机体的免疫防卫能力,维持内环境的稳定[13]。美洲大蠊是重要的卫生昆虫,有研究报道发现美洲大蠊在大肠杆菌诱导后,其血淋巴的抗菌活性增强,被认为是诱导后其体内溶菌酶、抗菌肽、凝集素、血素等抗菌蛋白增加[14]。李远辉等[15]运用不同的方法获得美洲大蠊提取液,证实其对大肠杆菌、金黄色葡萄球菌和绿脓杆菌均有抑菌活性。因此,本研究在获得美洲大蠊i型溶菌酶PaI编码序列的基础上,通过体外表达获得溶菌酶PaI蛋白并制备抗PaI多克隆抗体对其功能的研究具有重要的意义。
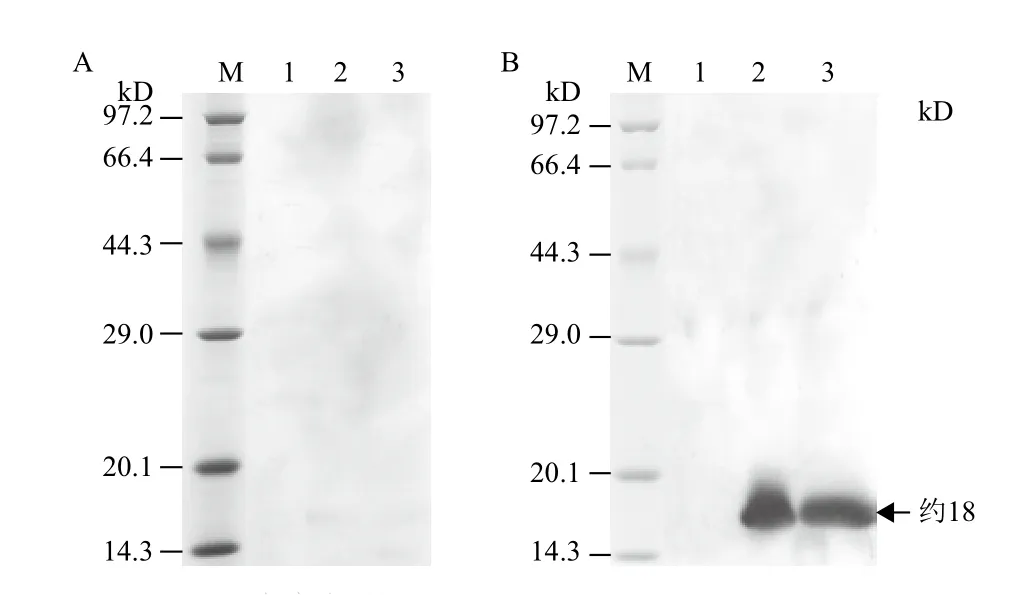
图7 Western blotting检测分析鼠抗PaI抗体的特异性
大肠杆菌原核表达系统由于其遗传背景清楚、转化及表达效率高、成本低廉,被广泛地用于异源蛋白的体外表达[16,17]。但在使用大肠杆菌对高等生物功能基因进行重组表达过程中,重组蛋白往往以无活性的包涵体形式存在,这主要是因为在重组蛋白的大量表达过程中,缺乏某些蛋白质正确折叠所需要的酶和分子伴侣等,或因环境不适无法形成正确的次级键等[18]。为了获得有活性的重组蛋白,需要将包涵体中的重组蛋白变性溶解,然后再加以复性,使重组蛋白分子重新折叠形成正确的空间结构[19,20]。本研究构建了重组表达载体pET28a-PaI,转入大肠杆菌Rosetta(DE3)感受态细胞中,经IPTG诱导后成功表达目的蛋白,但重组蛋白以包涵体形式存在。经高浓度尿素变性纯化并通过梯度尿素复性后,获得的目的蛋白可用于后续功能的研究。
抗PaI抗体是在翻译水平研究i型溶菌酶表达模式的关键试剂,但目前国内外尚未见该抗体的产品或抗体制备的研究报道。常规制备多克隆抗体可采用免疫家兔或小鼠获得,与免疫家兔相比,免疫小鼠制备免疫血清具有蛋白用量少、周期短、免疫效价高、成本低等优点[21]。因此,本研究利用原核表达获得的PaI重组蛋白免疫Balb/c小鼠,获得的抗血清能与PaI蛋白特异性结合,可用于PaI在美洲大蠊体内表达水平的研究,为美洲大蠊i型溶菌酶基因功能的研究奠定了基础。
4 结论
本研究获得了美洲大蠊i型溶菌酶(PaI)成熟肽编码序列,成功构建重组表达质粒pET28a-PaI,并在大肠杆菌中表达,亲和层析纯化获得大小约18 kD的目的蛋白,并成功制备了鼠抗PaI多克隆抗体,ELISA检测显示抗血清效价较高,Western blotting验证其具有较好的特异性。
[1]Li L, Zhao J, Wang L, et al. Genomic organization, polymorphisms and molecular evolution of the goose-type lysozyme gene from Zhikong Scallop Chlamysfarreri[J]. Gene, 2013, 513(1):40-52.
[2]Mitra P, Banerjee M, Biswas S, et al. Protein interactions of Merocyanine 540:spectroscopic and crystallographic studies with lysozyme as a model protein[J]. J Photochem Photobiol, B:Biology, 2013, 121:46-56.
[3]Huang P, Li WS, Xie J, et al. Charaterization and expression of HLysG2, a basic goose-type lysozyme from the human eye and testis[J]. Mol Immunol, 2011, 48(4):524-531.
[4]Callewaert L, Michiels CW. Lysozyme in the animal kingdom[J]. J Biosci, 2010, 35(1):127-160.
[5]Lapcharoen P, Komalamisra N, Rongsriyam Y, et al. Investigations on the role of a lysozyme from the malaria vector Anopheles dirus during malaria parasite development[J]. Dev Comp Immunol,2012, 36(1):104-111.
[6]Karthik V, Kamalakannan V, Thomas A, et al. Functional characterization of a c-type lysozyme from Indian shrimp Fenneropenaeus indicus[J]. Probiotics Antimicrob Proteins, 2014,6(2):114-121.
[7]Yue X, Liu B, Xue Q. An i-type lysozyme from the Asiatic hard clam Meretrix meretrix potentially functioning in host immunity[J]. Fish Shellfish Immunol, 2011, 30(2):550-558.
[8]Buonocore F, Randelli E, Trisolino P, et al. Molecular characterization, gene structure and antibacterial activity of a g-type lysozyme from the European sea bass(Dicentrarchus labrax L.)[J]. Mol Immunol, 2014, 62(1):10-18.
[9]Supungul P, Rimphanitchayakit V, Aoki T, et al. Molecular characterization and expression analysis of a c-type and two novel muramidase-deficient i-type lysozymes from Penaeus monodo[J]. Fish Shellfish Immunol, 2010, 28(3):490-498.
[10]Wanniqama DL, Dwivede R, Zahraei-Ramazani A. Prevalence and antibiotic resistance of gram-negative pathogenic bacteria species isolated from Periplaneta americana and Blattella germanica in Varanasi, India[J]. J Arthropod Borne Dis, 2013, 8(1):10-20.
[11]王赟, 龙高群, 张春林, 等. 美洲大蠊i型溶菌酶基因的克隆及其功能预测[J]. 动物医学进展, 2012, 33(9):21-27.
[12]萨姆布鲁克 J, 拉塞尔 DW. 分子克隆实验指南[M]. 第3版.黄培堂, 译. 北京:科学出版社, 2008.
[13]王荫长. 昆虫生物化学[M]. 北京:中国农业出版社, 2004:245-270.
[14]金小宝, 王艳, 朱家勇. 诱导前后美洲大蠊血淋巴抗菌活性的研究[J]. 广东药学院学报, 2006, 22(6):665-682.
[15]李远辉, 李希, 冯建安, 等. 美洲大蠊不同提取部位的体外抑菌活性研究[J]. 中药与临床, 2014, 5(6):27-29.
[16]Hata S, Ueno M, Kitamura F, et al. Efficient expression and purification of recombinant human m-calpain using an Escherichia coli expression system at low temperature[J]. J Biochem, 2012,151(4):417-422.
[17]才蕾, 矫丽媛, 王继华, 等. 甲胎蛋白的原核表达及复性优化[J]. 生物技术通报, 2015, 31(1):193-197.
[18]高翠娥, 任晓宇, 张学尧, 等. 飞蝗CYP408B1和CYP409A1基因的原核表达[J]. 应用昆虫学报, 2015, 52(1):153-161.
[19]孙卫国, 张灵霞, 杨秉芬, 等. 人血小板衍生生长因子BB的原核高表达及其包涵体复性[J]. 生物技术通讯, 2015, 26(1):91-94.
[20]王倩, 杨眉, 冯瑞丽, 等. 人源DCF1基因原核表达载体构建及蛋白分离纯化[J]. 生物技术通报, 2014, 12:195-200.
[21]韩慧平, 于三科. 小鼠抗HCMV-gB多克隆抗体的制备及初步应用[J]. 动物医学进展, 2012, 33(2):51-54.
(责任编辑马鑫)
Prokaryotic Expression of i-type Lysozyme from Periplaneta americana and Preparation of Its Polyclonal Antibodies
WANG Yun1ZHAI Su-zhen2ZHANG Chun-lin2WANG Ji-ping2
(1. School of Biology and Engineering,Guizhou Medical University,Guiyang 550004;2. School of Basic Medical Sciences,Guizhou Medical University,Guiyang 550004)
The objective of this work is to express i-type lysozyme(PaI)from Periplaneta americana in Escherichia coli and prepare its polyclonal antibodies of anti-PaI in mice. The coding gene of mature peptide region was amplified by PCR and prokaryotic expression vector pET28a-PaI was constructed. PaI-His fusion protein was expressed with IPTG induction and purified by Ni-NTA affinity chromatography. Then,Balb/c mice were immunized with the purified recombinant protein, and the titers of antiserum and the specificity of polyclonal antibodies were detected by indirect ELISA and Western blotting respectively. Results were as below. The length of nucleotide sequence encoding the mature peptide was 414 bp that encoded a putative protein with 137 amino acids. The constructed prokaryotic expression vector pET28a-PaI was successfully expressed in Escherichia coli. SDS-PAGE detection indicated that the PaI-His fusion protein was about 18 kD. Indirect ELISA and Western blotting analysis showed that the antiserum from immunized mice had high titer and specificity. In conclusion, the prokaryotic expression of PaI protein was successfully realized, and the anti-PaI polyclonal antibody with high efficiency and specificity were prepared, which laid the foundation for the further researches on the biological function of PaI protein.
Periplaneta americana;lysozyme;prokaryotic expression;polyclonal antibody
10.13560/j.cnki.biotech.bull.1985.2016.01.023
2015-05-19
贵州省科技合作计划项目(黔科合LH字[2015]7336号),贵阳市科技计划项目(筑科合同[20151001]社19号),贵州省科技基金项目(黔科合LH字[2014]7085号),贵州省教育厅自然科学研究项目(黔教合KY字[2012]039号)
王赟,女,硕士,研究方向:医学昆虫分子生物学;E-mail:forever_wangyun@sina.cn
张春林,男,硕士,研究方向:医学昆虫分子生物学;E-mail:zcl@gmc.edu.cn
