血清MIF、MMP-9、TNF-α水平诊断冠心病合并糖尿病的临床价值
2016-10-11刘建飞
刘建飞, 黄 鹤
(武汉大学人民医院 心血管内科, 湖北 武汉, 430060)
血清MIF、MMP-9、TNF-α水平诊断冠心病合并糖尿病的临床价值
刘建飞, 黄鹤
(武汉大学人民医院 心血管内科, 湖北 武汉, 430060)
目的探讨巨噬细胞移动抑制因子(MIF)、MMP-9、TNF-α水平对冠心病合并糖尿病诊断价值。方法选择本院住院患者及健康体检者共计158例作为研究对象,其中冠心病合并糖尿病患者62例为A组,单纯冠心病患者51例为B组,健康体检者45例为C组,比较3组MIF、MMP-9、TNF-α水平、A组中不同冠脉病变范围血清MIF、MMP-9、TNF-α水平以及不同Gensini积分组间血清MIF、MMP-9、TNF-α水平。结果① A组FBG、HbAlc及LDL-C水平均显著高于B组、C组(P<0.05), 且B组LDL-C水平显著高于C组(P<0.05); ② A组MIF、MMP-9及的表达水平显著高于B、C组(P<0.05), B组上述指标水平也均显著高于C组(P<0.05)。多支病变组指标水平均显著高于单支、双支病变组(P<0.05), 双支病变组上述指标表达水平均显著高于单支病变组(P<0.05);重度组表达水平均显著高于中度、轻度组(P<0.05), 中度组上述指标水平均显著高于轻度组(P<0.05)。结论冠心病合并糖尿病血清MIF、MMP-9、TNF-α水平增高,血清MIF、MMP-9、TNF-α水平对冠心病合并糖尿病具有较高的临床诊断价值。
巨噬细胞移动抑制因子; 冠心病; 糖尿病
冠心病是临床上常见的心血管疾病,糖尿病不仅是其高危因素,也是冠心病较为常见的合并症[1]。本研究探讨血清MIF、MMP-9、TNF-α水平诊断冠心病合并糖尿病的临床价值,现将结果报告如下。
1 资料及方法
1.1一般资料
本院内分泌科及心内科2011年7月—2014年12月收治的62例冠心病合并糖尿病患者为A组,其中男33例,女29例;年龄45~72岁,平均(63.32±2.52)岁;单支病变患者14例,双支病变患者22例,多支病变患者26例;空腹血糖10.8~19.2 mmol/L, 平均(14.39±1.37) mmol/L; 餐后2 h血糖水平14.3~22.3 mmol/L, 平均(17.62±1.07) mmol/L。51例单纯冠心病者为B组,其中男27例,女24例;年龄42~73岁,平均(61.85±2.05)岁;同期选择本院健康体检者45例为C组,其中男25例,女20例;年龄39~70岁,平均(59.87±1.78)岁,均经体格检查及心电图、胸片、心脏超声等明确为健康者,且无糖尿病史。冠心病诊断标准[2]: ① 使用Judkins法对冠脉进行多角度,多体位造影,冠脉造影阳性表现为冠脉管腔狭窄程度大于50%; ② 根据冠脉病变支数及受累情况,将冠脉病变分为单支血管病变、双支血管病变及多支血管病变; ③ 左冠脉主干狭窄程度超过50%即为双支病变。糖尿病诊断标准[3]: 根据1999年WHO制定的关于糖尿病的临床诊断标准:患者表现出糖尿病症状,且血浆葡萄糖水平在任意时间均高于11.1 mmol/L或者FPG水平高于7.0 mmol/L或者OGTT 2 h PG水平高于11.1 mmol/L。
1.2检测方法
① 一般指标检测方法:研究对象均空腹8 h以上,测量体质量、身高并计算BMI值;休息10 min后使用台式袖带血压计测量研究对象的DBP、SBP,连续测定2次,2次间隔1 min,取测量值的平均值。② 生化指标测定方法:研究对象在空腹状态下抽取肘静脉血,对HbAlc、TC、TG、HDL-C、LDL-C水平进行测定,其中TC、TG、LDL-C及HDL-C水平由均相酶比色法进行测定分析;使用Bio-Rad全自动血红蛋白检测仪测定HbAlc指标。③ 血MIF、MMP-9及TNF-α测定方法。样品采集:取3.0 mL全血置于促凝管之中,立即以4 000 r/min离心15 min, 取出血清置于冻存管中,贮存于温度为-20℃的冰箱中待用。采用双抗体夹心ELISA法联合自动酶标仪分析测定血清中MIF、MMP-9及TNF-α的水平。
1.3观察指标
比较3组一般资料、MIF、MMP-9、TNF-α水平、A组中不同冠脉病变范围血清MIF、MMP-9、TNF-α水平、A组内不同Gensini积分、组间血清MIF、MMP-9、TNF-α水平。
2 结 果
2.13组MIF、MMP-9、TNF-α水平对比
A组MIF、MMP-9及TNF-α水平均显著高于B、C组,B组上述指标水平也均显著高于C组(P<0.05),见表1。

表1 3组MIF、MMP-9、TNF-α水平比较 ng/mL
与A组比较, *P<0.05; 与B组比较, #P<0.05。
2.2不同冠脉病变范围血清MIF、MMP-9、TNF-α水平对比
冠心病合并糖尿病多支病变组MIF、MMP-9、TNF-α水平均显著高于单支、双支病变组,双支病变组上述指标水平均显著高于单支病变组(P<0.05),见表2。
2.3不同Gensini积分组间血清MIF、MMP-9、TNF-α水平对比
重度组MIF、MMP-9及TNF-α水平均显著高于中度组、轻度组,中度组上述指标水平均显著高于轻度组(P<0.05),见表3。
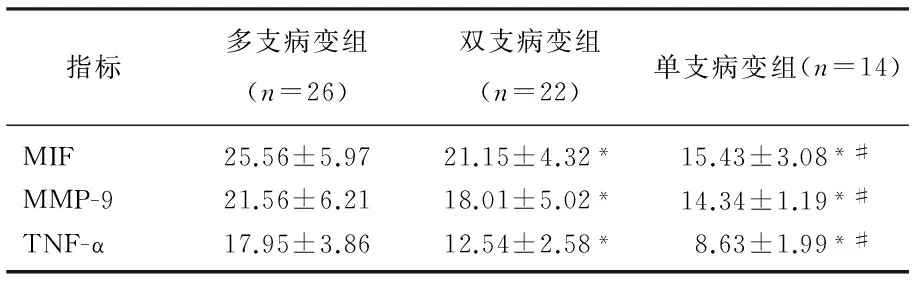
表2 不同冠脉病变范围血清MIF、MMP-9、TNF-α 水平比较 ng/mL
与多支病变组比较, *P<0.05; 与双支病变组比较, #P<0.05。
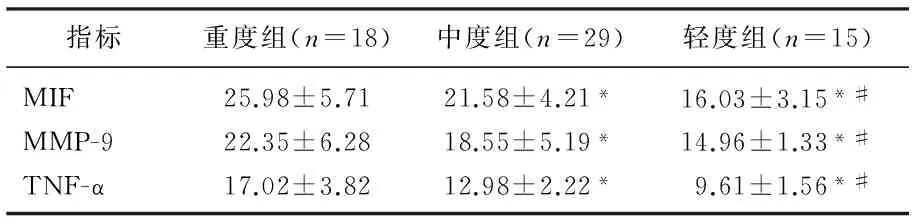
表3 不同Gensini积分组间血清MIF、MMP-9、TNF-α 水平比较 ng/mL
与重度组比较, *P<0.05; 与中度组比较, #P<0.05。
3 讨 论
冠心病是临床上最为常见的一种心血管疾病,其临床发病率及病死率呈现逐年上升的发展趋势。主要原因在于其并发症发生率较高,其中糖尿病是冠心病最为常见的一种并发症。研究[4]显示,心血管疾病人群中,合并糖尿病的临床病死率较未合并糖尿病要高5倍。内皮受损、血小板异常、氧化应激以及高凝状态等,均为冠心病易合并糖尿病的重要因素。
巨噬细胞移动抑制因子(MIF), 其本质为非糖基化蛋白质类。相关文献[8]报道显示, MIF基因的-173G/C位点的多态性和冠心病关系密切。MIF具有细胞特异性以及启动子多样性等方面的特征。临床研究[5]表明,多种类型的细胞均有不同程度的表达MIF, 主要包括单核、巨噬、淋巴、心肌、平滑肌以及脂肪细胞等, MIF也在胰岛β细胞中进行表达,且根据葡萄糖水平调节MIF的表达水平。近年来,研究[6]发现MIF参与血管生成过程及氧化应激反应等过程。随着对MIF研究的不断深入, MIF正逐渐成为代谢内分泌领域的一个研究热点。相关临床研究[7]证实,ox-LDL可显著提高细胞内MIF的水平,以此促进血管平滑肌细胞的迁移。相关研究[8]表明,血脂紊乱合并MIF表达水平升高,可能是造成冠心病合并糖尿病的一个重要的机制。
脂质代谢紊乱是多数糖尿病患者的并发症,LDL更易被氧化和糖基化,血管壁上形成 oxLDL是动脉粥样硬化早期的特点之一。oxLDL可诱导巨噬细胞和血管内皮细胞表达MIF、TNF-α等细胞因子, ox-LDL 可显著提高细胞MIF的表达,促进血管平滑肌细胞迁移。血脂紊乱并伴随 MIF 表达水平的增加等多种因素同时作用可能是2 型糖尿病患者大血管病变的主要原因。 糖尿病合并大血管病变患者血清中MIF的表达水平与高级糖基化终产物受体呈正相关,且较正常水平显著升高。研究者[9]认为利用血清MIF水平对糖尿病大血管病变进行早期诊断是一种可行方案。
MMP-9是一种糖蛋白,与血管病变有密切关系。潜伏的MMP-9可在病理条件下被激活, MMP-9mRNA及蛋白表达上调,参与并加速动脉粥样硬化斑块的形成与恶化。相关临床研究[10]结果显示,动脉球囊损伤后 MMP-9基因被激活,高表达MMP-9蛋白,同时血管壁细胞外基质被降解,平滑肌细胞突破组织屏障迁移至内膜,最终形成动脉粥样硬化斑块。此外,不稳定的动脉粥样斑块中MMP-9 活性显著高于较稳定的粥样斑块,过表达的 MMP-9可加速动脉粥样斑块变薄甚至破裂,增加斑块的不稳定性。而肿瘤坏死因子(TNF-α因子)主要在巨噬细胞和单核细胞中表达,是一种具有多种效应的细胞因子。TNF-α可作为炎性标记物,是体内炎性反应调节的媒介,可诱导冠脉内皮细胞功能紊乱及内膜厚度增大,同时促进动脉硬化的发生与发展。此外, TNF-α与MIF互相影响, MIF 刺激巨噬细胞可诱导巨噬细胞分泌TNF-α等细胞因子,产生的TNF-α同时促进MIF的释放,两种细胞因子协同促进冠状动脉粥样硬化。
本研究结果显示, A组FBG、HbAlc及LDL-C水平均显著高于B组、C组(P<0.05), B组LDL-C水平显著高于C组(P<0.05); A组MIF、MMP-9及TNF-α的水平显著高于B、C组(P<0.05), B组上述指标水平也均显著高于C组(P<0.05); 多支病变组水平均显著高于单支、双支病变组(P<0.05),双支病变组表达水平均显著高于单支病变组(P<0.05); 重度组表达水平均显著高于中度组、轻度组(P<0.05),中度组上述指标水平均显著高于轻度组(P<0.05)。上述结果表明冠心病合并糖尿病患者血清MIF、MMP-9、TNF-α水平显著高于正常标准。冠心病合并糖尿病患者体内MIF、MMP-9、TNF-α水平较高, MIF、MMP-9、TNF-α可能参与糖尿病大血管病变的发生及进展。
[1]孙 敏, 刘莹莹, 王晓彤, 等. 巨噬细胞移动抑制因子与冠心病合并糖尿病的关系[J]. 中国实验诊断学, 2014, 18(3): 501-503.
[2]Toso C, Emamaullee J A, Eranis, et al. Theroleofmacrophage migration inhibitory factor on glucose metabolism and diabetes[J]. Diabetologia, 2008, 51(11): 1937-1946.
[3]Schöttker B, Herder C, Rothenbacher D, et al. Pro-inflammatory cytokines, adiponectin, and increased risk of primary cardiovascular events in diabetic patients with or without renal dysfunction: results from the ESTHER study[J]. Diabetes Care, 2013, 36(6): 1703-1711.
[4]Stojanovic I, Saksida T, Stosic-Grujicic S, et al. Beta cell function: the role of macrophage migration inhibitory factor[J]. Immunol Res, 2012, 52(1/2): 81-88.
[5]Ferreira L, Teixeira-De-Lemos E, Pinto F, et al. Effects of sitagliptin treatment on dysmetabolism, inflammation, and oxidative stress in an animal model of type 2 diabetes (ZDF rat) [J]. Mediators Inflamm, 2010, 2010: 592760.
[6]Herder C, Peltonen M, Koenig W, et al. Anti-inflammatory effect of lifestyle changes in the Finnish Diabetes Prevention Study [J]. Diabetologia, 2009, 52(3): 433-442.
[7]朱遵平, 余细勇, 林秋雄, 等. 血浆巨噬细胞移动抑制因子与2型糖尿病大血管病变的关系[J]. 岭南心血管病杂志, 2009, 15 (1): 44-46.
[8]Shah Z, Kampfrath T, Deiuliis J A, et al. Long-term dipeptidyl-peptidase 4 inhibition reduces atherosclerosis and inflammation via effects on monocyte recruitment and chemotaxis[J]. Circulation, 2011, 124(21): 2338-2349.
[9]Müller II, Müller K A, Schönleber H, et al. Macrophage migration inhibitory factor is enhanced in acute coronary syndromes and is associated with the inflammatory response [J]. PloS One, 2012, 7(6): e38376.
[10]Pundziute G, Schuijf J D, Jukema J W, et al. Type 2 diabetes is associated with more advanced coronary atherosclerosis on multislice computed tomography and virtual histology intravascular ultrasound[J]. J Nucl Cardiol, 2009, 16(3): 376-83.
Clinical value of serum MIF, MMP-9 and TNF-α in the diagnosis of coronary heart disease complicated with diabetes mellitus
LIU Jianfei, HUANG He
(DepartmentofCardiovascularMedicine,People′sHospitalofWuhanUniversity,Wuhan,Hubei, 430060)
ObjectiveTo investigate the diagnostic value of macrophage migration inhibitory factor (MIF), MMP-9 and TNF- levels in patients with coronary heart disease complicated with diabetes mellitus. MethodsA total of 158 research objects including inpatients and healthy objects were included, 62 patients with coronary heart disease complicated with diabetes mellitus were as group A, 51 patients with coronary heart disease (CHD) alone were as group B, and 45 healthy cases were as group C, MIF, MMP-9 and TNF-α levels of three groups were compared, and serum MIF, MMP-9 and TNF-α levels of different coronary lesions in group A, the serum levels of MIF, MMP-9 and TNF-α level of different Gensini scores groups were compared. Results① FBG, HbA1c and LDL-C levels in group A were significantly higher than that of group B and group C (P<0.05), and LDL-C level in group B was significantly higher than that of group C (P< 0.05); ② The expression of MIF, MMP-9 and TNF-α levels in group A were significantly higher than that of B and C groups(P<0.05), the above indexes in group B were significantly higher than that of group C (P<0.05). In addition, the levels of multi vessel disease group was significantly higher than that of single branch, and double vessel disease group (P<0.05), expression levels in double vessel lesion group were significantly higher than that of the single vessel disease group (P<0.05); expression levels in severe group were significantly higher than those in moderate group, and mild group (P<0.05), the above indexes in moderate group were significantly higher than that of the mild group (P<0.05).
macrophage migration inhibitory factor; coronary heart disease; diabetes mellitus
2016-04-03
黄鹤
R 587.1
A
1672-2353(2016)17-011-04
10.7619/jcmp.201617004
ConclusionThe levels of MIF, MMP-9 and TNF-α are increased in patients with coronary heart disease complicated with diabetes mellitus. The levels of serum MIF, MMP-9 and TNF-α have high clinical value in the diagnosis of coronary heart disease complicated with diabetes mellitus.
