香樟组织培养及工厂化育苗技术研究
2016-10-11黄任泽
温 军,黄 庆,黄任泽
(广东省湛江市林业良种繁育场,广东 湛江 524300)
香樟组织培养及工厂化育苗技术研究
温 军,黄 庆,黄任泽
(广东省湛江市林业良种繁育场,广东 湛江 524300)
以健壮、无病虫害的当年优生香樟树新萌发出的嫩芽茎段为外植体进行了组织培养工厂化育苗技术研究。结果表明:外植体以1%次氯酸钠6 min+0.1%升汞7 min消毒时间较为佳;改良MS+6-BA1.0 mg/L+IBA0.1 mg/L是茎段诱导最合适的培养基;改良MS+6-BA1.2 mg/L+IBA0.1 mg/L+VC1.0 mg/L+PVP1.0 mg/L是理想的增殖培养基;在改良WPM+IBA0.5 mg/L+NAA0.5 mg/L+VC1.0 mg/L+PVP1.0 mg/L+活性炭0.1 mg/L中生根培养20 d后,单芽95%生根,移栽成活率达93%。
香樟;嫩芽;茎段;培养基;激素;生根
1 引言
香樟(Cinnamomumcamphora)古称“豫章”,为樟科樟属的亚热带常绿阔叶乔木,主要分布在台湾和长江流域以南各地。香樟材质优良,纹理雅致,且含有特殊的香气和挥发性油,具有耐水湿、抗腐、祛虫等特点。该树种枝叶茂密,冠大荫浓,树姿雄伟,能抗风、吸烟滞尘、涵养水源、固土防沙和美化环境。香樟不仅是我国园林绿化、水源涵养和河提防护的良好树种,同时也是珍贵用材和重要的经济树种。
近年来,香樟作为优良的乡土阔叶树种被广泛应用于绿化造林。目前,香樟采用扦插、嫁接等无性繁殖扩繁较困难,且母株材料来源有限,无法满足规模生产的需要。种子繁殖则实生苗后代分离严重,多数变异,且育苗时发芽迟缓,苗木参差不齐,而采用离体培养不仅能实现工厂化生产优良香樟,而且能够保持母本的优良特性。为了更好地推进香樟的生产发展,本试验对香樟茎段不定芽的诱导、增值培养基和激素配比等影响香樟组织培养的因素进行了初步的研究与探讨,为香樟的工厂化生产提供技术参考。
2 材料与试验设计
2.1材料
本实验的材料采自2011年湛江市林业良种繁育场营建的樟树示范林。以健壮、无病虫害的当年优生树新萌发出的嫩芽茎段为外植体进行组织培养,去除叶片并修剪成约3 cm带有腋芽的小段,先用清洁剂反复清洗2次,每次5 min,再用自来水冲洗30 min,然后进行不同的消毒处理。
2.2试验设计
2.2.1不同消毒时间对外植体的出芽率的影响
利用上述处理好的当年优生树新萌发出的嫩芽茎段为外植体,在超净工作台上用75%酒精对外植体消毒10 s,无菌水清洗3遍,再用1%的次氯酸钠6 min,无菌水清洗3遍,最后用0.1%升汞+吐温80消毒处理3~9 min(0.1%升汞消毒时间分别为:3 min、5 min、7 min、9 min),无菌水清洗6遍,放好备用。
2.2.2不同激素配比对外植体启动的影响
将消毒好的材料切成1.5 cm的茎段,每段只带有1个腋芽,接入不同激素配比的改良MS培养基中诱导培养。诱导培养基中添加的6-苄基氨基腺嘌呤(BA)分别为0.5 mg/L、1.0 mg/L、2.0 mg/L,吲哚丁酸(IBA)的分别为0.1 mg/L、0.2 mg/L、0.3 mg/L。每个处理接种30瓶外植体,先暗培养10 d,后转光照培养,35 d后统计萌芽率。萌芽率=萌芽的外植体数/外植体数(无菌外植体)×100%。
2.2.3基本培养基的筛选
经过初代培养3次(35 d继代1次)后,将长势相似的不定芽团转至添加6-BA1.0+IBA0.1的MS、改良MS(主要是降低硝酸钾和硝酸铵的量、用硝酸钙代替氯化钙)、1/2MS为基础培养基中,研究其对香樟不定芽增值的影响。每个处理接种15瓶,每瓶接种4丛芽团,所有处理均重复5次,35 d观察并记录苗的长势、状态,统计增殖倍数。
2.2.4不同激素配比对不定芽增殖的影响
经过继代培养5次(30 d继代一次)后,将长势相似的不定芽团继代到不同激素配比的改良MS培养基中,28 d后观察并记录苗的长势、状态,统计增殖倍数。上述每个处理接种15瓶,每瓶接种4丛芽团,所有处理均重复3次。
2.2.5生根培养
将增殖培养35 d后,高1.5 cm以上的单芽(所选的芽健壮,叶片舒展,长度1.5~2 cm)切下,转接到生根培养基中进行生根培养。以改良的WPM为基本培养基,采用IBA4个激素水平(0.5 mg/L、 0.7 mg/L、1.0 mg/L、 1.2 mg/L)与NAA3个激素水平(0.1 mg/L、0. 3 mg/L、 0.5 mg/L)进行正交设计,共12个处理。每处理接5瓶,每瓶接15棵,重复3次。接种22 d后,观察并统计苗的生根率、生根数。生根率=生根苗数/接种单芽数量×100%。
2.2.6炼苗与移载
当生根苗的根长到0.5 cm以上,把生根苗搬到带有水帘的炼苗大棚开始炼苗。炼苗期间的11~16时用透光率50%的遮阳网遮挡阳光,其它时间段不遮挡。当生根苗长至2~3 cm、具有6~8片叶、根系达到4~5条/根以上的完整植株,经炼苗后,用清水清洗植株上粘附的培养基,0.2%百菌清清洗2 min,再栽种到红心土的营养杯中进行抚育管理,浇透水,保持小苗周围空气相对湿度在80%以上,用50%的遮荫网拱形覆盖膜保湿7 d左右,遮荫30 d后进行常规管理,50 d后统计成活率。
2.2.7组培各阶段的基本培养条件及数据统计
接种后材料放在温度25±3 ℃培养室中培养,每天光照10 h,光照强度为2000~2500lx。培养基均添加白砂糖30 g/L(生根培养基白砂糖20 g/L)、VC1.0 mg/L 、PVP1.0vm g/L、卡拉胶5.7 g/L,生根培养基添加活性炭0.1 g/L,pH值5.8。本试验数据均为平均值。
3 结果与分析
3.1不同消毒时间对外植体的出芽率的影响
升汞易对外植体造成毒害,外植体出芽率、染菌率高低取决于其处理时间的长短。
表1结果表明:初代培养5 d后,可见无菌外植体顶芽伸长、有少量侧芽萌动。培养35 d后培养基中大部分无菌材料能伸长萌芽,且大部分芽体、叶片呈绿色或浅绿色。培养35 d后, 0.1%升汞处理时间3 min污染率最高63%,转绿时间最短,诱导率为100%,9 min的处理时间污染率最低3%, 15 d后转绿,诱导为56%。5 min处理时间与7min处理时间较为合适。综合污染率、回绿时间、萌芽率、诱导率等因素, 0.1%升汞处理时间为7 min较适宜。
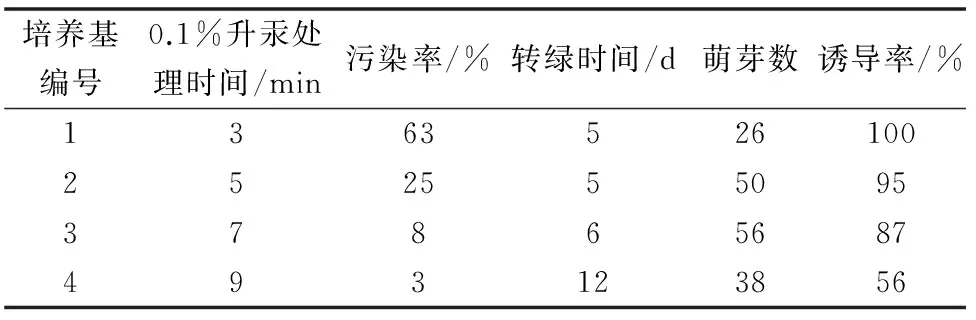
表1 不同消毒时间对外植体的出芽率的影响
注:萌芽率=萌芽的外植体数/外植体数(无菌外植体)×100%;诱导率=出芽的外植体数/萌芽的外植体数×100%
3.2不同激素配比对外植体启动的影响
本试验主要通过添加不同细胞分裂素6-BA与生长素IBA的质量浓度,以试验不同激素配比对无菌外植体启动诱导的的影响。从表2得出:培养基中随着添加6-BA的量增加,不定芽诱导数量也随之增加,但到2.0 mg/L时,有部分茎芽出现半透明状,说明6-BA mg/L的量偏高,不利于腋芽的诱导启动和培养。而添加IBA的量到0.1mg/L时诱导率达到最高,当IBA的量到0.2 mg/L时,有的腋芽基部出现膨大愈伤化的现象,说明IBA的量不需要太高,高反而使激素水平偏向于愈伤的分化,诱导率反而下降。因此启动诱导培养采用6-BA1.0 mg/L和IBA0.1 mg/L激素组合较好。
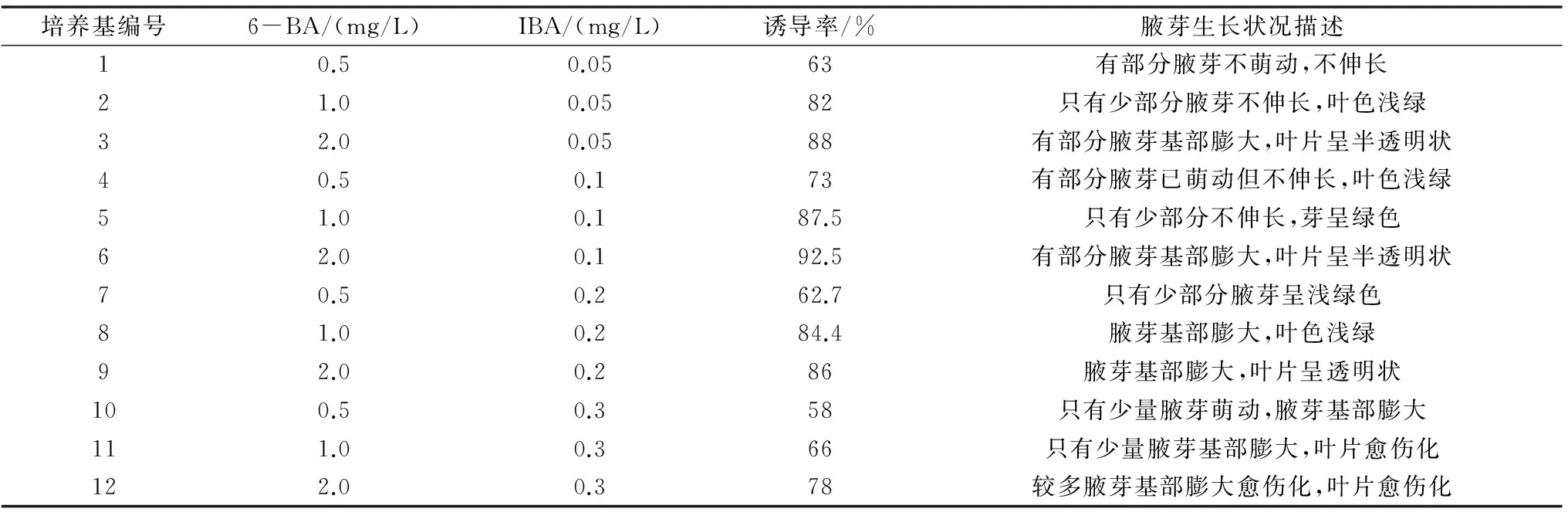
表2 不同激素配比对外植体启动的影响
3.3基本培养基的筛选
大量的试验证明基本培养基中大量元素的不同直接影响不定芽的培养与增殖。从表3可以看出:MS培养基中,有少量芽团切口处有褐化现象,叶片呈浅绿色且弯曲,有少量靠近培养基叶片膨大,出现愈伤。改良MS的不定芽团长势良好,叶片整齐,呈绿色,增殖系数是最高的。1/2MS虽无褐化现象,但苗纤细,叶片呈黄色或枣红色,增殖系数最低。因此改良MS培养基最适增殖和培养的基本培养基。

表3 基本培养基的筛选
3.4不同激素对不定芽增殖的影响
增殖培养是离体快繁的优势阶段,培养材料在短时间内大量增殖,植物生长调节剂在试管苗增殖中起了重要的作用。通过6-BA与IBA调节,控制香樟不定芽在短时间内即能稳定、快速增殖,又不产生或少量产生变异的植株,为生根提供更多的有效芽(表4)。

表4 不同激素对不定芽增殖的影响
由表4可知,随着添加6-BA的量增加,不定芽团增殖倍数随之增加,但添加至1.6 mg/L后,有部分茎芽出现弯曲、基部膨大、叶片半透明状等现象,说明6-BA的量超过1.6 mg/L后属于分裂素偏高,不利于不定芽的增殖和培养,可供生根的苗很少。当BA的浓度不变,添加的IBA的质量浓度达为0.05 mg/L时,香樟的增值率虽高,但芽团成簇状,苗长不高,可供生根的有效芽少;当添加IBA的浓度达到0.2 mg/L时,有的不定芽团基部出现膨大愈伤化,靠下的叶片出现黄化现象,说明IBA的量太高,高激素水平反而使不定芽团偏向于愈伤的分化,苗木出现玻璃化,增殖率反而下降。试验表明,改良MS+6-BA1.2 mg/L+IBA0.1 mg/L是较理想的不定芽增殖培养基。
3.5生根培养基的筛选
以改良WPM为基本培养基,添加IBA四个激素水平,NAA三个激素水平,每个激素组合都接五瓶生根,每瓶15棵,培养22 d后统计生根苗的数量,生根率=生根苗数/接种单芽数量×100% ,培养结果如表5。

表5 生根培养基的筛选:
从生根培养试验结果可知,香樟的生根率最低达到68%,最高可达100%。随着IBA量增高,根的长短、粗细没有太明显的变化,根的数量有一定的增加。但随着NAA的量达到0.3 mg/L,根的数量、长短、粗细都有明显的变化。NAA的量越高,根的数量也随之增加,根也变得又粗又短。综合生根苗的状态、长势、生根率、粗细等因素,其中以改良WPM+IBA0.5 mg/L+ NAA0.5 mg/L培养基中的生根率较高,质量最好。
3.6试管苗移载
试管苗移栽20 d左右开始生长,在户外采用黄心土为基质,50 d后统计成活率,移栽成活达93%。试验期间发现,试管苗的移栽最好避开炎热的6~9月,否则移栽成活率只有63%,冬季移栽一定注意盖膜保温。
4 结语
香樟优良无性系组培工厂化育苗是解决当前香樟优良种苗缺乏的有效途径,是实现香樟种苗产业化生产的基础。目前有不少香樟组培成功的报道,但不同学者间的观点存在一定的分歧。
本研究结果表明,盐度稍低的改良MS培养基(主要是降低硝酸钾和硝酸铵的量、用硝酸钙代替氯化钙)比MS培养基更加适合香樟组培的工厂化生产,结论与吴金寿一致。在本研究筛选出的增值培养基(改良MS+6-BA1.2 mg/L+IBA0.1 mg/L+VC1.0 mg/L+PVP1.0 mg/L)进行继代培养,不仅繁殖系数高,而且成苗快,苗木整齐一致,质量好,不须经过壮苗培养,直接接种在改良WPM+IBA0.5 mg/L+NAA0.5 mg/L+VC1.0 mg/L+PVP1.0 mg/L+活性炭0.1 mg/L中生根培养生根率达95%,移栽成活率达93%。经试验,笔者初步建立了香樟优良无性系继代增值培养与壮苗培养同步进行,以及一步生根、一步移栽成苗的组培快繁体系。
[1]王长宪,刘静,黄艳艳,等.山东抗寒香樟组培快繁体系的建立[J].山东农业大学学报:自然科学版,2006,37(4):513~516.
[2]郑红建.香樟组培快繁技术研究[J].林业科技开发,2012,26(1):103~105.
[3]曾令海,连辉明,张谦,等.香樟资源及其开发利用[J].广东林业科技,2012,28(3):62~66.
[4]容世清,曾少玲.马占相思工厂化组培育苗技术的研究[J].热带林业,1997,25(2):55~58.
[5]吴幼媚,王以红,蔡玲,等.香樟优良无性系快繁技术的研究[J].广西农业生物科学,2006,25(1):60~64.
2016-06-30
温军(1983—),男,助理工程师,主要从事植物组织培养及加勒比松杂交育种工作。
S792
A
1674-9944(2016)15-0098-04
