低血清培养的BHK21细胞染色体遗传稳定性分析
2016-10-10陈苗苗董金杰
陈苗苗, 董金杰, 杜 平
(中农威特生物科技股份有限公司, 甘肃兰州 730046)
低血清培养的BHK21细胞染色体遗传稳定性分析
陈苗苗, 董金杰, 杜 平
(中农威特生物科技股份有限公司, 甘肃兰州 730046)
[目的]对一种商业化的低血清培养基适应BHK21细胞进行传代培养,并分析该细胞染色体的变异稳定性,以判定其质量。[方法]采用直接法制备4个代次BHK21细胞的染色体标本,用常规Giemsa染色,在1 000倍光学显微镜下计数中期分裂相染色体数目,并进行核型分析。[结果]BHK21为亚二倍体或亚四倍体细胞系,亚二倍体总数为42,亚四倍体细胞总数为72~74,该细胞系染色体的畸变率在各代次所占比例为0~2%,均较低。[结论]该细胞系的遗传学特性相对稳定,各代次间无本质差异,可候选为制苗用细胞。
低血清;BHK21;染色体;遗传稳定性
BHK21细胞对口蹄疫病毒敏感,且又是口蹄疫病毒很好的宿主细胞,在口蹄疫疫苗生产中,均使用BHK21细胞对口蹄疫病毒进行繁殖。无论是传统的转瓶工艺还是悬浮培养工艺,都以贴壁的BHK21细胞为驯化对象,由权威机构ATCC保存的BHK21细胞,此传代细胞遗传上具有一定的变异性。为了保证口蹄疫病毒生产的高效性,保证宿主细胞的遗传稳定性则是重中之重。目前检测细胞变异系数的有效方法是核型分析,这是细胞遗传学及细胞生物学的核心技术之一。该技术可用于研究细胞和组织及个体的特异性鉴定、遗传变异和种属进化关系。
目前,医院常采用外周血、骨髓、羊水制备染色体诊断染色体上的疾病[1-2]。关于传代细胞的核型分析技术研究很少。传代细胞具有驯化成熟、人为控制性强的特点,在实际科研、检验、疫苗生产以及生物制品研发等领域被广泛应用。笔者以低血清培养适应的BHK21细胞进行传代培养,染色体标本制备参考翁炳焕等[3]提出的考评标准,其中,可分析分裂相的要求为数目明确、全部染色体集中但不重叠、染色体伸展适度、着丝粒清晰、染色清晰[4],取4个代次400个中期分裂相的染色体进行分析,判定该细胞系的畸变率,以此为依据筛选优良的细胞株。
1 材料与方法
1.1材料
1.1.1主要试剂。秋水仙素;卡诺氏固定液,甲醇∶冰醋酸=3∶1;吉姆萨染色液;25 g/L胰蛋白;胎牛血清;KCl。
1.1.2细胞BHK21。细胞BHK21购自中国兽药监察所,由中农威特生物科技股份有限公司质量保证部保存,按常规组织培养法进行培养和传代。
1.1.3培养基。MEM细胞培养基为GIBCO公司产品,MEM SLM低血清细胞培养基为北京清大天一生物技术有限公司产品,新生牛血清为兰州民海生物技术公司产品。
1.2方法
1.2.1细胞培养。将复苏的BHK21细胞在T75培养瓶中适应低血清培养基培养32代,其中,F1~F8代为传统201培养液+10%血清培养的BHK21细胞,F9~F16代为商业化低血清培养基+5%血清培养的BHKL21细胞,F17~F25代为商业化低血清培养基+4%血清培养的BHKL21细胞,F26~F32代为商业化低血清培养基+3%血清培养的BHKL21细胞。
1.2.2染色体标本制备。参照《四种动物传代细胞染色体遗传变异率分析》中染色体标本制备的方法。将5代、10代、20代、30代作为细胞染色体分析的代次,于细胞终止培养前5~6 h,在细胞培养物中加入适量的秋水仙素溶液,使秋水仙素的终浓度为0.01 μg/mL培养液,以便阻止细胞有丝分裂至中期,至培养结束时,倾弃培养液加入适量25 g/L胰蛋白酶消化液对细胞单层进行消化,收集细胞,再加入预热至37 ℃的75 mmol/L KCl溶液5~6 mL,室温下低渗30 min,离心倾弃上清液;然后加入固定液(甲醇∶冰醋酸=3∶1)5 mL固定30 min后,800~1 000 r/min离心10 min,重复固定1次,置于4 ℃过夜,次日离心倾弃上清液,沉淀加1 mL新配制的固定液制成细胞悬浮液,在冰水浸泡的干净玻片上滴加细胞悬浮液3~4滴,室温下晾干,即制成培养细胞有丝分裂中期的染色体玻片标本。
1.2.3染色体的Giemsa染色[5]。染色体玻片标本于室温下放置7 d,或37 ℃干燥2~4 h后,即可进行染色体的Giemsa染色,用pH 6.8的磷酸盐缓冲液配成100 g/L的Giemsa染色液,滴在染色体玻片标本上,染色30 min,蒸馏水冲洗干净,晾干。

注:a.F4在201培养液+10%血清中的细胞形态;b.F9在MEM SLM+5%血清中的细胞形态;c.F18 在 MEM SLM+4%血清中的细胞形态;d.F27在MEM SLM+3%血清中的细胞形态。 Note: a. Cell morphology of F4 (201 culture liquid + 10% serum); b. Cell morphology of F9 (MEM SLM + 5% serum); c. Cell morphology of F18 (MEM SLM + 4% serum); d. Cell morphology of F27 (MEM SLM + 3% serum). 图1 驯化稳定4个代次BHK21细胞48 h培养形态Fig. 1 Cultivation morphology of four generations of BHKL21 cells at 48 h after stable domestication
1.2.4染色体的观察与分析。每个代次选择100个中期分裂相细胞,在油镜(10×100)下计数染色体数目,并观察记录畸变染色体,计算出染色体的畸变率,每种血清含量培养的细胞选择1个分裂良好的中期分裂相拍摄显微照片,并进行核型分析。
2 结果与分析
细胞驯化过程中,每个代次BHK21细胞长势稳定,形态良好(图1)。BHK21是源于幼仓鼠肾的一种传代细胞系[6-7]。共计数了BHK21细胞系的5代、10代、20代和30代400个中期分裂相的染色体,染色体数目分布见表1。由表1可知,BHK21属于亚二倍体和亚四倍体系,5代、10代和30代主要是亚二倍体细胞系,其中,亚二倍体细胞染色体数目32~67,所占比例分别为76%、80%和79%,亚四倍体细胞染色体数目为68~87,所占比例分别为23%、20%和20%。20代主要是亚四倍体细胞,染色体数目为68~87,所占比例为68%。染色体的畸变率在各代次所占比例为0~2%,染色体畸变率很低。因此,该细胞经驯化,用低血清培养基培养后,不同的血清用量,各代次之间无本质差异,遗传学特性相对稳定,故可候选为制苗用细胞。4个代次细胞中期分裂相见图2。
表14个代次染色体数目分布
Table 1Distribution of four generations of chromosome number
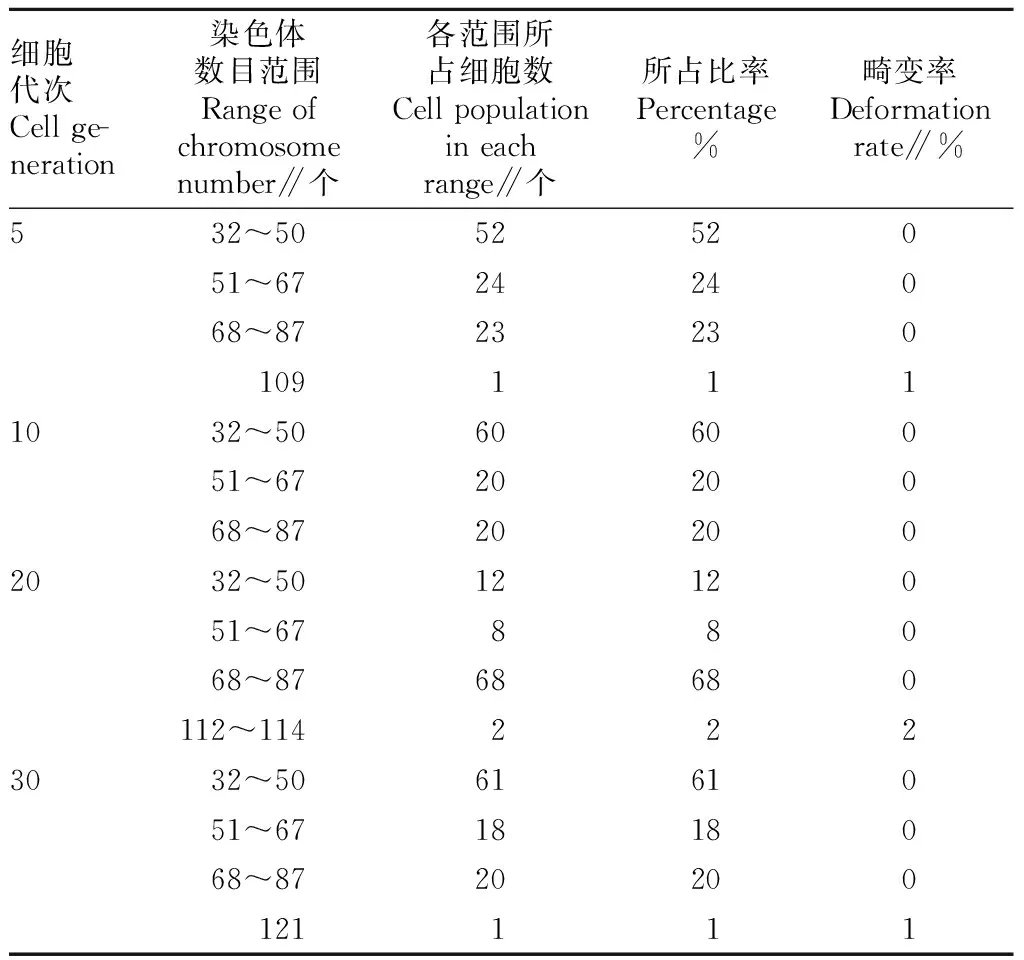
细胞代次Cellge-neration染色体数目范围Rangeofchromosomenumber∥个各范围所占细胞数Cellpopulationineachrange∥个所占比率Percentage%畸变率Deformationrate∥%532~505252051~672424068~87232301091111032~506060051~672020068~87202002032~501212051~6788068~8768680112~1142223032~506161051~671818068~8720200121111
3 结论
用商业化的代血清培养基驯化培养BHK21细胞,逐渐降低培养液中的血清含量,进行传代培养,通过选取不同代次细胞的染色体进行核型分析。结果表明,该细胞系的遗传学特性相对稳定,各代次间无本质差异,可候选为制苗用细胞。
[1] 张桂林,卫小静,郑梅玲.918例孕中期羊水细胞染色体核型分析[J].中华医学遗传学杂志,2012,29(1):102-104.
[2] 张旺东,王秋菊.染色体核型分析在白血病分型诊断和预后判断中的临床意义[J].国际检验医学杂志,2010,31(12):1359-1363.
[3] 翁炳焕,任宇珂,朱瑞建,等.染色体制备及核型分析室内控制标准及其考评标准的探讨[J].中国产前诊断杂志,2013,5(2):40-44.
[4] 黄燕,陈绍坤.动物骨髓细胞染色体标本制备失败的原因分析[J].生物学通报,2006,42(1):52-54
[5] 郭健民,张耀平,刘瑞清,等.常用实验动物肿瘤染色体的研究[J].遗传学报,1980,7(4):376-381.
[6] UMENE K, NISHIMOTO T. Replication of herpes simplex virustype 1 DNA is inhibited in a temperature-sensitive mutant of BHK-21 cells lacking RCC1(regulator of chromosome condensation)and virus DNA remains linear[J].J Gen Virol,1996,77(10):2261-2270.
[7] ISLAM M Q,ISLAM K,LEVAN G,et al. Monochromosome transfers to syrian hamster BHK cells via microcell fusion provide functional evidence for suppressor genes on human chromosome 9 both for anchorage independence and for tumorigenicity [J].Genes Chromosomes Cancer,1995,13(2):112-115.
Chromosome Genetic Stability Analysis of BHK21 Cells with Low Serum Culture
CHEN Miao-miao, DONG Jin-jie, DU Ping
(China Agricultural VET. BIO. Science and Technology Co., Ltd., Lanzhou, Gansu 730046)
[Objective] To analyze a commercialization low serum medium, which was suitable for subculture of BHK21 cells, to analyze the variation stability of the cell chromosome to determine its quality. [Method] Direct method was used to prepare chromosome specimens of 4 four generations BHK21 cells. Conventional Giemsa staining was adopted. The number of metaphase mitotic chromosomes was counted by 1 000 times of optical microscope, so as to find the rate of chromosome mutation, and to carry out karyotype analysis. [Result] BHK21 was a sub diploid or tetraploid cell line. The hypodiploid mode was 42, hypotetraploid cell mode was 72-74 .The chromosome aberration rate of the cell line was 0-2%., which was lower than that of the generation. [Conclusion] The genetic characteristics of the cell line are relatively stable, there is no essential difference between the generations, and it can be used as a candidate for the production of cells.
Low-serum; BHK21; Chromosome; Genetic stability
国家高新技术研究发展计划项目(“863”计划 2011AA10A211)。
陈苗苗(1980- ),女,四川广元人,助理研究员,硕士,从事生物制品研发工作。
2016-07-06
S 188
A
0517-6611(2016)23-097-02
