黄芪多糖对小鼠卵母细胞体外成熟的影响
2016-10-10闫学花王丽丽李科瑛雷安民张为民
闫学花,王丽丽,张 锐,文 杨,李科瑛,杨 萌,雷安民,张为民
(西北农林科技大学动物医学院,陕西杨凌 712100)
黄芪多糖对小鼠卵母细胞体外成熟的影响
闫学花△,王丽丽△,张锐,文杨,李科瑛,杨萌,雷安民*,张为民*
(西北农林科技大学动物医学院,陕西杨凌 712100)
采集未成熟小鼠卵母细胞添加不同浓度的黄芪多糖(APS)进行体外成熟(IVM)培养,统计卵母细胞生发泡破裂(GVBD)发生率以及第一极体(first polarbody,PB1)排出率,并通过卵母细胞JC-1染色方法进行线粒体膜电位检测;进一步在卵母细胞培养液中添加丙酮醛(MG)与黄芪多糖共培养,统计GVBD发生率及PB1排出率,检测活性氧(ROS)产生情况,探讨黄芪多糖在小鼠卵母细胞体外培养及体外成熟中的作用。结果显示,黄芪多糖对小鼠卵母细胞体外成熟,包括GVBD发生率和PB1排出率无显著影响。添加丙酮醛与黄芪多糖共培养结果显示,10 mg/mL+APS+MG试验组PB1排出率显著降低,相应的卵母细胞ROS产生量显著升高,但对GVBD发生率则无显著影响。
小鼠卵母细胞;黄芪多糖;体外培养
卵泡体外培养和卵母细胞体外成熟是获得成熟卵母细胞的重要途径,首个卵母细胞体外成熟的报道是在1939年[1-2]。卵母细胞成熟包括核成熟和质成熟,自然情况下,哺乳动物的卵母细胞成熟过程经历了一个不对等的减数分裂,形成一个大的单倍体卵子和一个小的极体,这对于受精是必不可少的。1983年,体外成熟(invitromaturation,IVM)技术首次成功应用于临床,目前IVM研究已由单纯基础研究扩展到试管婴儿、供卵、生殖保险等多个领域[3],有广阔的应用前景。大量试验证明,IVM是可行且安全的。体外成熟过程中卵母细胞的培养条件,包括温度、气体以及其他各种各样的媒介,对胚胎生产的质量和数量起到关键的作用[4]。因此,卵母细胞的体外培养条件的相关研究引起了越来越多学者的关注。
黄芪多糖(Atragaluspolysaccharides,APS)是黄芪的主要活性成分,是黄芪中含量最多、药理作用最显著的一类物质。鉴于中药在促细胞增殖、抗氧化、保胎及促精子活力[5-7]等方面的作用以及其能从整体性、多靶点、全方位改善机体的生理状态等特点。现代药理学研究发现,黄芪多糖具有清除自由基、抗氧化、改善微循环及免疫调节、促进骨髓造血、保护内皮细胞功能等药理作用,对各系统功能均有一定的影响[8]。已有研究证明,多种抗氧化剂对卵母细胞成熟以及胚胎发育有明显的影响[9-13]。
氧化应激是近几年已被证实的参与诱导细胞损伤的主要机制之一[14]。在卵母细胞成熟过程中,氧化应激能够抑制卵母细胞生发泡破裂(germinal vesicle breakdown,GVBD)及减数分裂纺锤体组装和功能[15-16]。此外,活性氧(reactive oxygen species,ROS)的生成可以改变几个氧化还原途径并可能最终导致卵母细胞凋亡和胚胎死亡[17]。研究表明,一些化学试剂可以导致卵母细胞中活性氧水平升高[18-19],而加入一些抗氧化剂,例如白藜芦醇,可以显著降低活性氧的产生[19],进而提高卵母细胞的成熟率。已有研究显示,丙酮醛(methylglyoxal,MG)可导致卵母细胞自由基生成增加,引起氧化损伤,干扰纺锤体的正确组装,导致成熟率降低[19],可用于构建卵母细胞氧化损伤模型。
本试验通过收集GV期小鼠卵母细胞,培养液中分别添加不同浓度的黄芪多糖进行体外培养,统计卵母细胞成熟率,检测卵母细胞线粒体膜电位变化;进一步添加丙酮醛与黄芪多糖对小鼠卵母细胞共培养,统计卵母细胞成熟率,同时检测活性氧水平,旨在研究黄芪多糖对卵母细胞体外成熟的影响及其可能机制,以期为哺乳动物卵母细胞体外成熟培养条件提供借鉴,也为黄芪多糖在生殖生物学方面的应用提供理论依据。
1 材料与方法
1.1材料
1.1.1实验动物6周龄~8周龄昆明白雌性小鼠,购自第四军医大学实验动物中心,饲养过程中的保持规律的光照周期(12/12h光照/黑暗),温度保持在23℃~27℃,相对湿度在40%~70%,小鼠自由采食和饮水。
1.1.2药品与试剂黄芪多糖(Z20040086),天津赛诺制药有限公司产品;DPPH、Hoechst33342、M2培养基、矿物油、丙酮醛(MG)、线粒体膜电位检测试剂盒(JC-1)等,美国Sigma-Aldrich公司产品;活性氧检测试剂盒,碧云天生物技术研究所产品;孕马血清(PMSG),宁波三生药业有限公司产品。
1.2方法
1.2.1清除DPPH自由基能力的测定称取适量DPPH溶于无水乙醇,配制成0.2 mmol/L的DPPH溶液。分别向6个不同浓度(5、10、15、20、25、30 mg/L)的黄芪多糖待测溶液2.0 mL,加入0.2 mmol/L的DPPH溶液2.0 mL,摇匀,静置100 min,以无水乙醇调零,测定在517 nm处的吸光度A0,同时测定2.0 mL DPPH溶液与2.0 mL无水乙醇混匀后在517 nm处的吸光度Ai,计算公式为:清除率(inhibition percent), I=[1(A0-Ai/A0]×100%,以维生素C作为黄芪多糖抗氧化能力的阳性对照。
1.2.2卵母细胞的收集和试验处理选取6周龄~8周龄的雌鼠,经腹腔注射10 IU的PMSG进行超数排卵处理,并刺激卵泡的生长,44 h~46 h后断颈处死小鼠,取出卵巢放入含有2.5 μmol/L米力农的MEM培养液,在体视显微镜下用针压破卵泡,挑选GV期卵母细胞,清洗后,将其移入预先平衡过的、植物油覆盖的M2培养基液滴中,放入37 ℃、体积分数为5%的CO2、饱和湿度的培养箱培养,17 h后统计GVBD发生率和PB1排出率。
1.2.3卵母细胞的体外培养分组按照以上方法采集小鼠卵母细胞,按以下分组进行培养。A,添加黄芪多糖组:空白对照组,0.1、1、10 mg/mL黄芪多糖培养组。B,添加黄芪多糖与丙酮醛共培养组:空白对照组,丙酮醛组,0.1 mg/mL APS+ MG组、1 mg/mL APS + MG组、10 mg/mL APS + MG组,MG浓度均为75 μmol/L。每个培养滴中加入20个~30个卵母细胞,于上述条件中培养,17 h后,统计PB1排出率,PB1排出率=17 h发生PBE1的卵母细胞数/发生GVBD的卵母细胞数,同时进行卵母细胞标记物免疫荧光染色。
1.2.4小鼠卵母细胞线粒体膜电位测定参照文献[20],将成熟培养17 h的卵母细胞进行JC-1染色。卵母细胞用PBS洗3遍,置于1 mmol/L JC-1的培养液中,37 ℃、体积分数为5%的CO2中孵育20 min。后用预冷的1×JC-1 staining buffer清洗卵母细胞,最后在荧光显微镜下观察。
1.2.5卵母细胞活性氧荧光探针标记用无血清培养液MEM按照1∶1 000稀释DCFH-DA,使其终浓度为10 μmol/mL,将培养17 h的卵母细胞置于此溶液中,37 ℃、体积分数为5%的CO2中孵育20 min,用MEM清洗卵母细胞,最后在荧光显微镜下观察。
1.2.6数据分析每个统计至少3个生物学重复,每个重复是由一个独立的试验在不同的时间完成。试验数据使用Graphpad Prism 5.0进行方差分析,P<0.05为差异显著,P<0.01为差异极显著。荧光强度用Image J进行分析。
2 结果
2.1DPPH自由基清除测定
如图1所示,VC作为阳性对照,黄芪多糖的清除率为30%左右,DPPH自由基清除随着黄芪多糖浓度增大变化不明显。
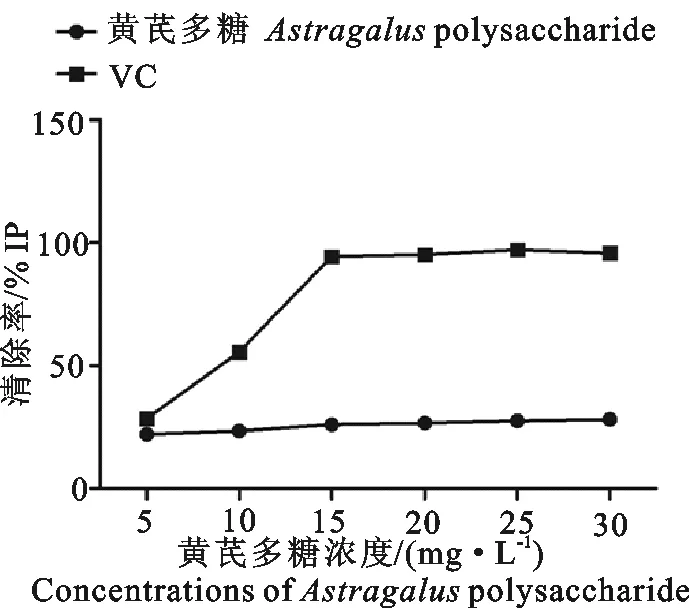
图1 不同浓度黄芪多糖对自由基的清除能力Fig.1 The scavenging ability of free radix by different concentrations of Astragalus polysaccharide
2.2黄芪多糖对卵母细胞体外成熟的影响
卵母细胞在加有黄芪多糖的M2培养基中培养17 h后,对生发泡破裂(GVBD)率和第一极体排出(PBE1)率进行统计(图2和图3)。可以看出,各组GVBD率为90%左右,各组间无显著性差异;PBE1率分别为76.91%(对照组),63.62%(0.1 mg/mL),47.70%(1.0 mg/mL),65.14%(10 mg/mL),添加黄芪多糖后,小鼠卵母细胞GVBD发生率以及PB1排出率无显著性变化,并且PB1排出率还有轻微降低,但与对照组相比差异不显著。
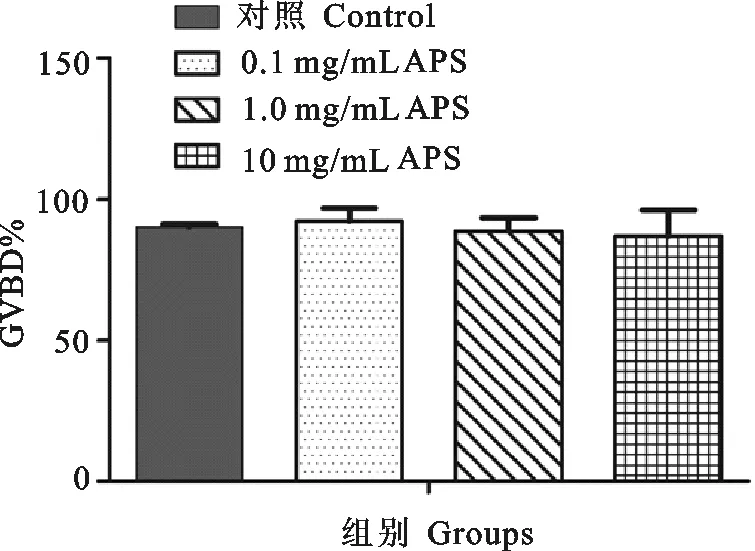
图2 添加黄芪多糖对卵母细胞GVBD发生率的影响Fig.2 Effect of addition of Astragalus polysaccharides on GVBD rate in mouse oocytes
2.3黄芪多糖对卵母细胞线粒体膜电位的影响
线粒体膜电位与线粒体ATP的产生直接相关,成熟培养卵母细胞体外培养17 h后同时进行线粒体膜电位检测,在荧光显微镜下卵母细胞显示出红色和绿色2种颜色,红色荧光代表较高的线粒体膜电位,主要分布于卵母细胞外围,绿色荧光代表较低的膜电位,在卵母细胞中散在分布,黄芪多糖对卵母细胞膜电位的影响如图4所示,可以看出,对照组、0.1、1、10 mg/mL黄芪多糖组红色荧光强度/绿色荧光强度的比值分别是1.6、1.2、1.4、1.5,与对照组相比,黄芪多糖处理组卵母细胞线粒体膜电位略有下降,但无显著差异。
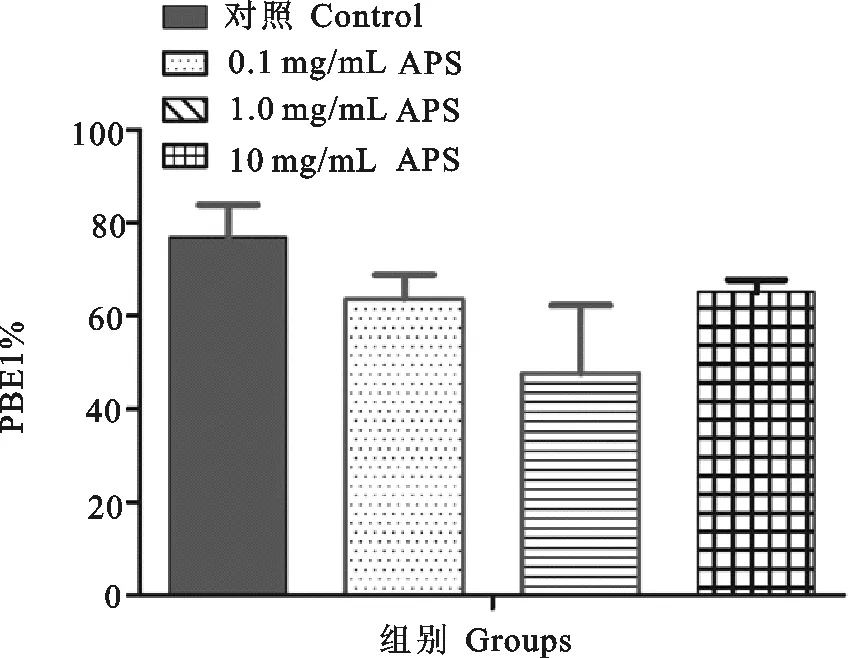
图3 添加黄芪多糖对卵母细胞PB1排出率的影响Fig.3 Effect of addition of Astragalus polysaccharides on PBE1 rate in mouse oocytes

A.绿色荧光;B.红色荧光;C.各组红色荧光/绿色荧光强度比
A.Green fluorescence;B.Red fluorescence;C.Red fluorescence/green fluorescence
图4黄芪多糖对卵母细胞线粒体膜电位的影响
Fig.4The influence ofAstragaluspolysaccharides on mitochondrial membrane potential of oocytes
2.4丙酮醛和黄芪多糖对卵母细胞体外成熟的影响
添加丙酮醛和黄芪多糖共培养小鼠卵母细胞,统计GVBD发生率(图5)和PBE1排出率(图6),由图可以看出,各组GVBD发生率为95%左右,各组间无显著差异 ;PBE1排出率分别为71.54%、48.40%、 67.41%、62.49%和 20.88%。结果表明,10 mg/mL黄芪多糖与MG共培养则会造成PBE1%显著降低(P<0.05)。
2.5丙酮醛和黄芪多糖对卵母细胞ROS水平的影响
运用ROS检测试剂盒检测处理后卵母细胞内ROS含量,结果如图7所示,可以看出,仅MG+10 mg/mL黄芪多糖组ROS含量明显升高,与对照组相比差异显著(P<0.05)。
3 讨论
黄芪粉或以黄芪为主的中药组方可提高畜禽的生产性能及饲料报酬率,黄芪多糖作为免疫增强剂的应用很多,但其应用于卵母细胞体外培养和成熟方面的研究较少。黄芪作为扶本固正类中草药饲料添加剂已开始应用于畜牧业生产。研究证实,作为黄芪中发挥作用的主要成分,黄芪多糖对睡眠剥夺小鼠损伤的雄性生殖器官以及精子冷冻后DNA片段的完整性具有明显的保护作用[21-22],能提高产蛋后期母鸡的生殖激素水平,有利于改善产蛋后期的卵巢功能,促进卵泡发育与排卵[23],这些资料提示,黄芪多糖在雌性动物生殖方面可能发挥一定作用。
本研究采集小鼠卵母细胞进行体外培养,对其进行不同浓度黄芪多糖处理,结果表明,黄芪多糖对小鼠卵母细胞的体外成熟无明显影响,反而与对照组相比有些许降低,其原因可能是原有培养基M2已含有卵母细胞体外成熟所需多糖,导致多糖作用占主导,从而影响其抗氧化作用的发挥,这与以往的抗氧化剂促进卵母细胞体外成熟及进一步发育不符[23-24],有待本课题组后续研究。已有研究结果证实丙酮醛(MG)可引起卵母细胞氧化损伤[19],可用于建立小鼠卵母细胞体外氧化损伤模型。我们采用丙酮醛与黄芪多糖共培养以观察黄芪多糖对氧化损伤卵母细胞的作用,结果显示,试验浓度的丙酮醛并不能造成小鼠卵母细胞体外成熟率的显著下降,但是试验组中黄芪多糖(10 mg/mL)与MG共培养可引起卵母细胞成熟率(PBE1)显著降低,而对GVBD的发生率没有影响;进一步检测这些卵母细胞中ROS的含量,与成熟率结果一致,由此推测卵母细胞中自由基浓度升高导致成熟率降低,而高浓度的黄芪多糖并没有起到清除自由基的作用,其原因有待于进一步研究。

图5添加黄芪多糖和丙酮醛共培养对卵母细胞GVBD发生率的影响
Fig.5Effect of addition ofAstragaluspolysaccharides and MG on GVBD rate in mouse oocytes

图6 黄芪多糖和丙酮醛共培养对小鼠卵母细胞 PB1排出率的影响Fig.6 Effect of addition of Astragalus polysaccharides and MG on PBE1 rate in mouse oocytes

A.ROS含量测定荧光图;B.ROS产生量
A.ROS content detected by fluorescence;B.ROS relative content
图7黄芪多糖和丙酮醛共培养对卵母细胞ROS水平的影响
Fig.7Effects of MG andAstragaluspolysaccharides treatment on ROS level in mouse oocytes
[1]Pincus G,Enzmann E V.The comparative behavior of mammalian eggsinvivoandinvitro.Ⅰ.The activation of ovarian eggs[J].J Exper Med,1935,62(5):665-675.
[2]Pincus G,Saunders B.The comparative behavior of mammalian eggsinvivoandinvitro. Ⅳ. The maturation of human ovarian ova[J].Anatom Rec,1939,75(4):537-545.
[3]Telfer E E,McLaughlin M.Strategies to support human oocyte developmentinvitro[J].Int J Develop Biol,2012,56(10-12):901-907.
[4]Khalil W A,Marei W F,Khalid M.Protective effects of antioxidants on linoleic acid-treated bovine oocytes during maturation and subsequent embryo development[J].Theriogenology,2013,80(2):161-168.
[5]李超,钱新华,千新来,等.黄芪多糖对人红白血病 K562 细胞增殖的抑制作用及机制[J].中华实用儿科临床杂志,2014,29(12):936-939.
[6]刘玉鹏,刘梅.30 种中草药的抗氧化活性研究[J].烟台大学学报:自然科学与工程版,2000,13(1):70-73.
[7]李轩,白勇,钟树怀,等.五子衍宗丸对不育患者附睾功能和精子活力的影响[J].光明中医,2009(7):1222-1223.
[8]Shao B M,Xu W,Dai H,et al.A study on the immune receptors for polysaccharides from the roots ofAstragalusmembranaceus,a Chinese medicinal herb[J].Biochem Biophys Res Commun,2004,320(4):1103-1111.
[9]Mokhber Maleki E,Eimani H,Bigdeli M R,et al.A comparative study of saffron aqueous extract and its active ingredient, crocin on theinvitromaturation,invitrofertilization,andinvitroculture of mouse oocytes[J].Taiwan J Obstet Gynecol,2014,53(1):21-25.
[10]Gale S L,Burritt D J,Tervit H R,et al.An investigation of oxidative stress and antioxidant biomarkers during greenshell mussel (Pernacanaliculus) oocyte cryopreservation[J].Theriogenology,2014,82(6):779-789.
[11]Abedi A,Rouhi L,Ghasemi Pirbalouti A.Effect of the extract fromGundeliatournefortiion immature mouse oocytes[J].J Herbal Drugs:An Int J Med Herbs,2014,5(2):87-92.
[12]Liu M,Yin Y,Ye X,et al.Resveratrol protects against age-associated infertility in mice[J].Hum Reprod,2013,28(3):707-717.
[13]Tavana S,Eimani H,Azarnia M,et al.Effects of saffron(CrocussativusL.) aqueous extract oninvitromaturation,fertilization and embryo development of mouse oocytes[J].Cell J,2012,13(4):259.
[14]Webster R P,Roberts V H J,Myatt L.Protein nitration in placenta- functional significance[J].Placenta,2008,29(12):985-994.
[15]Takami M,Preston S L,Toyloy V A,et al.Antioxidants reversibly inhibit the spontaneous resumption of meiosis[J].Am J Physiol,1999,276(4Pt1):E684-688.
[16]Sanfins A,Lee G,Plancha C,et al.Distinctions in meiotic spindle structure and assembly duringinvitroandinvivomaturation of mouse oocytes[J].Biol Reprod,2003,69(6):2059-2067.
[17]Ashok A,Sajal G,Lucky S,et al.Redox considerations in female reproductive function and assisted reproduction:from molecular mechanisms to health implications[J].Antioxidants & Redox Signaling,2008,10(8):1375-403.
[18]Duan X,Wang Q C,Chen K L,et al.Acrylamide toxic effects on mouse oocyte quality and fertilityinvivo[J].Sci Rep,2015,5:11562.doi:10.1038/srep11562.
[19]刘玉.白藜芦醇缓解丙酮醛对小鼠卵母细胞造成的氧化损伤[D].福建厦门:厦门大学,2014.
[20]Reers M,Smiley S T,Mottola-Hartshorn C,et al.Mitochondrial membrane potential monitored by JC-1 dye[J].Meth Enzymol,1995,260(260):406-417.
[21]柳立军,马鹏程,王磊,等.黄芪多糖对人精子冷冻后DNA完整性的保护作用[J].国际生殖健康/计划生育杂志,2015(5):361-363.
[22]李升和,金光明,许万祥,等.黄芪多糖对睡眠剥夺小鼠雄性生殖器官的影响[C]//中国畜牧兽医学会动物解剖学及组织胚胎学分会第十六次学术研讨会论文集,北京:2010.
[23]Wang X,Falcone T,Attaran M,et al.Vitamin C and vitamin E supplementation reduce oxidative stress-induced embryo toxicity and improve the blastocyst development rate[J].Fertil Steril,2002,78(6):1272-1277.
[24]Silva E,Greene A F,Strauss K,et al.Antioxidant supplementation duringinvitroculture improves mitochondrial function and development of embryos from aged female mice[J].Reprod Fertil Dev,2015,doi:10.1071/RD14474.
Effects of Astragalus Polysaccharides on in Vitro Maturation of Mouse Oocytes
YAN Xue-hua,WANG Li-li,ZHANG Rui,WEN Yang,LI Ke-ying,YANG Meng,LEI An-min,ZHANG Wei-min
(College of Veterinary Medicine,Northwest A&F University,Yangling,Shaanxi,712100,China)
In order to explore the effect ofAstragaluspolysaccharides(APS) in the process ofinvitromaturation (IVM) on mouse oocytes, immature mouse oocytes were collected from 6-8 week old mice and culturedinvitrowith APS( 0.1 mg/mL,1.0 mg/mL,10 mg/mL),and the rates of germinal vesicle breakdown (GVBD) and first polar body (PB1) elimination of oocytes were counted by statistics.The mitochondrial membrane potential in each group was detected.Simultaneously,the mouse oocytes were cultured with methylglyoxal (MG) and APS,and the production of ROS (reactive oxygen species) was detection.The results showed that addition of APS had no significant effects on mouse oocytes' maturation,including the rates of GVBD and PBE1.The result of addition of APS and MG for coculture of oocytes showed that the rate of PB1 elimination was significantly reduced in the group MG+10 mg/mL APS,and the ROS contents of oocyts increased significantly,but had no significant effect on GVBD rate.
mouse oocyte;Astragaluspolysaccharide;invitromaturation
2016-03-15
国家自然科学基金项目(31172280)
闫学花(1987-),女,陕西延安人,硕士研究生,主要从事动物胚胎工程研究。王丽丽(1986-)女,河北沧州人,博士研究生,主要从事动物胚胎工程研究。△同等贡献作者。*通讯作者
S852.165
A
1007-5038(2016)09-0079-05
