荧光PCR-熔解曲线法检测新疆回族人群CYP2C9和VKORC1基因多态性研究
2016-10-10柴树红唐丽红程瑞雪张中满张颖芬
柴树红,陈 丽,谷 苞,唐丽红,员 静,程瑞雪,张中满,张颖芬
(1.新疆维吾尔自治区乌鲁木齐市友谊医院检验科 830000;2.广州好芝生物科技有限公司,广州 510663)
·论著·
荧光PCR-熔解曲线法检测新疆回族人群CYP2C9和VKORC1基因多态性研究
柴树红1,陈丽1,谷苞1,唐丽红1,员静1,程瑞雪1,张中满2,张颖芬2
(1.新疆维吾尔自治区乌鲁木齐市友谊医院检验科830000;2.广州好芝生物科技有限公司,广州 510663)
目的应用荧光PCR-熔解曲线法检测新疆回族人群细胞色素P450酶2C9(CYP2C9)和维生素K环氧化物还原酶复合体亚单位1(VKORC1)基因多态性,研究新疆回族人群CYP2C9和VKORC1基因分布及基因突变频率情况,并评价荧光PCR-熔解曲线法临床使用的适用性。方法采用荧光PCR-熔解曲线法和测序法对比检测CYP2C9*2、CYP2C9*3和VKORC1(-1639G/A)的基因多态性。结果228例新疆回族人群中,共检测出CYP2C9*1/*1标本199例,CYP2C9*1/*2标本2例,CYP2C9*1/*3标本26例,CYP2C9*3/*3标本1例,未检测出CYP2C9*2/*2和CYP2C9*2/*3标本。VKORC1(-1639G/A)检测出2种等位基因G和A,其中VKORC1-1639G/G型标本检出2例,VKORC1-1639G/A型标本检出39例,VKORC1-1639A/A型标本检出187例,与测序法对比检测比较,荧光PCR-熔解曲线法与测序法检测结果完全一致。结论新疆回族人群同样具有CYP2C9基因*2、*3位点和VKORC1基因-1639位点的多态性,其发生频率与新疆维吾尔族及其他地域人群的具有一定差异,所采用的荧光PCR-熔解曲线法用于基因多态性检测可满足临床检测要求。
新疆回族;基因多态性;细胞色素P450酶2C9;维生素K环氧化物还原酶复合体亚单位1
华法林属香豆素类口服抗凝血药,是用于治疗血液栓塞性疾病的一线药物,其治疗窗口窄,很小的剂量变化都有可能导致严重不良反应。代谢华法林的酶、转运蛋白、受体和其他华法林靶蛋白的遗传多态性等因素均对华法林的疗效产生直接或间接的影响。随着药物遗传学的研究深入,越来越多的研究证实细胞色素P450酶2C9(CYP2C9)和维生素K环氧化物还原酶复合体亚单位1(VKORC1)基因多态性是造成华法林用量个体化差异的主要的遗传因素[1-3]。
华法林在肝脏的代谢依赖于细胞色素P450,其中CYP2C9是S-华法林的主要代谢酶。目前发现CYP2C9有50多个多态性位点,其中与华法林代谢最密切相关的是CYP2C9*2(430C/T,rs1799853)和CYP2C9*3(1075A/C,rs1057910)这两个多态性位点。携带CYP2C9*2或*3这两种等位基因的患者相对于野生型(CYP2C9*1)患者华法林剂量应减少[4]。VKORC1是维生素K循环中的关键酶,华法林是通过抑制该酶而阻断维生素K以辅助因子形式参与羧化酶的催化反应,抑制凝血因子Ⅱ、Ⅶ、Ⅸ、Ⅹ的功能活性,从而发挥抗凝作用。国内外大量研究发现,在VKORC1编码区和非编码区存在大量多态性位点,其中影响华法林使用的单核苷酸多态性位点主要是启动子区-1639G/A[5-6]。本文采用荧光PCR-熔解曲线法检测技术对新疆回族人群CYP2C9和VKORC1基因多态性进行检测,并应用测序法对比检测以评价该方法的灵敏度和特异度。本文所检测的新疆回族人群CYP2C9和VKORC1基因多态性,将为新疆地区回族人群的华法林个体化用药提供遗传学理论数据。
1 资料与方法
1.1一般资料乌鲁木齐市友谊医院检验科收集的228例新疆回族人群乙二胺四乙酸(EDTA)抗凝血液标本,要求各标本人群无血缘关系,其中男85例,女143例,年龄1~88岁。
1.2仪器与试剂罗氏公司LightCycler®480荧光PCR仪、美国ABI公司3130XL测序仪、血液基因组DNA提取试剂盒(货号DTK-250,广州好芝生物科技有限公司)、基因多态性检测试剂盒(广州好芝生物科技有限公司)。Taq酶(5 U/μL,PCR buffer,Mg2+,美国ABI公司),脱氧核糖核苷三磷酸(dNTP,25 mmol/L,美国ABI公司)、CYP2C9*2-测序引物SF/SR、CYP2C9*3-测序引物SF/SR、VKORC1-测序引物SF/SR引物合成均由上海生工生物工程技术有限公司合成。
1.3方法
1.3.1血液基因组DNA的提取收集2~4 mL经EDTA抗凝的外周血标本,取200 μL外周血液标本,使用广州好芝生物科技有限公司生产的血液基因组DNA提取试剂盒按说明书进行操作,提取的DNA于-20 ℃保存备用。
1.3.2基因多态性的检测(1)荧光PCR-熔解曲线法检测基因多态性。采用广州好芝生物科技有限公司生产的人CYP2C9和VKORC1基因多态性检测试剂盒,每个标本均需进行3个PCR反应,分别对应检测CYP2C9*2、CYP2C9*3和VKORC1(-1639)位点,每个反应体系总体积都是25 μL,每反应均由扩增试剂20 μL,DNA模板5 μL组成。扩增条件:UNG酶处理50 ℃,2 min;95 ℃预变性5 min;95 ℃变性15 s,60 ℃退火20 s,72 ℃延伸15 s,45个循环;95 ℃持续30 s,40 ℃持续30 s,45~75 ℃进入熔解曲线荧光采集步骤。具体操作参照说明书进行。(2)测序法检测基因多态性。CYP2C9*2、CYP2C9*3和VKORC1测序反应条件,每个反应体系总体积都是25 μL,含扩增试剂20 μL(含Hot start Taq酶、dNTPs),各型别引物CYP2C9*2-测序引物SF/SR、CYP2C9*3-测序引物SF/SR、VKORAC1-测序引物SF/SR),DNA模板5 μL。扩增条件:95 ℃ 5 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,45个循环;72 ℃ 2 min。扩增产物用于测序检测。
1.4结果判读荧光PCR-熔解曲线法检测基因多态性结果判读:对于每个靶点,阳性对照会显示2个熔解峰,Tm值较低的熔解峰指示该靶点野生型序列,Tm值较高的熔解峰指示该靶点突变型序列。若标本的熔解峰与阳性对照一致(熔解峰Tm在所示偏差范围内),则为杂合型;若标本的熔解峰为单峰,并且与阳性对照Tm值较低的熔解峰一致,则为纯合野生型;若标本的熔解峰为单峰,并且与阳性对照Tm值较高的熔解峰一致,则为纯合突变型。具体判读标准按说明书要求进行。
1.5统计学处理采用SPSS19.0软件进行统计处理,计数资料以率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
荧光PCR-溶解曲线法结果判读要求野生纯合和突变纯合型都是单峰,突变纯合型Tm值高于野生纯合型,杂合型为双峰,见图1。228例标本经测序验证与荧光PCR-熔解曲线对比,结果100%一致。本研究通过对228例新疆回族人群CYP2C9*2、CYP2C9*3位点检测,共发现2例CYP2C9*1/*2杂合突变型,其中男性和女性各占1例;发现26例CYP2C9*1/*3杂合型突变,其中男性11例,女性15例;发现1例女性为CYP2C9*3/*3突变纯合标本;其余199例为CYP2C9*1/*1野生标本。本研究中没有发现CYP2C9*2/*2突变纯合标本和CYP2C9*2/*3杂合标本。VKORC1基因(-1639位点)检测,共发现187例AA型,其中男性69例,女性118例;GA型39例,其中男性15例,女性24例;野生型GG型共2例,其中男、女性各1例。经χ2检验,新疆回族人群CYP2C9等位基因及基因频率分布符合Hard-Weinberg平衡定律(P>0.05),具有群体代表性。见表1、2。
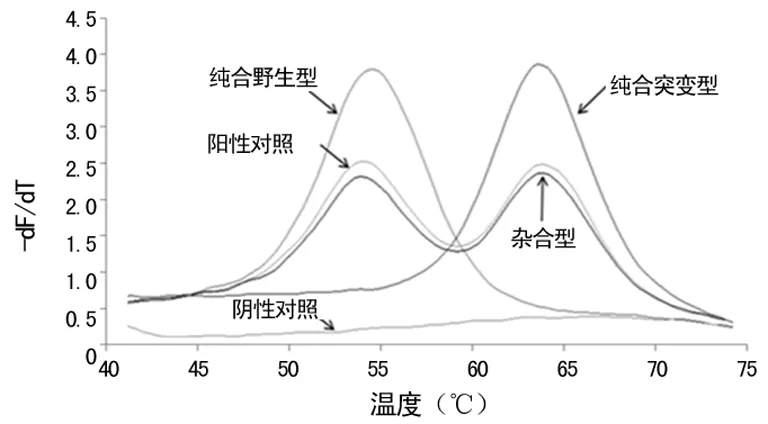
图1 纯合野生型、杂合型和纯合突变型的熔解峰示例

性别n*1/*1*1/*2*1/*3*2/*2*2/*3*3/*3男性8573(85.88)1(1.18)11(12.94)0(0.0)0(0.0)0(0.0) 女性143126(88.11)1(0.70)15(10.49)0(0.0)0(0.0)1(0.70)合计228199(87.28)2(0.88)26(11.40)0(0.0)0(0.0)1(0.44)
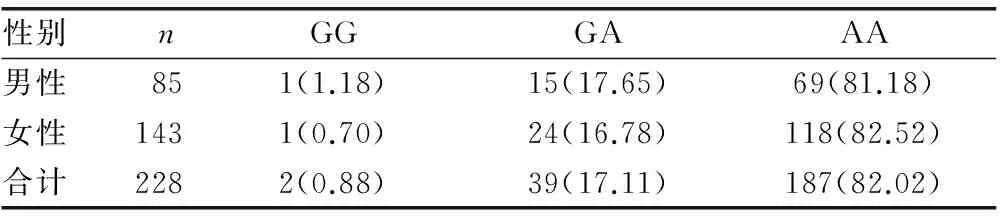
表2 VKORC1不同性别各基因型检出率[n(%)]
3 讨 论
影响个体适用华法林用药剂量的因素包括有遗传因素和非遗传因素,在遗传因素中基因多态性占据重要地位。CYP2C9和VKORC1基因的多态性位点直接影响华法林在个体中所起的疗效。研究表明个体有CYP2C9*2、CYP2C9*3等位基因,以及VKORC1基因(-1639位点)A等位基因的人群华法林用药剂量应比健康人群使用剂量减少。2007年8月美国食品药品监督管理局(FDA)建议加入药物遗传学信息来预测华法林的用量;2010年1月FDA建议检测CYP2C9和VKORC1基因型具体信息以更准确地预测华法林的个体化剂量。本研究基于新疆回族人群进行基因多态性的检测,发现基因型发生频率与不同民族/地区人群均有某程度上的差异,对评估新疆回族人群华法林临床使用剂量将有一定的临床意义。
经研究新疆回族人群CYP2C9和VKORC1基因多态性,通过查阅文献资料与国内其他民族及亚洲其他地区人群基因发生率比较,显示其分布有一定的人群和地域差异。新疆回族人群与哈萨克族在CYP2C9基因*2、*3位点的多态性发生频率上差异无统计学意义(P>0.05)[7],但与汉族[6,8],以及维族[7],差异有统计学意义(P<0.05)。在VKORC1基因-1639位点多态性发生频率的比较上,新疆回族人群与汉族差异无统计学意义(P>0.05)[6],但与维族和哈萨克族差异有统计学意义(P<0.05)[7,9]。
与东亚的日本、韩国,东南亚的泰国、印度尼西亚和印度,以及西亚的伊朗、以色列和阿曼人群相比[10-11],新疆回族人群的CYP2C9基因多态性发生频率,差异均有统计学意义(P<0.05)。印度、伊朗、以色列和阿曼的CYP2C9*2等位基因检出率较高,印度和以色列的CYP2C9*3等位基因检出率较高,而日本、韩国、泰国和印度尼西亚的这两种等位基因的检出率都很低,这是造成差异的主要原因。对于VKORC1基因(-1639位点),新疆回族人群与日本、韩国人群没有明显差异,但与泰国、印度尼西亚、印度、伊朗和阿曼则差异有统计学意义(P<0.05)。其中与印度的差异最大,印度人群主要为VKORC1基因(-1639位点)GG型,基因型发生率达到74.88%,而本研究的新疆回族仅为0.88%,差异有统计学意义(P<0.05)。
在基因多态性研究领域,检测手段各种各样,包括基因测序法、荧光PCR法以及芯片杂交法等[6-9]。基因测序法操作繁琐,成本相对较高,检测流程时间长,一般出检测报告需要一至数天,不适宜大规模的推广。荧光PCR法成本相对较高,需要多色荧光探针进行区分各突变位点,特异度需要严格控制。芯片杂交法,检测流程相对较长,需要PCR后进行开盖杂交,有潜在的污染风险。本研究中所使用的荧光PCR-熔解曲线法与以上方法相比有一定的优势,单管检测一个位点,依据熔解峰的个数和Tm值判读结果,操作简单、结果判读容易、检测流程短、不需要开管。本研究所用的方法与测序法对比检测,检测结果一致性为100%,适合临床上推广使用。
综上所述, CYP2C9和VKORC1基因多态性是影响华法林使用剂量的主要的遗传因素,本研究结果可为华法林临床个体化用药提供遗传学数据。
[1]Sanderson S,Emery J,Higgins J.CYP2C9 gene variants,drug dose,and bleeding risk in warfarin-treated patients:A HuGEnetTM systematic review and meta-analysis[J].Genet Med,2005,7(2):97-104.
[2]Rieder MJ,Reiner AP,Gage BF,et al.Effect of VKORC1 haplotypes on transcriptional regulation and warfarin dose[J].N Engl J Med,2005,352(22):2285-2293.
[3]Wang TL.Genetic factors contribute to patient-specific Warfarin dose for Han Chinese[J].Clin Chim Acta,2008,396(1/2):76-79.
[4]Taube J,Halsall D,Bagl T.Influence of cytochrome P-450 CYP2C9 polymorphisms on warfarin sensitivity and risk of over-anticoagulation in patients on long-term treat ment[J].Blood,2000,96(5):1816-1819.
[5]Yin T,Miyata T.Warfarin dose and pharmacogenomics of CYP2C9 and VKORC1-rationale and perspectives[J].Thromb Res,2007,120(1):1-10.
[6]徐仁爱,戴大鹏,胡利明,等.中国汉族人群CYP2C9常见多态性位点的检测及其与国外其他人群的比较研究[J].医学研究杂志,2011,40(6):27-30.
[7]张艳,赵军,凯塞尔·吾甫尔,等.新疆维吾尔族和哈萨克族健康人群CYP2C9和VKORC1基因多态性研究[J].中国药师,2013,16(12):1759-1763.
[8]刘媛,钟诗,龙杨敏,等.华法林药代学和药动学通路突变等位基因在中国汉族人群中的分布[J].北京大学学报,2011,43(6):798-803.
[9]李婧,木胡牙提·乌拉斯汉,卢武红,等.VKORC1基因1639G>A位点多态性与新疆地区哈萨克族、汉族心房颤动患者的相关性研究[J].新疆医科大学学报,2013,36(4):444-449.
[10]Gaikwad T,Ghosh K,Shetty S.VKORC1 and CYP2C9 genotype distribution in Asian countries[J].Thromb Res,2014,134(3):537-544.
[11]Finkelman BS,Gage BF,Johnson JA,et al.Genetic warfarin dosing:tables versus algorithms[J].J Am Coll Cardiol,2011,57(5):612-618.
Study on fluorescence PCR-melting curve method for detecting CYP2C9 and VKORC1 gene polymorphism in Xinjiang Hui population*
CHAIShuhong1,CHENLi1,GUBao1,TANGLihong1,YUANJing1,CHENGRuixue1,ZHANGZhongman2,ZHANGYingfen2
(1.DepartmentofClinicalLaboratory,UrumqiMunicipalFriendshipHospital,Urumqi,Xinjiang830000China;2.Helixgen(Guangzhou)Co.,Ltd,Guangzhou,Guangdong510663,China)
ObjectiveTo use the fluorescence PCR-melting curve method to detect CYP2C9 and VKORC1 gene polymorphism in Xinjiang Hui population,to analyze their gene distribution and gene mutation frequency,and to evaluate the clinical applicability of the fluorescence PCR-melting curve method.MethodsThe fluorescence PCR-melting curve method and sequencing method were adopted to contrastively detect CYP2C9*2,CYP2C9*3 and VKORC1(-1639G/A)gene polymorphism.ResultsAmong detected 228 Xinjiang Hui individuals,199 cases of CYP2C9*1/*1,2 cases of CYP2C9*1/*2,26 cases of CYP2C9*1/*3 and only 1 case of CYP2C9*3/*3 were detected,no case of CYP2C9*2/*2 and CYP2C9*2/*3 was detected.Two kinds of allele G and A were detected for VKORC1(-1639G/A),in which VKORC1-1639G/G type was detected in 2 cases,VKORC1-1639G/A type was detected in 39 cases and VKORC1-1639A/A type was detected in187 cases,compared with the sequencing method,the results of the fluorescence PCR- melting curve method were completely consistent.ConclusionXinjiang Hui population also has CYP2C9 gene *2,*3 loci and VKORC1 gene(-1639G/A) locus polymorphism,their occurrence frequency has a certain difference with Xingjiang Uygur and other regional populations,the adopted fluorescence PCR-melting curve method used in the gene polymorphism detection can meet clinical detection requirements.
Xinjiang Hui nationality;gene polymorphism;cytochrome P450 2C9;vitamin K epoxide reductase complex subunit 1
新疆维吾尔自治区乌鲁木齐市卫生和计划生育委员会科学技术计划项目(201501)。
柴树红,女,副主任技师,主要从事分子生物学和个体化基因检测研究。
10.3969/j.issn.1673-4130.2016.17.005
A
1673-4130(2016)17-2371-03
2016-04-05
2016-06-11)
