裸鼹鼠骨髓巨噬细胞分离培养方法的建立及其功能的初步研究
2016-10-09程继帅赵善民林丽芳余琛琳杨文静崔淑芳第二军医大学实验动物中心上海00433第二军医大学教学保障处上海00433
程继帅, 李 莉, 肖 邦, 赵善民, 林丽芳, 丛 薇,汤 球, 孙 伟, 余琛琳, 杨文静, 崔淑芳(. 第二军医大学实验动物中心, 上海 00433; . 第二军医大学教学保障处, 上海 00433)
裸鼹鼠骨髓巨噬细胞分离培养方法的建立及其功能的初步研究
程继帅1, 李 莉2, 肖 邦1, 赵善民1, 林丽芳1, 丛 薇1,汤 球1, 孙 伟1, 余琛琳1, 杨文静1, 崔淑芳1
(1. 第二军医大学实验动物中心, 上海 200433; 2. 第二军医大学教学保障处, 上海 200433)
目的 建立一种裸鼹鼠骨髓巨噬细胞分离培养的方法,并通过与小鼠骨髓巨噬细胞进行比较研究其吞噬功能。方法 分离裸鼹鼠骨髓细胞,在含60 ng/mL巨噬细胞集落刺激因子(M-CSF)完全培养基的诱导下,体外贴壁培养6~7 d,采用倒置显微镜观察细胞的生长状态。裸鼹鼠骨髓细胞诱导结束后,采用流式细胞术检测贴壁细胞表面抗原CD11b和F4/80的阳性率,鉴定骨髓巨噬细胞的纯度; 采用异硫氰酸荧光素(FITC)-dextran根据荧光强度比较裸鼹鼠和ICR小鼠骨髓巨噬细胞的吞噬功能。 结果 通过本方法获得的贴壁细胞具有典型的巨噬细胞的形态特征,且细胞表面抗原CD11b和F4/80的阳性率均高于80%; 裸鼹鼠与ICR小鼠骨髓巨噬细胞的吞噬率分别为99.87%±0.13%和88.79%±0.90%。结论 本文建立的方法是一种简单实用的体外分离培养裸鼹鼠骨髓巨噬细胞的方法,且能够获得高纯度、高活性的巨噬细胞。裸鼹鼠骨髓巨噬细胞的吞噬功能高于小鼠骨髓巨噬细胞。
裸鼹鼠; 骨髓巨噬细胞; 分离培养; 功能
裸鼹鼠是一种特别的啮齿类动物, 具有抗衰老、抗病毒、抗肿瘤等特性。目前, 裸鼹鼠生物学特性以及抗衰老、抗肿瘤、抗病毒相关的分子生物学机制一直是科学家们研究的热点[1]。研究[2]表明,15%的肿瘤是由病毒感染引起的,而某些病毒的长期感染能够导致机体免疫系统功能的紊乱。巨噬细胞是动物机体内重要的免疫细胞,具有抗肿瘤和免疫调节等重要作用[3]。然而由机体组织器官获取的巨噬细胞量较少,且巨噬细胞属不繁殖细胞群,在适宜的条件下仅能够生活2~3周,难以长期生存,多做原代培养,而骨髓造血干细胞经诱导分化可得到大量的巨噬细胞[4]。因此,裸鼹鼠骨髓巨噬细胞分离培养方法的建立是其抗病毒、抗肿瘤特性研究的重要基础。本实验建立了一种简单实用的裸鼹鼠骨髓巨噬细胞分离培养的方法,并检测其吞噬功能,为其抗病毒、抗肿瘤特性的研究提供理论依据。
1 材料与方法
1.1 实验动物
6~8周龄清洁级雄性ICR小鼠3只, 购于上海斯莱克实验动物有限责任公司[SCXK(沪)2012—0002]; 12~16月龄普通级雄性裸鼹鼠6只, 由第二军医大学实验动物中心繁殖[5]。
1.2 主要试剂与仪器
1.2.1 主要仪器 超净工作台(YJ-1450B,苏州金燕净化设备厂)、恒温干燥箱(D-6450,Heraeus)、三气培养箱(INCO246med, Memmert公司, 德国)、流式细胞仪(BD FACSCalibur, BD公司, 美国)等。1.2.2 主要试剂 粒细胞-巨噬细胞刺激因子(GMCSF, Peprotech, 美国)、巨噬细胞集落刺激因子(MCSF, Peprotech, 美国)、高糖DMEM(H-DMEM,Gibco,美国)、低糖DMEM(L-DMEM,Gibco,美国)、胎牛血清(Gibco,美国)、红细胞裂解液(生工生物科技有限公司)、PE-CD11b、PE-F4/80 (Biolegend,美国)、异硫氰酸荧光素(FITC)-Dextran(Sigma,美国)等。
1.3 实验方法
1.3.1 细胞准备 参照文献方法分离培养ICR小鼠骨髓巨噬细胞[6]。取成年裸鼹鼠,脱颈椎法处死,体积分数75%乙醇浸泡2~3 min,移入超净台,无菌条件下取其两后肢,剥离皮肤和肌肉,分离股骨和胫骨,去掉两端软骨组织,1 mL注射器轻轻插入骨髓腔,用完全培养基冲洗骨髓腔,制成单细胞悬液[7]。离心后弃上清,红细胞裂解液裂解红细胞,补加完全培养基终止裂解,离心后弃上清,完全培养基重悬细胞,37 ℃ 体积分数3%O25%CO2及92%N2条件下培养8~12 h。收集上清,离心后弃上清,分别用含60 ng/mL M-CSF的H-DMEM 和L-DMEM重悬细胞,继续培养6~7 d。倒置显微镜下观察细胞的生长状态和形态特征。
1.3.2 骨髓巨噬细胞的鉴定 细胞体外诱导结束后,弃上清,PBS洗涤后,用胰酶消化细胞,L-DMEM终止消化,离心弃上清,PBS洗涤后,室温避光分别孵育PE-CD11b和PE-F4/80,PBS洗涤后,PBS重悬细胞,上机进行流式细胞术检测。
1.3.3 骨髓巨噬细胞吞噬功能的检测 细胞体外诱导结束后,弃上清,PBS洗涤后,用胰酶消化细胞,完全培养基终止消化,离心弃上清,PBS洗涤后,室温避光孵育FITC-Dextran,PBS洗涤后,PBS重悬细胞,上机进行流式细胞术检测,同时以ICR小鼠骨髓巨噬细胞为对照。
2 结果
2.1 骨髓巨噬细胞的形态特征
细胞体外诱导过程中, 显微镜下可观察到: 诱导48 h内, 细胞形仍多为圆形, 与诱导前相比差异不大;随着诱导时间的延长, 细胞状态趋于稳定, 细胞凋亡减少; 诱导7 d时, 有些细胞呈放射状, 有许多伪足和突起。相较于高糖培养基,细胞于低糖培养基中的生活状态较好,细胞状态稳定且凋亡少(图1)。
2.2 骨髓巨噬细胞鉴定
流式细胞术检测表明: 使用上述方法获得的贴壁细胞表面抗原CD11b阳性率为84.51%±0.83%,F4/80的阳性率为82.41%±1.16%, 均高于80%, 说明采用该方法可以获得较高纯度的巨噬细胞(图2)。
2.3 裸鼹鼠与ICR小鼠巨噬细胞吞噬能力比较
流式细胞术检测表明, 使用上述方法获得的裸鼹鼠骨髓巨噬细胞的吞噬率为99.87%±0.13%(图3),ICR小鼠骨髓巨噬细胞的吞噬率为88.79%±0.90%(图3)。说明相比小鼠骨髓巨噬细胞,裸鼹鼠骨髓巨噬细胞的吞噬功能较强(图4)。

图 1 裸鼹鼠骨髓巨噬细胞体外培养细胞状态
3 讨论
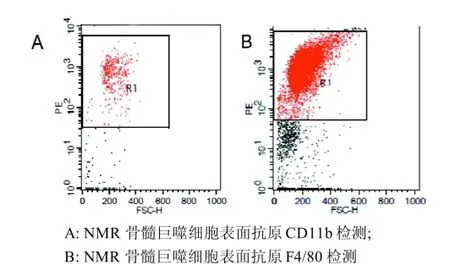
图 2 裸鼹鼠骨髓巨噬细胞纯度鉴定

图 3 ICR 小鼠骨髓巨噬细胞表面抗原CD11b检测
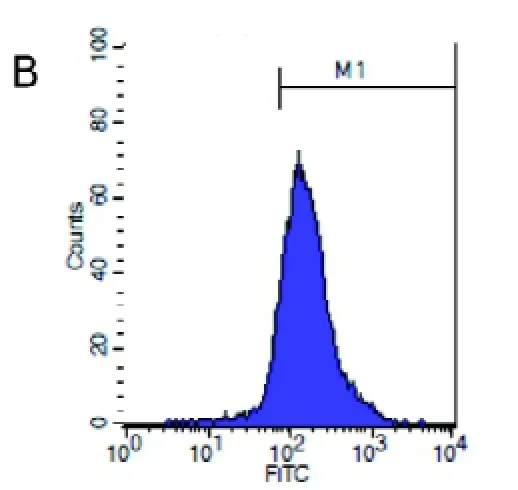
图 4 裸鼹鼠骨髓巨噬细胞表面抗原F4/80检测
裸鼹鼠于1967年首次被Jarvis引入实验室进行科学研究,之后不断有科学家将裸鼹鼠作为实验动物对其生物学特性进行研究[8]。由于地理环境的差异,国内学者对裸鼹鼠的研究很少,仅有个别单位与国外研究人员合作开展相关的研究[9]。本实验室引入裸鼹鼠后,对其生物学特性展开了一系列研究[10-14]。巨噬细胞作为一种重要的免疫细胞,具有多种功能,是研究细胞吞噬、细胞免疫和分子免疫学的重要对象。巨噬细胞在许多疾病中发挥着重要的作用,特别是在炎症性疾病的发病过程以及肿瘤的发生发展中发挥着关键作用[15, 16]。而裸鼹鼠具有抗病毒、抗肿瘤的特性,因此本实验室进行裸鼹鼠巨噬细胞的研究,以期为人类炎性疾病和肿瘤的防治提供新的思路。
裸鼹鼠脾淋巴细胞中巨噬细胞的比例低于5%,分离腹腔巨噬细胞时易分离出透明的粘性物质(本实验室检测数据,待发表),而M-CSF是一种具有谱系特异性的细胞因子,对单核细胞的增殖、分化及维持活性具有重要作用,常被用作造血干细胞增殖分化为巨噬细胞的细胞因子。因此,本文所建立的裸鼹鼠巨噬细胞分离培养的方法选用M-CSF诱导骨髓造血干细胞分化为骨髓巨噬细胞, 以期建立一种简单使用的裸鼹鼠巨噬细胞分离培养方法。
目前,巨噬细胞的鉴定通常包括形态学观察、吞噬功能的检测和免疫学标志检测[17]。本实验中,M-CSF诱导分化完成后,通过倒置显微镜观察贴壁细胞的形态特征,运用流式细胞术检测细胞表面抗原CD11b和F4/80鉴定并检测细胞纯度,同时使用FITC标记的葡聚糖比较裸鼹鼠和小鼠骨髓巨噬细胞的吞噬功能。实验结果表明:采用该方法获得的贴壁细胞呈放射状,多数细胞出现伪足和突触,具有巨噬细胞典型的形态特征,流式细胞术检测结果表明,获得细胞的CD11b和F4/80的阳性率均高达80%以上,巨噬细胞吞噬功能检测结果表明,裸鼹鼠骨髓巨噬细胞的吞噬率高于小鼠骨髓巨噬细胞的吞噬率。综上所述,本实验所建立的M-CSF体外诱导骨髓造血干细胞分化的方法是一种简单实用的体外分离培养裸鼹鼠骨髓巨噬细胞的方法,经形态学、功能学和免疫学鉴定,得到的贴壁细胞为高纯度、高活性的巨噬细胞。
本实验室前期实验[18, 19]结果表明,polyI:C分别刺激裸鼹鼠和小鼠后,小鼠的组织器官产生显著的病理变化,而裸鼹鼠的组织器官未表现出显著的病理变化,组织内自噬体增多,NF-κB信号通路关键基因NKRF的表达下降,证实裸鼹鼠具有较强的抗polyI:C感染的能力,且polyI:C刺激后裸鼹鼠自噬水平显著升高,并且polyI:C刺激后裸鼹鼠NF-κB信号通路的活化被抑制。本实验结果证明裸鼹鼠巨噬细胞可能在机体病毒感染过程中能够更加高效地清除病毒以及机体损伤处组织和细胞的坏死碎片。尽管众多数据证明裸鼹鼠的免疫系统与其抗病毒、抗肿瘤特性相关,但是免疫细胞和免疫组织在抵抗病毒侵染和抑制肿瘤发生过程中是如何相互作用的机制我们尚不明确。目前,裸鼹鼠免疫系统的研究处于起步阶段,仍有许多的未解之谜需要更进一步的研究。
[1] 林丽芳, 赵善民, 肖邦, 等. 裸鼹鼠成纤维细胞原代培养方法的建立 [J]. 实验动物与比较医学, 2013, 33(6):481-486.
[2] Stakaityte G, Wood JJ, Knight LM, et al. Merkel cell polyomavirus: molecular insights into the most recently discovered human tumour virus [J]. Cancers (Basel), 2014, 6(3): 1267-1297.
[3] 罗亚坤, 程燕. 小鼠腹腔巨噬细胞的分离培养与鉴定 [J].科技致富向导, 2013, (10):15,22.
[4] Epelman S, Lavine KJ,Randolph GJ. Origin and functions of tissue macrophages [J]. Immunity, 2014, 41(1):21-35.
[5] 孙伟, 汤球, 赵善民, 等. 裸鼹鼠人工饲养繁殖初步研究 [J].实验动物与比较医学, 2013, 33(4):296-300.
[6] 任凯夕, 赵诣林, 金超, 等. 小鼠骨髓来源巨噬细胞体外培养及极化相关实验方法的建立 [J]. 细胞与分子免疫学杂志, 2013, 29(3):310-313.
[7] Majumdar MK, Thiede MA, Mosca JD, et al. Phenotypic and functional comparison of cultures of marrow-derived mesenchymal stem cells (MSCs) and stromal cells [J]. J Cell Physiol,1998, 176(1):57-66.
[8] Edrey YH, Hanes M, Pinto M, et al. Successful aging and sustained good health in the naked mole rat: a long-lived mammalian model for biogerontology and biomedical research [J]. ILAR J, 2011, 52(1):41-53.
[9] 赵善民, 崔淑芳. 裸鼹鼠生物学特性的研究进展 [J]. 实验动物与比较医学, 2013, 33(5):400-405.
[10] 袁子彦, 赵懿宁, 张璐, 等. 裸鼹鼠肺脏显微结构与超微结构观察 [J]. 实验动物与比较医学, 2013, 33(5):378-387.
[11] 袁子彦, 赵懿宁, 张璐, 等. 裸鼹鼠肝脏显微结构与超微结构观察 [J]. 实验动物与比较医学, 2013, 33(5):373-377.
[12] 袁子彦, 赵懿宁, 张璐, 等. 裸鼹鼠心脏显微结构与超微结构观察 [J]. 实验动物与比较医学, 2013, 33(5):383-387.
[13] 赵善民, 赵懿宁, 汤球, 等. 裸鼹鼠胸腺、脾脏及淋巴结解剖学、组织学与超微结构研究 [J]. 实验动物与比较医学, 2013, 33(5):395-399.
[14] 赵善民, 孙伟, 汤球, 等. 裸鼹鼠血液生理生化及尿常规值的测定 [J]. 实验动物与比较医学, 2013, 33(6):469-472.
[15] Ruffell B, Affara NI, Coussens LM. Differential macrophage programming in the tumor microenvironment [J]. Trends Immunol, 2012, 33(3):119-126.
[16]Dushkin MI. Macrophage/foam cell is an attribute of inflammation: mechanisms of formation and functional role [J]. Biochemistry (Mosc), 2012, 77(4):327-338.
[17] 李静, 王亚平. 大鼠骨髓巨噬细胞的分离,纯化,培养以及鉴定 [J]. 重庆医科大学学报, 2003, 28(4):436-439.
[18] 林丽芳, 肖邦, 赵善民, 等. Poly I∶C刺激对裸鼹鼠体内自噬水平的影响 [J]. 实验动物与比较医学, 2014, 34(5): 411-416.
[19] 肖邦, 赵善民, 林丽芳, 等. 裸鼹鼠抵抗病毒感染相关机制的初步研究 [J]. 实验动物与比较医学, 2014, 34(5):422-427.
Establishment of Method for Separation, Cultivation of Bone Marrow Macrophage in Naked Mole Rats and Preliminary Research on Function
CHENG Ji-shuai1, LI Li2, XIAO Bang1, ZHAO Shan-min1, LIN Li-fang1, CONG Wei1,TANG Qiu1, SUN Wei1, YU Chen-lin1, YANG Wen-jing1, XU Chen1, CUI Shu-fang1
(1. Laboratory Animal Center; 2. Teaching Guarantee Department,Second Military University, Shanghai 200433, China)
Objective To establish the method for the primary culture of bone marrow macrophage in naked mole rats and study the phagocytosis compared with mice. Method The bone marrow cells from the hing leg of naked mole rats were detached. The cells were induced by 60 ng/mL Macrophage colony-stimulating factor (M-CSF) and cultured for 6~7 days in vitro. During the culture, the cell was observed in microscope. After induced, the flow cytometry was conducted to detect the purity of macrophage and the phagocytosis of macrophage with mouse as control. Result Through this method,the adherent cells with typical morphological characteristics were obtained and the positive rate of the cell surface antigen F4/80 and CD11b were higher than 80%. The phagocytosis rate of naked mole rats bone marrow macrophage was 99.87%±0.13%, but the ICR mice was 88.79%±0.90%. Conclusion This method is simple and practical for separation and culture of highly purified and functional naked mole rats bone marrow macrophage in vitro. It indicates that phagocytosis of naked mole rats bone marrow macrophage is higher than that of mice.
Naked mole rat; Bone marrow macrophage; Separation and cultivation; Function
Q95-33
A
1674-5817(2016)01-0072-04
10.3969/j.issn.1674-5817.2016.01.015
2015-12-14
国家科技支撑计划(2015BAI09B02); 上海市科委基金(14140900200)与上海市科委基金(15140900200)联合资助
程继帅(1991-), 女, 硕士生, 研究方向: 实验动物标准化及人类疾病动物模型研究。E-mail: handsome_91@163.com
崔淑芳, 教授, 研究方向: 实验动物标准化及人类疾病动物模型研究。E-mail: youngstar_sf@163.com
