环境丰富对SD大鼠生长和血液学指标的影响
2016-10-09李军延中国疾病预防控制中心职业卫生与中毒控制所北京100050
刘 帅, 李军延, 陈 巍, 张 奇, 吕 赛(中国疾病预防控制中心职业卫生与中毒控制所, 北京 100050)
环境丰富对SD大鼠生长和血液学指标的影响
刘 帅, 李军延, 陈 巍, 张 奇, 吕 赛
(中国疾病预防控制中心职业卫生与中毒控制所, 北京 100050)
目的 探讨环境丰富长期作用对于SD大鼠生长、摄食、血常规及血生化指标的影响。方法 48只3周龄SPF级SD大鼠,随机分为2组,环境丰富组用磨牙棒和木丝筑巢材料进行环境丰富。试验期间测量体质量和摄食量,32周龄时解剖采腹主动脉血进行血常规和血生化检测,并测量主要脏器重量。结果 与对照组相比,环境丰富组雄性大鼠10~19周龄的摄食量显著增加,体质量增加但不显著,血清总蛋白、白蛋白和胆固醇显著升高。雌性大鼠在上述指标无显著差异。主要脏器方面,环境丰富组雌性心脏和肝脏重量显著高于对照组,雄性附睾重量显著高于对照组,其他脏器无显著差异。环境丰富组雌性大鼠红细胞、血红蛋白、血小板指标显著升高,而雄性大鼠在上述指标间则无显著差异。结论 环境丰富对SD大鼠生长和部分血液学指标有一点程度影响,实验设计时应慎重考虑环境丰富条件的选择。
环境丰富; 生长发育; 动物福利; 血液学; 血液生化
环境丰富(environmental enrichment)是被广泛接受的一种提高实验动物福利待遇的方式[1],主要手段是采用各种方式增加实验动物饲养环境的复杂性,激发动物的兴趣,增加动物相互交往的机会,以使动物舒展自己的天性,避免各种异常行为的出现。已有大量研究表明,环境丰富能给实验动物带来有益影响,如减少刻板行为,提高记忆能力,增加神经可塑性等[2,3],而对大部分常规动物实验也无不利影响[4]。但前人的研究多关注于环境丰富对大鼠行为学和神经系统功能的影响[5-8],而对大鼠的生理生化方面指标的影响研究较少。本研究评估了长期环境丰富对SD大鼠生长、摄食以及血常规和血生化等指标的影响。
1 材料与方法
1.1 实验动物及分组
3周龄SPF级SD大鼠48只,雌雄各半,购自北京维通利华实验动物技术有限公司[SCXK(京)2012-0001]。随机分为2组,对照组饲养于标准笼盒中(47 cm × 31.5 cm × 20 cm),盒内添加杨木刨花和玉米芯颗粒为垫料。环境丰富组在对照组基础上添加高温灭菌消毒后的木质磨牙棒和木丝筑巢材料,进行环境丰富。20周龄前每笼4只, 20~32周龄间每笼3只,在中国疾病预防控制中心动物实验室屏障环境[SYXK(京)2009-0032]饲养7个月,饲喂60Co灭菌大、小鼠维持饲料,购自北京科澳协力饲料有限公司[SCXK(京)2009-0012]。饮水经反渗透紫外杀菌处理。
1.2 仪器与试剂
使用Sysmex XT1800i全自动血细胞分析仪及原厂血球试剂进行血常规检测。使用日立7020全自动生化分析仪及和光试剂进行血清生化检测。
1.3 检测指标及方法
1.3.1 体质量及摄食量测量 两组动物从4周龄开始称量体质量和摄食量。体质量测量22周龄前1周1次,22周龄后2周1次,摄食量称量1周2次,32周龄时结束。
1.3.2 脏器重量测量 SD大鼠32周龄时,使用质量分数10%的水合氯醛麻醉,腹主动脉采血处死,解剖。取心、肝、脾、肺、肾、肾上腺、胸腺、脑、垂体以及雄性的睾丸和附睾、雌性的卵巢、子宫用千分之一克电子天平称重。
1.3.3 血常规指标的检测 收集大鼠32周龄时采取的腹主动脉血进行血常规检测。血常规检测指标有: 白细胞(WBC)、红细胞(RBC)、血红蛋白(HGB)、红细胞比积(HCT)、红细胞平均容量(MCV)、红细胞平均血红蛋白量(MCH)、红细胞平均血红蛋白浓度(MCHC)、红细胞分布宽度(RDW)、血小板(PLT)、血小板比积(PCT)、血小板平均体积(MPV)、血小板体积分布宽度(PDW)、淋巴细胞(LYM)、淋巴细胞%(LYM%)、单核细胞(MON)、单核细胞%(MON%)、嗜中性粒细胞(NEU)、嗜中性粒细胞%(NEU%)、嗜酸性粒细胞(EOS)、嗜酸性粒细胞%(EOS%)、嗜碱性粒细胞(BAS)和嗜碱性粒细胞%(BAS%)。
1.3.4 血清生化指标的检测 收集大鼠32周龄时采取的腹主动脉血, 分离血清做血生化检测。血清中蛋白质、脂类、血糖检测指标包括: 总蛋白(TP)、白蛋白(ALB)、白蛋白/球蛋白(A/G)、胆固醇(CHO)、甘油三酯(TG)和血糖(GLU)。血清酶类指标包括: 肌酸激酶(CK)、乳酸脱氢酶(LDH)、碱性磷酸酶(ALP)、天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)。血清中代谢产物指标包括:总胆红素(BIL)、尿素氮(BUN)、肌酐(CRE)、尿酸(UA)。血清离子指标包括: 无机磷(P-3)和钙(Ca2+)。
1.4 统计学方法
2 结果
2.1 大鼠体质量、摄食量
如图1所示, 对照组和环境丰富组雌性大鼠生长曲线基本重合, 而环境丰富组雄性大鼠在12~20周龄体质量稍高于正常对照组, 但差异不显著(P>0.05),3~12周龄和22~32周龄间环境丰富组和对照组雄性大鼠体质量差异无显著性,生长曲线基本重合。由此可见环境丰富基本不对雌性大鼠体质量变化产生影响, 而对于雄性大鼠体质量的影响具有阶段性,可增进青壮年期(12~20周龄)大鼠体质量增长。
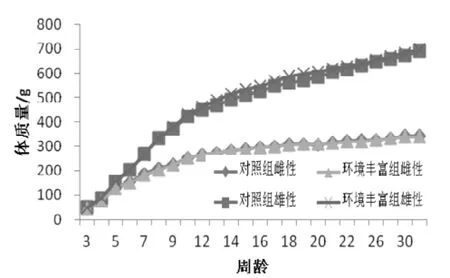
图 1 SD大鼠生长曲线Figure 1 Growth curves of the SD rats
如图2所示,环境丰富对雌性大鼠的摄食量无显著影响(P>0.05),对于雄性大鼠在10~12周龄、15~17周龄和19周龄,环境丰富组摄食量显著大于对照组(P<0.05), 其他时段摄食量差异无显著性。环境丰富对大鼠摄食量和体质量的影响趋势一致。
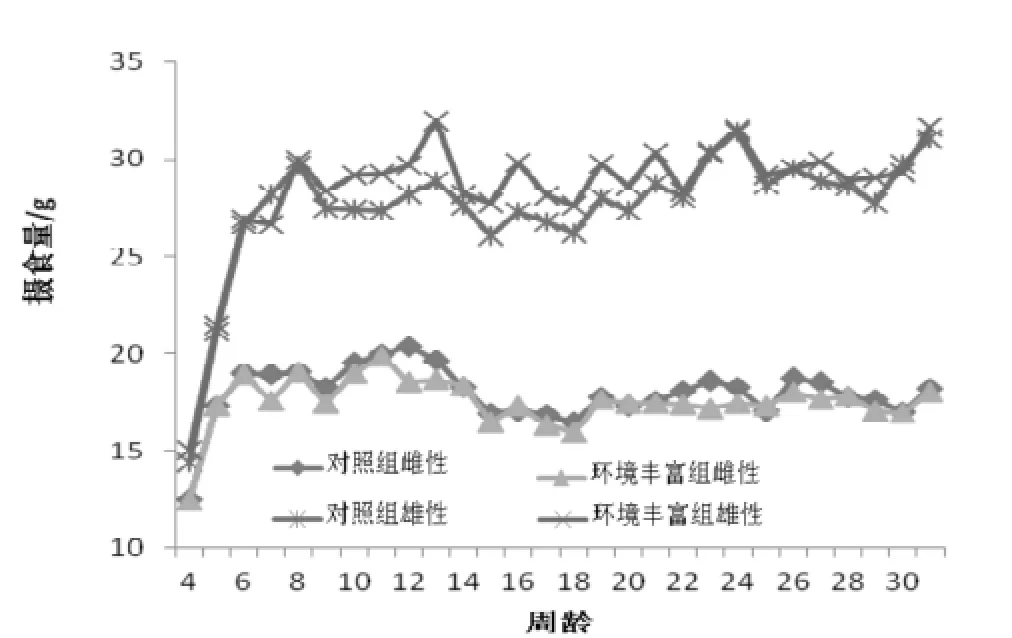
图 2 SD大鼠摄食量曲线Figure 2 The food consumption curves of the SD rats
2.2 大鼠主要脏器重量
环境丰富组雄性附睾显著高于对照组(P=0.039),雌性心脏和肝脏显著高于对照组(P<0.05, P<0.01),其他脏器(胸腺、脾、肺、肾、肾上腺、睾丸、卵巢、子宫、脑、垂体)差异不显著(表1)。
2.3 大鼠血液学
环境丰富组与对照组相比, 雄性血常规指标中差异显著的为: PDW、MPV、PCT、MCV、MCHC,差异极显著的为MONO和MONO%。雌性间血常规指标差异具有显著性的有: RBC、LYMPH,差异具有极显著性的指标有: HGB、PLT、PCT、MCHC、NEUT%、LYMPH%(表2)。

表 1 SD大鼠主要脏器重量Table 1 The weight of main organs in SD rats g
2.4 大鼠血清生化
环境丰富组和对照组结果经t检验,雌性之间所有指标都差异无显著性,雄性之间环境丰富组TP、ALB、CHO显著升高,其他指标差异不显著(表3)。
3 讨论
环境丰富由Hebb于1947年首先提出[9],指的是非生物刺激和社会刺激的复杂结合。应用于实验动物方面的主要目的是根据动物的特性,改变设施结构并提供相关资源,通过加强动物身体锻炼,促进动物的操作活动和认知活动,从而有利于发挥动物的物种特异性行为,刺激动物的感知和运动,加强动物福利[10]。各种环境丰富的方法和手段不断被开发和利用[11],而为啮齿类动物提供的木质磨牙棒是最常用的环境丰富资源。随着研究的深入,环境丰富对提高实验动物福利,减少应激和抑郁行为,改善生长发育以及繁殖性能等方面的有益影响已被广泛关注[12,13]。有些研究者对环境丰富存有顾虑,认为引入了变量,可能会影响实验的标准化,并可能增加动物行为的多样性,增加检测指标的变异系数,影响动物实验的结果,但对小鼠的系统分析表明,饲养环境丰富并没有影响动物实验的准确性和可重复性[14]。因此有必要对环境丰富进行评估和研究,环境丰富的应用应基于科学的证据,专业的判断和标准的实施条件[15]。在大鼠中的大部分研究多聚焦于短期或中期强环境丰富刺激对大鼠行为学及脑神经系统方面的作用[16-18],而关于环境丰富对大鼠生长发育及生理生化指标的影响的研究较少。
本研究探讨了磨牙棒和木丝筑巢材料长期暴露(7个月)对于大鼠生长和血液学指标的影响。研究结果显示,环境丰富显著提高雄性大鼠摄食量,增加体质量,显著升高了血清中蛋白质和脂类含量,而雌性大鼠两组间在体质量、摄食量、生化指标方面并无显著差异。环境丰富对雄性SD大鼠白细胞计数、红细胞计数、血红蛋白含量及血小板计数4个主要指标无显著影响,而升高了雌性大鼠的红细胞计数、血小板计数、血红蛋白含量。可见环境丰富的影响在动物不同性别之间的表现不一致, 这与其他关于环境丰富干预研究的结果类似。此环境丰富效果评价研究中多选用雄性动物[19],与对照差异显著,而选用雌性为研究对象的在体质量及摄食方面则无差异[20]。
体质量作为评价实验动物福利状况的常用指标,一般认为体质量的增长表明实验动物福利状况的改善或良好。在本研究中,环境丰富对雄性大鼠体质量和摄食量的影响具有阶段性。10~20周龄期间,环境丰富组雄性大鼠的体质量和摄食量高于对照组,而在10周龄之前和20周龄以后生长曲线几乎重合。文献报道中环境丰富对不同阶段动物体质量的影响也不尽相同,顾卫忠等[21]在小鼠中的研究显示,增加玩具对小鼠11~43日龄段体质量增加影响显著,43~57日龄段体质量增加影响不显著。而梁磊等[22]的研究显示添加玩具对小鼠4~6周龄间的体质量增长无显著影响。国外有报道环境丰富反而降低青春期大鼠的体质量增长量和摄食量[23,24]。体质量指标受多种因素影响,例如动物的摄食量和行为活动。环境丰富以让动物表现其物种特异性行为为目的。筑巢材料或是遮蔽物的增加就可能增加动物的休息睡眠时间,其体质量往往增长快速,而增加操作性或探索性的丰富材料,就可能增加了动物的自主活动,在摄食量不增加的情况下,动物体质量可能就不会增长明显甚至有可能减缓。不同的环境丰富方案对大鼠的刺激方式不同,其影响也不尽相同。此外环境丰富的刺激程度在大鼠不同的生长发育阶段表现也不相同[25]。就本研究而言,3~10周龄是SD大鼠体质量快速增长期,如果环境丰富的刺激不够,其对生长发育的影响被掩盖在动物本身快速生长发育的情况之下,表现不显著,而在10~20周龄,SD大鼠体质量增长进入缓慢平台期,环境丰富的影响则表现明显,可能会增加雄性大鼠的活动量,刺激进食,从而显著提高摄食量,体质量也比对照有所增加。由此可见体质量作为评价环境丰富效果的指标,不能一概而论,要结合大鼠的行为和生长阶段来具体分析。
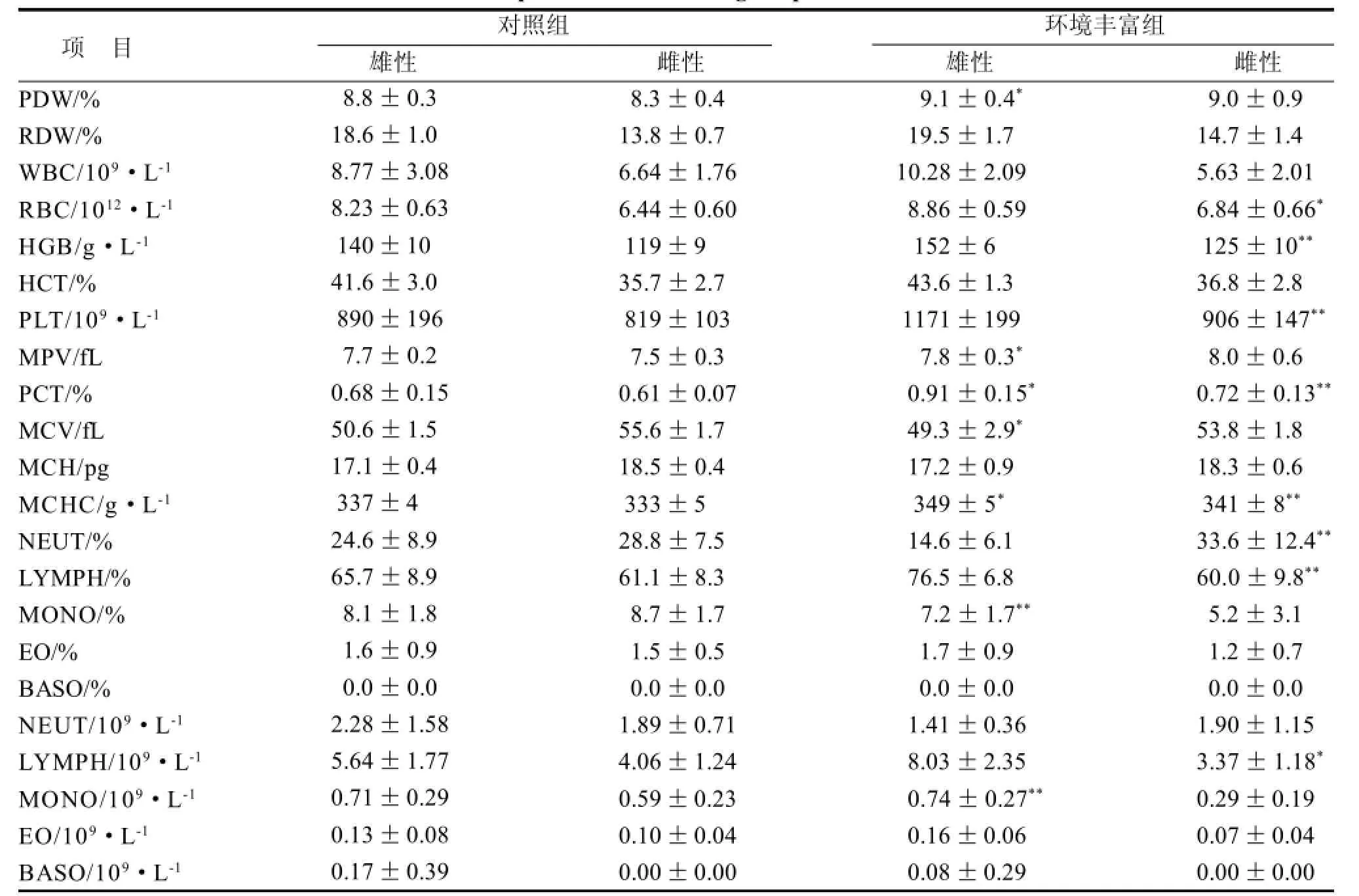
表 2 大鼠血常规检测Table 2 Comparison on hematological parameter in rats

表 3 大鼠血生化检测Table 3 Comparison on serum biochemical parameter in rats
环境丰富对免疫系统和神经系统的有益影响已在大量研究中得到证实。有报道[26]表明,环境丰富能够增加大鼠大脑的重量,增加胸腺、脾脏重量,降低肾上腺重量[27]。本研究中,环境丰富对主要脏器重量的影响并不显著,脑、脑垂体、胸腺、脾脏、肺、肾、肾上腺在环境丰富组和对照组间无显著差异。这可能跟环境丰富的方式有关,本研究应用的方式比较简单,不能持续给予大鼠新鲜感,对大鼠的兴趣激发不够强烈,从而对神经系统的作用不够显著。本研究选择7个月的环境丰富作用,解剖称量脏器重量时大鼠已进入中老年阶段,胸腺已经萎缩,因此对比也不明显。此外环境丰富的作用效果也可能与作用时间以及选择的动物性别和品种有关。
血常规指标中,雄性大鼠间红细胞、白细胞、血红蛋白、血小板指标差异无显著性,而环境丰富组雌性大鼠红细胞、血红蛋白、血小板显著高于对照组。国外在雌性小鼠中的研究报道,环境丰富组小鼠红细胞、红细胞比积少于对照组,而血红蛋白高于对照组,白细胞的影响则根据小鼠的品种而有所不同[28]。血常规指标受动物品种、性别、年龄、采血方式以及检测方法等因素的影响,且检测结果的变异系数较大,样本数量少的情况下经常会得出不一样的检测结果。环境丰富对SD大鼠血常规指标的影响还需进一步研究。
综上所述,环境丰富在改善实验动物福利状况的同时也会对实验动物的生理生化指标有影响,综合文献报道和本研究的结果,不同的环境丰富设计会产生不同的影响,积极的,消极的或是无影响,这取决于环境丰富的类型,环境丰富作用的时间,选择的动物品系与性别以及所要研究的指标。因此如果要在实验动物饲养管理中引入环境丰富方案,研究人员需要搜集更多的信息,评估丰富方案对具体动物品系和动物实验的影响,对各种丰富方案和丰富材料进行选择。
[1] Olsson IA, Dahlborn K. Improving housing conditions for laboratory mice: a review of “environmental enrichment”[J]. Lab Animals, 2002, 36(3):243-270.
[2] Leggio MG, Mandolesi L, Federico F, et al. Environmental enrichment promotes improved spatial abilities and enhanced dendritic growth in the rat[J]. Behav Brain Res, 2005, 163(1): 78-90.
[3] Van de Weerd HA, Van Loo PL, Van Zutphen LF, et al. Nesting material as environmental enrichment has no adverse effects on behavior and physiology of laboratory mice[J]. Physiol Behav,1997, 62(5):1019-1028.
[4] Dean SW. Environmental enrichment of laboratory animals used in regulatory toxicology studies[J]. Lab Animals, 1999,33(4):309-327.
[5] 方杰, 罗爱华, 潘翠环, 等. 丰富环境对颅脑外伤大鼠学习记忆及海马神经元凋亡的影响[J]. 中国康复医学杂志,2015, 30(2):117-121.
[6] 张玉静, 周焱, 许艳, 等. 丰富环境对创伤后应激障碍样大鼠自发活动和海马c-Fos、5-HT表达的影响[J]. 中华行为医学与脑科学杂志, 2015, 24(1):8-11.
[7] 赵燕, 胡洁, 康林, 等. 丰富环境及居住方式对快速老化小鼠认知功能和海马CA1区N-甲基-D-天门冬氨酸受体1的影响[J]. 中国康复医学杂志, 2015, 30(4):329-333,343.
[8] 李建忠, 郝兴华, 崔慧先, 等. 丰富环境对快速老化小鼠海马CA1区突触可塑性的影响[J]. 中华行为医学与脑科学杂志, 2015, 24(2):113-116.
[9] Hebb DO. The effects of early experience on problem solving at maturity[J]. Am Psychologist, 1947, 2:306-307.
[10] 梁磊, 恽时锋. 丰富环境在啮齿类实验动物中的应用及研究现状[J]. 中国比较医学杂志, 2015, 25(2):71-78.
[11] 胡樱, 许兰文, 杨斐, 等. 音乐、色彩干预对制动小鼠福利的影响[J]. 实验动物与比较医学, 2007, 27(2): 71-76.
[12] 周佳亮, 胡樱, 沙晓敏, 等. 几种福利干预措施对实验小鼠部分应激相关指标的影响[J]. 实验动物与比较医学, 2014,34(6):467-472.
[13] 梁磊, 许龙祥, 陈小晚, 等. 社居福利因素对小鼠生长发育及繁殖性能的影响[J]. 中国比较医学杂志, 2014, 24(1): 18-22.
[14] Richter SH, Garner JP, Wurbel H. Environmental standardization: cure or cause of poor reproducibility in animal experiments [J]. Nat Methods, 2009, 6(4):257-261.
[15] Toth LA, Kregel K, Leon L, et al. Environmental enrichment of laboratory rodents: the answer depends on the question [J]. Comp Med, 2011, 61(4):314-321.
[16] 刘媛, 柳朝阳, 张涛, 等. 丰富环境干预对生命早期不良经历雌性大鼠母爱行为的改善作用[J]. 中华行为医学与脑科学杂志, 2013, 22(7):594-597.
[17] 郭忠信, 李文宇, 李骏然, 等. 丰富环境和贫瘠环境对锰中毒小鼠学习记忆能力的影响[J]. 中华劳动卫生职业病杂志, 2013, 31(6):409-412.
[18] 谢鸿宇, 吴毅, 刘罡, 等. 不同的光线强度对丰富环境下大鼠运动水平的影响[J]. 中华物理医学与康复杂志, 2012, 34(5):330-333.
[19] Girbovan C, Plamondon H. Environmental enrichment in female rodents: considerations in the effects on behavior and biochemical markers[J]. Behav Brain Res, 2013, 253:178-190.
[20] 牛屹东, 张孟蕾, 刘继超. 应用波动性不对称评价以纸筒作为丰荣材料对BALB/c小鼠的影响[J]. 实验动物科学,2012, 29(5):9-12.
[21] 顾卫忠, 王晓东, 鲍世民, 等. 玩具对小鼠生长繁育性能影响初探[J]. 实验动物与比较医学, 2008, 28(2):131-132.
[22] 梁磊, 许龙祥, 刘家宽, 等. 玩具对小鼠生长发育及繁殖性能的影响[J]. 中国比较医学杂志, 2014, (9):48-52.
[23] Zaias J, Queeney TJ, Kelley JB, et al. Social and physical environmental enrichment differentially affect growth and activity of preadolescent and adolescent male rats[J]. J Am Assoc Lab Anim Sci, 2008, 47(2):30-34.
[24] Spangenberg EM, Augustsson H, Dahlborn K, et al. Housingrelated activity in rats: effects on body weight, urinary corticosterone levels, muscle properties and performance[J]. Lab Animals, 2005, 39(1):45-57.
[25] Goes TC, Antunes FD, Teixeira-Silva F. Environmental enrichment for adult rats: Effects on trait and state anxiety [J]. Neurosci Lett, 2015, 584:93-96.
[26] Bennett EL, Rosenzweig MR, Diamond MC. Rat brain: effects of environmental enrichment on wet and dry weights [J]. Science, 1969, 163(3869):825-826.
[27] Moncek F, Duncko R, Johansson BB, et al. Effect of environmental enrichment on stress related systems in rats [J]. J Neuroendocrinol, 2004, 16(5):423-431.
[28] Tsai PP, Pachowsky U, Stelzer HD, et al. Impact of environmental enrichment in mice. 1: effect of housing conditions on body weight, organ weights and haematology in different strains[J]. Lab Animals, 2002, 36(4):411-419.
Effect of Environmental Enrichment on Growth and Hematology in SD Rats
LIU Shuai, LI Jun-yan, CHEN Wei, ZHANG Qi, LV Sai
(National Institute of Occupational Health and Poison Control, China CDC, Beijing 100050, China)
Objective To study the effect of environmental enrichment on the growth and hematology of Sprague-Dawley (SD) rats. Method Forty-eight weaned 3-week old SD rats (male∶female = 1∶1) were allocated randomly to standard laboratory cages and enriched cages which were consisted of small sticks for grinding and wood-wool as nesting materials. The growth rate and food consumption were monitored. The rats were sacrificed at 32 weeks of age, and the indexes of organ weight, hematology and biochemistry were measured and analyzed. Results The food consumption of male rats in enriched cages was significantly increased between 10 and 19 weeks, but the weight gain was not significantly different compared to the standard group. The total serum protein, albumin and cholesterol were also increased significantly. No significant difference was found in the growth rate,food consumption or serum biochemistry in the female rats. The weights of epididymis of male rats and the weights of heart, liver of female rats were increased significantly. However, there was no significant difference for other organs. In addition, environmental enrichment showed significant impact on the erythrocyte, hemoglobin and platelet in the female rats, but not the male rats. Conclusions The environmental enrichment can alter the growth and hematology in SD rats to some degree, so the researchers need to pay attention on designing environmental enrichment strategies .
Environmental enrichment; Growth and development; Animal welfare; Hematology;Serum biochemical
R33 Q95-33
A
1674-5817(2016)01-0041-07
10.3969/j.issn.1674-5817.2015.06.008
2015-07-06
职业卫生与中毒控制所青年科技基金项目(DW201404)
刘 帅(1985-), 男, 硕士, 主要从事 实验动物学研究。E-mail: cauvet@126.com
李军延(1963-), 女, 副研究员, 主要从事实验动物及管理研究。E-mail: lijy1@chinacdc.cn
