不同生长条件下内生真菌对多年生黑麦草生理特性的影响
2016-10-09蔺伟虎汪建军李会强张光明
蔺伟虎,汪建军,李会强,张光明,田 沛
(1.草地农业生态系统国家重点实验室兰州大学草地农业科技学院,甘肃 兰州 730020;2.广东粤明电力工程有限公司,广东 珠海 519000)
不同生长条件下内生真菌对多年生黑麦草生理特性的影响
蔺伟虎1,汪建军1,李会强1,张光明2,田 沛1
(1.草地农业生态系统国家重点实验室兰州大学草地农业科技学院,甘肃 兰州 730020;2.广东粤明电力工程有限公司,广东 珠海 519000)
本研究通过比较带内生真菌(E+)、不带内生真菌(E-)和混合(M)3个种群的多年生黑麦草(Loliumperenne)在田间自然条件和温室不同水分处理下生理指标的变化,以解释内生真菌在不同生长条件下对多年生黑麦草内部生理机制的影响。结果表明,在温室条件下,土壤含水量为田间最大持水量(field water content,FWC)的15%(干旱)和60%(水淹)时,内生真菌侵染显著(P<0.05)提高了多年生黑麦草总叶绿素含量、可溶性糖含量、脯氨酸含量、超氧化物歧化酶活性和过氧化氢酶活性,同时降低了丙二醛含量和过氧化物酶活性,但在水分含量为45% FWC时,3个种群生理指标并无显著差异(P>0.05);说明在胁迫条件下,内生真菌通过提高保护酶活性以增加寄主的抗逆性。在田间条件下,黑麦草叶绿素含量、可溶性糖含量、脯氨酸含量、超氧化物歧化酶活性和过氧化氢酶活性的变化趋势依次为E+>M>E-,丙二醛含量和过氧化物酶活性的变化趋势依次为E->M>E+,表明在自然生长条件下,内生真菌仍然通过内部生理机制的改变促进寄主生长。
内生真菌;多年生黑麦草;水分胁迫;生理特性
多年生黑麦草(Loliumperenne)是一种冷季型禾草,其分蘖能力强,成坪率高,耐踩踏性好,适口性好,能够在不同环境下广泛播种,是全世界温带地区主要的牧草和草坪草[1-2]。作为牧草,多年生黑麦草具有建植性好、生长周期长和越冬性强等特征[3],而作为草坪草,它能与多种草种混播,快速建植以提高其草种建植的成功率[4-5],由于多年生黑麦草具有以上优良特性,目前已被广泛的研究和种植,因此,对多年生黑麦草抗逆性的研究具有重要意义。
禾草内生真菌是一大类能在禾草体内度过部分或全部生命周期,而禾草不显示外部症状的真菌[6]。这类真菌与寄主形成互惠共生体,内生真菌能促进寄主植物生长并增强寄主植物的抗逆性[7-10],与不带菌禾草相比,带菌禾草的抗逆性强、产量高,特别是内生真菌的侵染可增加宿主植物的抗旱性[11]。目前,对禾草内生真菌共生体抗逆性的研究大多集中在醉马草[12](Achnatheruminebrians)、披碱草[13](Elymusdahuricus)、野大麦[14](Hordeumbrevisubulatum)、羽茅[15](Achnatherumsilbiricum)、黑麦草[1](Loliumperenne)和高羊茅[16](Festucaarundinacea)等禾草上。虽然对多年生黑麦草在不同生境下生理指标变化的研究已有相关报道[17-19],但有关内生真菌在不同生长条件下对多年生黑麦草体内代谢变化的研究较少。研究表明,当遭受水分胁迫时,带菌黑麦草种群叶内超氧化物歧化酶(super oxide dismutase,SOD)活性明显高于不带菌黑麦草种群的[20],但对混合种群(M)并未探究,黑麦草内生真菌在不同带菌群落中所起作用是否相同也尚未知晓。为了进一步探究内生真菌对多年生黑麦草在不同水分条件和田间生理生长的影响,本研究以感染内生真菌和不感染内生真菌的黑麦草为材料,建立了带菌(E+)、混合(M)和不带菌(E-)种群,在田间和温室两种生长条件下,通过控制水分梯度,比较3个种群的叶绿素、可溶性糖、脯氨酸、丙二醛含量和保护酶活性等生理指标的差异,探讨内生真菌侵染对多年生黑麦草在不同生长条件下适应性的差异,了解其在抗旱性机理中的增益效应,以期为带菌禾草的引种和生产提供科学依据。
1 材料和方法
1.1材料
试验材料为商用多年生黑麦草品种顶峰(Pinnacle),由百绿国际草业(北京)有限公司提供。
1.2方法
1.2.1不同种群的建立和试验处理将供试种子于2015年6月初播种于育苗盘内,放置在兰州大学草地农业科技学院智能日光温室进行培育,每日适量浇水,待其生长至1~2个分蘖后,对成熟分蘖的叶鞘进行内生真菌带菌率的检测,建立E+、M和E-种群。将已建立的E+、M(平均带菌率为50%)和E-种群于8月17日分别移栽至兰州大学榆中草地农业试验站网室和草地农业科技学院智能日光温室内,室内温度18~25 ℃、湿度65%~80%、光照为自然光照。
盆栽试验:在智能温室中,选择大小、质量相同的塑料花盆(高25 cm,直径30 cm),依次在花盆底部装入800 g大小均匀的白卵石,然后在上部装1 500 g营养指标相同的黑壤土,花盆内壁附有竖直插入的两根塑料导水管,导管通花盆底部石中。将E+、M和E-种群分别移栽至准备好的塑料花盆,每盆6株,按照田间最大持水量(field water content,FWC)的15%、30%、45%和60%对花盆中的E+、E-和M种群进行土壤水分处理,每个处理设5个重复,处理开始时,先使土壤含水量达到田间持水量水平,然后停止供水使其自然下降,当达到预定的水分梯度后,称取各处理的初始重量并进行标记,此后每天用称重法通过导管将水灌入土壤底部来维持水分梯度。
田间试验:根据随机区组试验设计,对网室自然土壤进行除杂草浇水后将E+、M和E-种群幼苗分别移栽至小区,每个小区80株,行间距40 cm,每个种群设3个重复,共9个小区。移栽后进行田间管理维持其自然条件,每隔6 d除杂草浇水。土质为沙土和黄土混合型土壤,土壤含水量初期为45% FWC,后期随自然降水变化。
本研究中,内生真菌检测,E+、M和E-种群的建立,以及温室和田间移栽,温室水分处理及田间灌溉与李会强等[21]的一致。试验处理从2015年8月17日-10月17日共持续60 d。处理60 d后,收获植物地上部分,将鲜样用蒸馏水冲洗后用干净的报纸吸干表面水分,放入冰盒带回草地农业科技学院进行如下各项生理指标的测定。
1.2.2各项生理指标的测定叶绿素(Chl)测定采用丙酮浸提法[22];可溶性糖测定采用蒽酮比色法[23];脯氨酸测定采用磺基水杨酸法[24];丙二醛测定采用硫代巴比妥酸(TBA)法[25];过氧化物酶(peroxydase,POD)活性的测定采用愈创木酚法[26];SOD 酶活性的测定采用氮蓝四唑法[23];过氧化氢酶(catalase,CAT)活性的测定参照Wang和Huang[27]的方法。
1.3统计分析与作图
试验数据用SPSS 18.0 软件进行单因素方差分析,Duncan法进行多重比较,用Excel 2016制图。
2 结果与分析
2.1叶绿素含量
在温室不同水分处理下,E+、M和E-种群的叶绿素在同一水分处理下均表现为E+>M>E-的规律,在45% FWC水分处理时,3个种群无显著差异(P<0.05)(图1);在15% FWC和60% FWC水分处理时,E+种群的叶绿素含量分别显著高于E-种群10.8%和23.2%(P<0.05)。随着土壤水分含量的增加,叶绿素含量降低,在45% FWC水分处理时降到最小值,在60% FWC水分处理时含量又增加。
在田间条件下,E+和M种群叶绿素含量之间无显著差异(P>0.05),仅E+和E-种群叶绿素含量有显著差异(P<0.05), E+的叶绿素含量比E-的含量高32.9%(图1)。
2.2可溶性糖含量
在温室不同水分处理下,E+、M和E-种群的可溶性糖含量在同一水分处理下均表现为E+>M>E-的规律,在45% FWC水分处理时3个种群无显著差异(P>0.05)(图2);在15% FWC、30% FWC和60% FWC水分处理时,E+种群的可溶性糖含量分别显著高于E-种群46.8%、63.2%和41.1%(P<0.05)。随着土壤水分含量的增加,可溶性糖含量降低,在45% FWC水分处理时降到最小值,在60% FWC水分处理时含量又增加。
在田间条件下,E+和M种群可溶性糖含量之间无显著差异(P>0.05),仅E+和E-种群可溶性糖含量有显著差异(P<0.05), E+比E-含量高14.1%(图2)。

图1 温室不同土壤含水量和田间两种处理条件下3个黑麦草种群的叶绿素含量比较
注:不同大写字母表示同一水分处理不同黑麦草种群间差异显著(P<0.05),不同小写字母表示同一黑麦草种群不同水分处理间差异显著(P<0.05)。下同。
Note: Different capital letters for the same moisture condition indicate significant difference among different perennial ryegrass populations at 0.05 level and different lower case letters for the same perennial ryegrass population indicate significant difference among different soil moisture conditions at 0.05 level. The same below.

图2 温室不同土壤含水量和田间两种处理条件下3个黑麦草种群的可溶性糖含量比较
2.3脯氨酸含量
在温室不同水分处理下,E+、M和E-种群的脯氨酸含量在同一水分处理下均表现为E+>M>E-的规律,在45% FWC水分处理时3个种群间无显著差异(P>0.05)(图3);在15% FWC、30%FWC和60%FWC水分处理时,E+种群的脯氨酸含量分别显著高于E-种群38.1%、41.6%和36.6%(P<0.05)。随着土壤水分含量的增加,脯氨酸含量降低,在45%水分处理时降到最小值,在60%FWC水分处理时又增加。
在田间条件下,E+和M种群脯氨酸含量之间无显著差异(P>0.05),仅E+和E-种群脯氨酸含量有显著差异(P<0.05), E+比E-含量高19.7%(图3)。
2.4丙二醛含量
在温室不同水分处理下,E+、M和E-种群的丙二醛含量在同一水分处理下均表现为E->M>E+的规律,在45% FWC水分处理时3个种群无显著差异(P>0.05)(图4);在15% FWC、30% FWC和60% FWC水分处理时,E-种群的丙二醛含量分别显著高于E+种群40%、34%和42%(P<0.05)。随着土壤水分含量的增加,丙二醛含量降低,在45% FWC水分处理时降到最小值,在60% FWC水分处理时含量又增加。
在田间条件下,E-和M种群丙二醛含量之间无显著差异(P>0.05),仅E+和E-种群丙二醛含量有显著差异(P<0.05),E-比E+含量高10.8%(图4)。
2.5POD酶活性
在温室不同水分处理下,E+、M和E-种群的POD酶活性在同一水分处理下均表现为E->M>E+的规律,在45% FWC水分处理时3个种群无显著差异(P>0.05)(图5);在15% FWC、30% FWC和60% FWC水分处理时,E-种群的POD酶活性分别显著高于E+种群10.2%、11.3%和15.2%(P<0.05)。随着土壤水分含量的增加,POD酶活性降低,在60% FWC水分处理时降到最小值。

图3 温室不同水分处理和田间两种处理条件下3个黑麦草种群的脯氨酸含量比较
在田间条件下,E+和M种群POD酶活性之间无显著差异(P>0.05),仅E+和E-种群POD酶活性有显著差异(P<0.05),E-比E+含量高12.5%(图5)。
2.6SOD酶活性
在温室不同水分处理下,E+、M和E-种群的SOD酶活性在同一水分处理下均表现为E+>M>E-的规律,在45% FWC水分处理时3个种群无显著差异(P>0.05)(图6);在15% FWC、30% FWC和60% FWC水分处理时,E+种群的SOD酶活性分别显著高于E-种群32.6%、28.7%和24.2%(P<0.05)。随着土壤水分含量的增加,SOD酶活性降低,在45% FWC水分处理时达到最小值,在60% FWC水分处理时含量增加。
在田间条件下,E+和M种群SOD酶活性之间无显著差异(P>0.05),仅E+和E-种群SOD酶活性有显著差异(P<0.05), E+比E-活性高17.6%(图6)。
2.7CAT酶活性
在温室不同水分处理下,E+、M和E-种群的CAT酶活性在同一水分处理下均表现为E+>M>E-的规律,在45% FWC水分处理时3个种群无显著差异(P>0.05)(图7);在15% FWC、30% FWC和60% FWC水分处理时,E+种群的CAT酶活性分别显著高于E-种群20.9%、15.6%和29.4%(P<0.05)。随着土壤水分含量的增加,CAT酶活性降低,在45% FWC水分处理时降到最小值,在60% FWC水分处理时含量又增加。

图4 温室不同土壤含水量和田间两种处理条件下3个黑麦草种群的丙二醛含量比较

图5 温室不同土壤含水量和田间两种处理条件下3个黑麦草种群的POD酶活性比较
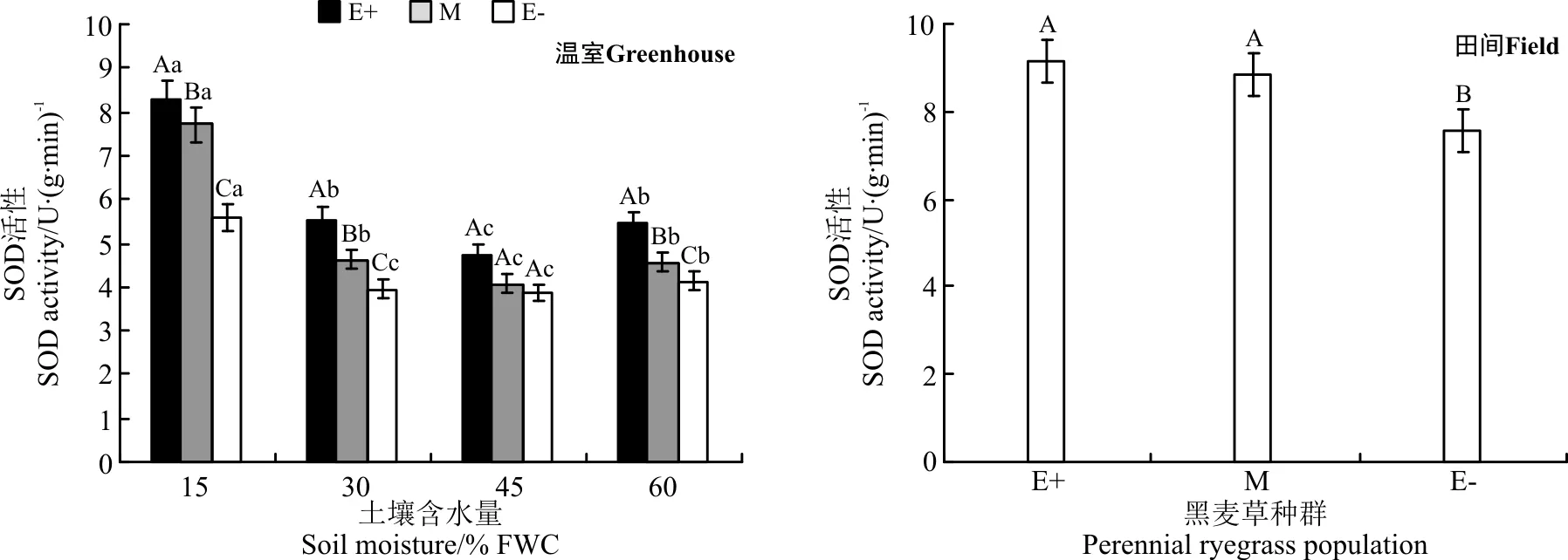
图6 温室不同土壤含水量和田间两种处理条件下3个黑麦草种群的SOD酶活性比较
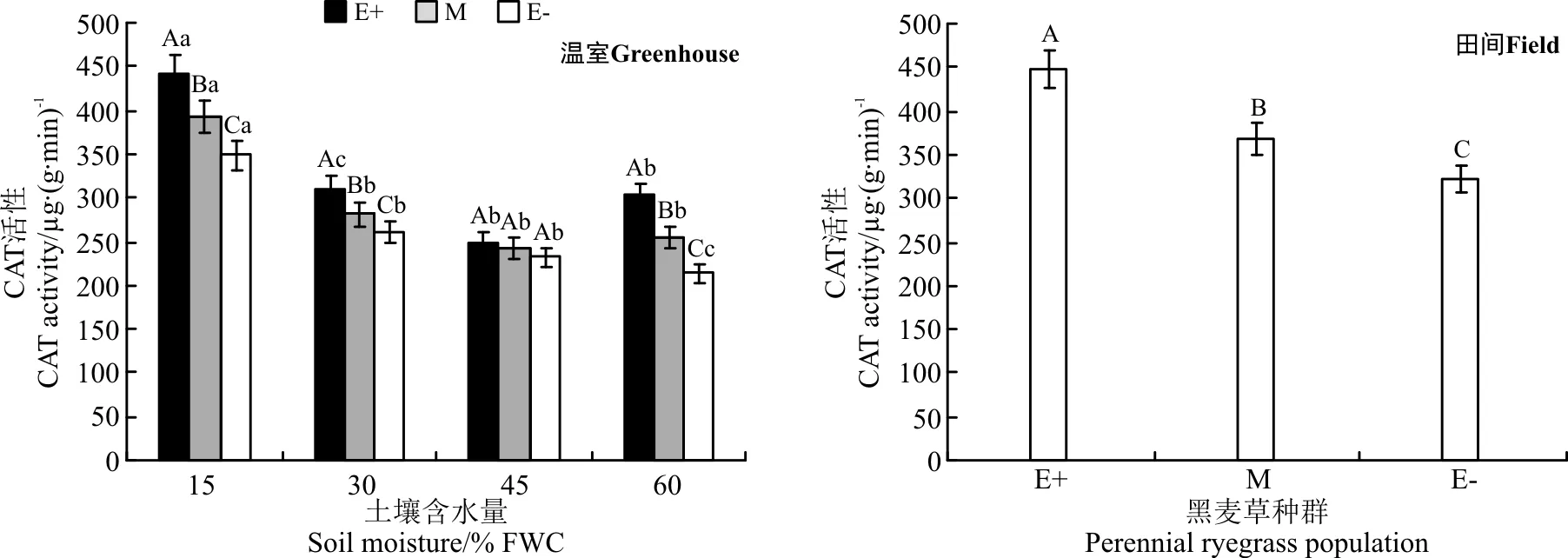
图7 温室不同土壤含水量和田间两种处理条件下3个黑麦草种群的CAT酶活性比较
在田间条件下,E+、E-和M种群CAT酶活性差异均显著(P<0.05),E+比E-、M分别高28.2%、17.9%(图7)。
3 讨论与结论
叶绿素是植物光合作用的主导因子,叶绿素含量的高低直接反映植物光合能力和抗旱能力的大小,因此,人们通常用测定叶绿素含量的方法来判断植物抗旱性[28]。本研究表明,在温室和田间两种条件下,E+种群较M和E-种群的总叶绿素含量大小依次表现为E+>M>E-的规律,这一规律在温室条件下表现更为明显,说明水分胁迫使内生真菌对宿主总叶绿素含量产生了影响,即在温室15%~45% FWC的含水量范围内,随着土壤含水量的减少,总叶绿素含量也随之升高,这可能是由于内生真菌作用促进黑麦草叶绿素合成,进而增加了其抗逆性;当水分含量为15% FWC和60% FWC时,内生真菌的增益效果最为明显。而在田间水分状况相同条件下其总叶绿素含量变化没有显著差异,这说明只有在水分胁迫时,内生真菌对叶绿素的合成才有促进作用。
可溶性糖和脯氨酸含量与植物生长所需水分含量变化有密切联系,当植物受到干旱胁迫时,可溶性糖含量和脯氨酸含量通过变化使细胞形态保持稳定。本研究中,在温室和田间两种条件下,E+、M和E-种群的可溶性糖含量和脯氨酸含量大小变化均表现为E+>M>E-的规律,且随着土壤水分含量变化,溶性糖和脯氨酸的含量也在发生变化;在温室15%~45% FWC的含水量范围内,随着土壤含水量的增加,可溶性糖和脯氨酸含量均降低,E+、M和E-之间的差异性也随之减小,这说明在水分胁迫下内生真菌能促进黑麦草的生长,且这种增益效应与胁迫强度呈正相关;而当水分含量为15% FWC和60% FWC时,内生真菌的增益效果最为明显。干旱胁迫下,E+高羊茅种群比E-高羊茅种群叶片和叶鞘中积累更多的葡萄糖、果糖[29]和植株脯氨酸[30],从而增强其对干旱环境的适应性,使其受干旱损伤轻。
在适宜水分条件下,细胞活性氧自由基代谢是一个产生和消除之间的动态平衡。水分和盐胁迫使细胞的叶绿体在电子传递中的电子数量增加,自由基代谢失衡,超氧阴离子和H2O2等活性氧的积累诱发膜脂过氧化,使膜透性增加,从而导致膜系统的氧化,给植物体造成产量下降,代谢紊乱等危害[31]。活性氧酶清除系统包括SOD、CAT和POD等物质,它们通过有序的生化反应来防御细胞膜系统受到过氧化物或超氧化物的毒害,这些相应的酶作为自由基的消除剂,可以增强植物的抗逆性[32]。在不同的水分条件下,植物通过自身调节各项生理指标来维持生长。本研究表明,在温室和田间两种不同条件下,E+、M和E-种群的SOD酶活性和CAT酶活性大小也都表现为E+>M>E-的规律;在温室条件下,15%~45% FWC的含水量范围内,随着土壤含水量的增加,SOD和CAT酶活性均降低,E+、M和E-之间的差异性也随之减小,这说明内生真菌在水分胁迫下能促进黑麦草SOD酶活性和CAT酶活性升高,从而促进其生长,这种增益效应与胁迫强度呈正相关;当水分含量为15% FWC和60% FWC时,内生真菌的增益效果最为明显。E+和E-野大麦种群的SOD酶活性都随着盐浓度的增加而升高,但变化幅度不同[33]。随着干旱胁迫程度增加,6个多年生黑麦草品种叶片内CAT活性均呈先升高后降低的趋势,低胁迫使CAT活性升高,高胁迫使CAT活性降低[34],在本研究中,通过对田间相同水分条件下和温室不同水分条件下进行比较发现,在水分胁迫下内生真菌对SOD和CAT酶活性的调节效益更高。
丙二醛在植物体内的含量一定程度上反映了植物对水分或其它胁迫的抗逆能力,在植物受到水分胁迫时,抗逆性强的植株叶片丙二醛含量较抗逆性弱的高。本研究中,3种不同种群相比,不管是温室还是田间,丙二醛含量变化趋势均为E->M>E+,总体变化趋势,E-和M种群丙二醛含量随水分含量增加呈“V”字型,E+种群丙二醛含量随水分含量增加而减小,田间自然条件下E+较E-和M种群丙二醛含量低,这表明内生真菌能有效地保护膜系统,进而增加了黑麦草抗逆性。这与陈世苹等[20]在水分胁迫下内生真菌感染对黑麦草叶内保护酶系统活力的研究结果趋势相似。
POD酶是植物体内活跃的同工酶之一,它能够消除细胞膜上的氧自由基使细胞代谢正常进行,植物受到外界不良环境时,POD酶活性会发生相应变化来应对逆境。本研究表明,在温室条件下E+、M和E-种群POD酶活性相比,其活性大小变化依次为E->M>E+,随着土壤水分含量的增加,POD酶活性逐渐降低,且3个种群之间的差异也随之减小。而在田间条件下,3个种群之间只有E+和E-种群之间存在较为明显的差异, E-和M种群间无显著差异,这有可能是水分胁迫下内生真菌的存在使得黑麦草叶内POD酶活性降低。这与任安芝等[35]以黑麦草为材料,探究不同干旱胁迫下黑麦草叶内POD酶活性变化的结果趋势类似。
禾草内生真菌这种微生物资源非常重要,内生真菌与禾草共生的草地群落更加稳定,能够有效地防治病虫害,对草原生态系统稳定性有着重要意义,另外作为经济收益的草坪草,引入内生真菌可防止选育抗逆性强而种类单一的问题,进而为抗逆性禾草品种的选育和育种提供了理论依据[36]。因此,开展内生真菌在不同生长条件下对黑麦草生理指标的影响研究有着重要的生态意义和经济意义,为探究其更适宜的生长环境和品种的推广提供了科学依据。现阶段对黑麦草内生真菌的研究已深入到分子水平,利用现代生物学技术,已经开辟了新的科学领域,但对内生真菌基因和黑麦草基因表达之间的关系尚需突破性进展,因此,有必要再次深入研究,以了解禾草与内生真菌之间的共生机理,为人类创造更多的价值。
References:
[1]田沛.多年生黑麦草、内生真菌与数种植物病原真菌的互作.兰州:兰州大学博士学位论文,2009.
Tian P.Interactions of ryegrass,Neotyphodiumloliiand several plant pathogenic fungi.PhD Thesis.Lanzhou:Lanzhou University,2009.(in Chinese)
[2]张磊,刘东燕,邵涛.黑麦草的饲用价值及其应用前景.草业科学,2008,25(4):64-69.
Zhang L,Liu D Y,Shao T.The feeding value and utilization prospect ofLoliummultiflorum.Pratacultural Science,2008,25(4):64-69.(in Chinese)
[3]Hume D E,Sewell J C.Agronomic advantages conferred by endophyte infection of perennial ryegrass (LoliumperenneL.) and tall fescue (FestucaarundinaceaSchreb.) in Australia.Crop and Pasture Science,2014,65(8):747-757.
[4]Hannaway D B,Fransen S,Cropper J B,Teel M,Chaney M,Griggs T,Halse R,Hart J,Cheeke P,Hansen D,Klinger R,Lane W.Perennial Ryegrass (LoliumperenneL.).Oregon:Oregon State University,1999:1-19.
[5]Fisher M J,Bohnert D W,Ackerman C J,Schauer C S,DelCurto T,Craig A M,Vanzant E S,Harmon D L,Schrick F N.Evaluation of perennial ryegrass straw as a forage source for ruminants.Journal of Animal Science,2004,82(7):2175-2184.
[6]Siegel M,Latch G,Johnson M.Fungal endophytes of grasses.Annual Review of Phytopathology,1987,25(1):293-315.
[7]Rice J,Pinkerton B,Stringer W,Undersander D.Seed production in tall fescue as affected by fungal endophyte.Crop science,1990,30(6):1303-1305.
[8]de Battista J,Bouton J,Bacon C,Siegel M.Rhizome and herbage production of endophyte-removed tall fescue clones and populations.Agronomy Journal,1990,82(4):651-654.
[9]任安芝,高玉葆,章瑾,张晶.内生真菌感染对黑麦草抗盐性的影响.生态学报.2006,26(6):1750-1757.
Ren A Z,Gao Y B,Zhang J,Zhang J.Effect of endophyte infection on salt resistance of regrass.Acta Ecologica Sinica,2006,26(6):1750-1757.(in Chinese)
[10]Elmi A,West C.Endophyte infection effects on stomatal conductance,osmotic adjustment and drought recovery of tall fescue.New Phytologist,1995,131(1):61-67.
[11]李飞,李春杰.内生真菌对禾草类植物抗旱性的影响.草业科学,2006,23(3):57-62.
Li F,Li C J.Effect of endophyte infection on drought-resistance of graminaceous grasses.Pratacultural Science,2006,23(3):57-62.(in Chinese)
[12]李飞.内生真菌对醉马草抗旱性影响的研究.兰州:兰州大学硕士学位论文,2007.
Li F.Effect of endophyte infection on drought resistance to drunken horse grass(Achnatheruminebrians).Master Thesis.Lanzhou:Lanzhou University,2007.(in Chinese)
[13]张盼盼.披碱草内生真菌的特性及其对寄主抗逆性的作用研究.新疆:新疆农业大学硕士学位论文,2013.
Zhang P P.Characteristic of endophytic fungi isolated fromElymusand their effect on host resistances.Master Thesis.Urumqi:Xinjiang Agricultural University,2013.(in Chinese)
[14]宋梅玲,李春杰,彭清青,梁莹,南志标.温度和水分胁迫下内生真菌对野大麦种子发芽的影响.草地学报,2010,18(6):833-837.
Song M L,Li C J,Peng Q Q,Liang Y,Nan Z B.Effects ofNeotyphodiumendophyte on germination ofHordeumbrevisubulatumunder temperature and water stress conditions.Acta Agrestia Sinica,2010,18(6):833-837.(in Chinese)
[15]李川,李夏,任安芝,高玉葆.内生真菌感染对宿主植物羽茅锌耐受性的影响.南开大学学报:自然科学版,2013,46(4):29-34.
Li C,Li X,Ren A Z,Gao Y B.Effect of endophyte infection on Zn resistance ofAchnatherumsibiricum.Acta Scientiarum Naturalium Universitatis Nankaiensis,2013,46(4):29-34.(in Chinese)
[16]胡桂馨,王代军,刘荣堂.干旱胁迫下内生真菌对高羊茅保护酶活性的影响.草原与草坪,2001(1):28-31.
Hu G X,Wang D J,Liu R T.The effect of endophyte on activities of protective enzyme of tall fescue under drought stress.Grassland and Turf,2001(1):28-31.(in Chinese)
[17]马祎,王彩云.几种引进冷季型草坪草的生长及抗旱生理指标.草业科学,2001,18(2):57-61.
Ma Y,Wang C Y.Growth and physiological indices for drought resistance on introduced cold-season turfgrasses.Pratacultural Science,2001,18(2):57-61.( in Chinese)
[18]赵昕,李玉霖.高温胁迫下冷地型草坪草几项生理指标的变化特征.草业学报,2001,10(4):85-91.
Zhao X,Li Y L.Variation of several physiological indices of five cool season turfgrasses under high temperature stress.Acta Prataculturae Sinica,2001,10(4):85-91.( in Chinese)
[19]夏超,钟睿,张兴旭,南志标.醉马草挥发油对多年生黑麦草种子萌发及幼苗生理变化的影响.草业科学,2015,32(5):658-666.
Xia C,Zhong R,Zhang X X,Nan Z B.Allelopathic effects of volatile compounds from endophyte-free and infectedAchnatheruminebriansonLoliumperenne.Pratacultrual Science,2015,32(5):658-666.(in Chinese)
[20]陈世苹,高玉葆,梁宇,任安芝.水分胁迫下内生真菌感染对黑麦草叶内保护酶系统活力的影响.应用与环境生物学报,2001,7(4):348-354.
Chen S P,Gao Y B,Liang Y,Ren A Z.Effects of endophyte infection on protective enzyme activities in leaves ofLoliumperenneunder water stress.Chinese Journal of Applied and Environmental Biology,2001,7(4):348-354.(in Chinese)
[21]李会强,汪建军,张光明,蔺伟虎,田沛.不同生长条件下内生真菌对多年生黑麦草生长的影响.草业科学,2016,33(4):599-607.
Li H Q,Wang J J,Zhang G M,Lin W H,Tian P.Effects of fungal endophytes on the growth of perennial ryegrass(Loliumperenne) under different growth conditions.Acta Prataculturae Sinica,2016,33(4):599-607.(in Chinese)
[22]孙群,李学俊,高俊风.植物生理学实验技术.西安:世界图书出版社西安分公司,2000:145-l48.
Sun Q,Li X J,Gao J F.Plant Physiology Experiments Technology.Xi’an:Xi’an World Publishing Xi’an Branch,2000:145-l48.(in Chinese)
[23]李合生.植物生理生化实验原理与技术.北京:高等教育出版社,2000:186-191.
Li H S.Plant Physiological and Biochemical Principles and Techniques.Beijing:Higher Education Press,2000:186-191.(in Chinese)
[24]张殿忠,汪沛洪,赵会贤.测定小麦叶片游离脯氨酸含量的方法.植物生理学通讯,1990(4):62-65.
Zhang D Z,Wang P H,Zhao H X.Determination of the content of free proline in wheat leaves.Plant Physiology Communications,1990(4):62-65.(in Chinese)
[25]林植芳,李双顺,林桂珠,孙谷畴,郭俊彦.水稻叶片的衰老与超氧物歧化酶活性及脂质过氧化作用的关系.植物学报,1984,26(6):605-615.
Lin Z F,Li S S,Lin G Z,Sun G T,Guo J Y.Superoxide dismutase activity lipid peroxidation in relation to senescence of rice leaves.Acta Botanica Sinica,1984,26(6):605-615.(in Chinese)
[26]袁朝兴,丁静.水分胁迫对棉花叶片中IAA含量,IAA氧化酶和过氧物.植物生理学报,1990,16(2):179-184.
Yuan C X,Ding J.Effect of water stress on the content of IAA and the activities of IAA oxidase and peroxidase in cotton leaves.Acta Phytophysiologica Sinica,1990,16(2):179-184.(in Chinese)
[27]Wang Z,Huang B.Physiological recovery of Kentucky bluegrass from simultaneous drought and heat stress.Crop Science,2004,44(5):1729-1736.
[28]周久亚,刘建秀.草坪草抗旱性研究概况.草业科学,2002,19(5):61-66.Zhou J Y,Liu J X.Introduction on progress of turfgrass draught resistance.Pratacultural Science,2002,19(5):61-66.(in Chinese)
[29]Richardson M,Chapman G,Hoveland C,Bacon C.Sugar alcohols in endophyte-infected tall fescue under drought.Crop Science,1992,32(4):1060-1061.
[30]Elbersen H,West C.Growth and water relations of field-grown tall fescue as influenced by drought and endophyte.Grass and Forage Science,1996,51(4):333-342.
[31]Sreenivasulu N,Grimm B,Wobus U,Weschke W.Differential response of antioxidant compounds to salinity stress in salt-tolerant and salt-sensitive seedlings of foxtail millet (Setariaitalica).Physiologia Plantarum,2000,109(4):435-442.
[32]Parida A K,Das A B.Salt tolerance and salinity effects on plants:A review.Ecotoxicology and Environmental Safety,2005,60(3):324-349.
[33]王正凤,李春杰,金文进,南志标.内生真菌对野大麦耐盐性的影响.草地学报,2009,17(1):88-92.
Wang Z F,Li C J,Jin W J,Nan Z B.Effect ofNeotyphodiumendophyte infection on salt tolerance ofHordeumbrevisubulatum(Trin.) Link.Acta Agrestia Sinica,2009,17(1):88-92.(in Chinese)
[34]石永红,万里强,刘建宁,王运琦,吴欣民,李向林.干旱胁迫对6个坪用多年生黑麦草品种抗旱性的影响.草地学报,2009,17(1):52-57.
Shi Y H,Wan L Q,Liu J N,Wang Y Q,Wu X M,Li X L.Effects of PEG stress on the drought resistance of six turfgrass varieties ofLoliumperenne.Acta Agrestia Sinica,2009,17(1):52-57.(in Chinese)
[35]任安芝,高玉葆,陈悦.干旱胁迫下内生真菌感染对黑麦草叶内几种同工酶的影响.生态学报,2004,24(7):1323-1329.
Ren A Z,Gao Y B,Chen Y.Effects of endophyte infection on POD,SOD and PPO isozymes in perennial ryegrass(LoliumperenneL.)under different water conditons.Acta Ecologica Sinica,2004,24(7):1323-1329.(in Chinese)
[36]Zhang Y,Mian M,Bouton J.Recent molecular and genomic studies on stress tolerance of forage and turf grasses.Crop Science,2006,46(2):497-511.
(责任编辑武艳培)
Effects of endophytic fungi on perennial ryegrass physiological characteristics under different growth conditions
Lin Wei-hu1, Wang Jian-jun1, Li Hui-qiang1, Zhang Guang-ming2, Tian Pei1
(1.State Key Laboratory of Grassland Agro-ecosystems, College of Pastoral Agriculture Science and Technology, Lanzhou University, Lanzhou 730020, China;2.Guangdong Yueming Electric Power Enginerring Co., Ltd, Zhuhai 519000, China)
In order to explain endophytic fungi affects internal physiological mechanisms of perennial ryegrass under different growth conditions. This study compared the physiological changes of infected endophytic fungi (E+), free endophytic fungi (E-) and mixed (M) three ryegrass (Loliumperenne) populations under natural field conditions and greenhouse with different water treatments.The results showed that endophyte significantly (P<0.05) increased the total chlorophyll content, soluble sugar content, proline acid content, superoxide dismutase activity and catalase activity of ryegrass, but the malondialdehyde content and peroxidase activity were reduced when the water content was 15% FWC (drought) and 60% FWC(flood) of the soil saturated water content under greenhouse conditions; These three populations had no significant difference in physiological parameters at 45% FWC soil moisture content; This showed that the endophytic fungi increased the resistance of the host by improving the protection of enzyme activity under stress conditions. Under natural field conditions, the changes trend of chlorophyll content, soluble sugar content, proline content, superoxide dismutase activity and catalase activity in ryegrass showed that E+> M> E-, malondialdehyde content and peroxidase activity showed that E-> M> E+. In conclusion, endophyte also can promote the growth of hosts by changing the internal physiological mechanisms under natural growth conditions.
endophytic fungi; perennial ryegrass(Loliumperenne); water stress; physiological characteristics
Tian PeiE-mail:tianp@lzu.edu.cn
10.11829/j.issn.1001-0629.2016-0131
2016-03-16接受日期:2016-05-15
国家基础研究发展规划“973”(2014CB138702);国家自然科学基金(31502001);兰州大学企事业单位委托科技项目[(15)0065]
蔺伟虎(1994-),男,甘肃西和人,在读硕士生,研究方向为禾草-内生真菌共生。E-mail:linwh15@lzu.edu.cn
田沛(1979-),女,河南新郑人,副教授,硕导,博士,研究方向为草业科学。E-mail:tianp@lzu.edu.cn
S543+.601;A945.79
A
1001-0629(2016)8-1574-09
蔺伟虎,汪建军,李会强,张光明,田沛.不同生长条件下内生真菌对多年生黑麦草生理特性的影响.草业科学,2016,33(8):1574-1582.
Lin W H,Wang J J,Li H Q,Zhang G M,Tian P.Effects of endophytic fungi on perennial ryegrass physiological characteristics under different growth conditions.Pratacultural Science,2016,33(8):1574-1582.
