偃麦草EST-SSR标记开发及应用
2016-10-09王瑞晶李培英张延辉
王瑞晶,李培英,张延辉
(新疆农业大学草业与环境科学学院,新疆草地资源与生态自治区重点实验室,新疆 乌鲁木齐 830052)
偃麦草EST-SSR标记开发及应用
王瑞晶,李培英,张延辉
(新疆农业大学草业与环境科学学院,新疆草地资源与生态自治区重点实验室,新疆 乌鲁木齐 830052)
利用NCBI数据库中偃麦草(Elytrigiarepens)EST序列开发偃麦草EST-SSR引物,并对47份偃麦草资源进行遗传多样性分析,验证所开发EST-SSR引物在偃麦草上的可应用性。结果显示,在27 891条偃麦草EST序列中可以搜索到SSR位点1 068个;其中六核苷酸重复序列最多,占总SSR的53.83%;二、三、四、五、六核苷酸优势重复基元及出现频率分别为AC/TG(2.72%)、CGC/GCG(1.87%)、CGAC/GCTG(5.24%)、CCGCC/GGCGG(0.37%)、CAGCTC/GTCGAG(3.37%)。开发的105对偃麦草EST-SSR引物中有64对引物(60.95%)可以有效扩增;随机选取18对多态性引物对47份偃麦草进行遗传多样性分析,其多态性百分率为78.64%,多态性指数(PIC)为0.22~0.83。以上结果表明,开发的偃麦草EST-SSR标记是有效的,有较高的应用价值,为偃麦草遗传多样性、重要性状关联分析研究奠定了基础。
偃麦草;EST-SSR;标记开发;遗传多样性
偃麦草(Elytrigiarepens)系禾本科小麦族偃麦草属多年生草本植物,是我国偃麦草属的重要代表种,在新疆、青海、甘肃、东北、内蒙古、西藏等地均有分布[1-2]。由于其具有根茎发达,抗旱、耐盐、耐寒,生态适应性强等优良特性,被认为是一种具有潜在开发价值的草种资源。偃麦草为异花授粉植物,异源六倍体,染色体组成为(S1S2X)2,遗传结构复杂[3]。但是,目前应用于偃麦草资源遗传多样性、抗性种质资源鉴定的有效标记数量有限[4-5]。EST-SSR是近年来开发的新型分子标记,具有多态性高,共显性、重复性好,数量丰富等优点,能反映基因的编码部分,在物种间通用性高,被用于许多作物的抗性遗传分析、图谱构建及辅助育种工作,如玉米(Zeamays)、水稻(Oryzasativa)、小麦(Triticumaestivum)等[6-7];在牧草和草坪方面,EST-SSR分子标记的开发及应用已在苜蓿(Medicagosativa)、苏丹草(Sorghumsudanense)等草种资源上开展[8-9]。
目前,在NCBI中登陆的偃麦草相关EST序列已达27 891条,但还未被开发利用,通过偃麦草EST开发新的EST-SSR标记,是增加偃麦草有效分子标记的一条重要途径。因此,本研究拟在分析偃麦草EST序列中SSR发生频率和特点的基础上,设计开发EST-SSR引物,并在47份偃麦草上进行引物功效评价,为未来开展偃麦草遗传多样性分析、遗传图谱构建、重要性状分子标记等研究工作奠定基础。
1 材料与方法
1.1材料
本研究所用的47份偃麦草材料中,5份材料引自北京农林科学院(国外引进),其余42份引自新疆各地区,包括34份北疆(乌鲁木齐、阿勒泰、伊犁等地)材料,5份南疆(库尔勒、和田)材料和3份东疆(哈密)材料。其具体来源见表1。
1.2方法
1.2.1源于偃麦草EST的SSR查找从NCBI下载由Bushman等[10]提供的偃麦草EST序列27 891条,并以Fasta格式保存;利用在线微卫星位点扫描工具SSRIT(simple sequence repeat identification tool) (http://www. gramene.org/db/searches/ssrtool)搜索SSR,搜索标准为重复序列不少于18~20 bp,即二、三、四、五、六核苷酸的最少重复次数分别为10、7、5、4、3次。
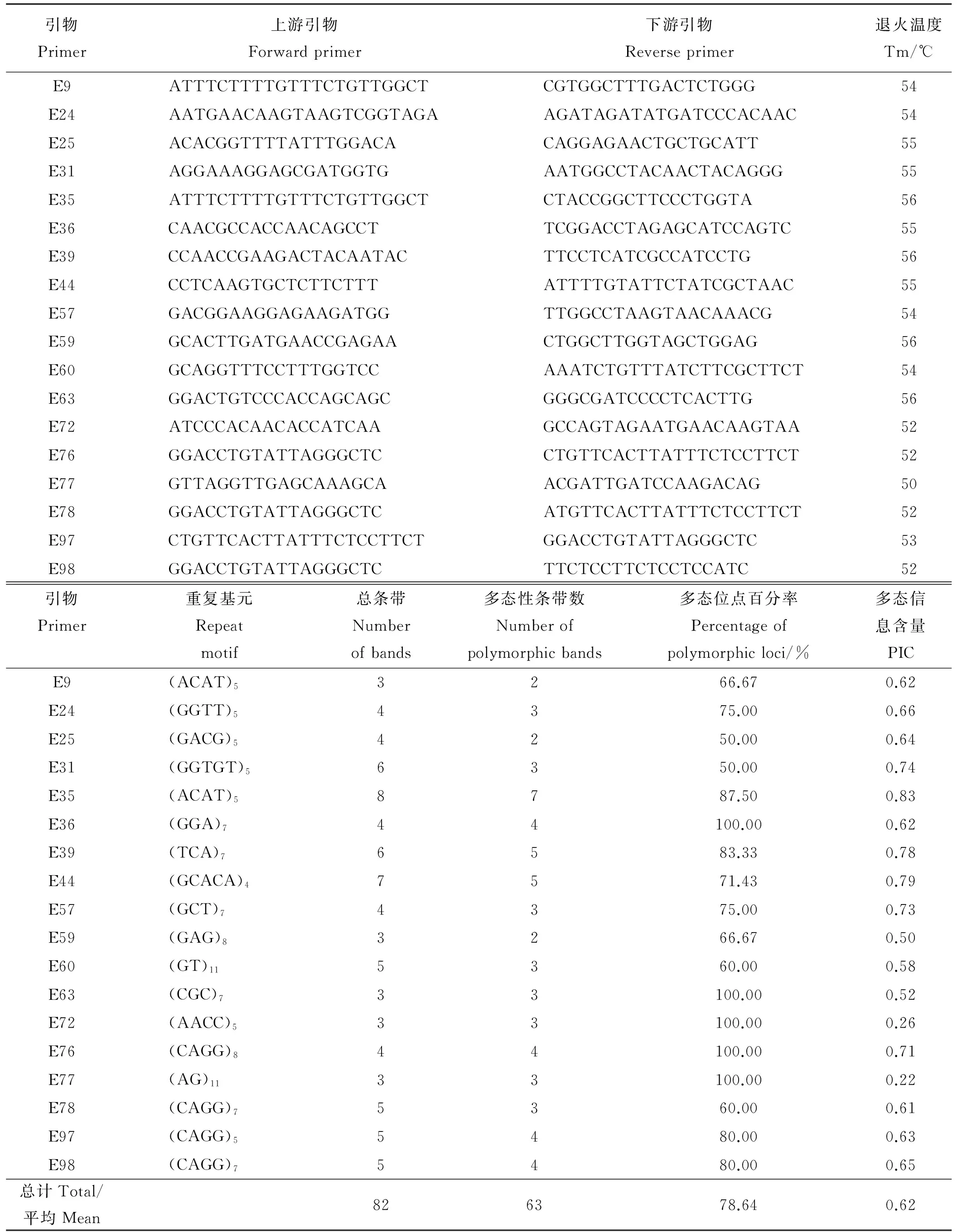
1.2.2EST-SSR引物设计利用DNAstar软件包中的Editseq将搜索到的SSR及侧翼序列保存成Seq格式,保证整个序列长度小于300 bp。利用Primer 5.0软件设计引物,设计原则为:引物长度范围18~22 bp;退火温度53~62 ℃,上下引物间退火温度相差不超过5 ℃;GC含量在40%~60%,最佳为50%;扩增片段长度150~300 bp,尽量避免形成稳定的引物二聚体(dimer and cross dimer)和发夹结构(hairpin)。遵循以上原则共设计105对偃麦草EST-SSR引物,送至上海鼎国昌盛生物技术有限公司合成,并将引物按照“E+序号”形式重新命名,如E1。
1.2.3EST-SSR引物筛选
(1)DNA提取
从每份材料中选取健壮、无病虫害的20个单株嫩叶混合,采用改良的CTAB法[11]对供试偃麦草基因组DNA进行提取。分别用0.8%琼脂糖凝胶电泳和核酸蛋白测定仪检测DNA纯度和浓度。纯化后的DNA用1×TE溶解,4 ℃保存备用。
(2)PCR扩增与电泳检测
PCR反应体系为15 μL:DNA总量为50 ng,1.5 μL 10×PCR buffer,1.2 μL dNTPs(0.2 mmol·L-1),正反引物(0.1 μmol·L-1)各1 μL,Taq DNA聚合酶(0.5 U)0.1 μL,ddH2O补充至15 μL。扩增反应在TC5000(Techne,Britain)PCR仪上进行。扩增程序:94 ℃预变性5 min;94 ℃变性50 s,58 ℃(部分引物退火温度使用62 ℃)退火45 s,72 ℃延伸1 min,进行30个循环;72 ℃保持10 min;4 ℃保存。扩增产物用6%的非变性聚丙烯酰胺凝胶电泳检测,所用的电泳缓冲液为1×TBE,在160 V恒压下电泳1 h,采用银染法对凝胶进行银染显色,拍照。
1.2.4数据分析根据EST-SSR引物在供试材料上的扩增情况,建立0、1矩阵,有带记为1,无带记为0。利用Anderson等[12]的方法计算多态信息含量(polymorphism information contene,PIC),计算公式如下:
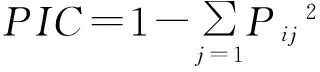
式中:Pij表示标记i的第j个带型出现的频率,标记i的总带型从1到n。
采用NTSYSpc 2.11统计分析软件,分析47份材料间的Dice遗传相似系数,基于Dice遗传相似系数进行UPGMA系统聚类[13],分析群体间的遗传分化关系。

表1 供试材料的编号及来源
续表1

材料名称Germplasmcode采集地点或引种地Collectingorintroducingsite经度(E)Longitude纬度(N)Latitude海拔Elevation/m36哈密市Hami---14*北京市农林科学院BeijingAcademyofAgricultureandScience---15*北京市农林科学院BeijingAcademyofAgricultureandScience---17*北京市农林科学院BeijingAcademyofAgricultureandScience---21*北京市农林科学院BeijingAcademyofAgricultureandScience---32*北京市农林科学院BeijingAcademyofAgricultureandScience---
注:*为引种,**为多年驯化。
Note:* mean introduction,** mean domestication.
2 结果与分析
2.1偃麦草EST序列中的SSR频率
从27 891条偃麦草EST序列中共搜索到1 068条SSR,SSR出现频率为3.83%,平均距离为19.05 kb。其中,主要重复类型是六核苷酸,共575个,占SSR总数的53.83%;其次为四核苷酸(16.01%)、三核苷酸(15.82%)、二核苷酸(9.55%)、五核苷酸(4.78%)(表2)。
偃麦草SSR重复单元的重复次数分布在3~43(表2),其中3次重复的SSR最多,有536个,占50.19%;其次为5次重复和7次重复的SSR,分别占15.07%和11.61%;重复次数≥11次的SSR共80个,占7.49%。二、三、四、五、六核苷酸基序的最大重复次数分别为43、12、8、6、8次。检索到的SSR序列中,98.32%的SSR长度为20~30 bp,仅有少部分SSR(1.68%)长度在30 bp以上。
2.2不同类型基序SSR的分布特征
在搜索出的1 069个偃麦草SSR中,共检测到322种重复基元,其中二、三、四、五、六核苷酸重复基元分别有5、22、41、40、214种(表3)。四核苷酸CGAC/GCTG出现频率最高,为5.24%,其它重复基元中的优势重复基元及出现频率分别为AC/TG(2.72%)、CGC/GCG(1.87%)、CCGCC/GGCGG(0.37%)、CAGCTC/GTCGAG(3.37%);优势重复基元SSR数量总和占总SSR的13.58%。
在所有重复基元中,重复次数跨度最大的为二核苷酸重复基元CA/GT,跨度为11~43,AG/TC、AC/TG、AT/TA跨度也相对较大,其它重复基元跨度相对较小(表4)。三核苷酸基元重复次数多以7~11次为主;四核甘酸、五核苷酸、六核苷酸基元的重复次数跨度分别为5~8、4~6、3~5。
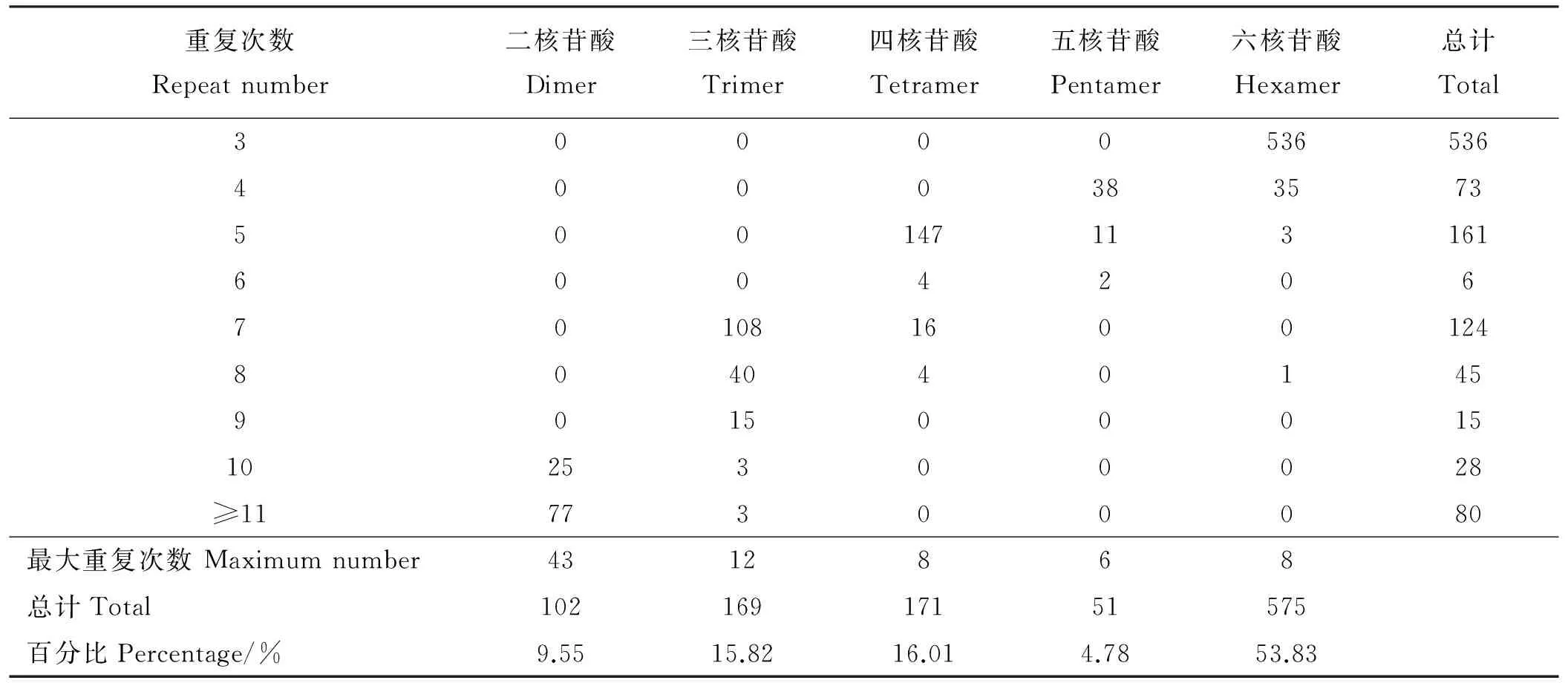
表2 偃麦草EST序列中不同核苷酸基序的SSR频率分布
2.3EST-SSR引物多态性评价
随机挑选8份偃麦草材料对合成的105对偃麦草EST-SSR引物进行初步筛选,有22对引物没有扩增产物,19对引物没能产生预期的扩增片段或条带较弱,认为其无效,64对引物可以有效扩增,占60.95%。64对引物在偃麦草中共扩增出158条清晰带,平均每对引物扩增2.47条,单个引物对最高扩增条带数为8条,最低扩增条带数为2条,扩增片段大小范围为70~600 bp。其中以三核苷酸重复的EST-SSR引物扩增率最高,为72.41%,五核苷酸重复的引物扩增率最低,为40.00%,相差32.41个百分点(表5)。
从扩增产物来看,基于四核苷酸序列,且重复基元重复次数在5~8次的引物,其主带信息清晰,杂带较少(图1);其次是基于三核苷酸重复次数为7~8的引物(图2)。同时发现,基于四核苷酸和三核苷酸所设计的引物在47份偃麦草中平均多态位点百分率较高,分别为79.86%和77.78%。
2.4基于EST-SSR的聚类分析
从64对有效引物中随机选取18对EST-SSR引物对47份供试偃麦草材料进行遗传多样性分析(表6)。

表3 重复基元类型的优势重复基元的比较分析

表4 基元类型的重复次数分布
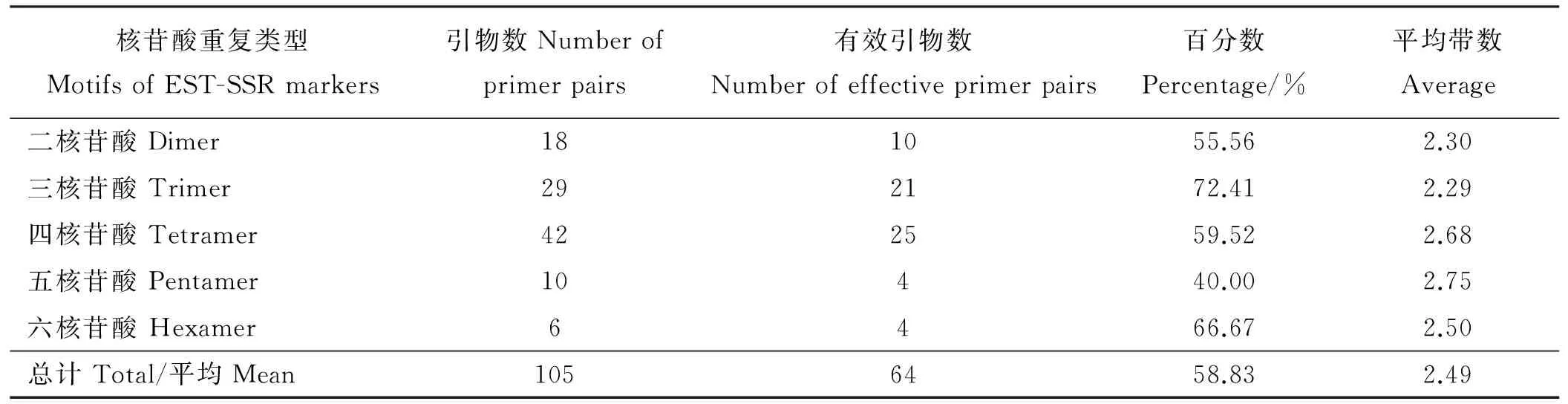
表5 不同核苷酸重复EST-SSR的PCR扩增结果

图1 引物E98对01-34种质的扩增结果
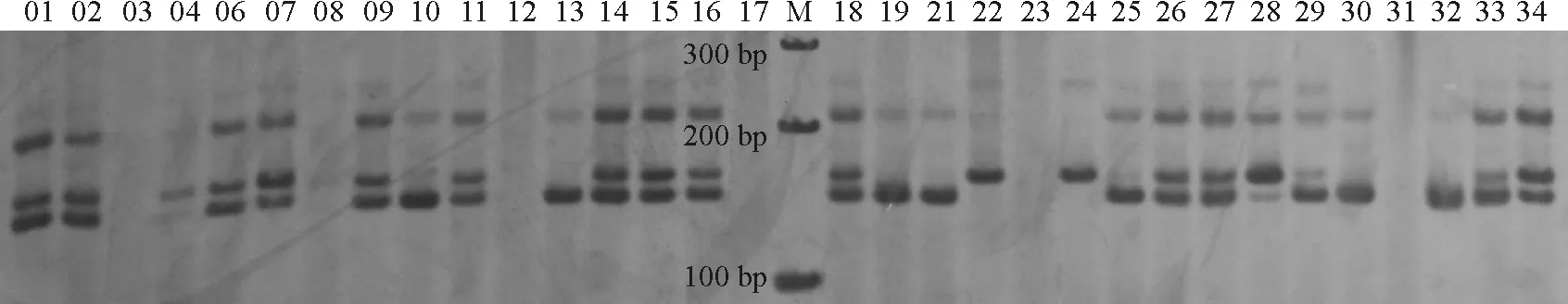
图2 引物E57对01-34种质的扩增结果
18对引物共产生82个条带,其中有63条显示多态性,多态性百分率为78.64%。同时发现,有5对引物的多态位点百分率达到了100.0%。多态信息含量(PIC)是表示微卫星位点变异程度高低的一个指标,当PIC>0.5时该位点为高度多态性;当0.25 以NSTYSpc2.11软件计算的遗传相似系数为依据,利用UPGMA法对47份偃麦草材料进行聚类分析,构建系统聚类图(图3),各材料间遗传相似性系数介于0.69~0.95,平均相似系数为0.82。47份材料聚类结果与地理来源没有绝对相关性。在相似系数为0.74处,将47份供试偃麦草材料分为三大类群:第一大类包括采自北疆的14份材料,采自南疆的全部材料、采自东疆的ER36以及引自北京农林科学院的(ER14、ER15、ER17),在相似系数为0.75处,第一大类又被划分成两个亚类,而采自南疆的5份材料也被划分到两个亚类中;第二大类包括采自北疆的ER12,采自东疆的ER24、ER35及引自北京农林科学院的ER21、ER32,而在相似系数为0.757处,ER16被单独聚为一类;第三大类仅包括采自北疆的ER41,表明其与其它材料有较远的亲缘关系。另外,有16份材料的相似系数为0.906,具有较近的亲缘关系;ER41、ER22、ER48、ER16与其它材料的遗传距离较远,亲缘关系相对较远,遗传背景丰富,可用于新品系选育。 3.1SSR的分布特征 EST-SSR引物源于表达序列,不同植物开发的EST序列中SSR分布的频率差异很大。本研究对目前为止NCBI所公布的27 891条偃麦草EST序列中的SSR的分布特征进行分析,共发现1 068个SSR,占偃麦草EST数据库的3.83%,与刘林等[15]对小麦SSR序列分析中的结果基本一致,但高于陈海梅等[16]而略低于陈军方等[17]对小麦SSR序列的分析结果。这样的区别一方面可能是由于所使用的数据库不同所导致,陈海梅等[16]和陈军方等[17]分别使用的是GenBank和EST协作网上的EST数据库,而本研究使用的是NCBI上的偃麦草EST数据库;另一方面搜索SSR时所选用的参数不同也会导致结果有所差异。陈海梅等[16]仅对二、三、四、五核苷酸重复序列进行搜索,所以其SSR出现频率低于本研究;而陈军方等[17]设置的三核苷酸最少重复次数低于本研究的,故其SSR出现频率低于本研究0.27%。 就EST中不同类型SSR的出现频率看,多数研究表明,二核苷酸和三核苷酸重复SSR的出现频率高[18],而本研究发现六核苷酸重复SSR出现频率最高,占所有SSR的53.83%。除刘林等[15]对小麦EST-SSR引物进行开发时发现六核苷酸出现频率较高之外,其它研究中未见报道,主要是因为多数研究者在搜索SSR时没有把六核苷酸列入搜索对象中。但是六核苷酸重复序列也存在丰富的多态性,对基因功能的影响也很大,应该列入SSR搜索对象。本研究搜索到的SSR中,五核苷酸出现频率最低,与孙清明等[19]的研究结果一致。 表6 18对偃麦草EST-SSR引物信息 图3 47份供试偃麦草材料的EST-SSR聚类图 3.2EST-SSR引物的有效性分析 目前对于SSR长度与引物多态性的关系,有3种研究结果[19]:1)SSR越长,多态性频率越高;2)SSR越短,多态性频率越高;3)SSR重复次数与多态性间不存在相关性。本研究并未发现SSR长度与多态性存在相关性。但是从扩增效果来看,基于四核苷酸序列和三核苷酸所设计的引物,扩增结果主带信息清晰,杂带较少。利用高粱(S.bicolor)EST-SSR标记对苏丹草的通用性研究中得到了同样的结果[9]。 基因型不同的品种,基因组内核苷酸序列也存在差异,当用相同的SSR引物对不同基因组进行体外扩增时,由于基因组上与引物互补DNA片段的数目、位点不同,扩增产物的大小、数目也不同,因此,扩增产物的多态性能反映材料的遗传多样性。用6对EST-SSR引物在9个抗蚜苜蓿品种(系)中检测到了63条多态性扩增带,每对引物平均扩增10.50条,多态位点百分率为91.30%[20]。用23对来自高粱、玉米、水稻的EST-SSR引物在43份西南扁穗牛鞭草(Hemarthriacompressa)中检测到261条多态性条带,多态位点百分率为80.4%[21]。本研究利用18对偃麦草EST-SSR引物在47份供试偃麦草材料中共产生63条多态性条带,且多态性百分率为78.64%。而在偃麦草分子标记研究方面,已经报道的仅有李培英[22]从100对RAPD引物中筛选出18对多态性RAPD引物,在32份偃麦草材料中检测到257条多态性条带,多态位点百分率为93.70%,明显高于EST-SSR。究其原因认为,一方面RAPD受条件影响较大,其稳定性和重复性较差,导致有效引物数量稍低;另一方面EST-SSR是来源于序列相对保守的基因组编码区,多态性主要基于微卫星重复序列数目的变化而有所差异,其多态性可能与功能基因有关,其多态性标记具有更高的应用价值。 3.3偃麦草遗传相似性分析 一般来说,位点的平均PIC可被用来估算群体的遗传多样性水平,PIC平均值越高,表明群体的变异程度越高,遗传多样性越丰富[8]。本研究选取的18对EST-SSR引物,多态信息指数范围在0.22~0.83,平均为0.62,具有较为丰富的遗传多样性。表明开发的EST-SSR标记有较高的应用价值,可用于偃麦草资源遗传多样性分析。 通过分析47份供试材料的遗传相似性,得到UPGMA亲缘关系树状图(图2)。其聚类结果和材料来源地并非完全吻合,表现为材料ER12和ER27,分别来自北疆和南疆,但其遗传相似系数大于0.92;部分来源地相同的材料虽然被聚在同一大类,但不属于同一亚类(采自南疆的5份材料),说明虽然来源于同一地理区域的材料间遗传上具有一定的相似性,但也可能由于分布地域微环境的影响,导致材料间存在一定的遗传分化。也有研究表明,野生偃麦草的群体之间的亲缘关系与地理距离没有绝对的相关性[3]。其原因可能为:1)虽然野生偃麦草具有较高的遗传多样性,但是等位基因处于不平衡状态,易受环境影响而改变,境内地型复杂,自然环境多样都会对其遗传多样性造成影响;2)偃麦草具有很强的无性繁殖能力,可能在材料交流过程中使其转入异地扩展繁殖;3)材料在进化过程中,个别基因发生了变异,且该突变体能较好地适应当地的环境并得到保存;4)在取样过程中,每份材料采集的单株数量也会影响到等位基因的检测,使得野生偃麦草的遗传相似性和地理来源关系复杂化。 偃麦草EST含有丰富的、多种类型的SSR位点,通过EST序列开发偃麦草SSR标记是一种简单、快速、经济和有效的途径。本研究明确了偃麦草EST序列中SSR的总体特征,开发了64个具有多态性的偃麦草EST-SSR标记,这些标记为偃麦草遗传多样性、重要性状关联分析研究奠定了基础。 References: [1]孙宗玖,李培英,阿不来提,李璇,杜珊珊.26份偃麦草种质苗期耐盐性评价.草原与草坪,2013,33(3):43-49,56. Sun Z J,Li P Y,Abulaiti,Li X,Du S S.Evaluation on salt resistance of 26Elytrigiarepensgermplasm in seeding stage.Grassland and Turf,2013,33(3):43-49,56.(in Chinese) [2]李培英,孙宗玖.33份偃麦草种质芽期耐盐性评价.草业科学,2015,32(4):593-600. Li P Y,Sun Z J.Evaluation on salt resistance of germplasm resources of 33Elytrigiarepensduring seeding period.Pratacultural Science,2015,32(4):593-600.(in Chinese) [3]唐顺学,贾旭,靳全文,李海健,庄家骏,陈永强.野生偃麦草遗传多样性研究及其保护和利用.杭州:浙江科学技术出版社,2008:170-177. Tang S X,Jia X,Jin Q W,Li H J,Zhuang J J,Chen Y Q.Genetic Diversity Research ofElytrigiarepensand its Protection and Utilization.Hangzhou:Zhejiang Science and Technology Press,2008:170-177.(in Chinese) [4]李雪莲.偃麦草和中间偃麦草抗旱鉴定及其分子标记辅助筛选.乌鲁木齐:新疆农业大学硕士学位论文,2005. Li X L.The drought resistant authenticate and the assistant selection with melocular markers techniques ofElytrigiarepensL. andE.intermediaNevski.Master Thesis.Urumqi:Xinjiang Agriculture University,2005.(in Chinese) [5]李培英,孙宗玖,朱昊,阿不来提.偃麦草种质资源遗传多样性的RAPD分析.中国草地学报,2012,34(3):12-20. Li P Y,Sun Z J,Zhu H,Abulaiti.Analysis of genetic diversity of 32Elytrigiarepensaccessions based on RAPD markers.Chinese Journal Grassland,2012,34(3):12-20.(in Chinese) [6]卢玉飞,蒋建雄,易自力.玉米SSR引物和甘蔗EST-SSR引物在芒属中的通用性研究.草业学报,2012,21(5):86-95. Lu Y F,Jiang J X,Yi Z L.Study on the transferability of maize SSR and sugarcane EST-SSR markers toMiscanthus(Poaceae).Acta Prataculturae Since,2012,21(5):86-95.(in Chinese) [7]陈立强,师尚礼.42份紫花苜蓿种质资源遗传多样性的SSR分析.草业科学,2015,32(3):372-381. Chen L Q,Shi S L.Genetic diversity among 42 alfalfa accessions revealed by SSR markers.Pratacultural Science,2015,32(3):372-381.(in Chinese) [8]温莹,逯晓萍,任锐,米福贵,韩平安,薛春雷.高丹草EST-SSR标记的开发及其遗传多样性.遗传,2013,35(2):225-232. Wen Y,Lu X P,Ren R,Mi F G,Han P A,Xue C L.Development of EST-SSR marker and genetic diversity analysis inSorghumbicolor×Sorghumsudanenes.Hereditas,2013,35(2):225-232.(in Chinese) [9]李杰勤,王丽华,詹秋文,陈亚.高粱EST-SSR标记的建立及其在苏丹草中的应用初探.草业科学,2010,27(3):112-117. Li J Q,Wang L H,Zhan Q W,Chen Y.Establishment of sorghum EST-SSR marker and its preliminary application to Sudangrass.Pratacultural Science,2010,27(3):112-117.(in Chinese) [10]Bushman B S,Larson S R,Mott L W,Cliften P F,Wang R R,Chatterton N J,Hernandez A G,Ali S,Kim R W,Thimmapuram J T,Gong G,Liu L,Mikel M A.Development and annotation of perennial Triticeae ESTs and SSR markers.Cyber Center Publication,2008,51(10):779-788. [11]王亚琴,施军琼,张婷,李燕,张天泉,张小龙,桑贤春,凌英华,何光华.水稻黄绿叶突变体ygl13的鉴定及候选基因分析.中国农业科学,2015,48(21):4197-4208. Wang Y Q,Shi J Q,Zhang T,Li Y,Zhang T Q,Zhang X L,Sang X C,Ling Y H,He G H.Characterization and candidate gene analysis of yellow-green leaf mutant ygl13 in rice(Oryzasativa).Scientia Agricultura Sinica,2015,48(21):4197-4208.(in Chinese) [12]Anderson J A,Churchill G A,Autrique J E,Tanksley S D,Sorrells M E.Optimizing parental selection for genetic linkage maps.Genome,1993,36(1):181-186. [13]徐立业,李玉鑑.UPGMA树的不惟一性问题及其解决方法.生物信息学,2007(4):160-162. Xu L Y,Li Y J.A solution to the “Tied Trees” problem of UPGMA.China Journal Bioinformatics,2007(4):160-162.(in Chinese) [14]余国辉.基于高通量测序的紫花苜蓿SSR引物的开发及其应用研究.杨凌:西北农林科技大学博士学位论文,2014. Yu G H.The development of SSR in alfalfa by using high throughput sequencing technology and its application.PhD Thesis.Yangling:Northwest Agriculture and Forestry University,2014.(in Chinese) [15]刘林,孙来亮,兰茗清,杨静,查友贵,李成云.小麦EST-SSR的分析及其引物的开发.云南农业大学学报,2012,27(5):623-630. Liu L,Sun L L,Lan M Q,Yang J,Zha Y G,Li C Y.Analysis and exploitation of EST-SSRs in theTriticumaestivum.Journal of Yunnan Agricultural University,2012,27(5):623-630.(in Chinese) [16]陈海梅,李林志,卫宪云,李斯深,雷天东,胡海洲,王洪刚,张宪省.小麦EST-SSR标记的开发、染色体定位和遗传作图.科学通报,2005,50(20):2208-2216. Chen H M,Li L Z,Wei X Y,Li S S,Lei T D,Hu H Z,Wang H G,Zhang X X.Development of EST-SSR markers,chromosome location and genetic mapping in wheat.Chinese Science Bulletin,2005,50(20):2208-2216.(in Chinese) [17]陈军方,任正隆,高丽锋,贾继增.从小麦EST序列中开发新的SSR引物.作物学报,2005,31(2):154-158. Chen J F,Ren Z L,Gao L F,Jia J Z.Development new SSR markers from EST of wheat.Acta Agronomica Sinica,2005,31(2):154-158.(in Chinese) [18]Liu Y L,Li Y H,Zhou G A,Uzokwe N,Chang R Z,Chen S Y,Qiu L J.Development of soybean EST-SSR markers and their use to assess genetic diversity in the SubgenusSoja.Agicultural Scienes in China,2010,9(10):1423-1429. [19]孙清明,马文朝,马帅鹏,赵俊生,白丽军,陈洁珍,蔡长河,向旭,欧良喜.荔枝EST资源的SSR信息分析及EST-SSR标记开发.中国农业科学,2011,44(19):4037-4049. Sun Q M,Ma W C,Ma S P,Zhao J S,Bai L J,Chen J Z,Cai C H,Xiang X,Ou L X.Characteristics of SSRs derived from ESTs and development of EST-SSR markers in Litchi(LitchichinensisSonn.).Scientia Agriculture Sinica,2011,44(19):4037-4049.(in Chinese) [20]王森山,唐守嵘,朱亚灵,贺春贵.抗蚜苜蓿品种(系)SSR标记的遗传多样性分析.草业科学,2010,27(7):78-83. Wang S S,Tang S R,Zhu Y L,He C G.Genetic diversity of aphid-resistant alfalfa varieties/lines based on SSR markers.Prataculturac Science,2010,27(7):78-83.(in Chinese) [21]陈永霞,张新全,谢文刚,马啸,刘影.利用EST-SSR标记分析西南扁穗牛鞭草种质的遗传多样性.草业学报,2011,20(6):40-44. Chen Y X,Zhang X Q,Xie W G,Ma X,Liu Y.Genetic diversity ofHemarthriacompressagermplasms from southwestern China based on EST-SSR markers.Acta Prataculturae Since,2011,20(6):40-44.(in Chinese) [22]李培英.新疆草坪用野生偃麦草种质资源评价.乌鲁木齐:新疆农业大学博士学位论文,2010. Li P Y.Turf-using germplasm resource evaluation on nativeElytrigiarepens(L.) Nevski in Xinjiang.PhD Thesis.Urumqi:Xinjiang Agriculture University,2010.(in Chinese) (责任编辑武艳培) Development ofElytrigiarepensEST-SSR markers and its application Wang Rui-jing, Li Pei-ying, Zhang Yan-hui (College of Pratacultural and Environmental Science, Xinjiang Agricultural University,Key Laboratory of Grassland Resources and Ecology of Xinjiang, Urumqi 830052, China) To develop new simple sequence repeat (SSR) markers forElytrigiarepens, EST-SSR primers ofE.repenswere designed using the EST sequences ofE.repensin NCBI database.The genetic diversity of 47Elytrigiasamples were analyzed using EST-SSR markers to determine the function of EST-SSR inE.repens. Results showed that: From the 27891ElytrigiaEST sequences released in NCBI, 1 068 SSRs were searched. Among those EST-SSRs, the frequency of hexamer motifs was the highest, which is 53.83% of the total number of SSRs,whereas the frequency of dimer, trimer tetramer, pentamer, hexamer were AC/TG(2.72%), CGC/GCG(1.87%), CGAC/GCTG(5.24%), CCGCC/GGCGG(0.37%), CAGCTC/GTCGAG (3.37%), respectively. 105 pairs of EST-SSR primers were designed and synthesized, and 64 pairs (60.95%) of EST-SSR primers led to PCR amplification products. 18 EST-SSR primers were randomly selected and used to analyze the genetic diversity of 47Elytrigiasamples. The results showed that the polymorphic percentage was 78.64%,polymorphic information content (PIC) was in the range of 0.22~0.83. Taken together, all results indicate that the EST-SSR markers ofE.repensdeveloped in this study is highly effective and valuable, and they can be used in the research of genetic diversity and association analysis for important trait inE.repens. Elytrigiarepens; EST-SSR; marker development; genetic diversity Li pei-yingE-mail:nmlpy_1234@sina.com 10.11829/j.issn.1001-0629.2015-0571 2015-10-19接受日期:2016-06-01 国家自然科学基金(31360580);新疆农业大学研究生科研创新项目(XJAUGRI2015002) 王瑞晶(1991-),女,山西运城人,在读硕士生,主要从事草种质的选育与遗传多样性研究。E-mail:wrj9275@163.com 李培英(1975-),女,内蒙古察右前旗人,教授,博士,主要从事草种资源评价、草新品种选育及草坪学的教学与科研工作。E-mail:nmlpy_1234@sina.com S540.1;Q943 A 1001-0629(2016)8-1526-10 王瑞晶,李培英,张延辉.偃麦草EST-SSR标记开发及应用.草业科学,2016,33(8):1526-1535. Wang R J,Li P Y,Zhang Y H.Development ofElytrigiarepensEST-SSR markers and its application.Pratacultural Science,2016,33(8):1526-1535.3 讨论

4 结论
