乌司他丁通过干预p38MAPK/ERK信号通路减轻脓毒症性肺损伤
2016-09-28张利鹏刘国娟杨大刚周丽华
张利鹏,赵 焱,刘国娟,杨大刚,周丽华
(1.内蒙古医科大学附属医院重症医学科,内蒙古 呼和浩特 010050;2.内蒙古自治区人民医院神经内科,内蒙古 呼和浩特 010051)
乌司他丁通过干预p38MAPK/ERK信号通路减轻脓毒症性肺损伤
张利鹏1,赵焱2,刘国娟1,杨大刚1,周丽华1
(1.内蒙古医科大学附属医院重症医学科,内蒙古 呼和浩特010050;2.内蒙古自治区人民医院神经内科,内蒙古 呼和浩特010051)
目的探讨乌司他丁(ulinastatin,UTI)对脓毒症性急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)大鼠的肺保护作用及可能机制。方法56只Wistar大鼠按随机数字表法分为对照组、模型(LPS 6、12、24 h)组、乌司他丁(UTI 6、12、24 h)组,每组8只。采用腹腔注射细菌脂多糖(lipopolysaccharide,LPS,10 mg·kg-1)的方法制备大鼠ARDS模型,乌司他丁组在左侧腹腔注射LPS后1 h后,在右侧腹腔注射乌司他丁20 000 U·kg-1,对照组、注射同等剂量的生理盐水,各组大鼠在不同时间点留取肺组织及血浆标本。计算肺组织湿/干质量(W/D)比值;光镜下观察肺组织病理改变;用ELISA法检测各组血浆中肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白细胞介素-18(interleukin-18, IL-18)、肺表面活性物质A((surfactant protein A,SPA)含量,检测各组肺匀浆中丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide Dismutase,SOD)和一氧化氮(nitric oxide, NO)含量;免疫组化法检测p38丝裂原活化蛋白激酶(mitogen activated protein kinase, p38MAPK)、细胞外信号调节蛋白激酶(extracellular-signal regulated protein kinase,ERK)蛋白表达情况;Western blot法检测肺组织中磷酸化p38MAPK(p-p38MAPK)及磷酸化ERK(p-ERK)蛋白表达的变化。结果光镜下观察对照组肺组织结构完整,肺泡腔清晰;LPS组肺泡壁增厚,渗出明显,肺组织出现损伤性变化,以12h组变化最明显;UTI组各组病理改变较LPS组明显减轻。与对照组比较,LPS组W/D比值、血浆TNF-α、IL-18含量,肺匀浆MDA、NO含量均明显升高(P<0.05),而肺匀浆SOD含量明显降低;与LPS组比较,UTI各组肺组织W/D比值、血浆TNF-α、IL-18含量,肺匀浆MDA含量均明显降低,而肺匀浆SOD含量明显增高,差异有统计学意义;免疫组化结果显示:与对照组比较,LPS组p38MAPK、ERK蛋白在胞质和胞核表达均明显增加,而UTI组较LPS组表达均明显减少;Western blot检测结果显示:与对照组比较,LPS组肺组织p-p38MAPK/ERK蛋白表达均明显增高,而UTI干预组蛋白表达均明显受抑制。结论乌司他丁通过干预p38MAPK/ERK信号通路、抗氧化作用而减轻炎症反应,发挥对LPS致脓毒性大鼠ARDS的保护作用。
乌司他丁;细菌脂多糖;急性呼吸窘迫综合征;p38丝裂原活化蛋白激酶;细胞外信号调节蛋白激酶;减轻
脓毒症是临床危重患者的一种常见并发症,可出现多器官功能障碍综合征,其中肺组织是最常且较早出现的损伤靶器官,急性呼吸窘迫综合症(acute respiratory distress syndrome, ARDS)是多种炎症细胞介导的肺部局部炎症反应和炎症细胞失控所致的肺毛细血管损伤而引起的临床综合征,虽经长期研究,仍无有效治疗方法,其高发病率、高病死率仍是目前困扰临床治疗的难点与热点[1]。乌司他丁(ulinastatin,UTI)是从健康男性尿液中提取出的一种物质,具有强效拮抗内毒素和抑制炎症介质释放的作用,可有效降低脓毒症患者的病死率[2]。丝裂原活化蛋白激酶(mitogen activated protein kinases, MAPKs)信号通路是细胞内调控炎症产生的主要信号转导通路,与LPS诱发的ARDS有密切关系[3]。本研究旨在通过脂多糖(LPS)诱导大鼠ARDS模型,探讨UTI在脓毒症肺损伤中的保护作用及可能机制。
1 材料与方法
1.1实验动物分组及模型制备健康♂ Wistar大鼠56只,体质量(180±20) g,由内蒙古大学动物实验中心提供,动物合格证号:SCXK(蒙)2002-0001,实验前大鼠在实验环境中适应1周。按随机数字表法将大鼠分为:正常对照组、模型(LPS 6、12、24 h)组、乌司他丁(UTI 6、12、24 h)组,每组8只。采用腹腔注射LPS 10 mg·kg-1的方法制备大鼠ARDS模型,对照组注射同等剂量的生理盐水,UTI组在左侧腹腔注射LPS后1h后在右侧腹腔注射UTI 20 000 U·kg-1,所有动物在给LPS后规定时间点处死并留取血及肺组织标本进行各项指标检测。
1.2主要试剂主要试剂:LPS购于Sigma公司;大鼠TNF-α、IL-18、SPA购于武汉基因美生物科技有限公司;MDA、SOD、NO试剂盒购于南京建成生物工程研究所;UTI购于广东天普生化医药股份有限公司,免疫组化和Western blot检测试剂均购于Sigma公司。
1.3检测指标及方法
1.3.1肺湿/干重比采用湿干重法,分别取右上肺,放入无菌无酶管,称湿重后,连续60°烘箱烘干72 h,称干重,记录湿/干重(W/D)值。
1.3.2因子测定用ELISA法严格按说明书步骤检测血浆TNF-α、IL-18、SPA含量;肺组织 MDA、NO活性检测:采用硫代巴比妥酸比色法检测肺组织 MDA 含量;采用硝基还原酶法测定肺组织NO2-和 NO3-浓度,以代表NO含量;采用黄嘌呤氧化酶法测定肺组织SOD含量。
1.3.3肺组织病理学观察取右下肺组织,冰冻盐水冲洗后,滤纸吸干,以4%甲醛固定24 h后,常规修块,脱水,透明,包埋,苏木精-伊红(HE)染色,在光镜下观察肺组织病理变化。
1.3.4免疫组化检测肺组织p-p38MAPK、pERK表达所用的载玻片需预先用0.1%的多聚赖氨酸处理,切片厚度为5 μm,肺组织石蜡标本常规脱蜡水化,抗原热修复12 min,PBS冲洗,3%双氧水阻断内源性过氧化物酶室温30 min,PBS冲洗,羊血清工作液封闭30 min,各组分别滴加1 ∶100兔抗大鼠p-p38MAPK、ERK蛋白激酶单克隆抗体一抗4℃过夜,分别加入生物素标记的相应的二抗,DAB显色,阴性对照用PBS代替一抗,光镜下观察肺组织中出现棕黄色颗粒为阳性信号。
1.3.5Western blot检测肺组织p-p38MAPK、p-ERK的表达肺组织称重、剪碎,加入组织裂解液于4 ℃下匀浆,4 ℃ 12 000×g离心10 min,吸取上清。应用考马斯亮蓝法进行蛋白定量,各组取80 μg样品蛋白行12% SDS-聚丙烯酰氨凝胶电泳后,转入硝酸纤维素膜。应用 2%脱脂奶粉室温封闭硝酸纤维素膜,加入以0.1% PBS溶液按1 ∶500稀释的p-p38 MAPK、ERK抗体,4 ℃密封过夜。TPBS振荡洗膜后,应用辣根过氧化物酶标记的二抗及DAB显色试剂盒进行检测,免疫印迹化学发光法(ECL)显色,凝胶图像处理系统分析目标条带的吸光度(A)值。
2 结果
2.1肺湿干重比LPS各组肺组织湿/干重比均较对照组减少(P<0.05),且以12 h组改变最明显,UTI 6 h及12 h组肺湿/干重比值较LPS组减轻(P<0.05),24 h组变化不明显;提示LPS 12 h组肺水肿最明显,UTI具有减轻肺水肿作用,但作用时间<24 h(Tab 1)。
2.2血浆中 TNF-α、IL-18、SPA水平对照组血浆中TNF-α、IL-18和SPA含量较低,LPS组大鼠血浆中TNF-α和IL-18水平均较对照组明显增加(均P<0.05),且以6 h组最明显,随后呈下降趋势,24 h最弱,而血浆中SPA增高在LPS 12 h组最明显(P<0.05),与肺湿/干重比值变化一致;而UTI可抑制LPS所致 TNF-α、IL-18和SPA增加(均P<0.05),分别以UTI 6、12、12 h组改变较明显(Tab 1)。
2.3肺组织MDA、SOD和NO含量与对照组比较,LPS 12、24 h组肺组织 MDA、NO含量均明显增加,LPS各组SOD含量明显减少(均P<0.05);UTI组肺组织MDA含量较LPS组明显下降,SOD含量明显上升(均P<0.05),但NO无明显改变(P>0.05),见Tab 2。
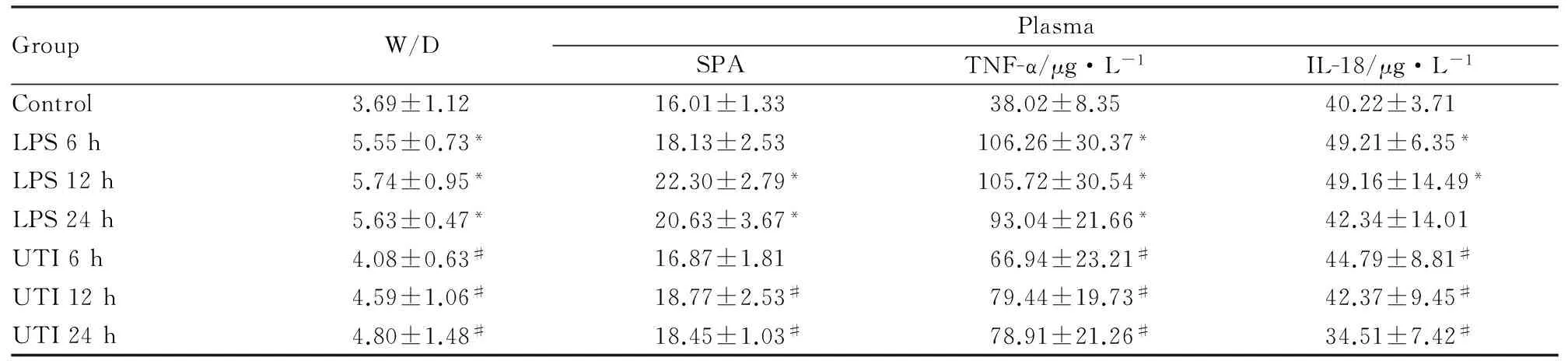
GroupW/DPlasmaSPATNF-α/μg·L-1IL-18/μg·L-1Control3.69±1.1216.01±1.3338.02±8.3540.22±3.71LPS6h5.55±0.73*18.13±2.53106.26±30.37*49.21±6.35*LPS12h5.74±0.95*22.30±2.79*105.72±30.54*49.16±14.49*LPS24h5.63±0.47*20.63±3.67*93.04±21.66*42.34±14.01UTI6h4.08±0.63#16.87±1.8166.94±23.21#44.79±8.81#UTI12h4.59±1.06#18.77±2.53#79.44±19.73#42.37±9.45#UTI24h4.80±1.48#18.45±1.03#78.91±21.26#34.51±7.42#
W/D: lung wet/dry ratio,UTI: ulinastatin,TNF-α:Tumor necrosis factor-α;*P<0.05vscontrol;#P<0.05vsLPS
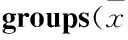
Tab 2 Comparision of levels of SOD, MDA and NO among seven ±s,n=8)
*P<0.05vscontrol;#P<0.05vsLPS
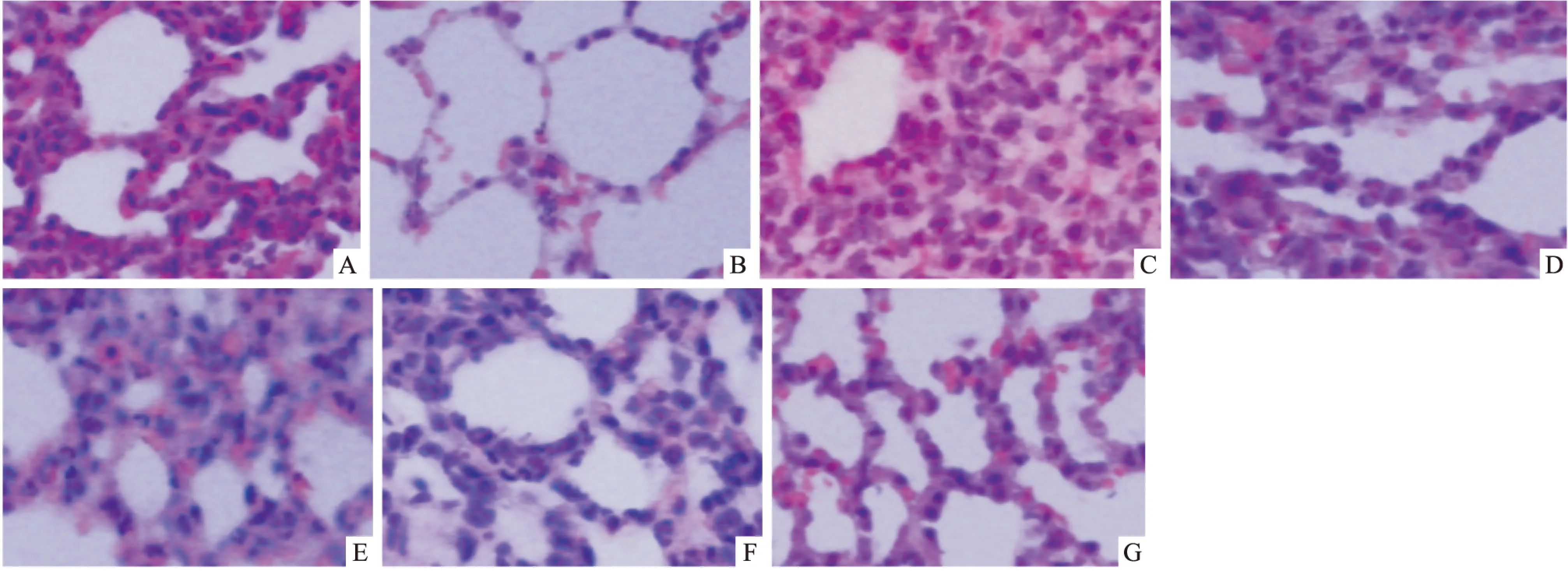
Fig 1Pathological changes in rat lung tissue was observed in the optical microscope
A:Control; B:LPS 6 h;C:LPS 12 h; D:LPS 24 h; E:UTI 6 h; F:UTI 12 h; G:UTI 24 h. ( original magnification ×400).
2.4肺组织病理学改变
2.4.1HE染色结果光镜下观察对照组肺组织结构完整、肺泡腔清晰且肺泡壁无充血,肺间质较少炎性细胞浸润;LPS组肺泡壁弥漫性增厚合并部分肺泡壁破坏,较多炎性细胞浸润、部分肺泡出血和结构破坏,以12 h病理改变最明显;UTI各组病理改变较LPS组明显减轻,证实UTI可改善LPS致大鼠肺损伤(Fig 1)。
2.4.2p-p38MAPK/p-ERK的免疫组化结果对照组肺组织磷酸化p38MAPK/ERK阳性信号极弱,偶见分布于气道上皮细胞和肺泡上皮细胞内。LPS组大鼠磷酸化p38MAPK/ERK阳性信号表达明显增强,主要分布于气道上皮细胞、浸润的炎性细胞和血管内皮细胞内,且胞质与胞核均呈阳性表达;UTI组肺组织磷酸化p38MAPK/ERK阳性细胞分布部位与LPS组相似,但胞核阳性表达细胞明显减少,信号明显较LPS组减弱(Fig 2)。
2.4.3p-p38MAPK/p-ERK的Western blot结果LPS组肺内p-p38MAPK的表达明显增加,UTI各组均能抑制LPS诱导的p38MAPK的磷酸化,而各组间p38MAPK的表达无明显差异。LPS组ERK1/2及p-ERK1/2表达均增强,UTI各组均能明显抑制LPS诱导的ERK1/2及其磷酸化(Fig 3)。
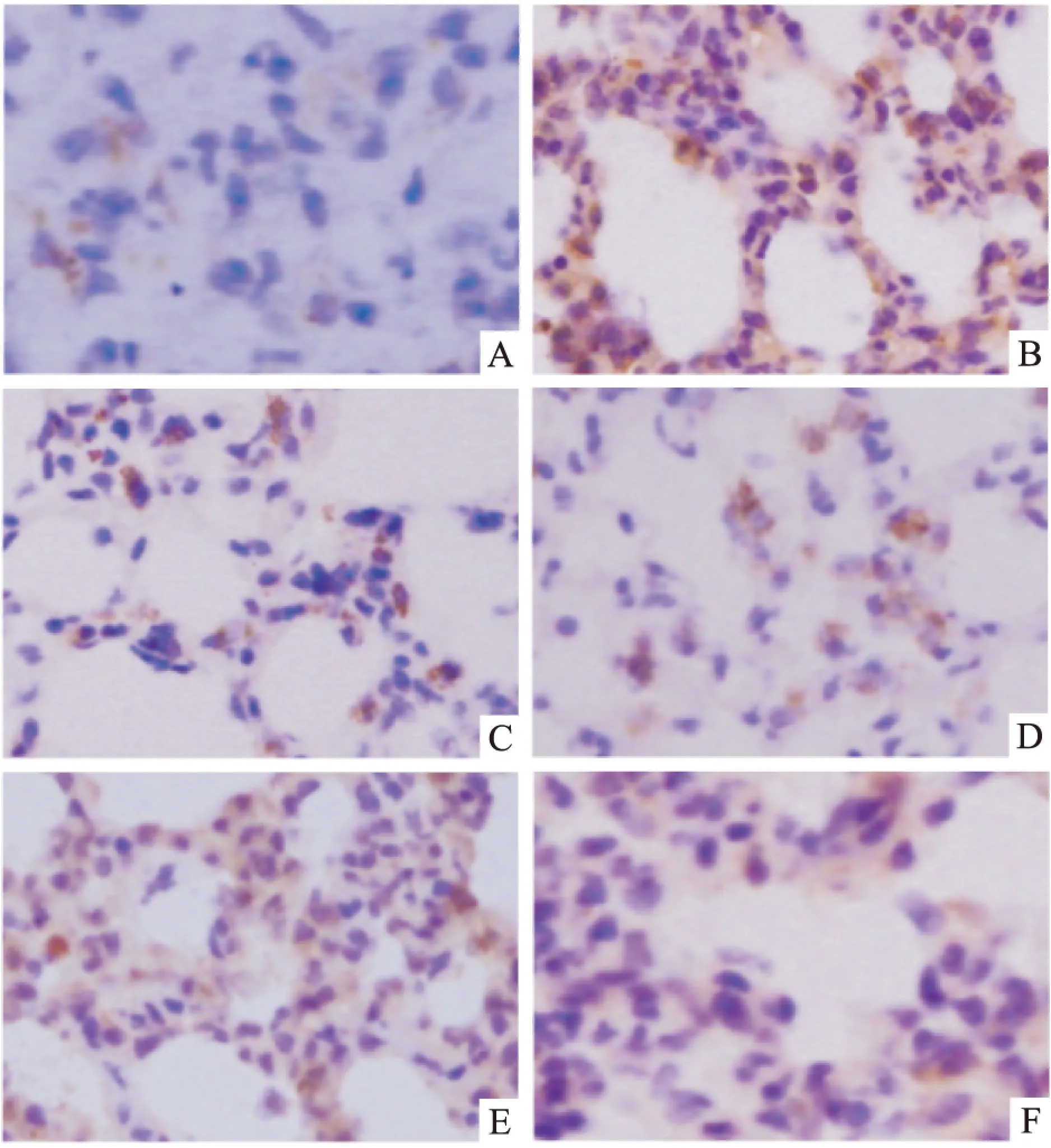
Fig 2 The expression of p-p38MAPK, ERK and pERK in the lung tissues by immunohistochemistry
p-p38MAPK: A:Control; B: LPS; C: UTI; pERK: D: Control; E: LPS; F:UTI. (original magnification ×400)
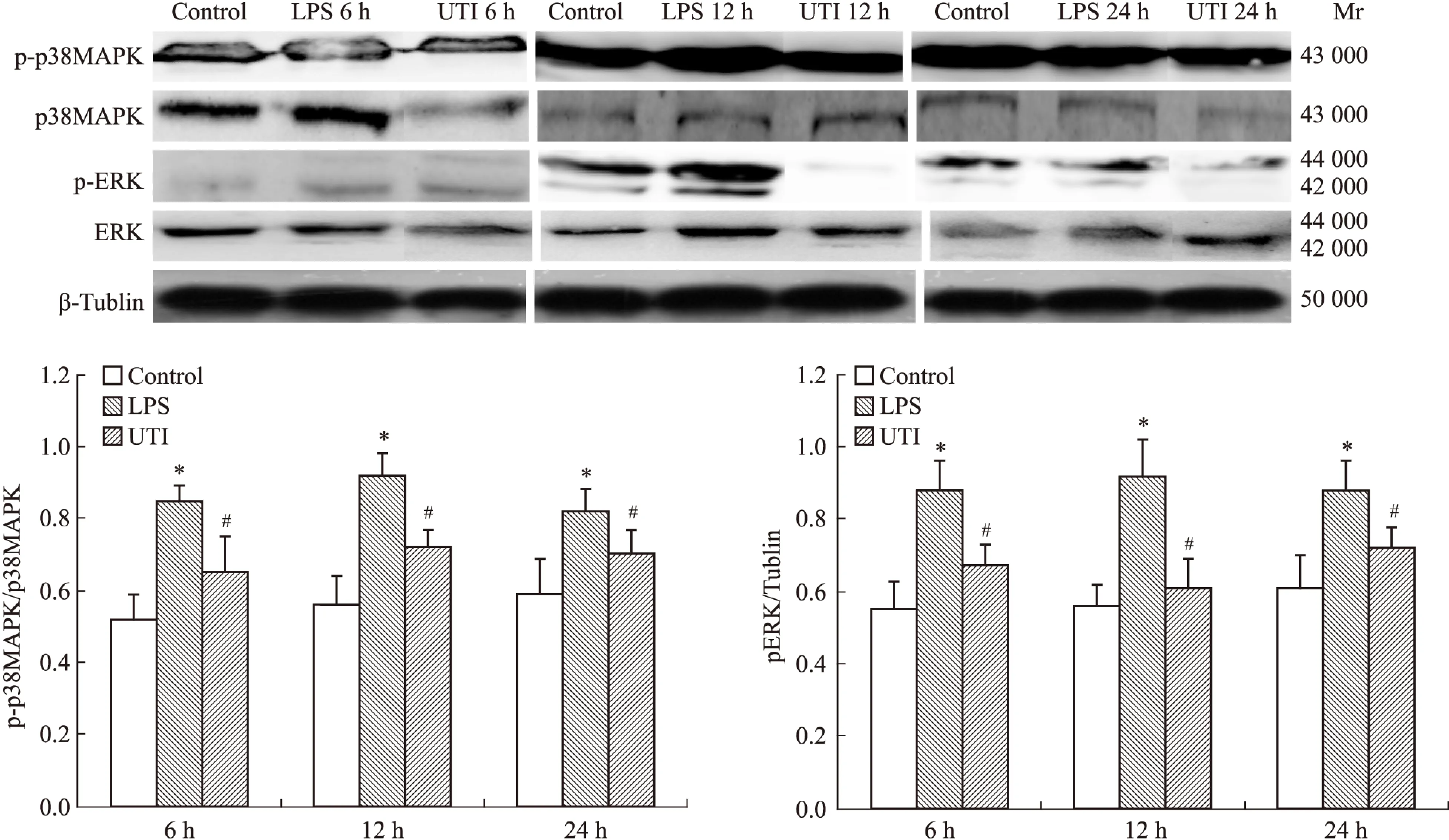
Fig 3 The expression of p-p38MAPK and pERK1/2 in different groups
The expression of p-p38MAPK,*P<0.05 LPS groupvscontrol group;#P<0.05 UTI group vs LPS group. The expression of ERK1/2 and pERK1/2,*P<0.05 LPS group vs control group;#P<0.05 UTI group vs LPS group.
3 讨论
近年来大量的临床及动物试验显示乌司他丁作为一种尿胰蛋白酶抑制剂通过抑制炎症介质释放,预防细胞因子级联反应,抑制白细胞过度激活, 阻断三者间的恶性循环,对全身炎性反应疾病的肺损伤具有保护作用[4-8]。 本研究结果提示:UTI可减轻LPS所致大鼠肺损伤程度,表现为与LPS组比较UTI组肺组织病理改变减轻,肺W/D比值减小,同时测得血浆中促炎介质TNF-α、IL-18含量减少,因此本研究结果与既往研究一致,UTI可通过抑制炎症介质而达到减轻炎症反应,从而缓解LPS导致的肺损伤。
在众多参与脓毒症性急性肺损伤的炎症介质中,TNF-α和IL-18具有重要作用。TNF-α可诱导白细胞迁移、粒细胞脱颗粒、毛细血管内皮细胞活化,进而使肺毛细血管渗漏、肺上皮细胞水肿,导致肺通气和换气功能障碍,影响肺功能[9]。血浆中IL-18是脓毒症和其他炎症性疾病中重要的炎症介质因子,它可以刺激T细胞增殖,增强自然杀伤细胞活性,参与细胞因子的生成等作用[10]。本研究发现TNF-α和IL-18在LPS 6h组升高,并持续维持在较高水平,其结果显示两者浓度升高有一定相关性。UTI各组血浆中TNF-α和IL-18的含量较LPS组明显减少,且以6h组改变最明显,因此证实乌司他丁可通过抑制TNF-α和IL-18升高,减轻过度炎性反应对机体的损伤,从而减轻肺损伤,且抑制炎症介质作用时间较持久。
肺表面活性物质是由肺泡Ⅱ型上皮细胞分泌的一种复杂的脂蛋白,其中SP-A具有促进肺泡巨噬细胞的活性,抵抗渗出到肺泡的蛋白质等对肺表面活性物质的抑制作用[11],因此其在肺组织中缺乏及活性下降是脓毒症性急性肺损伤的主要发病机制之一。SP-A亦具有调理巨噬细胞功能,促进其趋化活性,增强其吞噬作用,并刺激其产生氧自由基,因而导致血中氧自由基生成增加,加重脓毒症形成恶性循环。本研究发现:与对照组比较,LPS 12 h及24 h组血浆SPA含量升高,差异有统计学意义,而6 h组差异无统计学意义。UTI组血浆SPA含量各时间段含量均较LPS组降低。结合本研究肺湿/干比值结果,可推测UTI可能具有抑制肺表面活性物质的降解及增加SPA活性作用,并能降低肺毛细血管的通透性,减轻肺水肿及炎症因子的聚集,从而达到对脓毒症大鼠肺损伤的保护作用。
多项研究表明阻断p38MAPK级联反应能减轻炎症反应[2,12],因此不少学者提出将p38MAPK作为抗炎治疗的一个有效靶位,在信号通路水平阻断和调控p38MAPK的表达成为治疗ALI的一条新途径[13]。ERK是p38MAPK通路关键的信号物质,体内外实验均提示,接受机械牵拉后,肺部细胞ERK 磷酸化明显在增加,而特异性阻断ERK 后可明显降低各种原因导致的肺部损伤和炎症反应[14]。本研究结果显示:免疫组化及Western blot结果均证实乌司他丁能减轻LPS所致肺组织中p38MAPK及ERK的磷酸化,而p38MAPK及ERK信号通路是我们所熟知的与炎症反应及肺损伤密切相关的细胞信号通路,因此本研究证实UTI通过抑制p38MAPK及ERK信号通路而抑制炎症介质的形成及释放,从而减轻炎症反应,发挥减轻LPS诱发的肺损伤。
过氧化作用亦是急性肺损伤发病原因之一,MDA、NO含量可预示过氧化作用水平;SOD是生物体内氧自由基的天然清除剂,具有抗氧化作用。本研究发现,LPS各组中MDA的含量明显升高并长时间维持在高水平,说明LPS可通过过氧化作用导致急性肺损伤。而UTI各组中MDA含量明显低于LPS组,但6 h组变化最明显,随后逐渐增高,提示UTI的抗氧化作用起效快,但持续时间较短。与对照组比较,LPS组在早期6 h即可出现SOD的含量下降,且持续保持较低水平,UTI组各时间段SOD含量增加,与LPS组比较差异有统计学意义。因此本研究提示LPS通过氧化应激参与了脓毒症性急性肺损伤,而UTI可能通过抑制过氧化损伤并清除氧自由基等作用保护肺组织,且起效较快。
肺匀浆中NO含量各组变化不明显,可能与SP-A 抑制正常肺中分离出的肺泡巨噬细胞中脂多糖刺激后NO 的产量,但又能增加免疫反应性纤维结合素激活的巨噬细胞中NO 的产量[15-16],两者共同作用导致NO含量的相对稳定,亦可能是由于药物剂量等因素所致,有待进一步研究证实。
综上所述,本研究结果表明,UTI对LPS所致的大鼠ARDS具有保护作用,可能与以下机制有关:① UTI能干预p38MAPK及ERK信号转导途径激活,从而抑制炎症反应而发挥保护作用。② UTI可通过对炎症反应的抑制从而减少毛细血管渗漏,减少肺血浆中SPA含量及活性,增加其肺组织中的含量及活性而发挥肺保护作用。③ UTI可通过减少血浆中SPA含量,减轻其对巨噬细胞刺激产生的氧自由基,发挥抗氧化作用,清除氧自由基而减轻肺组织损伤。而UTI的最佳治疗剂量、作用持续时间以及其抗氧化、抗炎作用机制仍有待深入研究。
(感谢内蒙古医科大学分子病理学实验室肖瑞老师和内蒙古大学信号转导实验室娜仁格日勒的悉心指导!)
[1]乔良,刘志.按柏林新标准分析急诊脓毒症患者发生急性呼吸窘迫综合征的危险因素[J].中华危重病急救医学,2015,27(7):558-62.
[1]Qiao L,Liu Z.Analysis of the risk factors of acute respiratory distress syndrome of Berlin new definition in patients with sepsis in emergency department[J].ChineseCriticalCareMedicine,2015;27:558-62.
[2]Jonsson-Berling B M,Ohlsson K,Rosengren M.Radio immunological quantitation of the urinary trypsin inhibitor in normal blood and urine[J].BiolChemHoPPeSeyler,1989,370(11):1157-61.
[3]孟莹,余常辉,李婷,等.Toll样受体4在烟熏和脂多糖联合烟熏所致肺损伤大鼠中的表达及意义[J].中华医学杂志,2013,93(28):2230-4.
[3]Meng Y,Yu C H,Li T, et al.Expression and significance of Toll-like receptor-4 in rats lung established by passive smoking or associated with intratracheal instillation of lipopolysaccharide[J].ChinMedJ,2013,93:2230-4.
[4]Inoue K,Takano H,Smada A,et al.Urinary trypsin inhibitor protects against systemic inflammation induecd by lipopolysae charide[J].MolPharmacol,2005,67(3):673-80.
[5]Inoue K, Takano H.Urinary trypsin inhibitor as a therapeutic option for endotoxin-related inflammatory disorders[J].ExpertOpinInvestigDrugs,2010,19(4):513-20.
[6]Yu J B,Yao S L.Protective effects of hemin pretreatment combined with ulinastent on septic shock in rats[J].ChinMedJ(Engl),2008,121(1):49-55.
[7]陈怿,童华生,张兴钦,等.乌司他丁减轻重症中暑大鼠肺的炎症和氧化损伤[J].中华急诊医学杂志,2014,23(8):866-70.
[7]Chen Y,Tong H S,Zhang X Q,et al. The study of ulinastatin to reduce pulmonary inflammation and oxidative injury in rats with severe heatstroke[J] .ChineseJournalofEmergencyMedicine,2014,23(8):866-70.
[8]Wang S Y, Li Z J, Wang X L,et al. Effect of ulinastatin on HMGB1 expression in rats with acute lung injury induced by sepsis[J].GenetMolRes,2015,14(2):4344-53.
[9]朱桂军,孟志强,刘丽霞,等.DATS通过p38MAPK通路抑制LPS诱导的小鼠MH-S细胞TNF-α及IL-1β表达[J].中国药理学通报,2012,28(9):1303-7.
[9]Zhu G J,Meng Z Q,Liu L X,et al. Inhibition of LPS-induced TNF-α and IL-1β expression by DATS through p38 MAPK pathway in MH-S cell[J].ChinPharmacolBull, 2012,28(9):1303-7.
[10]Eidt M V, Nunes F B, Pedrazza L, et al.Biochemical and inflammatory aspects in patients with severe sepsis and septic shock: The predictive role of IL-18 in mortality[J].ClinChimActa,2016,453:100-6
[11]Linder A, Russell J A. An exciting candidate therapy for sepsis:ulinastatin, a urinary protease inhibitor[J].IntensiveCareMed,2014,40(8):1164-7.
[12]Rice T W,Bemard G R.Acute lung injury and the acute respiratory distress syndrome:challenges in clinieal trial design[J].ClinChestMed,2006,27(4):733-54.
[13]倪志宇,丛斌,董玫,等.八肽胆囊收缩素通过p38MAPK通路抑制LPS诱导的RAW264.7细胞IL-1β表达[J].中国药理学通报,2011,27(7):971-5.
[13]Ni Z Y,Cong B,Dong M,et al. CCK-8 inhibits LPS-induced IL-1β production in RAW264.7 cells by p38 MAPK pathway[J].ChinPharmacolBull,2011,27(7):971-5.
[15]Di Paola Rl, Crisafulli C, Mazzon E, et al. Effect of PD98059,a selective MAPK3/MAPK1 inhibitor,on acute lung injury in mice[J].IntJImmunopatholPharmacol,2009,22(4):937-50.
[16]Sawada K, Ariki S, Kojima T, et al. Pulmonary collectins protect macrophages against poreforming activity of Legionella pneumophila and suppress its intracellular growth[J].JBiolChem,2010,285(11):8434-8.
Ulinastatin attenuates lipopolysaccharide-induced acute lung injury by intervening p38MAPK/ERK signaling pathway
ZHANG Li-peng,ZHAO Yan,LIU Guo-juan,YANG Da-gang,ZHOU Li-hua
(1.ICU,theAffiliatedHospitalofInnnerMongoliaMedicalUniversity,Huhhot010050,China;2.DeptofNeurology,thePeople’sHospitalofInnnerMongolia,Huhhot010051,China)
AimTo investigate whether ulinastatin has a beneficial effect on lipopolysaccharide(LPS) induced acute respiratory distress syndrome(ARDS) in rats,and to explore the possible underlying mechanisms.MethodsFifty-six Wistar rats were randomly assigned into control group, model group(LPS 6,12,24 h groups), ulinastatin group(UTI 6,12,24 h groups), with 8 in each group. ARDS rat model was reproduced by intraperitoneal injection of LPS(10 mg·kg-1), The rats in UTI groups were injected ulinastatin(20 000 u·kg-1), The rats in the control group received an equal volume of normal saline at the same time, rats in each group were sacrificed at 6,12,24 hours after LPS challenge. Plasma and lung tissue samples were collected, Histopathological evaluation, lung wet/dry (W/D) ratio, Tumor necrosis factor-a(TNF-α), Interleukin-18(IL-18),surfactant protein A(SPA), malondialdehyde(MDA),nitric oxide(NO) and superoxide dismutase(SOD)were analyzed. Immunohistochemical method was performed to detect the protein expression of p38MAPK and ERK. Western blot method was used to detect lung phosphorylated p38MAPK(p-p38MAPK) and pERK protein expression changes.ResultIn the control groups, lung tissue showed a normal structure and clear pulmonary alveoli under a light microscope. In the model group, ARDS characters such as extensive thickening of the alveolar wall, significant infiltration of inflammatory cells,demolished structure of pulmonary alveoli,and hemorrhage were found. In the all UTI treatment groups,these pathological changes in lung were markedly alleviated compared with those of LPS-induced ARDS group. Compared with control groups, lung W/D ratio,tumor necrosis factor-a(TNF-α),interleukin-18(IL-18)and surfactant protein A(SPA)in plasma ,and lung MDA,NO levels in lung homogenates in the LPS group were increased significantly, while the lung SOD levels in the LPS group were decreased. Compared with the LPS group,lung W/D ratio,TNF-aIL-18 and(SPAin plasma ,and lung MDA levels in lung homogenates in the UTI groups were decreased significantly, while the lung SOD levels in the UTI groups were increased. Immunohistochemistry showed that positive expressions of p38MAPK and ERK in cytoplasm and nucleus in the ulinastatin treatment groups were significantly lower than those in the model group. Western blot showed that compared with the control group, the p-p38MAPK and pERK protein expression in LPS group were significantly increased, and the ulinastatin could inhibit the protein expressions compared with model group.ConclusionUlinastatin can significantly ameliorate the lung injury induced by LPS in rats via the intervention of p38MAPK and ERK signaling pathway and reducing inflammation and antioxidant effect.
ulinastatin; lipopolysaccharide; acute respiratory distress syndrome; p38MAPK; ERK;attenuate
2016-05-08,
2016-06-25
内蒙古自治区自然基金项目(No 2013MS1128);内蒙古自治区卫生与计划生育委员会基金(No 201302077)
张利鹏 (1980-),男,博士生,研究方向:脓毒症及ARDS的基础与临床,E-mail:zlp_boy2008@163.com
周丽华(1970-),女,博士,研究方向:脓毒症心肌损伤的信号通路研究,通讯作者,E-mail:rocboy2008@aliyun.com
10.3969/j.issn.1001-1978.2016.09.024
A
1001-1978(2016)09-1311-06
R-332;R332.35;R329.25;R345.57;R563.8;R631;R977.3
网络出版时间:2016-8-23 14:29:00网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160823.1429.048.html
