绞股蓝皂苷对AGEs诱导下人肾小球系膜细胞中RAGE及转化生长因子-β1表达的影响
2016-09-28张秋艳张慧云
张秋艳,唐 灵,王 艳,周 康,张慧云
(桂林医学院附属医院老年内科,广西 桂林 541001)
绞股蓝皂苷对AGEs诱导下人肾小球系膜细胞中RAGE及转化生长因子-β1表达的影响
张秋艳,唐灵,王艳,周康,张慧云
(桂林医学院附属医院老年内科,广西 桂林541001)
目的观察绞股蓝皂苷(gypenosides,GP)对晚期糖基化终末产物(advanced glycation endproducts,AGEs)诱导下人肾小球系膜细胞(human mesangial cells,HMCs)中晚期糖基化终末产物受体(RAGE)及转化生长因子-β1(TGF-β1)表达的影响。方法将体外培养的(体积分数为0.15的FBS的DMEM低糖培养液)人肾小球系膜细胞(HMCs)分为4组:正常组、模型组、GP组、阳性对照组。除正常组外,其余组均再给予200 mg·L-1AGEs 刺激。此外,GP组中加入不同浓度GP(25、75、175 mg·L-1)进行干预,阳性对照组中加入氨基胍盐酸盐(10-1mmol·L-1)。应用 Western blot技术检测各实验组中RAGE和TGF-β1蛋白的表达;RT-PCR技术检测各实验组中RAGE和TGF-β1mRNA的表达。结果模型组 AGEs 诱导下HMCs 中RAGE、TGF-β1蛋白及 mRNA 表达水平明显高于正常组(P<0.01);与模型组比较,GP组中GP可明显下调HMCs中RAGE、TGF-β1蛋白及mRNA的表达,且呈浓度依赖性(P<0.01)。结论GP可降低 AGEs 诱导下 HMCs中RAGE的表达,阻断AGEs-RAGE信号通路,并下调下游因子TGF-β1的表达,进而延缓糖尿病肾病纤维化进程。
绞股蓝皂苷; 糖尿病肾病; 人肾小球系膜细胞; 晚期糖基化终末产物; 晚期糖基化终末产物受体; 转化生长因子-β1; 纤维化
糖尿病肾病(diabetes nephropathy, DN)是糖尿病引起的一种极高危的慢性微血管并发症,终可发展为终末期肾病(ESRD),起病隐匿且发展缓慢,具体发病机制尚不明确,是糖尿病患者死亡的主要原因[1-2]。长期糖代谢紊乱导致大量 AGEs 的形成与蓄积,AGEs 与其受体 RAGE 结合,激活 AGEs-RAGE 信号通路,增强下游细胞因子及生长因子的表达活性,加快纤维化进程,促进DN恶化[3-4]。肾脏纤维化是 DN病理变化的中心环节及其发展为 ESRD的共同途径[5]。故有效地抑制 AGEs 的形成及阻断 AGEs-RAGE信号通路的同时,并下调下游细胞因子的表达,不仅可延缓 DN 发展,还能遏制肾脏纤维化这一核心环节,发挥双管齐下的作用,对抑制或逆转DN意义重大。绞股蓝是一种葫芦科中草药,美誉为“南方人参”。 已有研究发现[6-7]绞股蓝及其制剂具有降血糖、抗纤维化等广泛药理学作用,可干预 DN 多个病理环节,具有保护肾脏的作用。因此,本实验通过观察 GP 对 AGEs 诱导下 HMCs 中RAGE和 TGF-β1表达的影响,初步探讨其在延缓 DN 发生发展中的可能机制,为GP抗DN提供可靠的实验依据。
1 材料与方法
1.1材料及仪器HMCs(湘雅医学院中心实验室细胞库); DMEM低糖培养基、0.25%胰蛋白酶(美国,Gibco公司) ;晚期糖基化终末产物(AGEs)(美国,Biovision 公司);胎牛血清 FBS(南美,GEMINI);GP(标准,质量分数≥98%,每支20 mg)(大连美仑生物技术有限公司);氨基胍盐酸盐 (Aminoguanidine hydrochloride,AG,美国,Sigma);TRIzol试剂、逆转录酶试剂盒及 PCR 引物(美国,Invitrogen);PCR MasterMix及DNA Marker (中国,天根生化科技北京有限公司) ; GAPDH 鼠抗人单克隆抗体(中国, 北京中杉金桥生物技术有限公司); RAGE 兔抗人多克隆抗体(美国,ABGENT 公司);TGF-β1 兔抗人单克隆抗体(美国,Santa Cruz公司);CO2细胞培养箱(美国,MENOAI 公司) ; iMark 型酶标仪及 PCR 基因扩增仪(美国,Bio-Rad);TDL-80-2B低速离心机(上海安亭科学仪器厂);DYY-6D 型电泳仪(北京市六一仪器厂)。
1.2方法
1.2.1细胞培养将HMCs接种于体积分数为0.15的FBS的DMEM低糖培养液,在37℃、5% CO2饱和湿度的培养箱中进行常规培养,显微镜下观察细胞贴壁面积达培养瓶的80%~90%时,用0.25%胰酶消化传代培养,取3~6代生长良好的细胞进行实验。
1.2.2药物配制AGEs与体积分数为0.15的FBS的DMEM低糖培养液配制成浓度为200 mg·L-1的培养液,再加入不同剂量的GP,分别配制终浓度为25、75、175 mg·L-1的培养液,4℃保存备用。将阳性药物氨基胍配制成终浓度为10-1mmol·L-1的溶液,-20℃保存。
1.2.3给药及分组将对数生长期的HMCs以每瓶5×105个的数量接种于一次性培养瓶,在 37℃、5% CO2培养箱中培养24 h后,采取随机化原则分组:正常组(体积分数为0.15的FBS的DMEM低糖培养液);模型组(200 mg·L-1AGEs);GP组(25、75、175 mg·L-1);阳性对照组(氨基胍10-1mmol·L-1)。
1.2.4Western blot检测HMCs中RAGE及TGF-β1蛋白的表达用0.25%胰酶消化各组细胞后,分装至1.5 mL EP管,再分别加入150 μL细胞裂解液,置于冰上裂解30 min,反复吹打,充分裂解细胞。4℃,12 000 r·min-1,离心20 min后,收集上清并测定各组蛋白浓度。取30 μg蛋白,加入适量5×Buffer上样缓冲液,沸水煮5~10 min使其完全变性,-80℃保存备用。制12%分离胶与5%浓缩胶,电泳100 V,2 h后,4℃恒流,260 mA,转膜90 min将蛋白转至PDVF膜上。用含5%脱脂牛奶的 TBST 封闭2 h后,TBST 洗膜3次, 加入一抗(GAPDH鼠抗人单克隆抗体、RAGE兔抗人多克隆抗体及TGF-β1兔抗人单克隆抗体)4℃孵育过夜,TBST 洗膜3次,再加入相应二抗孵育1 h,TBST洗膜3次,在暗室加适量 ECL发光,覆上胶片、显影及定影。扫描底片,采用 Quantity One分析灰度值,得出相应蛋白的相对表达量。
1.2.5RT-PCR 检测 HMCs 中 RAGE 及 TGF-β1mRNA 的表达取生长良好的HMCs按每瓶5×105个的数量种植于一次性培养瓶。根据TRIzol法提取各组细胞总 RNA 并检测浓度。依照逆转录试剂盒使用书合成 cDNA,以 cDNA为模板,进行PCR扩增。反应总体系为25 μL。由Invitrogen公司合成引物,引物序列如下:RAGE:上游5′-TGGGATGGAAGTGCAGAGGT-3′;下游5′-TGGCGGTTTCCAAGACATTC-3′; TGF-β1:上游5′-CGTCTGCTGAGGCTCAAGTTA-3′;下游5′-CACAACTCCGGTGACATCAAA-3′; GAPDH:上游 5′-CAGGAATGGAAAGGAGACCAA-3′;下游 5′-TAGCTTCCCTCCGACACACA-3′。PCR的反应条件为:预变性94℃、3 min,94℃变性、30 s、退火温度1 min(RAGE 退火温度:57℃;TGF-β1 退火温度:59.3℃;GAPDH退火温度:59℃),复性72℃、1 min,共30次后,再延伸72℃、5 min。分别取5 μL PCR产物,加样于2%琼脂糖凝胶点样孔,电泳30 min,置于凝胶成像分析仪观察结果并拍照,运用 sensiAnsys 凝胶图像分析软件分析电泳图像,测量各条带的灰度值,得出各因子 mRNA 的相对表达量。
2 结果
2.1GP对AGEs诱导下各组HMCs中RAGE及TGF-β1蛋白表达的影响由Fig 1~2可见:体外培养条件下,HMCs 内 RAGE 及 TGF-β1蛋白低表达,AGEs 刺激能促使其异常高表达。与正常组比较,模型组 HMCs 内 RAGE 及 TGF-β1蛋白表达明显上调,同时各GP组及阳性对照组RAGE及TGF-β1蛋白表达量明显增高,差异具有统计学意义(P<0.01)。给予GP及阳性药物氨基胍干预后,可明显下调 RAGE 及 TGF-β1蛋白表达水平,与模型组比较,各GP组及阳性对照组RAGE及TGF-β1蛋白表达量下调,且各GP组呈浓度依赖性下调 RAGE 及 TGF-β1表达量,差异具有统计学意义(P<0.01)。
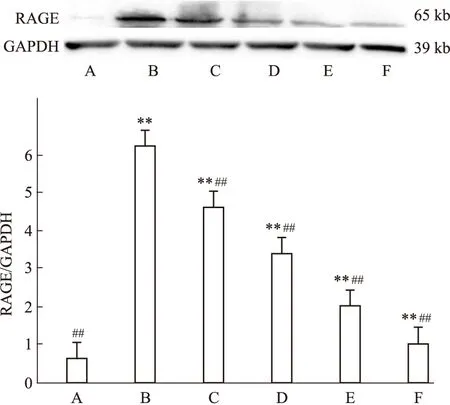
Fig 1 Effect of gypenosides on
A: Normal group;B:Model group(AGEs 200 mg·L-1);GP group(C:25、D:75 mg·L-1;E:175 mg·L-1); F:Positive control group(AG 10-1mmol·L-1).**P<0.01vsnormal group;##P<0.01vsmodel group
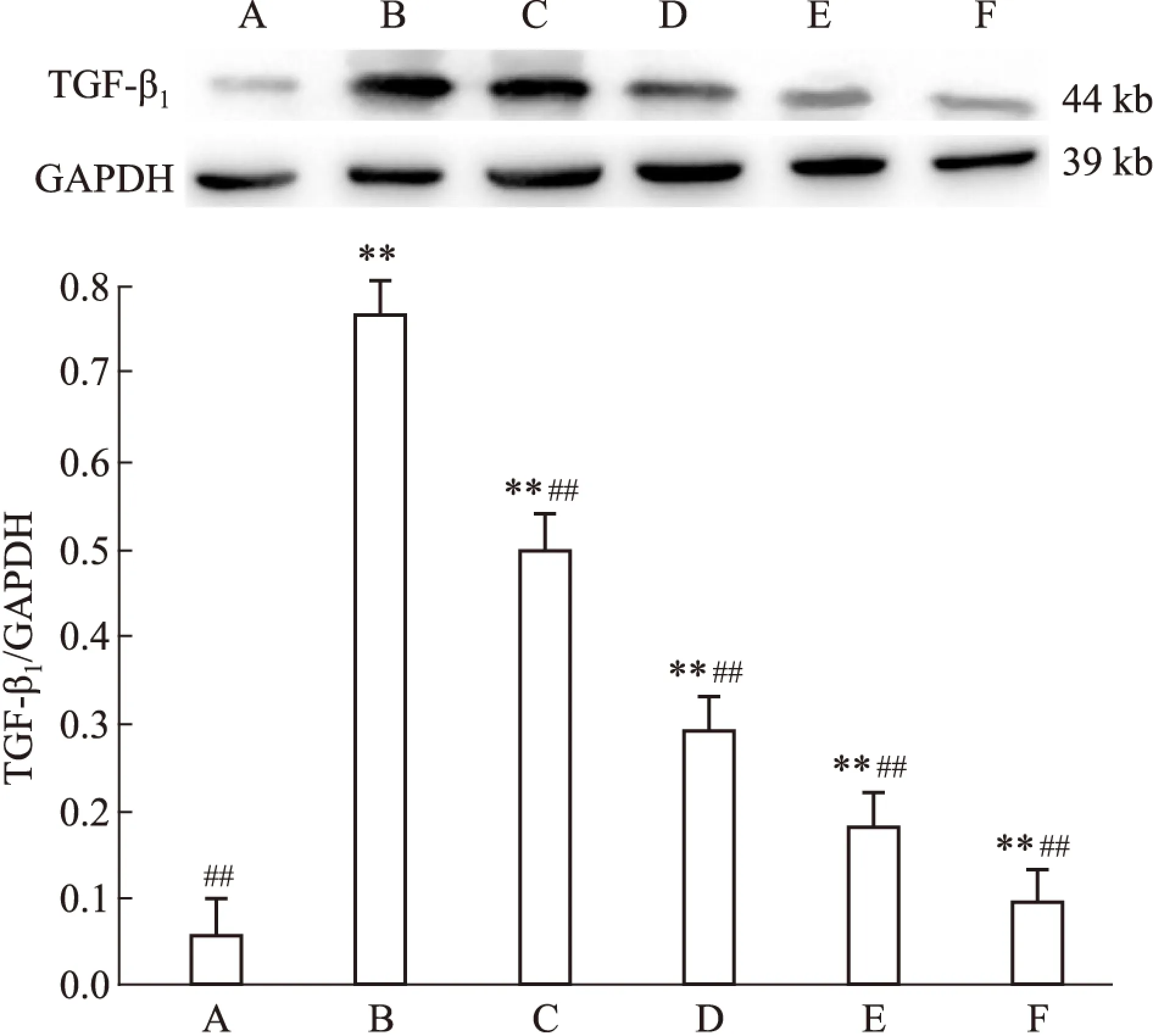
Fig 2 Effect of gypenosides on expression
A:Normal group;B:Model group(AGEs 200 mg·L-1);GP group(C:25 mg·L-1;D:75 mg·L-1;E:175 mg·L-1);F: Positive control group(AG 10-1mmol·L-1).**P<0.01vsnormal group;##P<0.01vsmodel group
2.2AGEs诱导下GP对各组HMCs中RAGE及TGF-β1mRNA表达的影响由Fig 3~4可见:正常组HMCs内RAGE及TGF-β1mRNA低表达。AGEs 诱导HMCs 72 h后,与正常组比较,模型组RAGE及TGF-β1mRNA表达量明显增高,各GP组及阳性对照组RAGE及TGF-β1mRNA表达量也上调,差异具有统计学意义(P<0.01)。给予GP干预后,可明显下调RAGE及TGF-β1mRNA表达,与模型组比较,各GP组及阳性对照组RAGE及TGF-β1mRNA表达量下调,且各GP组呈浓度依赖性下调RAGE及TGF-β1mRNA表达量,差异具有统计学意义(P<0.01)。
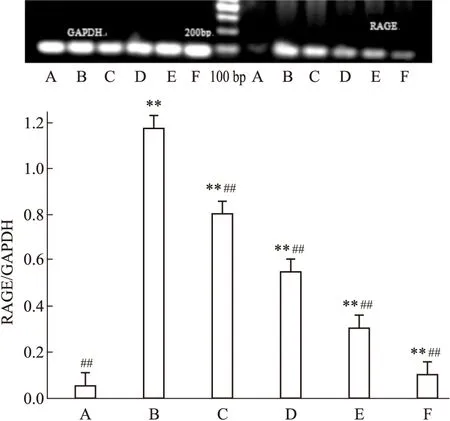
Fig 3 Effect of gypenosides on
A:Normal group;B:Model group(AGEs 200 mg·L-1);GP group(C:25 mg·L-1;D:75 mg·L-1;E:175 mg·L-1);F: Positive control group(AG 10-1mmol·L-1).**P<0.01vsnormal group;##P<0.01vsmodel group
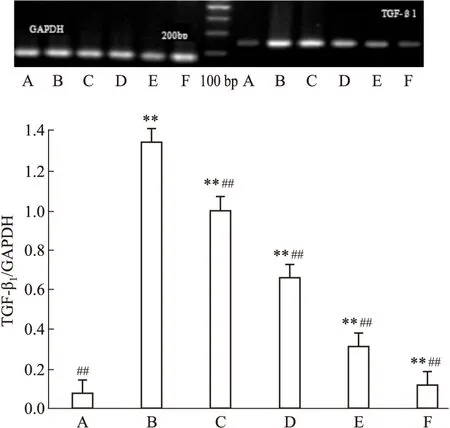
Fig 4 Effect of gypenosides on
A:Normal group;B:Model group(AGEs 200 mg·L-1);GP group(C:25 mg·L-1;D:75 mg·L-1;E:175 mg·L-1);F: Positive control group(AG 10-1mmol·L-1).**P<0.01vsnormal group;##P<0.01vsmodel group
3 讨论
DN是糖尿病并发症中危害最大的慢性血管病变之一,已成为 ESRD 主要的致病原因。其病理特点为肾小球肥大,基底膜增厚及细胞外基质(ECM)异常堆积,终发展为肾小管间质纤维化等,导致肾功能衰竭[8-9]。
肾小球系膜细胞(GMC)是肾小球中最为活跃的固有细胞,也是肾脏纤维化进程中产生纤维化因子的主要靶细胞[10]。长期慢性高血糖环境下,体内蛋白质与还原糖可形成一种不可逆的非酶糖基化终末产物(AGEs),不仅是 DN发展最关键的始动因子,还与肾脏纤维化发展有着密切联系。既往研究发现[11-12],当系膜细胞受到外源性 AGEs 刺激后,可直接导致系膜细胞增生,基底膜增厚及细胞外基质(ECM)过度聚集,最终导致肾小球硬化或小管间质纤维化等病理性改变。此外,还可通过与其系膜细胞上特异性受体(RAGE)结合,激活 AGEs-RAGE 通路,诱导并增强下游TGF-β1及其他致纤维化细胞因子的表达,加快纤维化进程,促进DN恶化[13]。
肾脏纤维化是各种肾脏疾病的共同病理基础,也是慢性肾功能衰竭的必经途径,其发展程度与肾功能的关系极为密切,能可靠地反映DN的预后[14]。目前认为,在肾脏纤维化病程中主要致纤维化因子包括TGF-β1、PDGF、VEGF及CTGF等。其中,TGF-β1是 DN 纤维化病程中研究最多、致纤维化作用最强的细胞因子,在 DN 发生发展中发挥重要作用[15]。TGF-β1不仅可直接介导 DN 纤维化病理改变的核心环节,还可通过受体信号参与调节细胞增殖、分泌、凋亡及肾小球硬化等多个病理过程[16-17]。
DN时多种因素可诱导TGF-β1表达异常升高,TGF-β1可刺激细胞外基质(ECM)合成增加,进而引起系膜区扩张、基底膜增厚,导致弥漫性或结节性肾小球硬化[18]。李业琼等[19]研究发现DN大鼠中AGEs 的聚集增加,还可诱导 RAGE 异常高表达,参与DN的发生发展。本研究显示[20]: AGEs 诱导刺激 HMCs 中 RAGE 高度表达,并上调下游因子 TGF-β1活性。已有研究表明,抑制 TGF-β1表达活性,在一定程度上可减轻和延缓肾脏纤维化进展,对防治DN具有重要意义。
近年来,中药在 DN 治疗方面颇具特色,并取得了一定疗效。GP 是一种名贵的中草药,称之“第二人参”。不断有研究表明,GP 在降血糖及改善糖尿病并发症方面具有明显作用[21]。陶利花等[22]观察了绞股蓝皂苷对糖尿病模型的相关基因表达,发现绞股蓝皂苷可抑制AGEs及RAGE,降低TGF-β1活性,用于糖尿病肾病早期治疗。王雁秋等[23]发现绞股蓝皂苷可抑制糖尿病肾脏VEGF表达,具有保护肾脏的作用。由此可见,绞股蓝皂苷对糖尿病肾病纤维化有一定的抑制作用。
本课题组前期研究发现,GP能抑制AGEs诱导下HMCs增殖及ECM堆积,改善氧化应激水平,延缓DN发展进程[24-25]。进一步研究发现,给予不同剂量GP及阳性药物氨基胍干预后,可明显下调HMCs中RAGE及TGF-β1mRNA及蛋白的异常高表达,且呈浓度依赖性。故可推测 GP 可通过阻断 AGEs-RAGE 信号通路,下调致纤维化因子TGF-β1的表达,从而延缓DN纤维化进程。氨基胍是目前研究中认为作用最强的AGEs抑制剂之一,可阻断AGEs-RAGE信号通路,但因其毒性较大,未能用于临床治疗[26],故作为本实验阳性对照。
目前,GP抗纤维化机制的文献报道多来源于动物实验,关于GP 抗纤维化的基础实验鲜有报道。因此,本实验采用 AGEs 体外培养的HMCs为研究模型,同时给予不同浓度GP进行干预,观察 GP对AGEs诱导下HCMs中RAGE及TGF-β1表达的影响,初步探讨其在延缓DN发生发展中的可能机制。
综上所述,GP可抑制AGEs诱导下HMCs中RAGE的异常表达,同时降低 TGF-β1的活性。由此推测GP可发挥类似于氨基胍的作用,抑制AGEs的形成及阻断AGEs-RAGEs信号通路,并下调致纤维化因子TGF-β1的活性表达,从而延缓肾脏纤维化发展进程,为防治DN发展提供新的策略。此外,GP是否还可通过阻断其它机制,如 NF-κB、PKC等信号通路,从而延缓 DN 纤维化进展,仍待研究证实。本实验仅从体外基础实验论证具有局限性,应结合动物实验及临床实验,为GP 在早期预防及治疗DN 纤维化发展提供更多可靠的理论依据。
(致谢:本实验在桂林医学院科学实验中心完成,感谢实验室老师们对本实验的指导和帮助!)
[1]Xu X, Xiao L, Xiao P, et al. A glimpse of matrix metalloproteinases in diabetic nephropathy[J].CurrMedChem,2014,21(28):3244-60.
[2]Macisaac R J, Ekinci E I, Jerums G. Markers of and risk factors for the development and progression of diabetic kidney disease[J].AmJKidneyDis,2014,63(2 Suppl 2):S39-62.
[3]Matsui T, Nakashima S, Nishino Y, et al. Dipeptidyl peptidase-4 defiCiency protects against experimental diabetic nephropathy partly by blocking the advanced glycation end products-receptor axis[J].LabInvest, 2015, 95(5):525-33.
[4]Singh V P, Bali A, Singh N, Jaggi A S. Advanced glycation endproducts and diabetic complications[J].KoreanJPhysiolPharmacol,2014,18(1):1-14.
[5]Lewis A, Steadman R, Manley P, et al. Diabetic nephropathy,inflammation, hyaluroman and interstitial fibrosis[J].HistolHistopathol,2008,23(6):731-9.
[6]He Q, Li J K, Li F, et al. Mechanism of action of gypenosides on type 2 diabetes and nonalcoholic fatty liver disease in rats[J].WorldJGastroenterol,2015,21(7):2058-66.
[7]Chen D J, Hu H G, Xing S F, et al. Metabolic profiling of Gynostemma pentaphyllum extract in rat serum, urine and faeces after oral administration[J].JChromatogrBAnalytTechnolBiomedLifeSci,2014,969: 42-52.
[8]单岩,马安娜,苗金红. 120例中老年慢性肾病患者生活质量调查及其影响分析[J]. 广东医学,2010,31(20):490-4.
[8]Shan Y, Ma A N, Miao J H. 120 cases of senile patients with chronic kidney disease quality of living survey and impact analysis[J].GuangdongMedJ,2010,31(20):490-4.
[9]Kanwar Y S, Sun L, Xie P, et al. A glimpse of various pathogenetic mechanisms of diabetic nephropathy[J].AnnuRevPathol,2011,6:395-423.
[10]Liu Y. New insights into epithelial-mesenchymal transition in kidney fibrosis[J].JAmSocNephrol,2010,21(2):212-22.
[11]侯绍章,郑芳芳,李媛, 等. 甘草酸对 AGEs 培养肾小球系膜细胞及 ECM 表达的影响[J]. 中国药理学通报,2014,30(5):642-5.
[11]Hou S Z, Zheng F F, Li Y, et al. Effects of glycyrrhizic acid on glomerular mesangial cells and ECM expression induced by AGEs[J].ChinPharmacolBull,2014,30(5):642-5.
[12]Zhang M H, Feng L, Zhu M M, et al. The anti-inflammation effect of Moutan Cortex on advanced glycation end products-induced rat mesangial cells dysfunction and High-glucose-fat diet and streptozotocin-induced diabetic nephropathy rats.[J].JEthnopharmacol,2014,151(1):591-600.
[13]张明华,封亮,顾俊菲,等. 牡丹皮对 AGEs 诱导的系膜细胞增殖及基底膜增厚的影响[J]. 中国中药杂志,2014,39( 3):478-82.
[13]Zhang M H, Feng L,Gu J F, et al. Effect of moutan cortex on AGEs-induced mesangial cell proliferation and basement membrane thickening[J].ChinaJChinMatMed,2014,39(3):478-82.
[14]Merchant M L, Klein J B. Proteomic discovery of diabetic nephropathy biomarkers[J].AdvChronicKidneyDis,2010,17(6):480-6.
[15]Hills C E, Squires P E. The role of TGF-β and epithelial-to mesenchymal transition in diabetic nephropathy[J].CytokineGrowthFactorRev,2011,22(3):131-9.
[16]Shen B, Liu X, Fan Y, Qiu J. Macrophages regulate renal fibrosis through modulating TGF-βsuperfamily signaling[J].Inflammation,2014,37(6):2076-84.
[17]Schnaper H W, Jandeska S, Runyan C E, et al. TGF-beta signal transduction in chronic kidney disease[J].FrontBiosci(LandmarkEd),2009,14:2448-65.
[18]娄凯,何永,魏静,等. 糖肾康中药复方含药血清对高糖环境下RMCs的增殖及TGF-β1/Smad2/3信号通路的影响[J]. 中国中西医结合杂志,2015,35(1):88-92.
[18]Lou K, He Y, Wei J, et al. Effect of tangshenkang granule containing serum on renal mesangial cells’ proliferation and TGF-β1/Smad2/3 pathway in the high glucose condition[J].ChinJIntegrTraditWestMed,2015,35(1):88-92.
[19]李业琼,叶山东,翟丽敏,胡闻. 二甲双胍对2型糖尿病模型大鼠肾组织 AGEs 表达的影响[J]. 中国药理学通报,2016,32(5):703-7.
[19]Li Y Q, Ye S D, Zhai L M, Hu W. Effects of metforminon expression of renal tissue AGEs in type 2 diabetic rats[J].ChinaPharmacolBull,2016,32(5):703-7.
[20]李怀山,张颖丽,吴恩亮,王青青. 普罗布考对早期糖尿病肾病患者炎症反应及纤维化程度的影响[J]. 山东医药,2014,54(29):82-3.
[20]Li H S, Zhang Y L, Wu E L, Wang Q Q. Effect of probucol on inflammation and fibrosis in patients with early diabetic nephropathy[J].ShandongMedJ,2014,54(29):82-3.
[21]刘美玉,刘铜华. 绞股蓝抗糖尿病作用研究进展[J]. 中国中医药信息杂志,2008,15(3):97-8.
[21]Liu M Y, Liu T H. Advances in anti-diabetic effect Gynostemma[J].ChinJInfTraditChinMed,2008,15(3):97-8.
[22]陶利花,黄平,钱康,等. 绞股蓝总皂苷对糖尿病肾病大鼠肾皮质基因表达谱的影响[J]. 中国中西医结合肾病杂志,2007,8(12):718-9.
[22]Tao L H, Huang P, Qian K, et al. Gynostemma total saponins renal cortex gene expression profile of diabetic nephropathy rats[J].ChinJIntegrTraditWestNephrol,2007,8(12):718-9.
[23]王雁秋, 黄平, 邓旻. 绞股蓝总皂苷对糖尿病肾病大鼠nephrin、VEGF表达及肾功能的影响[J]. 浙江中西医结合杂志,2015,25(1):17-9.
[23]Wang Y Q, Huang P, Deng M. Effect of gypenoside on nephrin, VEGF expression and the renal function of diabetic nephropathy rats[J].ZhejiangJIntegrTraditChinWestMed, 2015,25(1):17-9.
[24]唐灵,周康,王艳,张秋艳. 绞股蓝皂苷对AGEs诱导的人肾小球系膜细胞增殖及分泌细胞外基质的影响[J]. 中华中医药杂志,2015,32(12):4478-81.
[24]Tang L,Zhou K,Wang Y ,Zhang Q Y. Influence of gypenosides on the proliferation of HMCs and secretion of extracellular matrixc induced by AGEs[J].ChinaJTraditChinMedPharm,2015,32(12):4478-81.
[25]王艳,唐灵,周康,张秋艳. 绞股蓝皂苷对晚期糖基化终末产物诱导人肾小球系膜细胞晚期糖基化终末产物受体表达及氧化应激水平的影响[J]. 中草药,2015,46(20):3060-4.
[25]Wang Y, Tang L, Zhou K, Zhang Q Y. Effect of gypenosides on RAGE expression and oxidative stress in human mesangial cells induced by AGEs[J].ChinTraditHerbMed,2015,46(20):3060-4.
[26]Luo D, Fan Y, Xu X. The effects of aminoguanidine on retinopathy in STZ-induced diabetic rats[J].BioorgMedChemLett,2012,22(13):4386-90.
Effect of gypenosides on RAGE and TGF-β1expression in human mesangial cells induced by AGEs
ZHANG Qiu-yan,TANG Ling, WANG Yan, ZHOU Kang, ZHANG Hui-yun
(DeptofGeriatrics,theAffiliatedHospitalofGuilinMedicalUniversity,GuilinGuangxi541001,China)
AimTo observe the effect of gypenosides(GP) on the expression of receptor for advanced glycated endproducts(RAGE) and transforming growth factor-β1(TGF-β1) in human mesangial cells(HMCs) induced by AGEs.MethodsHMCs were cultured in DMEM of low glucose containing 15% fetal bovine seruminvitro, which were divided into four groups: the normal group, model group, GP group and positive control group. In addition to the normal group, the other groups were stimulated by AGEs(200 mg·L-1); furthermore, GP group was intervened with different concentrations(25,75,175 mg·L-1) of GP, while control group was given 10 mmol·L-1of aminoguanidine hydrochloride. The expression of RAGE and TGF-β1protein of each group was detected by Western blot; the expression of RAGE and TGF-β1mRNA of each group was detected by RT-PCR. ResultsThe expression of RAGE,TGF-β1protein and mRNA in HMCs induced by AGEs in the model group was significantly higher than that of the normal group(P<0.01); compared with the positive control group(P<0.01), GP could obviously reduce the expression of RAGE,TGF-β1protein and mRNA in a dose-dependent manner.ConclusionGP can reduce the expression of RAGE in HMCs induced by AGEs, block AGEs-RAGE signaling pathway and decrease the expression of the downstream factor TGF-β1, therefore, it plays the role in the resistance of rennal fibrosis in DN.
gypenosides;diabetic nephropathy;human mesangial cells;advanced glycation endproducts;receptor for advanced glycated endproducts;TGF-β1;fibrosis
2016-04-22,
2016-05-26
广西自然科学基金资助项目(No 2013GXNSFAA019197);广西壮族自治区卫计委项目(No Z2016387);桂林市科学研究与技术开发计划项目(No 20120121-1-1)
张秋艳(1990-),女,硕士生,研究方向:糖尿病及其并发症,E-mail:214180720@qq.com;
唐灵(1967-),女,主任医师,硕士生导师,研究方向:糖尿病及其并发症,通讯作者,E-mail: tanglinggem@163.com
10.3969/j.issn.1001-1978.2016.09.022
A
1001-1978(2016)09-1301-06
R284.1;R322.61;R587.2;R692.39;R977.6
网络出版时间:2016-8-23 14:29:00网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160823.1429.044.html
