肺动脉高压时肺血管内皮间质转化相关miRNAs网络调控的生物信息学分析
2016-09-28张卫芳熊爱珍吴卫华祝田田邹小舟胡长平
张卫芳,熊爱珍,吴卫华,祝田田,邹小舟,刘 汀,胡长平
(1.南昌大学第二附属医院药学部,江西 南昌 330006;2. 中南大学药学院药理学系,湖南 长沙 410078;3.湖南医药学院药理学教研室,湖南 怀化 418000)
肺动脉高压时肺血管内皮间质转化相关miRNAs网络调控的生物信息学分析
张卫芳1,2,熊爱珍1,吴卫华3,祝田田2,邹小舟2,刘汀2,胡长平2
(1.南昌大学第二附属医院药学部,江西 南昌330006;2. 中南大学药学院药理学系,湖南 长沙410078;3.湖南医药学院药理学教研室,湖南 怀化418000)
目的探索肺动脉高压(pulmonary hypertension,PH)时肺血管内皮间质转化(EndMT)相关miRNAs及其下游靶点的网络调控。方法利用文献挖掘PH相关基因及EndMT/EMT相关miRNAs。利用Biological General Repository for Interaction Datasets(BioGRID)数据库得到基因相互作用关系。利用生物信息学(DIANA3、Miranda4、PicTar5、TargetScan6、miRDB7和microT-CDS8)预测相应miRNAs的靶基因关系,超几何分析预测与肺动脉高压EndMT相关miRNAs,通过对miRNAs参与功能分区中的情况筛选评分最高的miRNAs并选择部分进行实验验证,利用Cytocape 3软件构建miRNAs与其下游靶点的相互作用网络。结果根据文献挖掘出与PH有关的基因230个,与EndMT/EMT相关miRNAs共189个,对应成熟体322个。其中98个miRNAs可能与PH时EndMT有关。其中,仅有22个miRNAs同时参与了TGF-β/BMP、低氧和炎症3个功能通路,评分最高,分别为miR-let-7家族、miR-124、miR-130家族、miR-135、miR-144、miR-149、miR-155、miR-16-1、miR-17、miR-181家族、miR-182、miR-200家族、miR-204、miR-205、miR-21、miR-224、miR-27、miR-29家族、miR-301a、miR-31、miR-361和miR-375。对let-7g、miR-21、miR-124及miR-130家族进行实时荧光定量PCR验证发现其在低氧诱导PH大鼠肺动脉中表达均明显变化。结论利用生物学信息技术从大量miRNAs中筛选得到的22个miRNAs同时参与TGF-β/BMP、低氧和炎症信号通路,可能与PH时EndMT相关,为后续深入研究PH时EndMT提供了重要的理论依据。
肺动脉高压;miRNAs;内皮间质转化;网络调控;生物信息学;网络药理;相互作用
肺动脉高压(pulmonary hypertension,PH)主要特征为肺动脉阻塞引起肺血管阻力及肺动脉压力渐进性升高,伴随不可逆的肺血管重构,最终导致右心衰竭而死亡[1]。PH时肺血管重构主要表现为内膜增生、中膜肥厚、外膜增生、原位血栓、不同程度的炎症以及丛状动脉样改变[2-3]。PH时重构的肺血管内膜中α-SMA标记的细胞明显增加[1]。传统的观念认为静止的肺动脉平滑肌细胞(pulmonary arterial smooth muscle cell,PASMCs)自身增殖是这些细胞的唯一来源。近期有学者在PH动物模型和患者病变肺血管中发现了内皮细胞间质转化(endothelial-mesenchymal transition, EndMT)的存在,并通过体外实验证实雷帕霉素可抑制各种因素诱导的肺血管EndMT[4-5]。提示,肺血管EndMT是肺血管重构时α-SMA样细胞的另一重要来源。进一步探索PH时肺血管EndMT的病理机制,为寻找防治PH的新靶点和药物具有重要意义。
微小非编码RNA(microRNA,miRNA)是一类存在于真核生物中具有调控功能的非编码小分子单链RNA,大约长度为21~25 nt。大量研究表明其参与生命过程中一系列的重要进程,包括个体发育、器官形成以及细胞增殖、死亡与分化等[6]。众所周知,一个miRNA有多个靶点,一个基因又可被多个miRNAs调控,他们之间往往形成复杂的网络调控机制参与疾病发生发展。因此,通过网络药理学技术探索相互作用网络,而不是单一的研究某个miRNA或基因的功能,能更好地解释miRNA或基因在疾病中的整体作用。
目前研究虽然提示miRNAs在PH的病理生理过程中扮演着重要的角色。但仅发现了少部分miRNAs在PH中起重要作用,且对于这类疾病分子机制的整体功能研究也尚在起步阶段。鉴于PH时肺血管EndMT的机制尚不明确,本文拟运用网络药理学方法探索与PH时肺血管EndMT相关miRNAs及其相关下游靶点的相互作用机制,为后续研究PH时肺血管EndMT的分子机制提供明确的方向及策略。
1 方法
1.1相关文献筛查通过Medline(PubMed)搜索“pulmonary hypertension”,通过此我们寻找到与PH疾病相关的基因,我们称为PH模块。通过进一步切换关键词,包含“pulmonary hypertension”、“microRNA”、“miRNA”、“endothelial to mesenchymal transition”、“epithelial-mesenchymal transition”。搜索得到与PH时EMT/EndMT相关的miRNAs及EMT/EndMT相关的miRNAs。
1.2PH模块网络属性评价从Medline(PubMed)基因数据库中随机选取与PH模块个数相同的蛋白编码基因,作为随机网络模块。随机网络模块重复选取3次。同时将PH模块及随机网络模块中的基因分别通过蛋白质-蛋白质相互作用软件数据库BioGRID(Biological General Repository for Interaction Datasets)数据库得到各自模块基因相互作用关系,并计算各自网络的最大连接组件的“节点数”(largest connected component,LCC)和直接相互作用的“边”(edges)。用Cytocape 3软件做相互作用网络图,孤立的节点不在图上画出。
1.3miRNAs相关靶点分析通过生物信息数据库(DIANA3、Miranda4、PicTar5、TargetScan6、miRDB7和microT-CDS8)进行搜索得到相应miRNAs靶基因关系。
1.4miRNAs富集分析及评分通过miRNAtap9工具包超几何分析列表中每个miRNA的靶基因在PH模块中的富集效应。具体方法为选择PH模块中的230个基因作为基因集合,每个miRNAs预测得到的所有miRNAs为基因列表,以在2个或以上不同靶基因预测数据源中出现过的基因为全部基因背景,四联表卡方分析,采用蒙特卡洛模拟方法计算确切显著性概率值P值。对于在基因集合中出现基因列表中的基因的比例小于随机概率的,P值赋予0.95,即直接认定富集不显著。校正P值计算用到BH(Benjamini Hochberg)方法。通过设定筛选条件[校正P值<0.05, 靶基因在基因集合中富集的基因个数(setsize)≥5]得出与PH时肺血管EndMT相关miRNAs。将参与PH疾病的功能通路主要分为TGF-β、低氧和炎症,通过miRNAs基因靶点所属功能类别进一步对miRNAs进行功能分类评分,筛选出评分较高的miRNAs,并用Cytocape 3软件构建miRNAs-靶点相互作用网络图。
1.5低氧大鼠PH模型建立清洁级Sprague-Dawley(SD)♂大鼠20只,合格号为scxk(湘)2009-0004,体质量180~200 g,适应性喂养1周后称量体质量、标号;按体质量随机分为对照组(n=10)和低氧模型组(n=10)。对照组常氧下(21% O2)饲养;低氧模型组于低氧仓中(10% O2,放有无水氯化钙和钠石灰分别用来吸收水分和CO2)饲养,两组大鼠自由饮水、进食。3周后颈静脉插管分别检测右心室收缩压(right ventricular systolic pressure,RVSP)及肺动脉平均压(mean pulmonary artery pressure, mPAP)以确定造模是否成功。
1.6实时荧光定量PCR肺动脉用液氮磨碎后加TRIzol。根据逆转录试剂盒(TaKaRa)说明书逆转录为cDNA。cDNA经适当稀释后,用SYBR Premix Ex TaqⅡ试剂盒(TaKaRa)进行实时荧光定量PCR。PCR反应条件:95℃ 30 s,(95℃ 5 s,60℃ 31 s)40个循环。内参选用U6,内参及目的miRNAs引物由广州锐博生物有限公司提供。
2 结果
2.1PH模块建立通过Medline(PubMed)搜索pulmonary hypertension(2016年2月14日),共50 307篇文献,寻找到与PH疾病相关的基因共230个,我们将其称为PH模块。将这230个基因通过22个不同功能进行分类并做相互作用关系图(Fig 1A)。图中每个节点表示一个基因,颜色为该基因对应的功能;字体大小表示该节点的度的大小,度越大节点字体越大;每条边的粗细表示该两两基因作用的研究报道支撑多寡,线条越粗则该两两作用在不同研究中报道的次数越多。分别计算PH模块及随机网络模块的网络属性得到PH模块共有195个节点,LCC为76,Edges为727;随机模块LCC为3.7±3,Edges为36.7±3.5。PH模块LCC及Edges显著高于随机网络模块(Fig 1B~C,P<0.01)。表明PH模块具有巨大而稠密的相互关联,是作为筛选相关miRNAs的理想模块。
2.2与PH时EndMT相关的miRNAs通过Medline(PubMed)搜索得到PH时EndMT相关的文献23篇;PH时EndMT相关miRNAs文献0篇;EndMT/EMT有关的miRNAs文献56篇(2016年2月14日)。通过阅读摘要,必要时阅读全文,得到相关miRNAs189个,对应成熟体322个。通过富集分析发现可能与PH时EndMT相关的miRNAs共98个,将其称为“目标miRNAs”(Tab 1)。

Fig 1 The PH-network
2.3对目标miRNAs进行功能分类评分并进行miRNAs-靶点网络构建由于“目标miRNAs”数目较多,为了筛选评分最高的miRNAs,将参与PH疾病的功能通路主要分为TGF-β、低氧和炎症并对得到的目标miRNAs进行功能分类。其中有22个miRNAs同时参与了TGF-β、低氧和炎症3个功能通路,评分最高,它们分别是miR-let-7家族、miR-124、miR-130家族、miR-135、miR-144、miR-149、miR-155、miR-16-1、miR-17、miR-181家族、miR-182、miR-200家族、miR-204、miR-205、miR-21、miR-224、miR-27、miR-29家族、miR-301a、miR-31、miR-361和miR-375(Fig 2)。

Fig 2 A subset of miRNAs previously associated with hypoxia,inflammation and TGF-β is predicted to target PH network

miRNAtargetCntsetSizePvaluePadjustedlet-7a-3p2067450.00010.0021miR-130a-3p1677410.00010.0021miR-130b-3p1680420.00010.0021miR-139-5p401150.00010.0021miR-148a-5p1750400.00010.0021miR-181a-5p1286350.00010.0021miR-181b-5p1259340.00010.0021miR-181c-5p1285350.00010.0021miR-224-5p1476350.00010.0021miR-27a-3p2406490.00010.0021miR-338-5p2368570.00010.0021miR-33a-3p2386540.00010.0021miR-374a-3p1076290.00010.0021miR-42993351510.00010.0021miR-44887641480.00010.0021miR-56885281480.00010.0021miR-589-3p1693390.00010.0021miR-9-3p1819400.00010.0021miR-124-3p2340470.00020.0032miR-144-3p1627370.00020.0032miR-301a-3p1700410.00020.0032miR-320a2574530.00020.0032miR-129-5p2453500.00030.0039miR-135a-5p1497360.00030.0039miR-149-5p1783380.00030.0039miR-302a-5p1797390.00030.0039let-7b-3p2118440.00040.0044miR-106a-3p1086270.00040.0044miR-150-5p1470330.00040.0044miR-106a-5p2273460.00060.0059miR-200b-3p1928400.00060.0059miR-200c-3p1980410.00060.0059miR-33b-5p1032250.00060.0059miR-93-5p1178280.00070.0064miR-148a-3p1460320.00080.0066miR-199a-3p728190.00080.0066miR-506-3p2367460.00080.0066let-7g-3p1960400.00100.0075miR-590-3p4122710.00100.0075miR-126-5p2071410.00120.0084miR-200b-5p811210.00120.0084miR-490-5p442140.00120.0084miR-183-5p1134260.00130.0088let-7f-2-3p891220.00150.0096miR-186-5p3049550.00150.0096miR-17-5p1195270.00170.0106miR-200a-5p875220.00190.0113miR-29c-3p1704350.00200.0117miR-1371465310.00220.0123miR-20b-5p1199270.00220.0123miR-29b-3p1709350.00220.0123miR-19b-1-5p14270.00230.0128miR-29a-3p1703350.00250.0133miR-589-5p984230.00250.0133miR-16-1-3p461140.00260.0135miR-335-3p3510610.00260.0135
续表

miRNAtargetCntsetSizePvaluePadjustedmiR-3751357290.00260.0135miR-103a-3p2346440.00270.0136miR-6123297580.00270.0136miR-205-3p1004230.00310.0151miR-222-3p984220.00390.0178miR-374a-5p2011390.00390.0178miR-185-5p1674330.00430.0192miR-221-3p976220.00450.0196miR-92a-3p1504310.00450.0196miR-2061654330.00460.0197miR-26b-5p1740340.00460.0197miR-155-5p1225260.00470.0200miR-27a-5p736180.00490.0204miR-361-5p1307270.00500.0207miR-204-5p857200.00530.0216miR-9-5p2265420.00550.0222miR-491-5p872200.00570.0229miR-26a-5p1770340.00630.0249miR-34b-5p1307270.00630.0249miR-218-5p995220.00700.0271miR-409-3p726170.00750.0279miR-182-3p389110.00800.0294miR-205-5p1715330.00800.0294miR-1072650470.00810.0296miR-31-3p542140.00820.0297miR-127-5p1684320.00840.0303miR-155-3p557140.00930.0321miR-19b-3p1795340.00930.0321miR-21-5p788180.00930.0321let-7f-1-3p1305260.01050.0352miR-19a-3p1806340.01050.0352miR-204-3p1815340.01070.0353miR-21-3p1169240.01070.0353miR-29a-5p628150.01080.0353miR-590-5p987210.01080.0353let-7a-2-3p796180.01120.0358miR-34c-3p1337260.01320.0415miR-424-5p2959500.01390.0432miR-136-3p648150.01460.0444miR-382-5p1063220.01490.0451miR-424-3p25780.01650.0491
target Cnt: the number of all predicted targets;set size:the number of all predicted targets in PH model
2.4低氧PH模型大鼠构建为进一步验证生物信息学分析所得miRNAs,我们构建了低氧诱导PH大鼠模型,探讨miRNAs在肺动脉中的表达变化。结果显示,低氧模型组大鼠的RVSP及mPAP均显著高于对照组(Fig 3,P<0.01)。提示:低氧PH模型大鼠构建成功。
2.5实时荧光定量PCR验证随机挑选在EMT和PH中作用均肯定的miRNAs 2个(miR-21、miR-124)、只在EMT中作用肯定的miRNAs 1个(let-7g)及只在PH中作用肯定的miRNAs 1个(miR-130家族)进行实时荧光定量PCR初步验证。结果发现与对照组相比,低氧诱导PH大鼠肺动脉中let-7g和miR-124表达明显下调,miR-21、miR-130家族表达明显上调(Fig 4,P<0.05)。进一步提示通过生物信息学预测得到的let-7g、miR-21、miR-124、miR-130家族可能与低氧PH时EndMT有关。
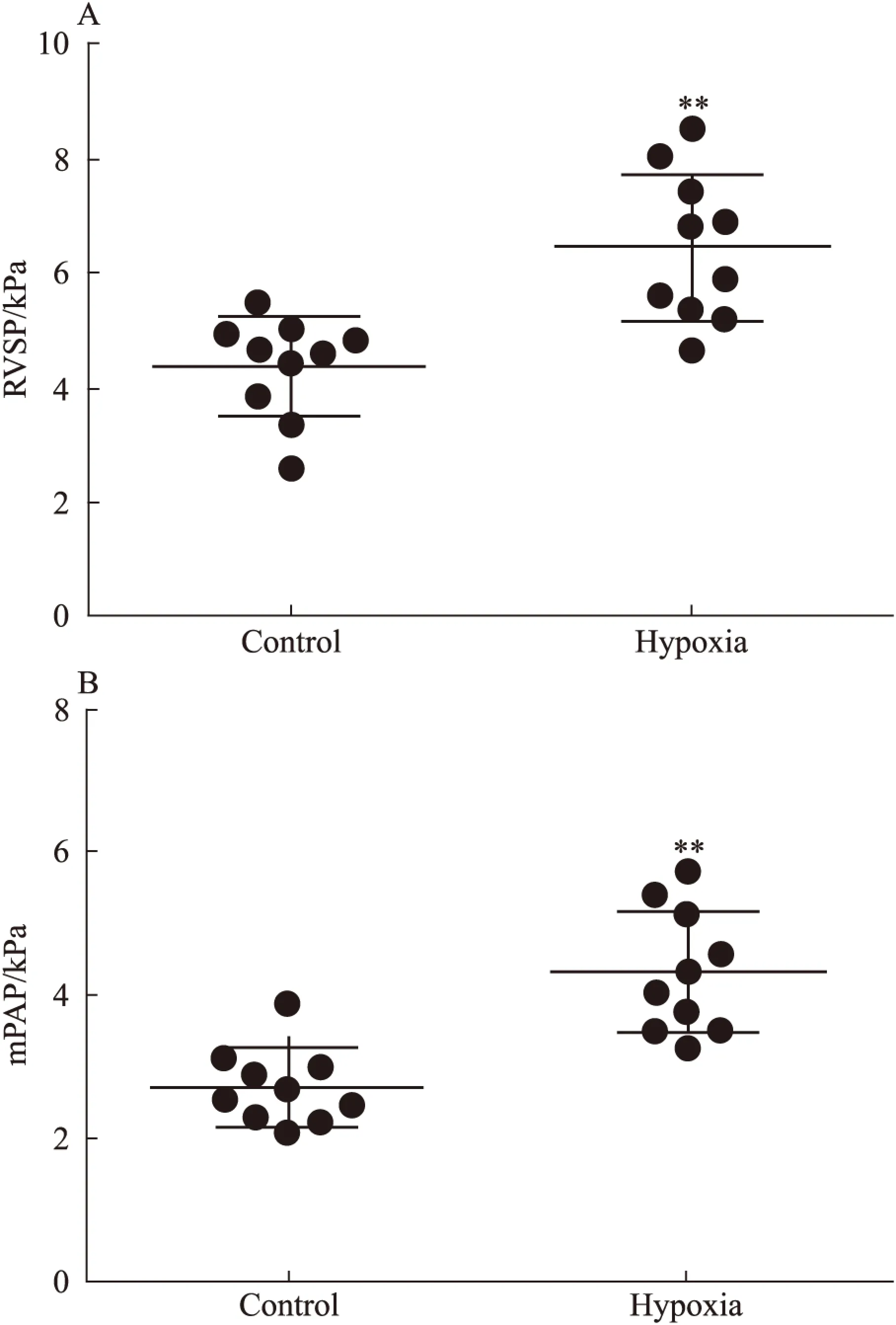
Fig 3 Homodynamic index for hypoxia-induced PH rats(n=10)
**P<0.01vsControl
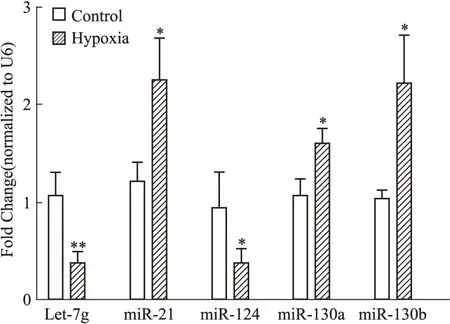
Fig 4 Change of miRNAs in pulmonary artery
*P<0.05,**P<0.01vsControl
2.6miRNAs-靶点网络构建对这22个miRNAs进行miRNAs-靶点(PH网络中的)网络构建,以直观观察该22个miRNAs在PH内皮间质转化中可能发挥的整体作用(Fig 5)。
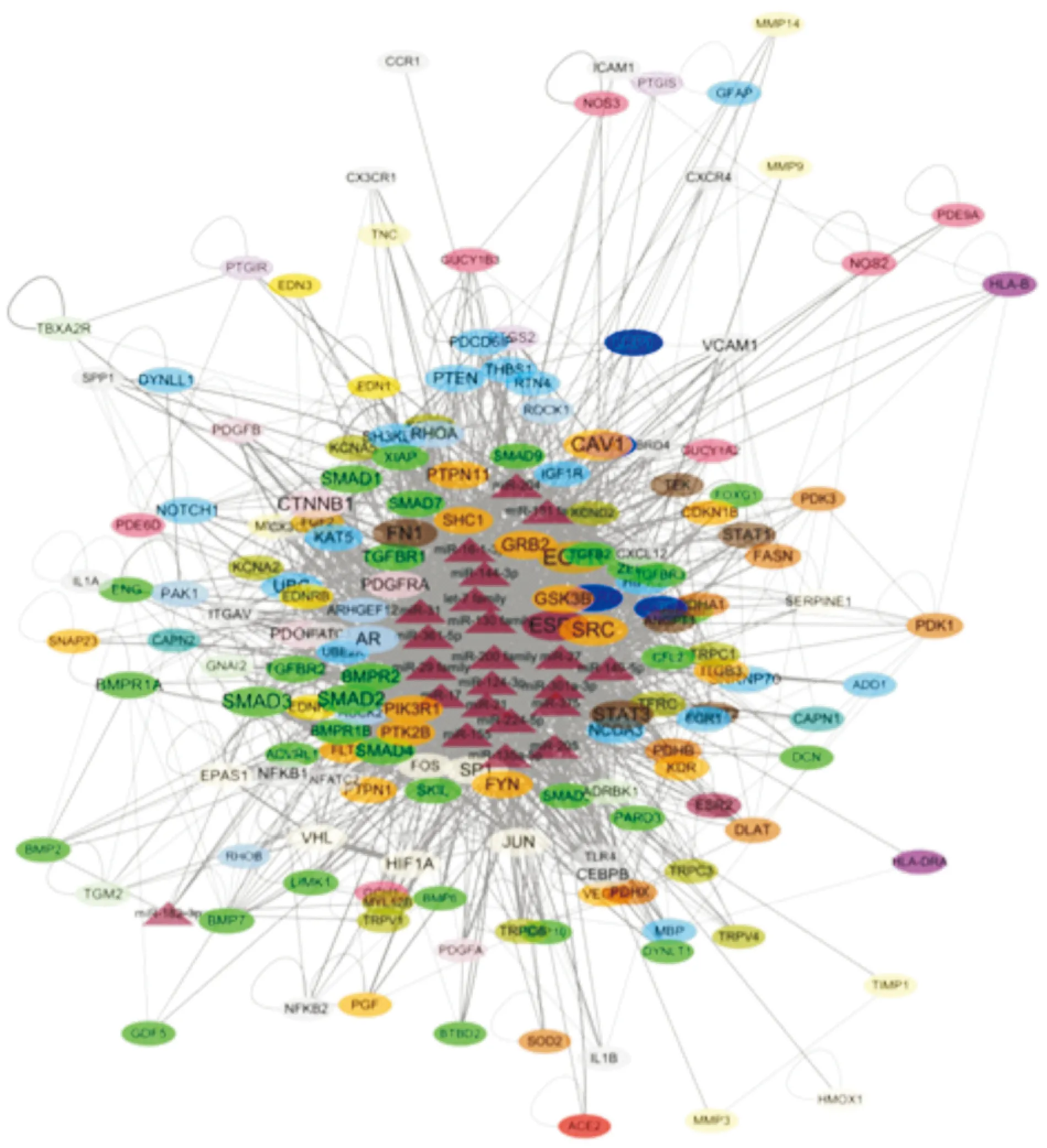
Fig 5 Predicted target network of 22 miRNA groups
3 讨论
EndMT即在外界刺激及体内微环境的影响下,单层内皮细胞间固有的联系遭到破坏,内皮细胞失去原有的表型,获得狭长的间质样及肌成纤维细胞样表型[7]。在EndMT过程中,内皮细胞标志蛋白(VE-cadherin, Tie-1/2, VEGFR1/2, PECAM/CD31)表达明显下调,肌成纤维细胞和平滑肌细胞标志蛋白波形蛋白(vimentin)和α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)表达增加。实验证据提示[8],EndMT在心血管发育(包括肺动脉发育)、各种血管疾病(如动脉粥样硬化和血管再狭窄时内膜增生)以及伤口愈合中发挥重要作用。有学者发现在PH患者的肺动脉内膜中,同时存在着内皮细胞和多功能间质祖细胞,其中肌成纤维细胞在肺动脉内膜增生中发挥重要作用[9];PH患者肺动脉内皮细胞形态发生改变,并且通过标志蛋白的表达检测发现有平滑肌样细胞(即α-SMA标记细胞)和小部分移行细胞(即内皮样细胞标志蛋白和平滑肌样细胞标志蛋白同时出现的细胞)的存在[10]。提示EndMT可促进α-SMA样细胞在病变血管部位聚集从而参与PH时肺血管重构。但PH时肺血管EndMT发生的机制尚不明确。
自2007年英国药理学家Hopkins[11]率先提出“网络药理学”概念后,由于该方法成本较低,并可有效地帮助科研工作者从大数据中缩小范围寻找靶标,显示出重要的理论和实际应用价值。目前被迅速应用于众多领域的研究中,以探索miRNAs和基因在人类疾病中的整体作用。早在2012年便有学者运用网络药理学的方法探索了与PH相关的miRNAs,并最终通过实验证实了miR-21在多种PH模型中表达上调并可通过抑制其靶点RhoB改善PH肺血管重构,延缓病情的发展[12]。本文首次运用网络药理学方法探索与PH时肺血管EndMT相关miRNAs及其相关下游靶点的相互作用机制,并通过实验对部分miRNAs进行实验验证。其中let-7家族属于肿瘤抑制因子,可通过HMGA2抑制多种肿瘤细胞的EMT[13];miR-130可促进多种类型的PH肺血管重构[14];miR-124及miR-21已确证参与了PH的发生发展,且参与了多种细胞的EndMT/EMT。PH时,miRNA124在肺动脉外膜及肺组织中均表达下调,通过多个靶点(NFATc1、CAMTA1、PTBP1)抑制PASMCs的增殖和表型转化及肺动脉成纤维细胞的增殖、迁移和炎症[15-16]。miR-124还可通过多个靶点(CDH2、RHOG)抑制TGF-β或低氧诱导的肺癌细胞[17]及视网膜色素上皮细胞[18]EMT。与其他学者结果一致,我们验证时发现低氧PH时let-7g下调而miR-130上调,这从侧面反映了低氧PH时可能发生了EndMT。而miR-124在低氧诱导的肺动脉中表达下调,提示其可能在PH时具有抑制肺血管EndMT的作用。总之,网络药理学方法不仅可通过生物信息学预测从而为后续的研究提供方向和策略,还可通过探究信号分子在疾病中的整体作用而解释表面看似矛盾的结果。
对于本研究的实验验证,尚存在以下不足。首先,我们通过分子生物学实验验证了部分miRNAs在低氧PH大鼠肺动脉中的表达变化,对于其它miRNAs如何改变未做探讨;其次,我们仅在低氧诱导的PH模型中进行了miRNAs验证而未涉及其他动物模型如野百合碱诱导PH模型,而两种模型代表的PH病理过程有差异;再次,肺动脉由肺动脉内皮细胞、平滑肌细胞及成纤维细胞等多种细胞组成,我们仅检测了miRNAs在肺动脉中的表达变化,故这不足以说明其参与了PH时肺血管EndMT。因此,后续还需在多种动物模型及细胞水平进一步验证这些miRNAs在PH时肺血管EndMT的整体作用及机制。
(致谢:本文实验在中南大学药学院药理学系心血管药理研究室完成。湖南医药学院药理学教研室吴卫华博士以及中南大学药学院药理学系博士生祝田田、邹小舟、刘汀和硕士生葛晓月参与完成本文实验,并协助数据分析。)
[1]Morrell N W, Adnot S, Archer S L, et al. Cellular and molecular basis of pulmonary arterial hypertension[J].JAmCollCardiol, 2009,54(1 Suppl): S20-31.
[2]Crosswhite P, Sun Z. Molecular mechanisms of pulmonary arterial remodeling[J].MolMed, 2014,20:191-201.
[3]Li X W, Hu C P, Wu W H, et al. Inhibitory effect of calcitonin gene-related peptide on hypoxia-induced rat pulmonary artery smooth muscle cells proliferation: Role of ERK1/2 and p27[J].EurJPharmacol, 2012, 679(1-3). 117-26.
[4]Ranchoux B, Antigny F, Rucker-Martin C, et al. Endothelial-to-mesenchymal transition in pulmonary hypertension[J].Circulation, 2015,131(11):1006-18.
[5]Good R B, Gilbane A J, Trinder S L, et al. Endothelial to mesenchymal transition contributes to endothelial dysfunction in pulmonary arterial hypertension[J].AmJPathol, 2015,185(7):1850-8.
[6]He L, Hannon G J. MicroRNAs: small RNAs with a big role in gene regulation[J].NatRevGenet, 2004,5(7):522-31.
[7]Lin F,Wang N,Zhang T C. The role of endothelial-mesenchymal transition in development and pathological process[J].IUBMBLife, 2012, 64(9):717-23.
[8]Arciniegas E, Frid M G, Douglas I S, et al. Perspectives on endothelial-to-mesenchymal transition: potential contribution to vascular remodeling in chronic pulmonary hypertension[J].AmJPhysiolLungCellMolPhysiol, 2007,293(1):L1-8.
[9]Maruoka M, Sakao S, Kantake M, et al. Characterization of myofibroblasts in chronic thromboembolic pulmonary hypertension[J].IntJCardiol, 2012,159(2):119-27.
[10]Sakao S, Hao H, Tanabe N, et al. Endothelial-like cells in chronic thromboembolic pulmonary hypertension: crosstalk with myofibroblast-like cells[J].RespirRes,2011,12:109.
[11]Hopkins A L. Network pharmacology[J].NatBiotechnol, 2007, 25(10):1110-1.
[12]Parikh V N, Jin R C, Rabello S, et al. MicroRNA-21 integrates pathogenic signaling to control pulmonary hypertension: results of a network bioinformatics approach[J].Circulation, 2012,125(12):1520-32.
[13]Ma C, Nong K, Zhu H, et al. H19 promotes pancreatic cancer metastasis by derepressing let-7′s suppression on its target HMGA2-mediated EMT[J].TumourBiol, 2014,35(9):9163-9.
[14]Bertero T, Lu Y, Annis S, et al. Systems-level regulation of microRNA networks by miR-130/301 promotes pulmonary hypertension[J].JClinInvest, 2014,124(8):3514-28.
[15]Kang K, Peng X, Zhang X, et al. MicroRNA-124 suppresses the transactivation of nuclear factor of activated T cells by targeting multiple genes and inhibits the proliferation of pulmonary artery smooth muscle cells[J].JBiolChem, 2013,288(35):25414-27.
[16]Wang D, Zhang H, Li M, et al. MicroRNA-124 controls the proliferative, migratory, and inflammatory phenotype of pulmonary vascular fibroblasts[J].CircRes,2014,114(1):67-78.
[17]Ma T, Zhao Y, Wei K, et al. MicroRNA-124 functions as a tumor suppressor by regulating CDH2 and epithelial-mesenchymal transition in non-small cell lung cancer[J].CellPhysiolBiochem, 2016,38(4):1563-74.
[18]Jun J H, Joo C K. MicroRNA-124 controls transforming growth factor beta1-induced epithelial-mesenchymal transition in the retinal pigment epithelium by targeting RHOG[J].InvestOphthalmolVisSci, 2016,57(1):12-22.
MicroRNAs integrates pathogenic signaling to control endothelial-mesenchymal transition in pulmonary hypertension: results of a network bioinformatic approach
ZHANG Wei-fang1,2, XIONG Ai-zhen1, WU Wei-hua3,ZHU Tian-tian2, ZOU Xiao-zhou2, LIU Ting2, HU Chang-ping2
(1.DeptofPharmacy,theSecondAffiliatedHospitalofNanchangUniversity,Nanchang330006,China;2.DeptofPharmacology,SchoolofPharmaceuticalSciences,CentralSouthUniversity,Changsha410078,China;3.DeptofPharmacology,HunanUniversityofMedicine,HuaihuaHunan418000,China)
AimTo explore micro RNAs-integrated pathogenic signaling to control endothelial-mesenchymal transition(EndMT) in pulmonary hypertension(PH) by a network bioinformatic approach.MethodsLiterature-mining method was used to find PH -related genes and EndMT/EMT-related miRNAs. Bioinformatic prediction approach(DIANA3,Miranda4,PicTar5,TargetScan6,miRDB7 and microT-CDS8) was used for miRNA target prediction. Hypergeometric analysis was used to predict miRNAs related to EndMT in PH. The analysis of interactions between PH-relevant genes(PH network) was performed with the use of Biological General Repository for Interaction Datasets(BioGRID). These miRNAs were ranked with the highest probability of substantial overlap among their gene targets in the PH-network, the relationship between their targets and the PH functional categories which include hypoxia, inflammation, and transforming growth factor/BMP signaling. Then, the part of results was validated by animal experiment. Lastly the miRNA-Target network was built using Cytocape 3.ResultsList of 230 genes was compiled that were directly implicated in the development of PH and 189 miRNAs were related to EndMT in PH. Among 189 miRNAs, only 22 microRNAs(miR-let-7 family, miR-124, miR-130 family, miR-135, miR-144, miR-149, miR-155, miR-16-1, miR-17, miR-181 family, miR-182, miR-200 family, miR-204, miR-205, miR-21, miR-224, miR-27, miR-29 family, miR-301a, miR-31, miR-361 and miR-375) were related to hypoxia, inflammation, and transforming growth factor/BMP signaling. Among these miRNAs, the levels of let-7g, miR-21, miR-124 and miR-130 family were significantly changed in the pulmonary artery in hypoxia-induced PH rats.ConclusionsAmong numerous miRNAs,22 of which may be involved in hypoxia, inflammation, and transforming growth factor/BMP signaling and related to EndMT in PH by network bioinformatic approach, which provides a theoretical basis for further investigation of EndMT in PH.
pulmonary hypertension; miRNAs; EndMT; network regulation; bioinformatics; network pharmacology;interaction
2016-05-23,
2016-06-25
国家自然科学基金资助项目(No 81273512,81473209,91439105,81460010);江西省科技厅青年科学基金(No 20142BAB215035);南昌大学第二附属医院院内课题(No 20142YNQN12018)
张卫芳(1987-),女,博士,研究方向:心血管药理学,E-mail:z_weifang@163.com;
胡长平(1969-),男,教授,博士生导师,研究方向:心血管药理学,通讯作者,E-mail: huchangping@yahoo.com
10.3969/j.issn.1001-1978.2016.09.021
A
1001-1978(2016)09-1294-07
R322.12;R318.04;R329.2;R342.2;R394.2; R544
网络出版时间:2016-8-23 14:29:00网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160823.1429.042.html