EGCG通过miR-33a上调ABCA1表达减少巨噬细胞脂质蓄积
2016-09-28杨红霞蒋恒波刘录山
杨红霞,高 亚,蒋恒波,刘录山
(1.湖南永州职业技术学院,湖南 永州 425000;2 南华大学心血管疾病研究所,湖南 衡阳 421001)
EGCG通过miR-33a上调ABCA1表达减少巨噬细胞脂质蓄积
杨红霞1,高亚2,蒋恒波1,刘录山2
(1.湖南永州职业技术学院,湖南 永州425000;2 南华大学心血管疾病研究所,湖南 衡阳421001)
目的研究EGCG是否通过影响miR-33a的表达,进而调控ABCA1表达,促进巨噬细胞内胆固醇流出。方法先建立THP-1巨噬细胞源性泡沫细胞,然后用EGCG处理,Real time PCR检测细胞miR-33a表达。细胞随机分为3组:空白对照组、50 μmol·L-1EGCG处理组、50 μmol·L-1EGCG+80 nmol·L-1miR-33a mimic处理组,Real time PCR和Werstern blot检测细胞ABCA1 mRNA和蛋白表达,油红O 染色和高效液相色谱法检测细胞内脂质含量,[3H]法检测细胞内胆固醇流出。结果在不影响细胞活性状况下,EGCG呈浓度和时间依赖性下调miRNA33a表达;EGCG能明显上调ABCA1 mRNA 和蛋白的表达,但能被转染miRNA33 mimic抑制;EGCG可减少THP-1 巨噬细胞源性泡沫细胞中的脂质蓄积,但能被细胞中转染miRNA33 mimic所弱化;EGCG减少细胞内胆固醇蓄积是与其促进细胞内胆固醇流出有关,细胞中转入过量miRNA33a可以抑制胆固醇流出。结论EGCG可通过减少miRNA33a的生成,进而上调ABCA1表达,促进巨噬细胞中胆固醇流出,这可能是EGCG抗动脉粥样硬化作用的分子机制之一。
三磷酸腺苷结合盒A1;小分子RNA;巨噬细胞;表没食子儿茶素没食子酸酯;泡沫细胞;脂质代谢
MicroRNAs(miRNAs)是一类高度保守的非编码小RNA,主要通过与靶标基因的3′非翻译区(3′UTR)靶向结合,直接降解靶基因的mRNA或抑制蛋白质翻译而调控基因的表达。目前,miRNAs在脂质代谢中的调节作用日益得到重视,miR-33a位于固醇调节元件结合蛋白-2(sterol regulatory element binding protein-2,SREBP-2)基因的第16位内含子中,在哺乳动物体内高度保守,其主要靶基因是三磷酸腺苷结合盒A1(ATP binding cassette transporter A1, ABCA1)[1]。ABCA1是介导细胞胆固醇流出的主要膜转运体,研究表明,miR-33a可抑制ABCA1表达,减少细胞内胆固醇流出,导致泡沫细胞的形成[1-2]。
表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate,EGCG)是绿茶中的一种主要活性成分,对动脉粥样硬化、糖尿病、肿瘤[3]等多种疾病均具有明显的药理作用。研究表明,EGCG可通过调节脂质代谢而抑制动脉粥样硬化的发展[4-5]。近来研究也发现EGCG可上调巨噬细胞ABCA1表达抑制泡沫细胞形成[6],但miR-33a是否在其中发挥作用尚不清楚。因此,本研究观察EGCG是否影响THP-1 巨噬细胞源性泡沫细胞miR-33a的表达,并探讨miR-33a在EGCG上调巨噬细胞ABCA1表达抑制泡沫细胞形成中的作用,从而为动脉粥样硬化的防治提供新的策略。
1 材料与方法
1.1细胞及主要试剂THP-1细胞购自中国科学院上海生科院细胞资源中心; miR-33a 模拟物(miR-33a mimic)购自广州锐博公司;EGCG、ABCA1 兔抗人一抗以及佛波酯(phorbol myristate acetate,PMA)购自Sigma 公司;GAPDH和辣根过氧化物酶标记的羊抗兔二抗购自杭州贤致公司;总RNA 抽提试剂盒购自Invitrogen 公司,SYBR Master Mixture购自TAKARA公司,RNA 逆转录试剂盒购自Promega 公司,BCA 蛋白定量试剂盒、Western blot 荧光检测试剂盒为江苏碧云天公司产品,oxLDL购自广州奕源生物科技有限公司,其余试剂为国产或进口分析纯。
1.2细胞培养THP-1细胞160 nmol·L-1的PMA处理24 h,使其诱导分化为巨噬细胞,再用50 mg·L-1oxLDL孵育使其变成泡沫细胞作为实验模型。THP-1 巨噬细胞源性泡沫细胞换无血清培养基培养后加按照实验设计加处理因素。
1.3Real time PCR检测细胞miR-33a表达用不同浓度EGCG(0、12.5、25、50 μmol·L-1)处理THP-1 巨噬细胞源性泡沫细胞24 h,或用50 μmol·L-1的EGCG处理THP-1 巨噬细胞源性泡沫细胞不同时间(0、6、12、24 h),提取细胞RNA。miR-33a检测引物由广州锐博设计合成,上游引物为: 5′-GUGCAUUGUAGUUGCAUUG-3′,下游引物miScript 通用引物。 PCR条件为: 95℃ 10 min,95℃ 15 s,60℃ 1 min,共40个循环,设U6为内参,其相对表达量采用△△CT法计算。
1.4Real time PCR检测细胞ABCA1 mRNA表达细胞随机分为3组:空白对照组、50 μmol·L-1EGCG处理组、50 μmol·L-1EGCG+80 nmol·L-1miR-33a mimic处理组,处理24 h后,提取细胞RNA。ABCA1上游引物为: 5′-GGTTTG GAGATGGTTATACAATAGTTGT-3′, 下游引物为: 5′-CCCGGAAACGCAAGTCC-3′。采用SYBR绿色荧光检测试剂盒进行Real time PCR分析。β-actin的表达用做内参照,其相对表达量采用△△CT 法计算。
1.5Werstern blot检测细胞ABCA1 蛋白表达细胞分3组同1.4,处理24 h后收集细胞,加入裂解液,冰浴中放置30 min,4℃离心10 min,收集上清液备用。上清液中按4 ∶1加入5×SDS凝胶加样缓冲液,100℃孵育10 min。10% SDS聚丙烯酰胺凝胶电泳分离,12 V恒压半干转膜40 min后,丽春红染色5 min观察转膜情况。5%脱脂牛奶封闭2 h,按1 ∶ 500加入兔抗人ABCA1 一抗,4℃孵育12 h,TBST 洗3次,1 ∶1 000加入辣根过氧化物酶标记的小鼠抗兔二抗,室温孵育2 h,TBST洗3次,用Tanon 5500免疫荧光检测系统激发荧光,Tanon软件摄取图像并分析结果。
1.6油红O染色检测细胞内脂质含量取出预置盖玻片,PBS液洗涤3次,用4%多聚甲醛固定10 min,油红O染液染色10 min,再用苏木精染色5 min,10 mL·L-1HCl分色及返蓝,双蒸水冲洗后甘油明胶封片。倒置显微镜下观察,可见细胞内脂质呈红染,细胞核呈蓝染。
1.7高效液相色谱法检测细胞内胆固醇含量参照文献方法,收集细胞,加入生理盐水200 μL,冰浴中超声破碎细胞,用BCA 法测定蛋白含量后,加入三氯乙酸(6%)沉淀并去除蛋白,取上清进行胆固醇检测。取100 μL上清液,加入氢氧化钾溶液(8.9 mol/L) 200 μL,水解胆固醇酯后作为细胞内总胆固醇待测样品。将样品分别与内标液(豆甾醇)混匀,在用正己烷 ∶异丙醇(3 ∶2 ,V/V)溶液和无水乙醇抽提后真空干燥。上样前用100 μL乙晴-异丙醇(70 ∶30,V/V) 溶解样品,采用C-18 柱,温度为室温,流速1 mL·min-1,检测波长为250 nm,以峰面积定量胆固醇,内标校准,以mg·g-1细胞蛋白为单位。
1.8[3H]法检测细胞内胆固醇流出细胞先在正常培养液中和7.4 μGBq×103/L[3H]胆固醇共同孵育24 h,用PBS液洗涤细胞后置含脂蛋白的无血清培养液中再培养24 h。PBS 液漂洗细胞3次,加入闪烁液裂解细胞,用液闪计数法检测培养液和细胞中的[3H]胆固醇含量。胆固醇流出率=培养液中cpm+总cpm(培养液cpm+细胞cpm)×100%。
2 结果
2.1EGCG对THP-1巨噬细胞毒性的观察分别用0、12.5、25、50、100 μmol·L-1的EGCG处理THP-1 巨噬细胞24 h。采用MTT法检测细胞活力,结果显示,与0 μmol·L-1EGCG处理组相比,12.5~100 μmol·L-1EGCG各处理组细胞活力无明显差异(Fig 1),表明100 μmol·L-1浓度内的EGCG对THP-1巨噬细胞没有明显毒性。本研究后续实验中采用12.5、25、50 μmol·L-1的EGCG作为细胞处理浓度。
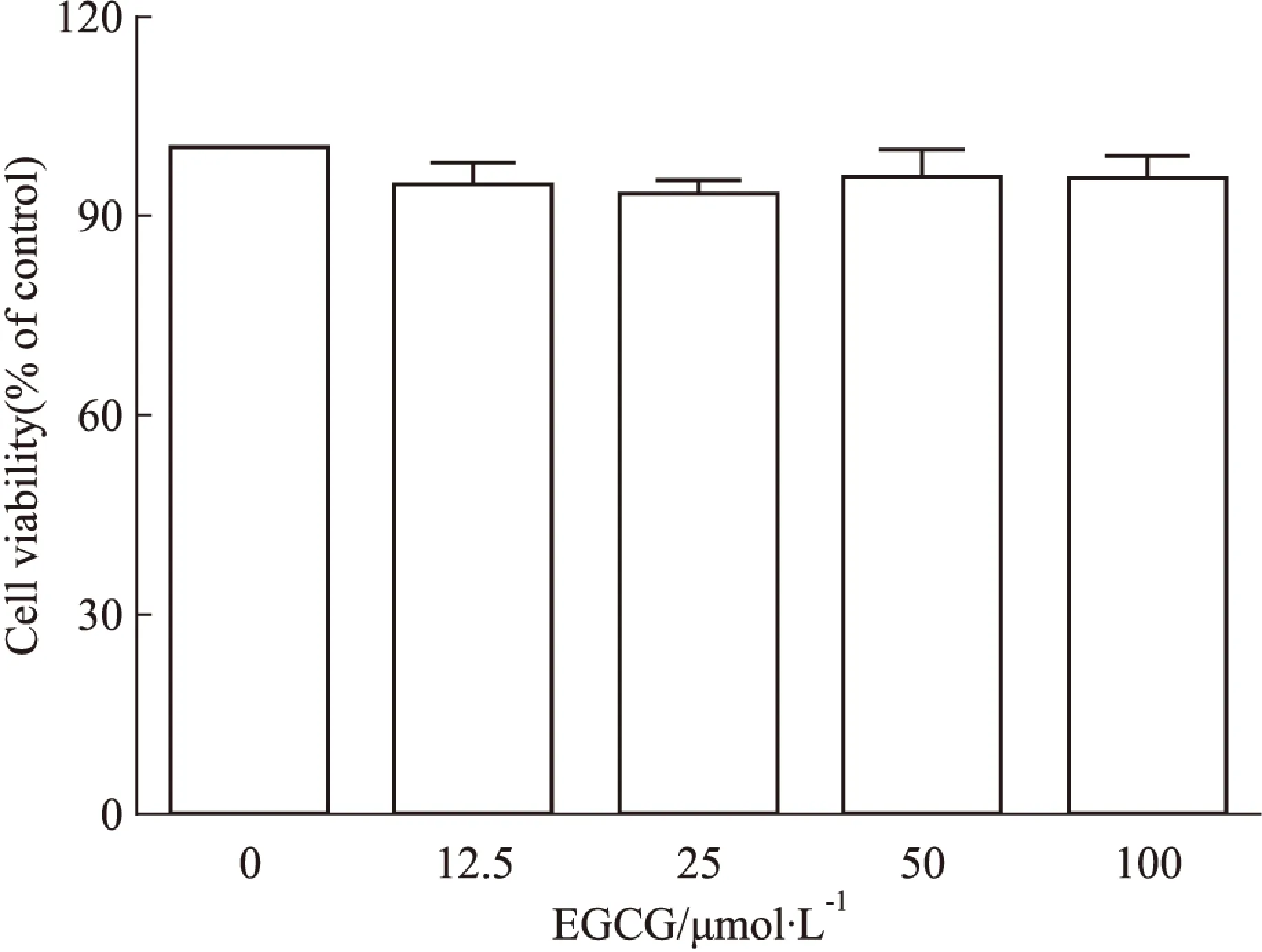
Fig 1 Influence of different concentrations of EGCG on THP-1 macrophage viability after treatment 24 hours
2.2EGCG 对THP-1巨噬细胞源性泡沫细胞miR-33a表达的影响0、12.5、25、50 μmol·L-1的EGCG处理THP-1巨噬细胞源性泡沫细胞24 h,Real time PCR检测结果显示,25、50 μmol ·L-1的EGCG处理后,细胞中miR-33a表达均下调(P<0.05),50 μmol·L-1EGCG处理组下调最为明显(Fig 2)。随后,用50 μmol·L-1的EGCG处理THP-1巨噬细胞源性泡沫细胞不同时间,Real time PCR检测结果显示,与0 h组相比,处理12 h组细胞miR-33a表达出现下调(P<0.05),处理24 h组细胞miR-33a表达下调更为明显(Fig 3)。

Fig 2 Influence of different concentrations of EGCG on miR-33a expression of THP-1
*P<0.05vs0 μmol·L-1EGCG treatment group
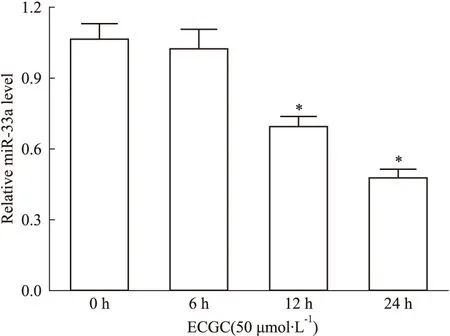
Fig 3 Influence of 50 μmol·L-1 EGCG on miR-33a expression of THP-1 macrophage-derived foam cells in different time point
*P<0.05vs0 h treatment group
2.3miR-33a在EGCG上调THP-1巨噬细胞源性泡沫细胞ABCA1表达中的作用细胞随机分为3组:空白对照组、50 μmol·L-1EGCG处理、50 μmol·L-1EGCG+80 nmol·L-1miR-33a mimic处理组,处理24 h后,分别提取细胞RNA和蛋白质,采用Real time PCR以及Western blot检测。Fig 4和Fig 5结果显示,与空白对照组相比,50 μmol·L-1EGCG处理组细胞ABCA1 mRNA和蛋白质均明显上调(P<0.05);而50 μmol·L-1EGCG+80 nmol·L-1miR-33a mimic处理组与50 μmol·L-1EGCG单独处理组相比,细胞ABCA1 mRNA和蛋白质均明显下调(P<0.05)。这提示使THP-1 巨噬细胞源性泡沫细胞miR-33a过表达后,EGCG 上调细胞ABCA1表达的作用被明显抑制。
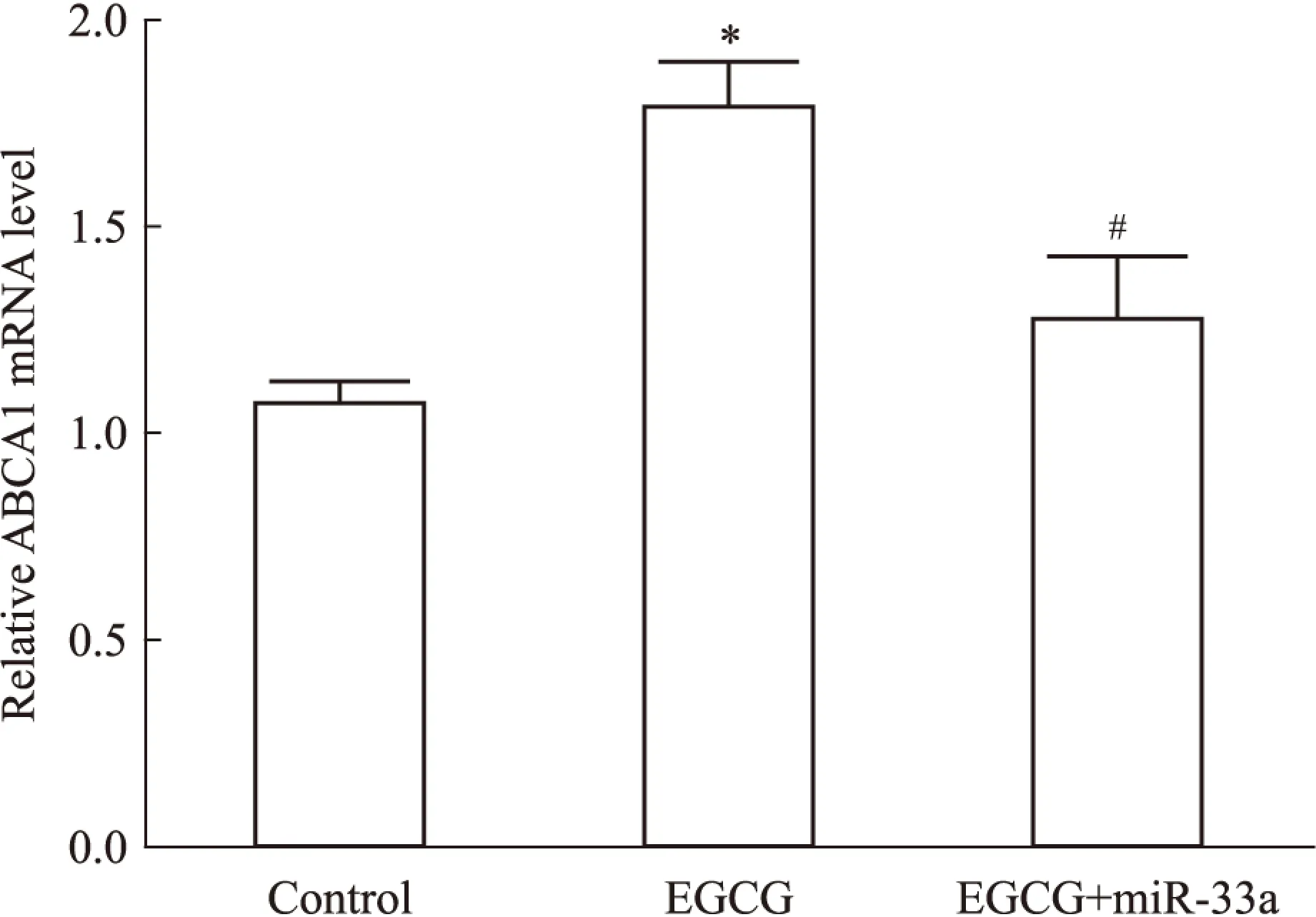
Fig 4 Influence of miR-33a on EGCG increasing ABCA1 mRNA expression of THP-1 macrophage-derived foam cells
*P<0.05vscontrol;#P<0.05vsEGCG treatment group
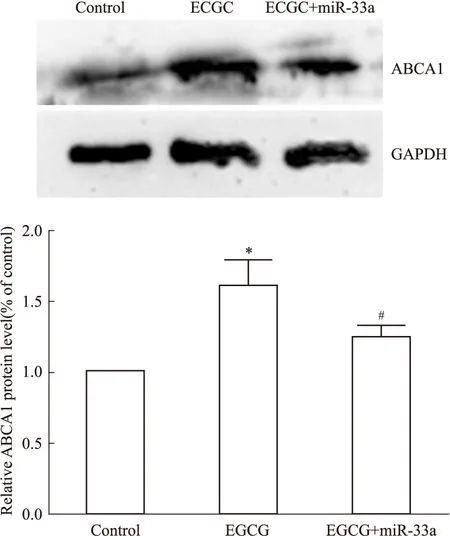
Fig 5 Influence of miR-33a on EGCG increasing ABCA1 protein expression of THP-1 macrophage-derived foam cells
*P<0.05vscontrol;#P<0.05vsEGCG treatment group
2.4miR-33a在EGCG减少THP-1巨噬细胞源性泡沫细胞脂质蓄积中的作用油红O结果显示,与空白对照组相比,50 μmol·L-1EGCG处理组细胞内红色脂滴明显减少,而加入80 nmol·L-1miR-33a mimic共同处理后,细胞内的红色脂滴又明显增多(Fig 6)。HPLC检测结果显示,与空白对照组比较,50 μmol·L-1EGCG处理组细胞内总胆固醇、游离胆固醇、胆固醇酯均明显减少;而50 μmol·L-1EGCG+80 nmol·L-1miR-33a mimic处理组与50 μmol·L-1EGCG单独处理组相比,细胞内总胆固醇、游离胆固醇、胆固醇酯的含量则明显增加(Tab 1)。
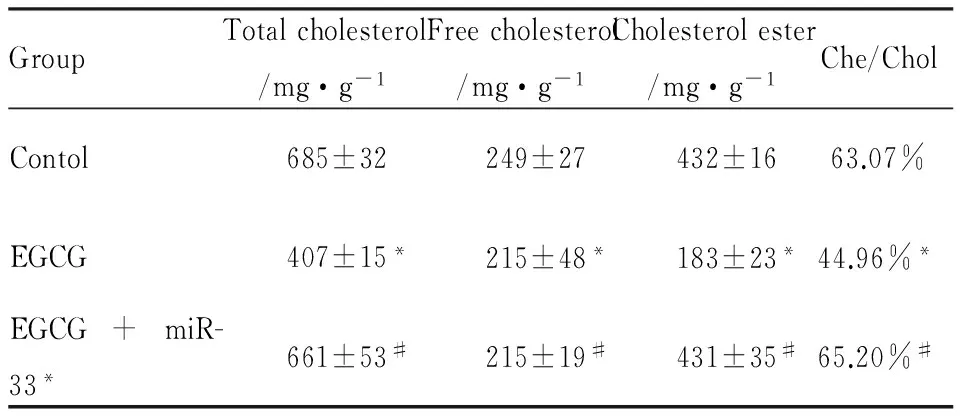
Tab 1 Influence of miR-33a on EGCG reducing cholesterol content within THP-1 macrophage-derived foam cells(n=3)
*P<0.05vscontrol;#P<0.05vsEGCG treatment group
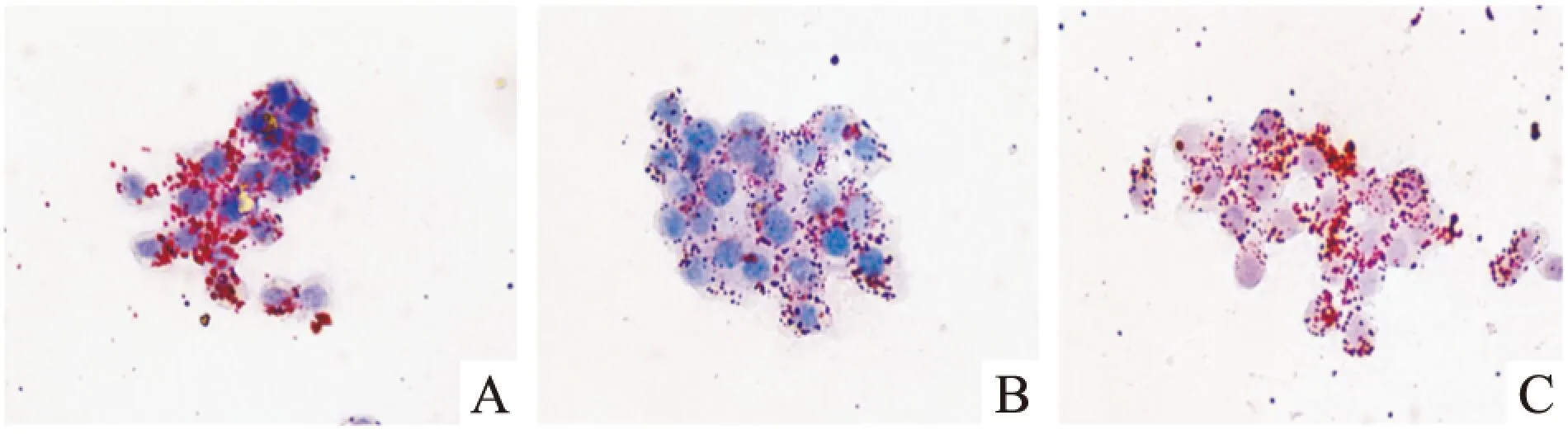
Fig 6 Influence of miR-33a on EGCG reducing lipid droplets impact within THP-1 macrophage-derived foam cells
A:Control;B:EGCG;C:EGCG+miR-33a
2.5miR-33a在EGCG促THP-1巨噬细胞源性泡沫胆固醇流出中的作用Fig 7结果显示,与空白对照组相比,50 μmol·L-1EGCG处理使细胞胆固醇流出明显增加(P<0.05)。而加入80 nmol·L-1miR-33a mimic共同处理细胞后,EGCG促胆固醇流出作用被明显抑制(P<0.05)。

Fig 7 Influence of miR-33a on EGCG promoting cholesterol efflux from THP-1 macrophage-derived foam cells
*P<0.05vscontrol;#P<0.05vsEGCG treatment group
3 讨论
绿茶是中国传统的保健养生饮品,茶多酚是绿茶中最主要的生物活性成分,主要由儿茶素、花色素、黄酮类和酚酸类4种物质组成[7]。EGCG是茶叶中含量最多的儿茶素,具有多种药理学作用,其中就包括抗动脉粥样硬化作用。EGCG抗动脉粥样硬化作用的主要机制包括[7-8]:在肠道内和胆固醇形成沉淀物,并抑制肠道内酶的作用,二者共同降低肠道胆固醇的吸收;具有较强的抗低密度脂蛋白氧化作用,而氧化低密度脂蛋白是促使动脉粥样硬化发生的关键因素。最近有研究[6]报道EGCG还可以上调巨噬细胞ABCA1的表达促进细胞内胆固醇流出,抑制巨噬细胞源性泡沫细胞形成,有可能是EGCG抗动脉粥样硬化的一个新机制。但EGCG调节ABCA1表达的分子机制有待进一步阐释。
miRNA与mRNA结合后诱导后者降解是新发现的一种调节基因表达的重要分子机制,miRNA介导的基因表达是机体内一个广泛存在的基因表达调控方式,涉及到诸多生理过程和病理过程。其中miRNA调节脂质代谢相关基因表达是目前脂质代谢研究领域的一个热点。目前已知参与脂质代谢基因表达调控的miRNAs包括miR-33、miR-122、miR-27a、miR-27b、miR-144和miR-370等,靶基因包括ABCA1、NPC1、ABCG1、SREBP和PPARγ等[9]。其中miRNA33通过调控ABCA1表达,影响胆固醇逆向转运在脂质代谢中发挥重要作用。
miRNA在调节别的基因表达的同时,其自身的产生也受到内源性和外源性因素的调控。近来,一些天然化合物如姜黄素、白藜芦醇、异黄酮、番茄素和EGCG等[10]被报道能够调节miRNAs的表达。其中包括EGCG通过调节miRNA16进而调节Bcl-1抑制细胞凋亡,但未见EGCG对miRNA33a表达调节的报道,EGCG是否是通过调控miRNA 33a,进而调节ABCA1表达发挥抗动脉粥样硬化作用呢?
我们的研究表明,在不影响细胞活性状况下,EGCG呈浓度和时间依赖性下调miRNA33a表达,EGCG能明显上调ABCA1 mRNA 和蛋白的表达,且这种上调作用能被过表达miRNA33a所弱化,表明EGCG确实可通过抑制miRNA33a的生成上调ABCA1表达。进一步的研究证实,EGCG可减少THP-1 巨噬细胞源性泡沫细胞中的脂质蓄积,且这种作用也可被细胞中转入过量miRNA33a所弱化。细胞内胆固醇流出实验证明,EGCG减少细胞内胆固醇蓄积是与其促进细胞内胆固醇流出有关,细胞中转入过量miRNA33a可以抑制胆固醇流出。这和上述的EGCG促进了细胞内胆固醇流出关键蛋白ABCA1表达相一致。
综上所述,我们的研究结果发现,EGCG是通过减少miRNA33a的生成,进而上调ABCA1表达,促进巨噬细胞中胆固醇流出,这可能是EGCG抗动脉粥样硬化作用的分子机制。但很显然,EGCG是否还可以通过调节其它miRNAs的表达,进而调节ABCA1表达,影响巨噬细胞胆固醇代谢有待进一步研究。
(致谢:本文部分工作在南华大学心血管疾病研究所完成,特此感谢!)
[1]Rayner K J, Suarez Y, Davalos A, et al. MiR-33 contributes to the regulation of cholesterol homeostasis[J].Science,2010, 328(5985): 1570-3.
[2]Mao M, Lei H, Liu Q, et al. Effects of miR-33a-5P on ABCA1/G1-mediated cholesterol efflux under inflammatory stress in THP-1 macrophages[J].PLoSOne,2014, 9(10):e109722.
[3]魏芳,刘浩,张配,等.EGCG对三阴乳腺癌细胞MDA-MB231的增殖抑制作用及机制[J].中国药理学通报,2013,29(5):280-4.
[3]Wei F,Liu H,Zhang P, et al. The inhibitory action of EGCG on the proliferation in the triple-negative breast cancer cell MDA-MB231 and its mechanism[J].ChinPharmacolBull, 2013 , 29(5):280-4.
[4]Hong Z, Xu Y, Yin J F, et al. Improving the effectiveness of (-)-epigallocatechin gallate(EGCG) against rabbit atherosclerosis by EGCG-loaded nanoparticles prepared from chitosan and polyaspartic acid[J].JAgricFoodChem,2014,62(52):12603-9.
[5]Xu X, Pan J, Zhou X.Amelioration of lipid profile and level of antioxidant activities by epigallocatechin-gallate in a rat model of atherogenesis[J].HeartLungCirc,2014,23(12):1194-201.
[6]Jiang J, Mo Z C, Yin K, et al. Epigallocatechin-3-gallate prevents TNF-α-induced NF-κB activation thereby upregulating ABCA1 via the Nrf2/Keap1 pathway in macrophage foam cells[J].IntJMolMed,2012,29(5):946-56.
[7]葛建,林芳,李明揆,等.表没食子儿茶素没食子酸酯(EGCG)生物活性研究进展[J].安徽农业大学学报,2011,38(2):156-63.
[7]Ge J, Lin F, Li M K, et al. Research progress on biological activity of epigallocatechin-3-gallate(EGCG)[J].JAnhuiAgricUniver, 2011,38(2):156-63.
[8]唐伟军,陈美芳,江俊麟,等.表没食子儿茶素没食子酸酯对低密度脂蛋白诱导的血管内皮损伤的保护作用[J].中国动脉硬化杂志,2006,14(1):21-4.
[8]Tang W J, Chen M F, Jiang J L, et al. Epigallocatechin gallate preventing low density lipoprotein-induced endothelial dysfunction[J].ChinJArterioscler, 2006,14(1):21-4.
[9]Novák J,Bienertová-Vaškü J,Kára T,NoVák M.MicroRNAs involved in the lipid metabolism and their possible implications for atherosclerosis development and treatment[J].MediatorsInflamm,2014,2014:275867.
[10]Li Y, Kong D, Wang Z, et al. Regulation of microRNAs by natural agents: an emerging field in chemoprevention and chemotherapy research[J].PharmRes,2010;27(6):1027-41.
EGCG upregulated ABCA1 expression by decreasing miR-33a generation to reduce lipid accumulation of macrophage-derived foam cells
YANG Hong-xia1,GAO Ya2, JIANG Heng-bo1,Liu Lu-shan2
(1.HunanYongzhouVocationalTechnicalCollege,YongzhouHunan425000,China;2.InstituteofCardiovascularDiseases,UniversityofSouthChina,HengyangHunan421001,China)
AimTo investigate whether EGCG regulates ABCA1 expression by influencing the expression of miR-33a to promote cholesterol efflux from macrophages.MethodsTHP-1 macrophage-derived foam cells were established by co-incubated with oxLDL, and then treated with EGCG, and miR-33a expression was detected with Real-time PCR. THP-1 macrophage-derived foam cells were randomly divided into the following groups: control group, 50 μmol·L-1EGCG treatment group, 50 μmol·L-1EGCG+80 nmol·L-1miR-33a mimic treated group. Real-time PCR and Werstern blot was used to detect ABCA1 mRNA and protein expression, Oil Red O staining and high performance liquid chromatography were used to detect intracellular lipid content, and [3H] assay was used to determine cellular cholesterol efflux.ResultsEGCG could downregulate miRNA33a expression in a dose-and time-dependent fashion within safe doses. EGCG significantly upregulated ABCA1 mRNA and protein expression, which could be inhibited after miRNA33 mimic transfected into cells, however. EGCG may reduce lipid accumulation in THP-1 macrophage-derived
ABCA1; microRNA; macrophage; EGCG; foam cell; lipid metabolism
2016-04-10,
2016-06-12
生物流变科学与技术教育部重点实验室开放基金课题(No CQKLBST-2014-002)
杨红霞(1980-),女,硕士,副教授,研究方向:心血管药理,E-mail:13574696288@163.com;
高亚(1990-),女,硕士生,研究方向:心血管疾病发病机制与防治;
10.3969/j.issn.1001-1978.2016.09.018
A
1001-1978(2016)09-1279-06
R282.71;R329.24;R342.22;R344.81;R543.5
网络出版时间:2016-8-23 14:29:00网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160823.1429.036.html
刘录山(1974-),男,博士,教授,硕士生导师,研究方向:心血管疾病发病机制与防治,E-mail:liuls2000@163.com
foam cells, and this effect could also be weakened after miRNA33 mimic transfected. EGCG could reduce the accumulation of intracellular cholesterol,which was related with EGCG promoting intracellular cholesterol efflux, and excess miRNA33a transfected into cells could inhibit intracellular cholesterol efflux.ConclusionEGCG may upregulate ABCA1 expression by reducing miRNA33a generation, resulting in the promotion of cholesterol efflux from macrophages, which may be one of the molecular mechanisms of EGCG anti-atherosclerotic effect.
