希森美康试剂和罗氏试剂检测乙肝表面抗原的比较
2016-09-28卢新杨海珊黄雁翔魏飞力陈德喜
卢新 杨海珊 黄雁翔 魏飞力 陈德喜
100080 北京市海淀区妇幼保健院检验科(卢新、杨海珊);100069 北京,首都医科大学附属北京佑安医院 北京市肝病研究所(黄雁翔、魏飞力、陈德喜)
·技术方法·
希森美康试剂和罗氏试剂检测乙肝表面抗原的比较
卢新杨海珊黄雁翔魏飞力陈德喜
100080 北京市海淀区妇幼保健院检验科(卢新、杨海珊);100069 北京,首都医科大学附属北京佑安医院 北京市肝病研究所(黄雁翔、魏飞力、陈德喜)
目的 评估希森美康试剂定量检测乙肝表面抗原(Hepatitis B surface antigen,HBsAg)结果的重复性和罗氏试剂的相关性。方法收集580例血清标本,用希森美康HISCL HBsAg试剂盒和罗氏Elecsys HBsAg Ⅱquant试剂盒进行检测,用统计学方法分析检测结果的相关性,通过与罗氏试剂检测结果比较,对希森美康试剂的特异性、敏感性和抗干扰物质能力进行评估。结果希森美康试剂检测HBsAg 的批内变异系数(coefficients of variation,CV)<5.0%,批间CV≤5.5%。238例标本用希森美康试剂重复检测,符合率100%,其中174例HBsAg阳性标本重复检测 HBsAg结果相关性r=0.999,P<0.01。122例正常对照组两种试剂检测HBsAg均为阴性,符合率100%。287例HBsAg标本阳性希森美康与罗氏试剂检测HBsAg结果的相关性r=0.996,P<0.01。对含有可疑干扰物的标本,两种试剂检测结果相近(孕妇和婴儿r=0.992,P=0.000;各种病毒或梅毒感染r=0.995,P=0.000;抗病毒药物r=0.994,P=0.000;HBV基因变异耐药r=0.998,P=0.000;抗核抗体及类风湿因子r=0.997,P=0.000)。结论希森美康试剂检测HBsAg结果的重复性佳,与罗氏试剂具有良好的相关性。
【主题词】肝炎表面抗原, 乙型;相关性;符合率
乙型肝炎病毒(hepatitis B virus,HBV)感染是全世界的健康问题,据世界卫生组织报道,全球约有3.5亿慢性HBV感染者,其中因肝衰竭、肝硬化和肝细胞癌死亡的每年约有100万人[1]。我国现有慢性乙型肝炎患者约2 000万例,因此研究HBV检测技术,评估HBV诊断试剂敏感性对改善HBV感染的诊断和治疗尤为重要[2]。乙肝表面抗原(Hepatitis B surface antigen,HBsAg) 在血液中的水平能充分反映HBV感染复制的活跃程度,它的水平在监测乙型肝炎药物治疗效果和预后判断方面具有至关重要作用[3],为此,我们选取了德国罗氏HBsAgⅡquant试剂盒、应用罗氏Cobas e601型全自动电化学发光免疫分析系统和日本希森美康HISCL HBsAg试剂盒、希森美康HISCL-2000i全自动免疫检测系统,分别检测HBsAg, 对结果进行比较分析。
1 对象与方法
1.1研究对象收集2013年9月至2014年12月在北京市海淀区妇幼保健院就诊的住院和门诊患者临床检测标本358例,收集HBV疫苗接种者且HBsAb阳性血清标本122例为健康对照,入选580例标本均于-70℃冷冻保存;血清含量至少为1 ml以便于进行复检;未经反复冻融。该研究由首都医科大学附属北京佑安医院伦理委员会批准实施,所有患者或家属均签署书面知情同意书。
1.2主要试剂与仪器德国罗氏Elecsys HBsAgⅡQuant试剂盒(批号:173962),检测下限0.05IU/ml,配套仪器为罗氏Cobas e601型全自动电化学发光免疫分析系统。日本希森美康HISCL HBsAg试剂盒(批号:ZS3001),检测下限0.03IU/ml,配套仪器为HISCL-2000i全自动免疫检测系统。
1.3方法
1.3.1检测方法: 抽取患者静脉血3.5 ml,离心取血清,首先用德国罗氏Elecsys HBsAgⅡQuant试剂盒,筛选出HBsAg<0.05 IU/ml及HBsAg>0.05 IU/ml(小于52000 IU/ml)标本,再用日本希森美康HISCL HBsAg试剂盒进行HBsAg定量检测,检测结果不符合的标本用第三方Abbott ARCHITECT i2000 发光免疫分析仪ARCHITECT HBsAg试剂(美国雅培有限公司)检测,检测下限0.05 IU/ml,具体操作和结果判定参照说明书进行,本课题仅作为科学研究,不牵涉利益问题。
1.3.2分组方法: 580例分成7个组:第1组:74例有乙肝病史,HBV DNA>20 IU/ml(罗氏乙型肝炎病毒核酸定量检测试剂盒)且未用抗病毒药治疗的患者标本;第2组:104例有乙肝病史,经抗病毒治疗1年以上,HBV DNA检测不到(罗氏乙型肝炎病毒核酸定量检测试剂盒)且无HBV变异耐药;第3组:有乙肝病史,HBV DNA>20 IU/ml,用抗病毒药治疗的患者出现不同HBV基因型变异耐药标本40例,其中HBV基因A型 5例、B型15例、C型15例、D型5例;第4组:孕妇及幼儿标本60例;第5组:各种病毒或梅毒感染标本140例:CMV(巨细胞病毒)抗体阳性20例、EBV(EB病毒)抗体阳性20例、HSV(单纯疱疹病毒)抗体阳性20例、风疹抗体阳性20人、抗-HCV(丙肝病毒)阳性20例、抗-HIV(艾滋病毒)阳性20例、梅毒抗体阳性20例;第6组:ANA(抗核抗体)或RF(类风湿因子)阳性标本40例:ANA阳性20例、RF阳性20例。正常对照组122例:HBV疫苗接种者且HBsAb阳性血清标本。各组标本用两种试剂检测HBsAg,评价两种试剂检测结果的相关性。对于超出试剂测定范围的标本,罗氏Cobas e601仪器进行自动稀释,HISCL-2000i仪器通过人工稀释,计算最终浓度。
1.3.3希森美康检测系统精密度验证方法:采用希森美康公司的HBsAg定量试剂对HBsAg中、低浓度质控品:希森美康株式会社HBsAg Viratrol Level 1[VL1,1.98(1.58-2.38)IU/ml]和Viratrol Level 2[VL2,11.21(8.97-13.45) IU/ml]分别进行批内精密度检测:同一批次内连续检测20次,计算变异系数( coefficient of variation,CV)值;批间精密度检测:1 d 1次连续20 d检测,计算CV值。
1.3.4希森美康试剂对不同患者标本重复性验证方法: 第1组、第2组和第4组共238例标本用同一批号希森美康试剂检测重复检测,重复检测结果进行相关性分析。
1.4统计学方法应用SPSS19.0统计学软件。两种试剂检测的HBsAg定量值取自然对数后进行统计分析,希森美康检测系统精密度验证质控品检测结果用均数±标准差表示,并计算CV值。对各组测定结果进行Pearson相关性分析,计算相关系数,显著性检验为双侧检验,设置显著性水平为0.05。
2 结果
2.1两种试剂检测HBsAg结果122例正常对照组两种试剂检测HBsAg均为阴性。580例Elecsys

表1 两种试剂检测HBsAg结果(n=580)
HBsAgⅡQuant试剂检测阳性率为49.48%,HISCLHBsAg试剂检测阳性率为50.34%;两种试剂检测阳性符合率为100%;阴性符合率为98.29%;临床总体符合率为99.14%,见表1。两种试剂检测287例HBsAg共阳性标本结果相关性:r=0.994,P=0.000。两种试剂检测287例HBsAg共阳性标本结果差值:R2=0.201。不符合标本5例:其中第2组4例,检出值分别为0.05 IU/ml、0.05 IU/ml、0.04 IU/ml、0.03IU/ml,均为乙肝感染者治疗恢复期标本;第6组1例,0.04 IU/ml,HBeAb阳性,HBcAb阳性,ANA阳性。5例不符合样本分别用上述两种试剂重复检测,结果同前。用第三方雅培HBsAg试剂检测结果HBsAg<0.05 IU/ml与罗氏试剂检测相同。
2.2两种试剂定量检测HBsAg相关性分析第1组74例标本罗氏试剂检测出HBsAg>0.05 IU/ml 74例,希森美康试剂检测出HBsAg > 0.03 IU/ml 74例;两者反应性均相符,检测结果进行双侧Pearson相关性分析,相关系数r=0.997,P=0.000,见图1a。对两种试剂检验的差值分析结果显示,R2=0.001,图1b为差值分布,图中结果显示差值均匀分布于坐标轴两侧,离散程度较小。第2组罗氏试剂检测出HBsAg>0.05 IU/ml 64例,希森美康试剂检测出HBsAg>0.03 IU/ml 68例;4例不符合标本详见结果1。对64例两种试剂检测均阳性结果进行相关性分析,相关系数r=0.994,P=0.000,见图1c。对两种试剂检验结果进行差值分析,R2=0219,差值分布,见图1 d。第3组40例两种试剂检测结果均为阳性,两种试剂检测结果相关性:r=0.998,P=0.000,见图1e。两种试剂检测结果差值比较:R2=0.056,见图1f。第4组共30例幼儿、30例孕妇标本,分别用两种试剂检测HBsAg结果,10例幼儿,22例孕妇阳性,符合率100%。两种试剂检测HBsAg结果相关性:r=0.992,P=0.000,见图1g。两种试剂检测结果差值比较:R2=0.003,见图1 h。第5组CMV抗体阳性20例、EBV抗体阳性20例、HSV抗体阳性20例、风疹抗体阳性20人、抗-HCV阳性20例、抗-HIV阳性20例、梅毒抗体阳性20例、共140例,用两种试剂检测,均检出HBsAg阳性49例,49例HBsAg阳性结果的相关性:r=0.995,P=0.000,见图1i。49例两种试剂检测HBsAg阳性结果差值分析:R2=0.146,见图1j。第6组ANA抗体阳性20例、RF阳性20例,罗氏试剂检测出HBsAg>0.05IU/ml 28例,希森美康试剂检测出HBsAg > 0.03IU/ml 29例;1例不符合标本详见结果1。28例两种试剂检测均阳性结果相关性:r=0.997,P=0.000,见图1k。两种试剂检测均阳性结果差值分析,R2=0.010,见图1l。
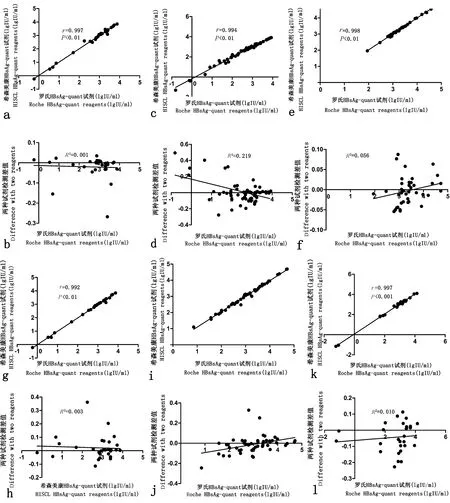
相关性:第1组(a),第2组(c),第3组(e),第4组(g),第5组(i),第6组(k);差值分析:第1组(b),第2组(d),第3组(f),第4组(h),第5组(j),第6组(l)图1 两种试剂检测HBsAg相关性及差值分析Correlation:Group 1(a),Group 2(c),Group 3(e),Group 4(g),Group 5(i),Group 6(k);Difference:Group 1(b),Group 2(d),Group 3(f),Group 4(h),Group 5(j),Group 6(l)Fig.1 The correlation and difference between the detection results of HBsAg with two reagents
2.3希森美康检测系统精密度验证结果希森美康检测系统检测HBsAg质控品结果见表2。
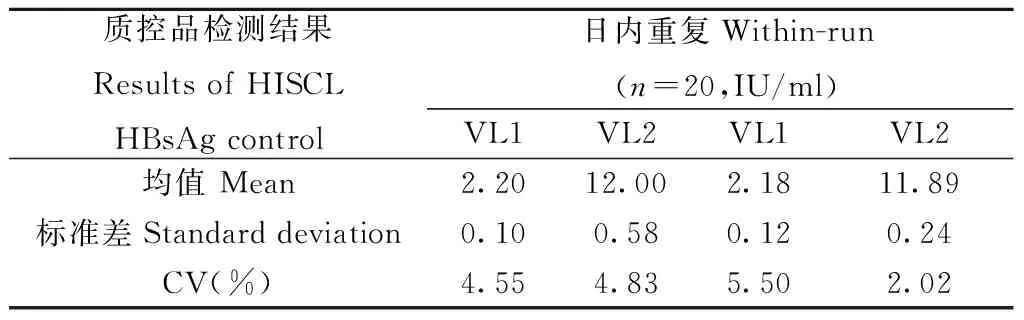
表2 希森美康试剂HBsAg质控品检测结果
按照厂家提供的CV<10%作为重复性的最高可接受限,本次实验CV≤5.5%,检测系统批内精密度,批间精密度可接受。
2.4希森美康试剂对不同患者标本重复性验证结果第1组、第2组、第4组共238例标本用希森美康试剂重复检测,阴阳性符合率100%。3组共检出174例阳性标本,重复检测结果相关性r=0.999,P<0.01。对重复检验结果进行差值分析,R2=0.028。
3 讨论
近年来,血清HBsAg 定量检测技术快速发展,其中化学发光法因其操作简单、检测速度快且稳定、其线性检测范围和敏感性显著高于传统的ELISA法而且自动化程度高等优点,已渐成为HBsAg常用检测方法[4]。 HBsAg检测不仅用于HBV感染筛查,而且对治疗效果判定也很重要,因此,我们选取了灵敏度和特异度都较高的HBsAg罗氏试剂与希森美康HBsAg试剂进行检测灵敏度和特异性分析,比较两种同属化学发光法但检测方法仍有差异的检测试剂的临床应用性能。在方法学上,希森美康试剂是采用包被抗HBs单克隆抗体微粒子进行化学发光免疫测定,而罗氏试剂是采用包被抗HBsAg单克隆抗体进行电化学发光免疫测定。最后,以英国国家生物制品检定所NIBSC标准(世界卫生组织国际标准)对其定量标准进行溯源,因方法学类似、因此相同溯源标准是两种检测结果具有相关性的基础。
罗氏HBsAg-quant试剂检测出HBsAg<0.05 IU/ml (阴性)293例中用希森美康试剂检测出HBsAg<0.03 IU/ml(阴性)288例,其中有5例不符合。分析原因:①两种试剂检测下限不一致,HBsAg浓度低于罗氏检测方法的灵敏度;②两种检测试剂包被的抗体不一样,罗氏检测方法所使用的检测抗体对该标本抗原缺乏特异性反应。
本研究中同一标本不论普通标本还是服用抗病毒药物患者标本、孕妇及婴儿标本,希森美康HBsAg定量试剂重复检测结果相关性均很好,差值离散程度较小,没有统计学意义,从精密度水平来看,希森美康HBsAg定量试剂批内和批间CV值均约为5%,检测系统批内精密度,批间精密度可接受,能满足临床使用的需要。
两种试剂检测HBsAg阳性标本:从普通标本到服用抗病毒药物患者标本、不同HBV基因型变异耐药标本、孕妇及婴儿标本、感染其他病毒或梅毒标本、抗核抗体或类风湿因子阳性标本、其相关性均很好,同一标本两种试剂检测结果差值离散程度较小,差值没有统计学意义,提示两种试剂的检测结果之间具有良好的一致性。
两种试剂对含有潜在干扰物质的标本检测结果进行比较显示,两种试剂对孕妇、于抗病毒药物、乙肝疫苗接种后、其他病毒(CMV,EBV,HSV,风疹病毒,HCV,HIV)及梅毒感染、婴儿、抗核抗体或类风湿因子阳性血清,都具备相似的抗干扰能力。
[1]中华医学会肝病分会,中华医学会感染病学分会.慢性乙型肝炎防治指南(2010年版)[J].中华肝脏病杂志,2011,19(1):13-24.doi: 10.3760/cma.j.issn.1007-3418.2011.01.007.
[2]孙彬, 李康, 吴纯,等. 罗氏Cobas e601与雅培Architect i2000检测乙肝表面抗原的比较[J]. 国际检验医学杂志, 2014,35(20):2823-2824.doi:10.3969/j.issn.1673-4130.2014.20.45.
[3]盛欢, 胡晓波, 许洁. 两种方法检测HBsAg定量结果的临床互认研究[J]. 检验医学,2013,28(9):828-834.doi:10.3969/j.issn.1673-8640.2013.09.023.
[4]Brunetto MR, Moriconi F, Bonino F, et al. Hepatitis B virus surface antigen levels: A guide to sustained response to peginterferon alfa-2a in HBeAg-negative chronic hepatitis B [J]. Hepatology, 2009, 49(4):1141-1150. doi: 10.1002/hep.22760.
Comparison of HBsAg detection results between HISCL kits and Roche kits
LuXin,YangHaishan,HuangYanxiang,WeiFeili,ChenDexi
ClinicalLaboratoryofHaidianMaternal&ChildHealthHospital,Beijing100080,China(LuX,YangHS);CapitalMedicalUniversityBeijingYouanHospital,BeijingHepatologyInstitute,Beijing100069,China(HuangYX,WeiFL,ChenDX.)
ChenDexi,Email:dexichen@ccmu.edu.cn
ObjectiveTo evaluate the repeatability of HISCL HBsAg kits and the correlation comparing with Roche kits. MethodsA total of 580 serum samples were collected, HBsAg levels were detected by HISCL HBsAg kits and Elecsys HBsAgⅡQuant kits, respectively.Data were analyzed, and the specificity, sensitivity and anti-jamming capability of HISCL kits were assessed by comparing with Roche kits.Results The intra-assay coefficients of variation (CV) of HISCL HBsAg kits was<5.0%, and Inter-assayCVwas≤5.5%. 238 samples were repeated testing with HISCL HBsAg kits and the coincidence was 100%. Within them, the repeating detection results of 174 positive samples by HISCL HBsAg kits had agood correlation (r=0.999,P<0.01). 122 cases of normal control were detected negative by both kits, and the coincidence was 100%. The correlation of HBsAg results from 287 HBsAg positive samples detected by the two kits wasr=0.996,P<0.01. For the samples containing suspicious interferences, the results of the two kits were similar( pregnant women and infantsr=0.992,P=0.000; antiviral drugsr=0.994,P=0.000; various virus or syphilisr=0.995,P=0.000; HBV gene mutationr=0.998,P=0.000; antinuclear antibodies and rheumatoid factorr=0.997,P=0.000). ConclusionsHISCL HBsAg kits have a good repeatability and a excellent correlation with Elecsys HBsAgⅡQuant kits.
Hepatitis B surface antigens; Correlation; Coincidence
陈德喜, Email: dexichen@ccmu.edu.cn
10.3760/cma.j.issn.1003-9279.2016.04.017
2016-02-28)
