模式类黑精及其分级产物清除自由基能力、抗氧化性及还原力分析
2016-09-26王忠合王军胡慧娟
王忠合,王军,胡慧娟
(韩山师范学院 生命科学与食品科技学院,广东 潮州,521041)
模式类黑精及其分级产物清除自由基能力、抗氧化性及还原力分析
王忠合,王军*,胡慧娟
(韩山师范学院 生命科学与食品科技学院,广东 潮州,521041)
以甘氨酸和葡萄糖为底物制备模式类黑精,采用膜法制备分级产物,分析模式类黑精及其分级产物的自由基清除能力、抗氧化性及还原力。结果表明:水溶性类黑精及其分级产物具有较好的清除羟自由基、超氧阴离子和DPPH自由基的能力;鸡卵黄脂质过氧化模型分析表明模式类黑精及其分级产物的抗脂质过氧化性差异较大,模式类黑精和高分子质量的类黑精抗氧化效果较理想;采用铁氰化钾法和二氯酚定酚法测定模式类黑精及分级产物的还原力表明,高分子质量的类黑精还原力最大。
类黑精;清除自由基;抗氧化;还原力
类黑精(melanoidins)是一类结构复杂、聚合度不等的高分子聚合物的混合体,属于美拉德反应后期形成的一类棕褐色物质[1- 2],广泛分布于热加工食品中,如面包、蜂蜜、豆豉、咖啡、醋等食品中[3-6]。许多研究表明,类黑精不仅影响食品的色泽、风味等感官特性,还可抑制食品的氧化变质及矿物质的吸收代谢,同时,类黑精可被肠道微生物降解,与膳食纤维类似,可改变肠道菌群、促进双歧杆菌和乳酸菌等有益菌的生长繁殖、产生短链脂肪酸,具有较好的益生特性[7],因此,食品中类黑精与人类健康的关系非常密切。另外,类黑精有结合风味物质等生理活性,对食品风味品质保持和延长商品货架期也有重要意义[8-9]。
类黑精是美拉德反应后期阶段低分子质量的反应产物经环化、脱水、缩合等过程形成的,分子结构复杂,加之目前的分析检测方法有限,因此无法得知其具体结构。类黑精的制备普遍采用氨基酸、蛋白质等氨基化合物与羰基化合物长时间加热后分离纯化得到,其分子质量差异较大,模拟法制备的类黑精可溶于水、等电点为pH 2.5、带有负电荷[2,7],而食品中的类黑精常以非共价键的形式结合其他组分,结构更加复杂,现有的分离手段和检测技术尚无法完全确定其结构。本文采用模式美拉德反应体系制备类黑精,并采用透析法制备分级产物,以深入探索类黑精及分级产物的抗氧化性、清除自由基能力和还原力等性质。
1 实验材料与仪器
1.1材料与试剂
新鲜鸡蛋,购于当地市场;1,1-二苯基-2-苦肼基自由基(DPPH),美国Sigma公司,优级纯;2-硫代巴比妥酸(2-TBA),上海晶纯,生化试剂;L-甘氨酸,上海伯奥生物科技有限公司,分析纯;无水葡萄糖,广州化学试剂厂,分析纯;FeSO4、抗坏血酸、2, 6-二氯酚靛酚、邻苯三酚(焦性没食子酸)、K3Fe(CN)6、水杨酸、三氯乙酸、H2O2、FeCl3、Na2HPO4、Na2HPO4、无水乙醇等均为分析纯。
1.2仪器与设备
TU-1901型紫外分光光度计,北京普析通用仪器有限公司;Flowmen-0015螺旋平板膜设备,厦门福美科技有限公司;Parr 4597高压反应釜,美国Parr仪器公司;Scientz-18N型冷冻干燥机,宁波新芝生物科技有限公司;2-16P型高速离心机,美国Sigma公司;ZHWY-2102C恒温摇床,上海智城分析仪器有限公司;85-3恒温磁力搅拌器,常州华普达教学仪器有限公司等。
1.3实验方法
1.3.1模式类黑精及其分级产物的制备
模式类黑精的制备:取9.00 g葡萄糖和3.75 g甘氨酸溶于加入20 mL蒸馏水中,冷冻干燥,置于预热至125 ℃的真空干燥箱中加热2 h。反应后取出,放入干燥器中冷却至室温,粉碎,取5 g粉末加入200 mL蒸馏水于4 ℃搅拌12 h充分溶解,再用4号滤纸过滤,滤渣各用20 mL水洗涤2次,收集滤液合并,定容至250 mL得到水溶性类黑精M。
分级产物的制备:取50 mL水溶性类黑精M,用截留量分子质量为10 kDa的超滤膜分级得到截留物和透过液,真空浓缩后,冷冻干燥得到低分子质量的类黑精和高分子量的类黑精,各取1 g左右定容至50 mL,分别得到低分子质量类黑精LWM和高分子量类黑精HWM。
1.3.2模式类黑精的图谱扫描及定量分析
分别于200~800 nm下扫描模式类黑精及其分级产物的图谱,并利用类黑精在470 nm处的消光系数相当于(0.64±0.03) L/mmol的特性计算其含量。
1.3.3羟自由基清除能力测定
按照文献中Fenton反应的方法[10]测定,在试管中依次加入0.5 mL 9 mmol/L水杨酸-乙醇溶液,0.5 mL不同浓度的样液,0.5 mL 9 mmol/L FeSO4溶液,3.5 mL蒸馏水,最后加入5 mL 88 mmol/L H2O2溶液启动Fenton反应,摇匀后于510 nm处测定吸光度A1;取0.5 mL蒸馏水代替9 mmol/L FeSO4溶液所测得的吸光度为A2;取0.5 mL蒸馏水代替样液所测得的吸光度为A3。按式(1)计算羟自由基的清除率P:
(1)
1.3.4超氧阴离子清除能力测定
采用邻苯三酚自氧化法[11]测定样品对超氧阴离子的清除作用,取9 mL pH 8的0.01 mol/L磷酸盐缓冲液分别与1 mL不同浓度的样液混合,于25 ℃恒温15 min,取混合液3 mL在比色皿中加入45 mmol/L的邻苯三酚(用0.01 mmol/L HCl配制)溶液0.1 mL,摇匀,反应3 min,在波长420 nm处测定吸光度。按照式(2)计算超氧阴离子清除率P:
(2)
其中:A1为9 mL磷酸盐缓冲溶液+1 mL样品+0.1 mL 45 mmol/L邻苯三酚溶液;A2为9 mL磷酸盐缓冲溶液+1 mL样品+0.1 mL 0.01 mmol/L的盐酸;A3为9 mL磷酸盐缓冲溶液+1 mL蒸馏水+0.1 mL 45 mmol/L邻苯三酚溶液。
1.3.5清除DPPH自由基能力测定
DPPH在有机溶剂中是一种稳定的自由基,其结构中含有3个苯环,1个氮原子上有1个孤对电子,呈紫色,在517 nm有强吸收。当有自由基清除剂存在时,DPPH的单电子被配对而使其颜色变浅,在最大吸收波长处的吸光度变小,而且这种颜色变浅的程度与配对电子数是成化学剂量关系的,因此常用于检测自由基的清除情况,从而评价试验样品的抗氧化能力[12]。取不同浓度的样品溶液2 mL,与2 mL 0.1 mmol/L DPPH溶液(溶于乙醇)混合,暗处静置30 min,在517 nm处测定吸光度As,用蒸馏水代替样品测定吸光度Ab,用乙醇代替DPPH溶液测定吸光度Ac。按照式(3)计算样品对DPPH自由基的清除率P:
(3)
1.3.6抗脂质过氧化能力的测定
采用依赖鸡卵黄脂蛋白的脂质过氧化模型测定样品抗氧化能力[13],将新鲜卵黄用0.1 mol/L的磷酸盐缓冲液(PBS,pH 7.4)按1∶1(g:mL)配成悬液,再稀释25倍,磁力搅拌30 min。向试管中加入卵黄悬液0.4 mL;然后分别依次加入不同稀释浓度的样品0.2 mL(对照管加入相同体积的PBS溶液)、25 mmol/L的FeSO4溶液0.4 mL,并用0.1 mol/L的PBS溶液补至4.0 mL,置于37 ℃水浴中,振荡50 min。取出后加入20%的三氯乙酸溶液1 mL,静置10 min后以3 000 r/min离心15 min,取上清液4 mL加入质量分数0.8%硫代巴比妥酸溶液2 mL,塞紧管口,于100 ℃水浴中反应15 min,空白管以PBS溶液取代上清液,其余操作相同。最后在532 nm处测定样品的吸光度,平行测定3次,取平均值,并根据式(4)计算样品抗脂质过氧化能力P:
(4)
式中,A0和A1分别为对照组和样品组的吸光度。
1.3.7还原力分析
铁氰化钾法:参考BENJAKUL等人[14]的方法测定。取不同浓度的样品液1 mL,再加入1 mL 0.2 mol/L的磷酸盐缓冲液(pH 6.6)、1 mL 1%K3Fe(CN)6溶液混合,在50 ℃水浴中暗处反应20 min,之后加入1 mL质量分数10%的三氯乙酸溶液,750×g 25 ℃离心10 min,取1 mL上清液加1 mL去离子水和200 μL 0.1% FeCl3溶液,于700 nm处测定吸光度。还原能力用吸光度的增加值来表示。
2,6-二氯酚定酚法:采用类似于测定Vc的方法[15]分析样品的还原性,准确吸取1 mL样液于惰性气体中用微量滴定管以1 mmol/L的2,6-二氯酚靛酚标准液滴定至淡红色,并保持15 s不褪色即为终点,2,6-二氯酚靛酚标准液的浓度以定量的滴定测得,样品还原力的实验结果以等量值μmol/g表示。
1.4实验数据处理
实验平行测定2次以上,实验结果以平均值±标准偏差SD表示,用SPSS 17.0进行一维方差分析(one-way ANOVA),差异显著性采用Duncan(邓肯)检验,检验水平P<0.05。
2 结果与分析
2.1模式类黑精及分级产物的紫外可见图谱分析
模式类黑精M及分级产物LWM(<10 kDa)、HWM(>10 kDa)的分级组分在200~800 nm的图谱如图1所示。

图1 模式类黑精及其分级产物的扫描图谱Fig.1 Absorption spectra of melanoidins and fractions
由图1可知,类黑精及其分级组分在波长400~800 nm的可见光区域都是随着波长的增大而逐渐降低,而在200~400 nm的紫外区域类黑精及其低分子量的分级产物均有最大吸收峰,分别在295 nm和284 nm处有最大吸收峰,这主要是一些美拉德反应中间产物的特征吸收峰,在低分子质量的分级产物中其吸光度增大,而在高分子质量的分级产物中其吸光度非常小,这表明一些小分子组分可通过超滤处理而除去,与文献[16]中报道的结果一致。高分子质量的分级组分在405、420或470 nm处的吸光度较大,而其他低分子质量的分级组分吸收情况较小,因此测定类黑精含量时常选用此波长范围[17]。由模式类黑精及其分级组分在470 nm处的吸光度可计算各出模式类黑精样品M、低分子质量的分级产物LWM和高分子质量的分级产物HWM中类黑精的含量分别为;0.053 8、0.012 5、0.155 8 mmol/L。
2.2模式类黑精及分级产物对羟自由基清除能力
模式类黑精及其分级组分清除羟自由基能力的实验结果如图2所示从图2中可知,模式类黑精及其分级组分对羟自由基清除能力随着样品浓度的升高而增大,由清除作用的回归方程可知模式类黑精、LWM及HWM分级组分清除羟自由基的IC50值分别为1.21、0.39、2.48 mg/mL,其中低分子质量的类黑精LWM对羟自由基清除作用最明显,这与其中含有的小分子类化合物如5-羟甲基糠醛等有关。
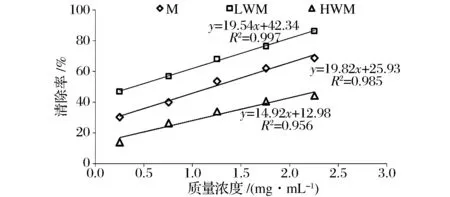
图2 模式类黑精及其分级产物对羟自由基清除能力Fig.2 Hydroxyl radical-scavenging ability of modelmelanoidins and fractions
2.3模式类黑精及分级产物清除超氧阴离子能力
模式类黑精及分级产物对超氧阴离子清除能力的测定结果如图3所示。从图3中可知,类黑精M、LWM、HWM清除超氧阴离子的能力随着样品浓度的增加而增大,其IC50值分别为455.02、200.44、1 350.76 mg/mL,样品清除超氧阴离子能力的大小为:LWM>类黑精M>HWM,这表明类黑精及其分级产物具有一定的清除超氧阴离子的能力。

图3 模式类黑精对超氧阴离子的清除能力Fig.3 Superoxide anion scavenging ability of model melanoidins and fractions
2.4模式类黑精及分级产物对DPPH自由基清除能力
类黑精样品及其分级产物清除DPPH自由基能力实验结果如图4所示。由图4可知,类黑精M、LWM、HWM对DPPH自由基具有较显著的清除作用,且随着样品浓度的增加而增大,其IC50值分别为0.21、0.17、0.11 mg/mL。类黑精及其分级产物均具有较好的清除DPPH自由基的能力,这可能是因为在美拉德反应过程中形成的中间产物及终产物色素类物质均可作为氢的供体而与DPPH自由基反应,与其他文献报道的结果一致[18],因而模式类黑精及其分级组分均可有效地清除DPPH自由基。
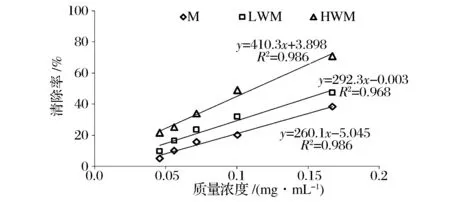
图4 模式类黑精及分级产物对DPPH自由基清除能力Fig.4 DPPH radical-scavengingability of model melanoidins and fractions
2.5模式类黑精及分级产物抗脂质过氧化能力
模式类黑精及分级产物抗脂质过氧化能力的实验结果如图5所示。由图5可知,模式类黑精M、LWM、HWM在采用依赖鸡卵黄的脂质过氧化模型中的抗脂质过氧化效果较好,其中,类黑精M及其LWM的抑制脂质过氧化的效率随着样品浓度的增加而逐渐增大,与文献[19]中报道的结果一致,主要受美拉德反应初级阶段的反应产物影响。而高分子质量的分级组分的抑制脂质过氧化的效率随着样品浓度的增加而急剧增大,这可能是由于高分子质量的类黑精具有较强的络合亚铁离子的能力从而可以显著降低其催化脂质过氧化反应[20]。
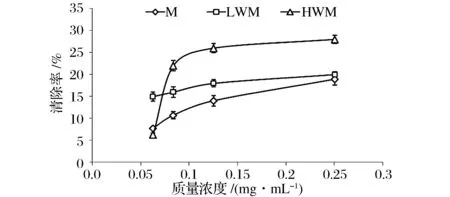
图5 模式类黑精及其分级产物的抗脂质过氧化能力Fig.5 Anti-lipid peroxidation ability of model melanoidins and fractions
2.6模式类黑精及分级产物的还原力分析
2.6.1铁氰化钾法测还原力
铁氰化钾法测定类黑精及其分级组分的总还原力的实验结果如图6所示。类黑精M、LWM、HWM的吸光度随着样品浓度的增加而逐渐增大,这表明其还原能力逐渐增强,并且其大小趋势为HWM>M>LWM,这说明高分子质量的模式类黑精分级产物的还原力较大,可能与高分子质量的类黑精具有较强的络合亚铁离子的能力有关[20]。

图6 铁氰化钾法测定类黑精及其分级组分的还原力Fig.6 Reducing power of melanoidins and fractions assessing by potassium ferricyanide
2.6.2二氯酚定酚法测还原力
采用2,6-二氯酚定酚法测定类黑精及其分级组分还原力的实验结果如表1所示。结果表明,类黑精M及其分级组分均具有一定的还原性,大小依次为HWM>LWM>M,与铁氰化钾法测定的总还原力结果一致。
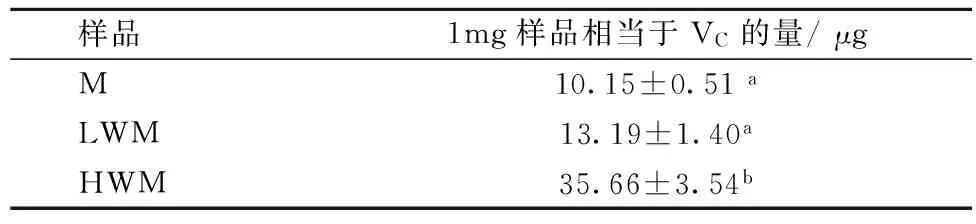
表1 二氯酚靛酚法测定还原力实验结果
注:数据标注不同的小写字母表示差异显著,P<0.05。
3 结论
模式类黑精及其分级产物均有一定的清除超氧阴离子、羟自由基和DPPH自由基的能力,其中低分子质量的类黑精LWM对超氧阴离子和羟自由基的清除作用最明显,这与其中含有的小分子类化合物有关。
采用鸡卵黄脂质过氧化模型分析表明,高分子质量的分级组分HWM的抑制脂质过氧化的效果相对较大,可能与其螯合亚铁离子的能力有关。
采用铁氰化钾法和二氯酚靛酚法测定类黑精及其分级组分的还原力,其中高分子质量的分级组分HWM的还原性最大。
[1]HAYASE F, USUI T, WATANABE H. Chemistry and some biological effects of model melanoidins and pigments as Maillard intermediates [J]. Molecular Nutrition & Food Research, 2006, 50(12): 1 171-1 179.
[2]WANG H Y, QIAN H, YAO W R. Melanoidins produced by the Maillard reaction: Structure and biological activity [J]. Food Chemistry, 2011, 128(3): 573-584.
[3]MORALES F J, FERNANDEZ-FRAGUAS C, JIMENEZ-PEREZ S. Iron-binding ability of melanoidins from food and model systems [J]. Food Chemistry, 2005, 90(4): 821-827.
[4]秦礼康, 丁霄霖. 陈窖豆豉粑类黑精组分体外抗氧化活性研究 [J]. 食品与发酵工业, 2006, 32(1): 88-92.
[5]BORRELLI R C, VISCONTI A, MENNELLA C, et al. Chemical characterization and antioxidant properties of coffee melanoidins [J]. Journal of Agricultural and Food Chemistry, 2002, 50(22): 6 527-6 533.
[6]XU Q P, TAO W Y, AO Z H. Antioxidant activity of vinegar melanoidins [J]. Food Chemistry, 2007, 102(3): 841-849.
[7]BORRELLI R C, FOGLIANO V. Bread crust melanoldins as potential prebiotic ingredients [J]. Molecular Nutrition & Food Research, 2005, 49(7): 673-678.
[8]BORRELLI R, FOGLIANO V, Monti S M, et al. Characterization of melanoidins from a glucose-glycine model system [J]. European Food Research and Technology 2002, 215(3): 210-215.
[9]MORALES F J, SOMOZA V, Fogliano V. Physiological relevance of dietary melanoidins [J]. Amino Acids, 2012, 42(4): 1 097-1 109.
[10]王忠合, 黄晋荣. 麦麸中抗氧化性物质的提取技术[J]. 食品科技, 2007, 32(11): 202-206.
[11]王惠英, 孙涛, 周冬香, 等.L-赖氨酸与葡萄糖美拉德反应及其产物的抗氧化性能研究[J]. 食品与发酵工业, 2007, 33(9): 54-56.
[12]鲁伟, 黄筱茜, 柯李晶, 等. 美拉德反应产物的抗氧化活性研究[J]. 食品与机械, 2008(4): 61-64.
[13]SABIR S, ROCHA J. Water-extractable phytochemicals fromPhyllanthusniruriexhibit distinctinvitroantioxidant andinvivohepatoprotective activity against paracetamol-induced liver damage in mice [J]. Food Chemistry, 2008, 111(4): 845-851.
[14]BENJAKUL S, LERTITTIKUL W, BAUER F. Antioxidant activity of Maillard reaction products from a porcine plasma protein-sugar model system [J]. Food Chemistry, 2005, 93(2): 189-196.
[15]RIZZI G P, AMBA E E, HEINEMAN W R. Quantification of chemically reducing species in the phosphate ion catalyzed degradation of reducing sugars [J]. Journal of Agricultural and Food Chemistry, 2010, 58(17): 9 739-9 743.
[16]BEKEDAM E K, SCHOLS H A, van BOEKEL M, et al. High molecular weight melanoidins from coffee brew [J]. Journal of Agricultural and Food Chemistry, 2006, 54(20): 7 658-7 666.
[17]MARTINS S, van BOEKEL M. Melanoidins extinction coefficient in the glucose/glycine Maillard reaction [J]. Food Chemistry, 2003, 83(1): 135-142.
[18]GU F L, KIM J M, HAYAT K, et al. Characteristics and antioxidant activity of ultrafiltrated Maillard reaction products from a casein-glucose model system [J]. Food Chemistry, 2009, 117(1): 48-54.
[19]JAYATHILAKAN K, SHARMA G K. Role of sugar-amino acid interaction products (MRPs) as antioxidants in a methyl linoleate model system [J]. Food Chemistry, 2006, 95(4): 620-626.
[20]WANG Z, WANG J, GUO S, et al. Iron-chelating properties of melanoidins and inducing effect of pulsed electric field [J]. Journal of Food Process Engineering 2013, 36(6): 786-792.
Analysis of free radical-scavenging and reducing ability of melanoidins and its fractions
WANG Zhong-he, WANG Jun*, HU Hui-juan
(School of Life Science and Food Technology,Hanshan Normal University, Chaozhou 521041,China)
In this paper, standard melanoidins derived from glycine-glucose model system were prepared using Maillard reaction and ultrafiltration methods, and radical-scavenging ability, antioxidant ability and reducing capacity of standard melanoidins and its fractions were also investigated. Results showed that water-soluble melanoidins and fractions possessed stronger radical-scavenging ability, including hydroxyl radical, superoxide anion and DPPH radical. However, only water-soluble melanoidins showed better antioxidant properties in yolk lipid peroxidation model. Finally, high molecular weight fraction (HMW) has the best reducing capacity by potassium ferricyanide and 2, 6-dichloroindophenol evaluation methods.
melanoidins; radical-scavenging ability; antioxidant properties; reducing capacity
10.13995/j.cnki.11-1802/ts.201601017
博士,讲师(王军博士为通讯作者,E-mail:wangjun19811210@163.com)。
广东省自然科学基金项目(S2013040015478); 广东省高校优秀青年创新人才培养计划项目(2013LYM0056); 韩山师范学院青年计划项目(LQ201202); 韩山师范学院博士启动项目(QD20130516); 韩山师范学院一般项目(LY201306); 潮州市科技计划项目(2013X05&2013X06&2014N02)资助
2015-07-13,改回日期:2015-09-02
