AD大鼠模型脑血管淀粉样变性的病理学改变研究
2016-09-26陈永衡李建明
陈永衡,李建明
1.长沙医学院临床学院,湖南长沙 410219;2.长沙医学院研究中心,湖南长沙 410219
AD大鼠模型脑血管淀粉样变性的病理学改变研究
陈永衡1,李建明2
1.长沙医学院临床学院,湖南长沙 410219;2.长沙医学院研究中心,湖南长沙 410219
目的 研究建立阿尔茨海默氏病(AD)豚鼠模式的脑血管淀粉样变性的病理学改变特征。方法 于2016年3月在长沙医学院选取50只成年豚鼠(以下简称大鼠)作为该次实验动物,随机均分为对照组与AD组,对照组20只,AD组30只;将AD组30只大鼠建立阿尔茨海默氏病模型;采取水迷宫试验观察AD组大鼠高级认知功能的改变情况;采取刚果红染色法及HE染色法观察淀粉样蛋白于阿尔茨海默氏病大鼠脑内的沉积情况及淀粉样变性的脑血管病理改变情况。结果 AD组12周时大鼠找到安全平台的用时为(20.09±7.16)s,显著长于 4周时(12.31±2.17)s的所用时间,差异有统计学意义,P<0.01;4、12周时AD组大鼠找到安全平台的用时分别为(12.31±2.17)s及(20.09±7.16)s均显著长于对照组,差异有统计学意义,P<0.01。AD组大鼠12周探索安全平台(1.87±0.62)次明显少于该组4周时(2.41±0.73)次,P<0.05;4、12周AD组大鼠探索平台的次数分别为(2.41±0.73)次及(1.87±0.62)次均显著少于对照组,差异有统计学意义,P<0.01。染色试验AD组海马区的颗粒细胞明显减少,细胞可见变性,胶质细胞明显异常增殖,海马内的小血管壁发生变性。刚果红染色试验可见Aβ纤维于小血管壁处逐渐沉积,管壁显示增厚,小血管发生狭窄、闭塞。结论 脑血管的淀粉样变性是AD的主要病理改变,在无干预的前提下淀粉样变性所致病理改变随之时间延长而加重,AD模型的认知功能随之降低。
阿尔茨海默氏病;动物模型;淀粉样变性
阿尔茨海默氏病(AD)是一种以进行性的认知功能降低及行为功能障碍为主要特点的中枢神经功能退行性病理改变。其病理特征表现为大脑皮层及海马组织可见β淀粉样蛋白(Aβ)汇聚组成老年斑(SP)[1-3]。目前,淀粉样变性的脑血管病变(CAA)被认为是AD的典型性病理特征,在AD的发生、发展中发挥着关键性作用。由于AD的发病机制尚不完全明确,因此研究CAA的病理变化机制对于了解AD的发生及进展具有重要作用,可为AD的预防及早期诊断治疗提供新的靶向性指导。该次研究于2016年3月选择能产生与人类等同的淀粉蛋白的自然动物豚鼠30只,以立体定向性双侧海马组织内注射Aβ纤维的方法建立AD动物模型,力求以最为接近人类的模型,研究淀粉样蛋白沉积在脑组织中的规律及对认识功能的改变。
1 资料与方法
1.1 一般资料
于2016年3月选取50只成年健康雄性豚鼠(下简称大鼠)作为该次研究用动物。将全部大鼠随机分对照组与AD组,对照组20只,AD组30只;体重均为350~420 g;两组大鼠一般资料差异无统计学意义(P>0.05)。
1.2 方法
1.2.1 建立动物模型 制备Aβ纤维,将Aβ粉末充分溶解于完全灭菌的PBS溶液当中,按1 μg/μL比例配备为混悬液,将配制完成的Aβ混悬液置于37℃的水浴恒温摇床上,持续振荡水浴7 d,熟化为Aβ纤维。建立动物模型,将AD组大鼠以10%的水合氯醛(20090922)3 mL/kg,行腹腔注射麻醉;将大鼠固定于定位仪上。于大鼠的头顶部常规备皮、消毒。沿头顶部的正中线作一3 cm手术切口,以双氧水(国药准字H13022648)对骨膜进行腐蚀。以前囟后2.5 mm、深3.2 mm为靶点,于靶点两侧各开2 mm。使用10 μL的微量注射器依1 μL/min的速度向靶点内缓慢推注Aβ纤维,5 μL/侧,留针静置10 min,缓慢拔除注射针。逐层缝合,消毒、抗感染。两组大鼠给予同样的饲养方式,包括活动、饮食等。
1.2.2 Morris水迷宫试验 建模手术4周后,观察30只手术大鼠恢复情况,选取20只恢复情况最佳的大鼠纳入AD组行水迷宫试验,其余10只AD组大鼠分别于建模后1、2、4周及12周时制作脑组织切片,观察AD病理改变过程。两组大鼠均于建模4周后及12周后进行水迷宫试验,试验第1~5天对两组大鼠进行安全相关内容的训练,将依次从4个象限放入水中,引导大鼠找到位于水下的平台,并记录寻找过程的时间;以4个象限为1个训练单位,每只大鼠每日训练4个单位。定位航行试验,第6天时将大鼠从训练过的某一个固定象限放入水中,记录大鼠找到水下平台的用时,试验规定时间为120 s,如在规定时间内未能找到平台则将结果记为120 s,连续测试4次,每次均选择不同固定象限,取4次试验均值。空间探索试验,于定位航行试验结束后,次日将水下安全平台移除,将大鼠从训练过的某一固定象限放入水中,记录大鼠在120 s内正确的探索平台次数。
1.2.3 脑组织观察 全部大鼠完成试验后,以冰冻的多聚甲醛 (20130805)4%溶液及生理盐水经心脏进行灌注,切下大鼠头颅取脑组织,以4%的多聚甲醛溶液固定24 h。以梯度蔗糖溶液进行脱水,液氮速冻后使用冰冻切片机按6 μm厚度行连续切片。以梯度酒精进行脱水,行HE常规染色,经二甲苯做透明化处理后使用中性树胶将切片封片。以苏木素行1 min染色用自来反复水冲洗1 min,使用1%的醋酸酒精行n秒分化,再用自来反复水冲洗1min,自来水至60℃返蓝30 min,使用甲醇刚果红行染色25 min,0.1%的碱性酒精行n秒分化,以梯度酒精进行脱水,二甲苯行透明处理后以中性树胶进行封片。
1.3 统计方法
将水迷宫试验结果使用SPSS 17.0统计学软件进行数据处理。进行对比分析,计量资料采取均数±标准差(±s)表示,采取t检验;计数资料采用[n(%)]表示,采取χ2检测;双侧检验值为α=0.05,以P<0.05为差异有统计学意义。
2 结果
2.1 水迷宫定位航行试验
对照组4周时与12周时大鼠找到安全平台的用时无明显变化,P>0.05。AD组12周时大鼠找到安全平台的用时为(20.09±7.16)s,显著长于4周时(12.31±2.17)s的所用时间,P<0.01;4、12周时AD组大鼠找到安全平台的用时分别为(12.31±2.17)s及(20.09±7.16)s均显著长于对照组,差异有统计学意义(P<0.01)。具体数据见表1。
表1 定位航行试验结果统计对比表[(±s),秒]

表1 定位航行试验结果统计对比表[(±s),秒]
组别 4周 12周 t P对照组(n=20)AD组(n=30)0.444 4.650>0.05<0.01 tP 7.97±2.52 12.31±2.17 5.836<0.01 7.62±2.47 20.09±7.16 7.363<0.01
2.2 水迷宫空间探索试验
对照组大鼠4、12周时探索安全平台的次数差异无统计学意义,P>0.05。AD组大鼠 12周探索安全平台(1.87±0.62)次明显少于该组 4周时(2.41±0.73)次,P<0.05;4、12周AD组大鼠探索平台的次数分别为(2.41± 0.73)次及(1.87±0.62)次均显著少于对照组,P<0.01,差异有统计学意义。具体数据见表2。
表2 空间探索试验结果统计对比表[(±s),次]

表2 空间探索试验结果统计对比表[(±s),次]
组别 4周 12周 t P对照组(n=20)AD组(n=30)>0.05<0.05 3.51±0.71 1.87±0.62 7.781<0.01 3.97±1.02 2.41±0.73 5.562<0.01 1.655 2.521 tP
2.3 HE脑组织染色
HE染色后AD组大鼠的脑组织切片海马区的颗粒细胞、锥体细胞明显减少,神经元病变,胶质细胞可见异常增殖,海马内的小血管壁病变,典型表现见图1;HE染色后对照组无明显变性见图2。
2.4 刚果红脑组织染色
刚果红染色后,于显微镜下可见AD组大鼠脑的组织内、脑血管壁处均可见橘红色的无结构均一性淀粉样物质沉淀,典型表现见图3;于偏振光型显微镜下其呈果绿色的双折光成像,典型表现见图4;对照组的刚果红染色无此类病变发生。刚果红染色AD组大鼠建模后1周时脑组织内未见明显的淀粉样物质沉积,2周时于海马小血管的周围脑组织处可见淀粉样物质沉积,4周时于小血管周围处可见淀粉样物质沉积,12周时可见大量的淀粉样物质沉积于小血管壁处,管壁明显增厚,小血管可见狭窄或者阻塞,典型表现见图5。
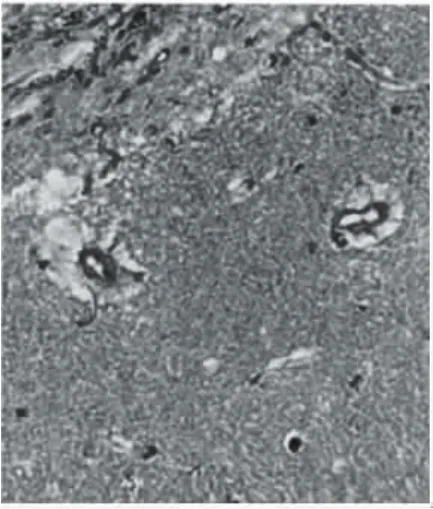
图1 AD组大鼠脑组织HE染色切片

图2 对照组大鼠脑组织HE染色切片
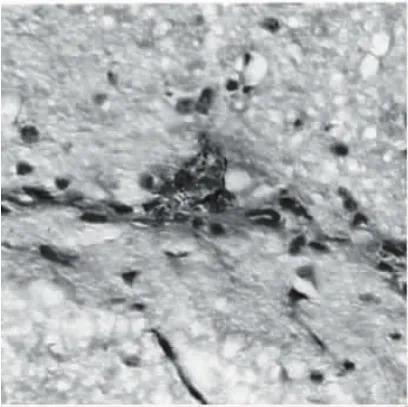
图3 显微镜下AD组淀粉样物质沉淀

图4 偏振光下AD组淀粉样物质沉淀

图5 AD组大鼠随时间推移淀粉样物质沉积演进过程(从左至右为建模手术后1、2、4、12周)
3 讨论
Aβ是含有39~43个氨基酸的一种可溶性多肽,在病理状况中Aβ多肽可以以多肽链中的β片状折叠的方式汇聚成为不溶性的Aβ纤维,极易于脑组织中沉淀积聚为淀粉样的斑块,这种病理改变过程被认为是AD发生的一项主要诱因[4-6]。AD的病理改变特征主要可见Aβ积聚组成的SP、Tau蛋白的异常积聚导致的神经元丢失、纤维纠缠结以及突触减少,另外CAA已被认为是AD病理学改变另一主要特征。约有94%左右的AD患者于脑毛细血管壁处见有Aβ纤维的异常沉积所构成的CAA病变[7-9]。在无AD的同龄人群当中CAA改变的发生率仅为10%~40%左右。因此CAA可以视为AD患者脑组织中Aβ纤维异常沉积所致的脑组织严重性局部病理改变,可导致脑组织中微小血管通透性升高,最终致使脑血管壁发生纤维蛋白性坏死、狭窄,脑的血流量因此显著降低,形成痴呆症状的发生。
该研究中,通过进行水迷宫试验证明,AD大鼠4周时与12周时的认知功能出现显著变化,4周时找到安全平台的用时为 (12.31±2.17)s,探索安全平台的次数为(2.41±0.73)次;12周时找到安全平台的用时为 (20.09± 7.16)s,探索安全平台的次数为(1.87±0.62)次;说明12周时AD大鼠的认识功能显著降低。吕田明[10]的定位航行试验结果为AD大鼠4周时找到安全平台的用时为(12.28± 2.09)s,12周时找到安全平台的用时为 (20.08±7.18)s,与该次研究结果近似。通过对AD大鼠进行脑组织切片染色我们发现,AD大鼠脑组织中淀粉样蛋白的积聚是一个慢性进展过程,提示对于AD患者尽早诊断尽早治疗对于阻止或延缓患者认识功能障碍的发生及程度具有关键性作用。
综上所述,脑组织中的淀粉样蛋白变性是AD的重要病理改变症状,这一病理改变过程是一项缓慢的演进过程,因此对AD患者于疾病早期给予有效治疗可有效减轻AD导致的认知功能障碍,对于预防或减轻老年痴呆具有重要意义。提示临床上应在高危老年群体中开展AD筛查以提高该病的早期诊断率。从理论上说,阻断Aβ纤维异常沉积形成CAA的过程能够成为阻断痴呆发生的关键环节,这一点有待于开展进一步相关研究加以论证。
(
)
[1]Global.Regional and national age-sex specific all-cause and cause-specific mortality for 240 causes of death,1990-2013:a systematic analysis for the Global Burden of Disease Study 2013[J].Lancet,2015,385(9963):117-171.
[2]梁彦珊.实验性阿尔茨海默氏病大鼠脑血管淀粉样变性的病理学研究[D].广州:南方医科大学,2014.
[3]Kvari E,Herrmann FR,Hof PR,et al.The relationship between cerebral amyloid angiopathy and cortical microinfarcts in brain ageing and Alzheimer's disease[J].Neuropathol Appl Neurobiol,2013,39(5):498-509.
[4]Souza LC,Filho CB,Goes AT,et al.Neuroprotective effect of physical exercise in a mouse model of Alzheimer's disease induced by β-amyloid1-40 peptide[J].Neurotox Res, 2013,24(2):148-163.
[5]Morley J E,Farr S A.The role of amyloid-beta in the regulation of memory[J].Biochem Pharmacol,2014,88(4):479-485.
[6]Durand D,Carniglia L,Beauquis J,et al.Astroglial mGlu3 receptors promote alpha-secretase-mediated amyloid precursor protein cleavage[J].Neuropharmacology,2014(79):180-189.
[7]Pekny M,Wilhelmsson U,Pekna M.The dual role of astrocyte activation and reactive gliosis[J].Neurosci Lett,2014(565C): 30-38.
[8]Dhoi B R,Cho W H,kim J,et al.Increased expression of the receptor for advanced glycation end products in neurons and astrocytes in a triple transgenic mouse model of Alzheimer's disease[J].Exp Mol Med,2014(46):75.
[9]周原.对两种阿尔茨海默氏病大鼠模型进行形态学对比的结果研究[J].当代医药论丛,2015,13(5):11-12.
[10]吕田明,梁彦珊,史翠丽,等.阿尔茨海默氏病大鼠淀粉样变性脑血管病的病理学变化[J].南方医科大学学报,2014, 34(7):969-973.
Pathological Changes of Cerebral Vascular Amyloidosis in AD Rat Model
CHEN Yong-heng1,LI Jian-ming2
1.Changsha Medical College Institute of Clinical,Changsha,Hunan Province,410219 China 2.Changsha Medical College Research Center,Changsha,Hunan Province,410219 China
Objective Develop alzheimer's disease(AD),guinea pig model of cerebrovascular pathological change characteristic of amyloidosis.Methods In March 2016 in changsha medical school select 50 guinea pigs (hereinafter referred to as"rats")as the experimental animals,randomly divided into control group and theAD group and the control group of 20,30 AD group;The AD group and 30 alzheimer's disease model in rats;Take the water maze test to observe the AD group rats high-level cognitive function;in the case of a change Take Congo red staining and HE staining observation of amyloid protein in alzheimer's disease in rats of deposition and cerebrovascular pathological changes of amyloidosis.Results AD group 12 weeks to find a safe platform for the time of (20.09± 7.16)seconds,significantly longer than 4 weeks of(12.31±2.17)seconds of time,P<0.01;4,12 weeks when the AD group to find a safe platform with time Respectively,(12.31±2.17)seconds and(20.09±7.16)seconds were significantly longer than the controlgroup,P<0.01.Group AD rats 12 weeks to explore the security platform of(1.87±0.62)times significantly less than the group for 4 weeks at(2.41±0.73)times,P<0.05.and that of AD group was(2.41±0.73)times,P<0.05;(1.87±0.62)times were significantly less than the control group,P<0.01.staining test of AD group in hippocampus decreased significantly visible,cell degeneration,glial cell abnormal proliferation,vascular wall degeneration in the hippocampus.Congo red staining test showed A beta fibers in the wall of small vessels gradually deposited,wall thickened,small vascular stenosis and occlusion.Conclusions Cerebrovascular amyloidosis is the main pathological change in AD.Under the premise of no intervention by amyloidosis
Alzheimer's disease;Animal model;Amyloidosis
R749.16
A doi 10.11966/j.issn.2095-994X.2016.02.04.05
2016-10-11;
2016-11-05
湖南省科技计划项目(2015JC3059)。
陈永衡(1979.10-),男,湖南衡阳人,硕士,副教授,研究方向:诊断学教学、心血管疾病治疗。
李建明(1975.9-),男,湖南涟源人,博士,副教授,研究方向:血管病变与神经退变,E-mail:ljming0901@sina.com。
