关于硫酸性质与应用的系列问题(2)
——对硫酸化学性质的理解
2016-09-26北京王笃年
◇ 北京 王笃年
(作者单位:北京十一学校)
关于硫酸性质与应用的系列问题(2)
——对硫酸化学性质的理解
◇北京王笃年
4) 硫酸分子能不能一次性电离出2个氢离子?
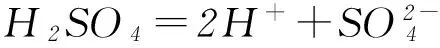


开始/(mol·L-1)0.10.10
平衡/(mol·L-1)0.1-x0.1+xx
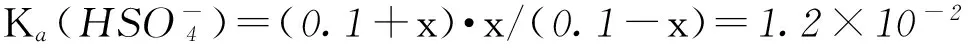
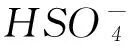
5) 在浓硫酸和稀硫酸中,硫元素都是+6价,为什么浓硫酸具有强氧化性而稀硫酸没有强氧化性?

6) 怎样理解硫酸与铜反应中有的硫酸表现了氧化性而有的则只表现了酸性?
铜与浓硫酸反应的化学方程式为:

1molCu与2molH2SO4发生反应,显然被还原为SO2的1molH2SO4得到电子.显示了氧化性,另外1molH2SO4起了怎样的作用呢?一般认为它只起了酸的作用,显示了酸性.为什么说它显酸性呢?
初中化学里学习酸的性质时,提到酸具有一些通性,如:与酸碱指示剂作用、与活泼金属反应放出H2、与碱性氧化物反应得到盐和水、与碱中和得到盐和水、与某些盐反应得到新酸和新盐等.可以看到,上述酸的各项通性里,除了与指示剂作用外,其他反应中的酸都变成了盐.所以说,在Cu与H2SO4的反应中,没有被还原的1molH2SO4由反应前的酸转化为生成物里的盐(CuSO4),显示了酸性.还可以这样理解,铜被氧化,最初生成的产物是CuO,CuO作为碱性氧化物会立即与H2SO4发生反应,最终得到CuSO4与H2O.当然,这些都只是根据宏观规律所做的表面化的解释.因为酸的本质不是酸根离子,而是H+.请问,被还原的1molH2SO4除了氧化性(是硫元素表现出来的)外,有没有表现出酸性?如果说它没有表现酸性,那么H+在反应后去哪里了?同样的,在碳与浓硫酸的反应中,硫酸是否表现出酸性呢?硫酸的H+在反应后都已经不再单独存在,而是转化为H2O,也可以认为它们表现了酸性.
7) 硫酸与铜反应生成CuSO4和H2O,为什么溶液不呈蓝色呢?

(作者单位:北京十一学校)
