化学图象图表题易错例析
2016-09-26黑龙江卢国锋
◇ 黑龙江 卢国锋
(作者单位:黑龙江省大庆市第五十六中学)
化学图象图表题易错例析
◇黑龙江卢国锋
图象图表题具有信息隐蔽性、思维性强、层次要求高、综合程度大的特点,是考查化学抽象概括能力、逻辑思维能力和读图识图能力的热点题型.对于常考常新的图象图表题,从哪些角度能够有效避免失误呢?现以常见的典型易错试题为例简单加以剖析.
1 只观不察误入歧途
“观”即看,“察”即想,观坐标图中横坐标、纵坐标所表示的物理量,察其数值和单位,察图中起点、拐点、终点、交叉点的化学意义,察图中曲线的走向与变化趋势,察问题解决所涉及的化学原理.只看不想,缺乏思维的加工是肤浅的观察.


图1
A溴酸银的溶解是放热过程;
B温度升高时溴酸银溶解速度加快;
C60 ℃时溴酸银的Ksp约等于6×10-4;
D若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
错因眼光只盯住了曲线随温度升高增大的趋势,想当然认为温度对溶解度的影响大,与硝酸钾溶解度曲线相似,不能采用重结晶法提纯,错选D.

2 实验数据应用无序
要想获得正确的实验结果,一定要运用科学的实验方法,才能找到解决问题的正确思路.条件控制是化学实验的灵魂,如控制化学药品的种类、浓度、状态、体积,控制反应条件温度、压强、电流、电压等.科学逻辑方法,包括比较、分类、归纳、概括.


表1
Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化.
由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有还原性.
Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证.电解pH=1的NaCl溶液做对照实验,记录如表2.

表2
(1)NaCl的浓度是________mol·L-1;
(2)与Ⅱ对比,得出的结论(写出2点)________.
错因(1)误将pH=1作为计算NaCl浓度的关联条件,盲目根据pH=1的NaCl溶液计算,错解c(H+)=10-pHmol·L-1=10-1mol·L-1.(2)就事论事得出结论:结论1,是否生成产物Cl2阳极都没有明显变化;结论2,控制电压可以控制氯气的生成.

(2)用数轴法将实验结果呈现,如图2所示.

图2
结论1:通过控制电压,验证了Fe2+先于Cl-放电; Ⅳ与Ⅱ对比,电压高,氯气放电,产生的Cl2氧化Fe2+,无气泡产生. 结论2:通过控制电压,证实了产生Fe3+的2种原因都成立.
3 审题不细解答随意
审题只求快,没有真正理解题意,盲目解答,导致审题差“毫厘”,解答谬“千里”.


表3
(1)根据上述实验结果,该反应的平衡常数K的计算式为________________.
(2)由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用图3表示.当升高到某温度时,反应重新达到平衡,相应的点分别为________(填字母.)
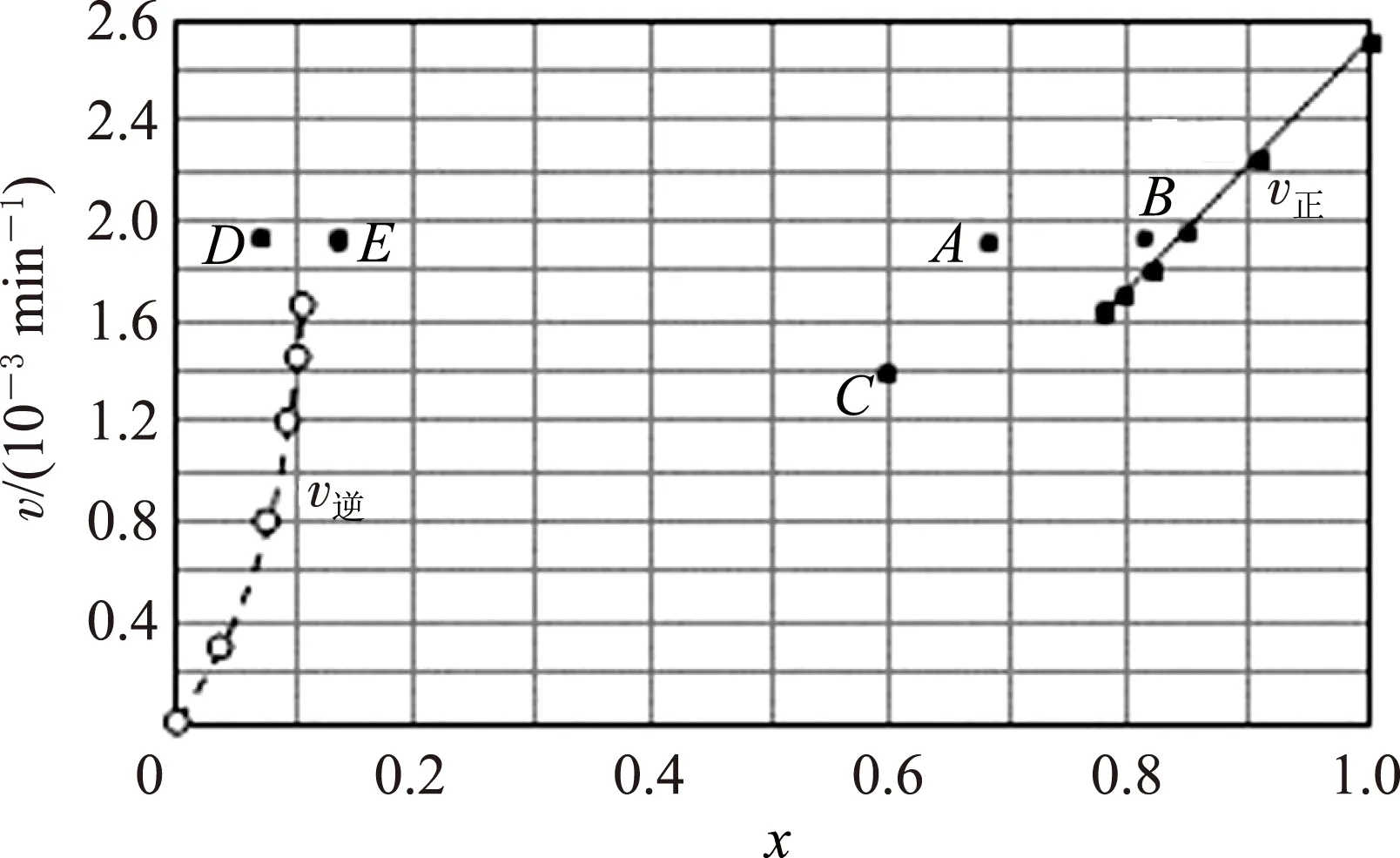
图3


2HI(g)H2(g) +I2(g)
n始/mol100
n变/mol0.2160.1080.108
n平/mol0.7840.1080.108

(2)升高温度分析速率和平衡移动,v正直线上有6个点,组分0.784是最左下的点,温度升高v正增大该点向上移动,x(HI)降低该点向左移动,A点符合要求.同理分析v逆~x(H2), 温度升高v逆增大该点向上移动,x(HI)增大该点向右移动,E点符合要求.
4 眼界狭隘思维不全
物质的变化是多种因素作用的结果,全面分析影响因素,找出关联因素各个击破.

①CO(g)+2H2(g)CH3OH(g)
ΔH1=-99kJ·mol-1;
②CO2(g)+3H2(g)CH3OH(g)+H2O(g)
ΔH2=-58kJ·mol-1;
③CO2(g)+H2(g)CO(g)+H2O(g)
ΔH3=+41kJ·mol-1.

图4
合成气的组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图4所示.α(CO)值随温度升高而________(填“增大”或“减小”),其原因是________.图中的压强由大到小为________,其判断理由是________.
错因分析温度升高对CO转化率的影响,只考虑反应① 没有考虑反应③,认为ΔH1<0,图象可知等压线随温度升高α(CO)降低,其原因是反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO增多,α(CO)减小.选择510~540K中任一条等温线,α(CO)大小为α(CO)1>α(CO)2>α(CO)3,温度不变时,压强越大转化率越高,推断p1>p2>p3.理由是反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,增大压强有利于CO的转化率升高,也没有考虑反应③的影响.

5 情景陌生感觉作答
遇到平时未曾见过的新情境问题,容易失去理性不淡定,跟着感觉答题.为克服失误不仅需要扎实的基本功,更需要毅力和勇气.

图5

在OA段,氢溶解于M中形成固溶体MHx,随着氢气压强的增大,N(H)/N(M)逐渐增大;在AB段,MHx与氢气发生H2反应生成氢化物MHy,氢化反应方程式为zMHx(s)+H2(g)zMHy(s)ΔH1;在B点,氢化反应结束,进一步增大氢气压强,N(H)/N(M)几乎不变.η表示单位质量贮氢合金在氢化反应阶段的最大吸氢量占其总吸氢量的比例,则温度为T1、T2时,η(T1)____η(T2)(填“>”“<”或“=”).当反应处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应可能处于图中的________点(填“b”“c”或“d”).
错因没有理解η的含义,直接利用图象T2曲线在T1之上做出判断,η(T1)<η(T2).恒容体系中通入少量H2,平衡向右移动,N(H)/N(M)增大,气体压强增大,错选b点.

6 自选方案缺乏主见
平时化学实验“照方抓药”,缺少探究化设计训练,不掌握实验探究方法,如实验条件控制方法、测量方法、记录方法,很容易陷入盲目状态,导致设计方案失败.

① 实验目的:探究对溶液中NH4Cl水解程度的影响.
② 设计实验方案,拟定实验表格,完整体现实验方案(列出能直接读取数据的相关物理量及需拟定的数据,数据用字母表示,表4中V(溶液)表示所配制溶液的体积).

表4
③ 按实验序号I所拟数据进行实验,若读取的待测物理量的数值为Y,则NH4Cl水解反应得平衡转化率为____(只列出算式,忽略水自身电离的影响).
错因第1种错误,将提供的V(溶液)错误地认为是已知浓度,只需测定水解出的H+浓度,即pH.第2种错误,选择探究温度的影响,只填写温度和测定结果pH.2种错误都缺少变量控制,只注重结果的填写.

探究温度对NH4Cl水解程度的影响时数据见表5.

表5
探究浓度对NH4Cl水解程度的影响时数据见表6.

表6
③ 如果pH为Y,那么c(H+)=10-Ymol·L-1,物质的量为10-Ymol·L-1×0.1L=10-Y-1mol,那么水解的NH4Cl的物质的量也为10-Y-1mol,质量为10-Y-1mol×53.5g·mol-1=10-Y×5.35g,NH4Cl水解反应得平衡转化率为

7 绘制图象貌似正确
图象绘制是用曲线形式,直观表示出某种化学量随时间或条件的改变而变化.对关键节点进行精确定位,关键节点包括起点、拐点、终点,3点连线呈现图象变化,此3点是采分点,更是易错点.

图6

错因如图7所画图象是平衡后温度升高,平衡逆向移动的图象,错将部分图象当做全过程图象,如图8缺少NH3从无到有的起始阶段,只体现平衡建立和平衡移动2个阶段.

图7 图8

图9

(作者单位:黑龙江省大庆市第五十六中学)
