利用单核苷酸多态性标记定位玉米叶夹角主效QTL
2016-09-26张沁斌秦永田许蒙蒙陈永强李卫华付志远
张沁斌,秦永田,许蒙蒙,陈永强,李卫华,付志远
(1. 河南农业大学农学院,河南 郑州 45002;2. 河南省鹤壁市农业科学研究院,河南 鹤壁 456284)
利用单核苷酸多态性标记定位玉米叶夹角主效QTL
张沁斌1,秦永田2,许蒙蒙1,陈永强1,李卫华1,付志远1
(1. 河南农业大学农学院,河南 郑州 45002;2. 河南省鹤壁市农业科学研究院,河南 鹤壁 456284)
对EMS诱变获得的平展叶夹角突变体M 87-1的遗传规律进行了标记分析。结果表明,在豫82背景影响下,M 87-1与豫82组配的分离群体的叶夹角表现典型的数量性状遗传。在3 072个单核苷酸多态性(Single nucleotide polymorphisms, SNPs)标记中,共检测到1 254个SNPs在双亲间存在多态性。通过简化的数量性状位点(Quantitative trait locus, QTLs)分析方法,对BC1((豫82×M 87-1)×M 87-1)分离群体的叶夹角性状进行遗传定位,共检测到3个主效QTLs,分别位于第1, 2, 7染色体上,其中位于第7染色体上的QTL与叶夹角表型拟合程度最高,可能包含EMS诱变的突变位点。
玉米;叶夹角;主效QTL;单核苷酸多态性
随着饲料加工业的发展和种植业结构的调整,中国玉米长期自给有余的现状在2010年出现逆转,成为玉米净进口国。在耕地资源日益减少的情况下,依靠单位面积产量的提高来增加总产已成为中国现阶段玉米育种的主要目标[1-2]。单位面积产量的提高以群体光合效率的增强、抗耐倒伏和逆境能力的提高为基础。叶夹角是玉米株型育种中的重要性状之一,叶夹角小的株型能提升种植密度,增强光合性能。因此,定位和克隆控制玉米叶夹角性状的QTLs,解析玉米株型性状分子生物学机制,对促进耐密型高产玉米新品种选育和相关分子标记辅助选择育种具有重要理论和实践意义。尽管叶夹角性状是株型育种的重要参考指标,但是相应QTL的定位和克隆研究很少。目前仅有少数几篇关于玉米叶夹角QTL定位与分析的报道,且这些研究多是利用SSR标记进行遗传分析和定位[3-8]。该方法得到的定位区间大,进一步精细定位所需要的多态性SSR标记较难开发。与SSR标记相比,SNP标记数量多,在基因组中的分布密度很高,更适合于对数量性状的遗传解剖以及基于群体的基因定位和克隆研究。而且转录组测序开发的SNP标记多为基因内标记,有助于更快实现候选基因的精细定位。TIAN等[9]通过全基因组关联方法对玉米叶夹角相关QTL进行定位分析,是目前仅有的1篇用SNPs获得叶夹角主效QTL的文章。通过EMS诱变研究,获得了一个叶夹角基本趋于平展的突变体M 87-1,为解析其突变位点,与87-1组配了F2和BC1群体。F1叶夹角表现与87-1接近,F2(720株)和BC1(630株)群体表现单隐性基因控制的性状遗传分离规律。但由于EMS诱变导致的突变多为单碱基突变,在有限的分离群体中未筛选到与叶夹角性状紧密连锁的SSR标记。进一步利用M 87-1与紧凑株型自交系豫82构建了BC1分离群体,在豫82背景影响下,叶夹角性状的分离表现典型的数量性状遗传特点。本研究利用SNPs标记对该分离群体的叶夹角性状进行遗传分析,鉴定控制叶夹角性状的主效QTLs,为叶夹角相应基因的克隆奠定基础,为合理株型育种提供可用的基因和标记信息。
1 材料与方法
1.1供试材料
2013年夏以87-1为材料,通过EMS诱变获得了叶夹角突变体M 87-1(图1)。2013年冬于海南组配了2个杂交组合F1(87-1×M 87-1和豫82×M 87-1)。2014年夏于河南农业大学科教园区组配了87-1为背景的F2(720株)和BC1(630株)分离群体及豫82为背景的BC1分离群体(540株)。
1.2田间试验
分离群体及亲本材料于2015年夏分别种植于河南农业大学科教园区和长葛市,田间采取完全随机区组试验设计,行距0.67 m,株距0.22 m,每行20株。
1.3性状调查
在植株授粉后15 d对单株穗部叶及穗上和穗下第1片叶与茎的夹角进行测定。亲本及F1各选取有代表性的20株,分别测量单株的穗位叶、穗位上和穗位下第1叶叶夹角,并以相应的平均值代表各自的叶夹角。
1.4标记分析及连锁作图
采用CTAB法提取BC1单株及双亲DNA(幼嫩叶片),并用于单核苷酸多态性(SNP)标记分析。3 072个均匀分布于玉米10条染色体的SNP标记用于检测双亲的核苷酸多态性。BC1分离群体中两种极端类型个体(93株)用于亲本间有多态性的SNP标记分析。SNP标记的统计分析在Genome studio data分析软件(Illumina Inc., San Diego, CA, USA)中进行。连锁遗传分析和主效QTL定位同时采用JoinMap 4.0软件的最大释然估计算法[10]和fisher独立性测验完成。
2 结果与分析
2.1棒三叶叶夹角的表型变异分析
87-1,M 87-1,豫82及杂种F1(豫82×M 87-1)的穗位叶叶夹角普遍较穗上叶叶夹角和穗下叶叶夹角大(表1)。EMS诱变得到的M 87-1突变体的棒三叶叶夹角与87-1有显著变异,且变异倍数都在2倍以上,较紧凑株型自交系豫82的棒三叶叶夹角变异倍数高达3倍以上,且2个地点间棒三叶叶夹角的变化趋势一致。可见,M 87-1与豫82组配群体较M 87-1与 87-1组配群体能够获得更丰富的叶夹角表型变异。豫82与M 87-1的杂交种的棒三叶叶夹角均介于低亲和双亲平均值之间,说明棒三叶叶夹角性状表现出负的中亲优势。以上结果表明,紧凑株型玉米品种在株型改良方面有较大利用价值,可以在很大程度上减小棒三叶叶夹角,改良特定自交系的株型,改善其光合性能。
对BC1分离群体的棒三叶叶夹角进行方差分析,结果表明,棒三叶叶夹角在基因型间均达到极显著水平(表2),2个亲本自交系的棒三叶叶夹角在不同地点间的差异都不显著,杂交组合仅穗下叶叶夹角在不同地点间存在极显著差异。以上结果说明,基因型间的差异是棒三叶叶夹角差异显著性的主要原因。
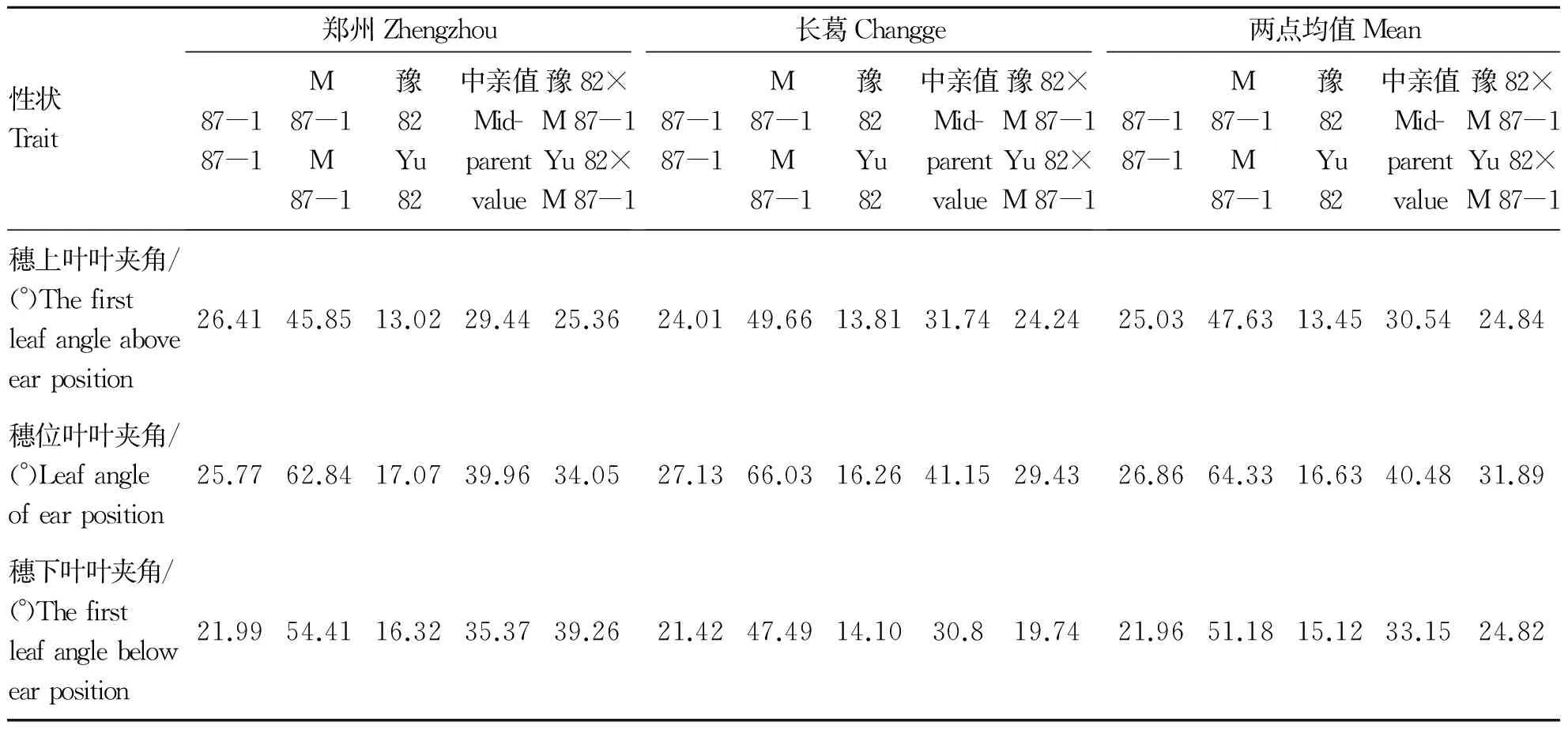
表1 亲本及F1棒三叶叶夹角分析Table 1 Leaf angle analysis of the trefoil angel bar in parental lines and F1

表2 BC1群体棒三叶叶夹角的方差分析Table 2 Combined analysis of variance of the trefoil angel bar leaf angle
注:***为0.001显著水平;a为P值.
Note: *** means significant level at 0.001;ameansPvalue.
2.2BC1群体叶夹角性状的SNP分析
为定位叶夹角性状的主效基因,研究采用了简化QTL定位方法,仅选择群体中的两种极端叶夹角类型个体进行遗传分析。极端类型个体共有93株,46株叶夹角极小,47株叶夹角极大。3 072个SNP标记中,剔除缺失率大于20%的标记和亲本是杂合的标记,共检测到1 254个在亲本间有多态性的标记。用多态性SNPs的分布频数和极端叶夹角表型个体的理论分布频数做Fisher独立性测验,结果显示,在玉米第1, 2, 7条染色体上存在叶夹角的主效QTL,qLA1,qLA2和qLA7。qLA1与SNP标记SYN35048和PZE-101205714紧密连锁,qLA2与SNP标记PZE-102013873和PZE-102017304紧密连锁,qLA7与SNP标记SYN19272和 PZE-107074405紧密连锁(图1)。将极端类型个体表型对应的基因型作为标记信息,用joinmap软件得到了类似的结果,qLA1与邻近标记的遗传距离最远,qLA2与邻近标记的遗传距离次之,qLA7与邻近标记的遗传距离最近。

图1 多态性SNPs与叶夹角表型间的fisher独立测验结果Fig.1 Results of fisher test between polymorphic markers and leaf angle
3 结论与讨论
叶夹角是玉米合理株型育种中的重要参考指标。紧凑上冲型玉米品种通常种植密度高,叶面向上挺拔,有利于降低玉米群体遮荫综合征,提高光合效率。前人对玉米叶夹角遗传规律进行了较为深入的研究,认为叶夹角性状的遗传力高,在遗传中同时受基因的加性效应和非加性效应的影响,但加性效应在遗传中占主导地位。因此,可以通过有利等位基因的标记筛选和聚合获得合理株型种质资源,为玉米株型育种提供有利玉米株型的自交系。
基于叶夹角性状在株型育种中的重要性,多位学者利用不同的群体和方法对控制叶夹角性状的基因进行了遗传定位分析。MICKELSON等[3]利用B 73×Mo 17的重组自交系群体,采用复合区间作图法,2个环境共检测到9个控制叶夹角的QTL,分别位于第1, 2, 4, 5和7染色体,其中qLA7(第7染色体)可以解释27.7%的叶夹角表型变异,是一个主效QTL。TIAN等[9]以B 73为母本,以25个自交系为父本构建的25个重组自交系群为材料采用GWAS方法对叶夹角进行QTL定位,共定位到30个主效QTL,分布于10条染色体上。于永涛等[4]以3个F2群体(H 21×M o17, 自330×K 36, B 73×L 050)及其衍生的3个F2:3家系为材料,利用区间作图法,定位到9个控制叶夹角的QTL,分别位于第1, 2, 3, 8, 9和10染色体上。路明等[5]以掖478×丹340的F2为群体,利用复合区间作图法,共定位到6个控制叶夹角的QTL,分别位于第1, 2, 3和5染色体上,位于第1和第3染色体上的主效QTL可以分别解释10.8%和11.2%的叶夹角表型变异。KU等[6]利用豫82与沈137、豫87-1、D 132构建的3套F2群体及相应的F2:3家系为材料,共检测到14个叶夹角QTLs,分别位于第1, 2, 3, 4, 5, 7, 8和9染色体上。KU等[7]通过精细定位克隆了位于第1染色体上的qTAC1。ZHANG等[8]通过精细定位克隆了位于第4染色体上的主效qLAC4-1。本研究利用EMS诱变得到的叶夹角突变体与豫82(回交亲本)构建的BC1群体为材料,通过简化QTL定位方法,同时利用fisher测验和Jionmap作图,鉴定的3个主效QTLs中,qLA7将是叶夹角主效基因克隆的一个关键QTL。本研究利用的是分布于全基因的SNPs标记,较前人研究中所用的SSR标记更有助于明确QTL区间内相应的基因信息。
[1] 佟屏亚.中国玉米种业形势和发展前景 [J].玉米科学,2012,20(2):144-148.
[2] 杨镇, 才卓, 景希强, 等. 东北玉米 [M]. 北京:中国农业出版社, 2007:73-109.
[3] MICKELSON S M, STUBER C S, SENIOR L. Quantitative trait loci controlling leaf and tassel traits in a B 73×Mo 17 population of maize [J]. Crop Science, 2002, 42(6): 1902-1909.
[4] 于永涛, 张吉民, 石云素, 等. 利用不同群体对玉米株高和叶片夹角的QTL分析 [J]. 玉米科学, 2006, 14(2): 88-92.
[5] 路明, 周芳, 谢传晓, 等. 玉米杂交种掖单13号的SSR连锁图谱构建与叶夹角和叶向值的QTL定位与分析 [J]. 遗传, 2007, 29(9): 1131-1138.
[6] KU L X,ZHANG J,GUO S L, et al. Integrated multiple population analysis of leaf architecture traits in maize (ZeaMaysL.) [J]. Journal of Experimental Botany, 2011, 63(1): 261-274.
[7] KU L X, WEI X M, ZHANG S F, et al. Cloning and characterization of a putativeTAC1 ortholog associated with leaf angle in maize (ZeamaysL.) [J]. PLoS one, 2011, 6(6): e20621.
[8] ZHANG J, KU L X, HaAN Z P, et al. TheZmCLA4 gene in theqLA4-1 QTL controls leaf angle in maize (ZeamaysL.) [J]. Journal of Experimental Botany, 2014, 65(17): 5063-5076.
[9] TIAN F, BRADBURY P J, BROWN P J, et al. Genome-wide association study of leaf architecture in the maize nested association mapping population [J]. Nature Genetics, 2011, 43: 159-162.
[10] VAN OOIJEN J W. JoinMap 4. Software for the calculation of genetic linkage maps in experimental populations [M]. Wageningen (Netherlands): B V Kyazma, 2006.
(责任编辑:常思敏)
Geneticanalysisforleafangleinmaize
ZHANG Qinbin1, QIN Yongtian2, XU Mengmeng1, CHEN Yongqiang1, LI Weihua1, FU Zhiyuan1
(1. College of Agronomy, Henan Agricultural University, Zhengzhou 450002,China; 2. Hebi Agricultural Science Institute, Hebi 456284, China)
The marker analysis of genetic rule was conducted for leaf angle mutant of M 87-1 derived from EMS mutagenesis. The results showed that the leaf angle was quantitatively controlled under the genetic background of Yu 82. 1 254 of the 3 072 SNPs were polymorphic between the two parental lines M 87-1 and Yu 82. Three major QTLs were detected on chromosome 1, 2, and 7 in BC1population by simplified QTL analysis, respectively. The degree of fitting between QTL and leaf angle was the best for QTL on chromosome 7. And this QTL might contain the EMS mutation site in M 87-1.
maize; leaf angle; major quantitative trait locus; single nucleotide polymorphism
S 513
:A
2015-09-28
省部共建小麦玉米作物学国家重点实验室项目(SKL2014ZH-09)
张沁斌(1990-),男,河南鹤壁人,硕士研究生,主要从事玉米遗传育种研究。
付志远(1980-),女,河南安阳人,副教授,博士。
1000-2340(2016)02-0157-04
