鸡β干扰素的原核表达及抗病毒活性检测
2016-09-26吴斯宇黄健妮冯赛祥欧阳国文向程威焦培荣
吴斯宇,黄健妮,崔 进,冯赛祥,欧阳国文,向程威,郭 旸,廖 明,焦培荣
(华南农业大学兽医学院 人兽共患病防控制剂国家地方联合工程实验室,广州510642)
·研究论文·
鸡β干扰素的原核表达及抗病毒活性检测
吴斯宇,黄健妮,崔 进,冯赛祥,欧阳国文,向程威,郭 旸,廖 明,焦培荣
(华南农业大学兽医学院 人兽共患病防控制剂国家地方联合工程实验室,广州510642)
根据大肠杆菌密码子的偏好性对GenBank中发表的鸡β干扰素基因序列进行密码子优化与人工合成,构建原核表达质粒pET-28b-ChIFN-β,重组表达质粒转化大肠杆菌BL21(DE3),经IPTG诱导表达,产物主要以包涵体形式存在。包涵体进行变性、复性和镍柱亲和纯化后,SDS-PAGE、Western blot分析表明pET-28b-ChIFN-β表达正确,并且表达量较高。重组鸡β干扰素蛋白在DF-1细胞上能明显抑制水疱性口炎病毒繁殖,抗病毒活性达2.73×106UI/mg。本研究结果为鸡β干扰素在临床防治禽类病毒性疾病的探索奠定了基础。
鸡β干扰素; 原核表达; 抗病毒活性
干扰素(interferon,IFN)是一类重要的细胞因子,是由生物体细胞受到病毒或其他诱生剂的作用而产生的分泌性蛋白,具有抗病毒、抗肿瘤细胞增殖、免疫调节等多种生物学活性。与哺乳动物相似,鸡的干扰素也有α、β、γ三种类型。Sekellick等[1]1994年首次成功克隆和表达出了鸡干扰素基因。1995年Digby等[2]克隆出鸡γ干扰素基因。Sikc等[3]随后克隆出鸡β干扰素(chicken interferon-β,ChIFN-β)基因。近年来很多国内学者也开展了鸡干扰素的抗病毒研究。陈红英等[4]克隆出了罗曼鸡α干扰素基因,并通过原核表达获得了具有抗病毒活性的干扰素。戴华等[5]通过原核表达获得了能够抑制H5N1禽流感病毒的鸡α干扰素。王黎霞等[6]克隆出了海蓝灰蛋鸡的γ干扰素基因并成功进行了原核表达。何静等[7]将鸡α干扰素基因与白细胞介素18基因融合表达获得了具有抗病毒活性的融合蛋白。目前国内大部分的研究主要集中在重组鸡α干扰素的表达和活性分析,但关于鸡β干扰素的研究相对较少[8]。禽流感、新城疫等禽类病毒性疾病在我国时有发生,其病原变异快,增加了药物预防和疫苗免疫的难度,给我国的养禽业造成了巨大的经济损失,因此迫切需要研制广谱抗病毒生物制剂来防治禽类病毒性疾病。研究表明鸡β干扰素具有良好的抗病毒生物活性,可以作为一种广谱的抗病毒生物制剂。
本研究根据大肠杆菌密码子的偏好性对GenBank中发表的鸡β干扰素基因序列进行了密码子优化,人工合成该鸡β干扰素基因,成功构建了该基因的原核表达质粒,经诱导表达后该蛋白以包涵体的形式表达。SDS-PAGE结果显示鸡干扰素成功表达,细胞病变抑制试验显示其抗病毒效价达2.73×106UI/ mg。
1 材料与方法
1.1菌种与病毒 E.coli/DH5α、BL21(DE3)、水疱性口炎病毒(Vesicular stomatitis virus,VSV)由华南农业大学兽医学院动物传染病实验室保存。
1.2质粒及相关酶 pET-28b为本实验室保存;限制酶EcoR I、Nde I及T4 DNA连接酶等购置于宝生物工程(大连)有限公司;DNA片段快速回收试剂盒购于天根生化科技有限公司。
1.3鸡β干扰素基因的获得及密码子的优化 参照NCBI中已发表的鸡β干扰素基因序列(AHB60 416.1),根据大肠杆菌密码子的偏好性对去除信号肽序列的干扰素基因进行密码子的优化,优化后的序列由英潍捷基(上海)贸易有限公司合成。
根据密码子优化后的鸡β干扰素基因,利用primer primier 5.0软件设计1对引物,由英潍捷基(上海)贸易有限公司合成。ChIFN-β- NdeI - UP(上游引物):5'-AGCCATATGATGTGTAATCACCT GCGTCA -3';ChIFN-β- EcoRI -DOWN(下游引物):5'-AAGGAATTCTTATTGGGTATTCAGACG TT -3'
1.4重组表达质粒的构建 以合成的鸡β干扰素基因为模板,采用含Nde I酶切位点的ChIFN-β-F,含EcoR I酶切位点的ChIFN-β-R为引物,用PCR扩增鸡β干扰素基因。pET-28b载体、PCR产物经Nde I、EcoR I双酶切回收,连接,获得重组质粒,转化至大肠杆菌DH5α感受态细胞。通过卡那霉素抗性筛选、PCR及Nde I、EcoR I双酶切鉴定重组质粒,鉴定正确的重组质粒送英潍捷基(上海)贸易有限公司测序,进一步验证重组质粒是否构建成功。
1.5重组表达质粒的转化和鉴定 将测序正确的鸡β干扰素重组质粒,转化BL21(DE3)感受态细胞,经卡那霉素抗性筛选后,PCR检测确认插入片段是否为目的基因。
1.6重组表达质粒在大肠杆菌中的诱导表达 将鉴定正确的表达菌株接种于液体LB培养基,37℃震荡培养至OD值为0.6时,以终浓度为1 mmol/L IPTG诱导培养4 h。8000×g离心收集菌体,进行SDS-PAGE以及Western blot分析。
1.7表达产物的提取与纯化
1.7.1包涵体的提取与处理 取1 L诱导表达的重组菌E.coli/pET-28b-ChIFN-β,以8000×g离心收集菌体,按1:5的比例加入菌体超声缓冲液(0.05 mol/ L Tris、0.0005 mol/L EDTA、0.05 mol/L NaCl,pH7.0)重悬菌体,冰浴条件下,充分超声破碎,然后于4℃、12 000×g 离心15 min,收集沉淀(沉淀即为粗制包涵体)。离心收集的包涵体用洗涤缓冲液1(0.05 mol/L Tris-HCl、0.5% TritonX-100、0.5 mol/L NaCl,pH8.0)充分悬浮,磁力搅拌30 min后,4℃、12 000×g离心20 min。然后依次用洗涤缓冲液2(0.05 mol/L Tris-HCl、2 mol/L Uera、1%巯基乙醇、0.002 mol/L EDTA、0.15 mol/L Nacl、pH8.0)、洗涤缓冲液3(0.05 mol/L Tris- HCl、4 mol/L Uera、0.005 mol/L DTT、0.5 mol/L NaCl,pH8.0)对包涵体进行洗涤。
1.7.2包涵体变性 使用含8 mol/L尿素的变性液(0.05mol/L Tris-HCl、8 mol/L Uera、0.005 mol/L DTT,pH8.0)按1:5的包涵体变性液比例将洗涤后的包涵体溶解于变性液中。室温磁力搅拌6 h,然后以4℃、12 000×g离心20 min,收集变性液上清,4℃保存。
1.7.3变性液复性 采取梯度稀释法进行蛋白复性,把收集的变性液上清按1:20加至预冷的复性液中(0.015 mol/L Tris-HCl、0.15 mol/L NaCl、0.3 mol/ L L-Arg、0.001 mol/L GSSG、0.005 mol/L GSH、10%甘油,pH7.0)。复性时采用滴管悬滴法,逐滴向复性液中加入变性液,同时磁力搅拌5 min,而后转入4℃冰箱,静置复性24 h。
1.7.4镍柱亲和纯化 复性完成后,复性液经透析以除去L-Arg(会影响蛋白镍柱结合),参照QIAGEN公司镍柱纯化说明书纯化含有His Tag的目的蛋白。
1.7.5SDS-PAGE、Western blot检测 将SDS-PAGE凝胶上的蛋白转印至硝酸纤维素膜(NC),用His标签抗体(1:2000稀释)作为一抗,用辣根过氧化物酶标记的羊抗鼠(1:10 000稀释)作为二抗,Western blot检测目的蛋白。
1.8重组ChIFN-β抗病毒活性测定 采用细胞病变抑制法测定重组鸡干扰素的活性。将DF-1细胞接种于96孔细胞培养板,在37℃、5% CO2的培养箱中培养至细胞长成单层。96孔板的12列分为3组,第1组(第1列)为阳性病毒对照组,第2组为干扰素试验组(第2~11列),第3组为正常细胞对照组(第12列)。首先干扰素试验组每列分别加入4倍系列稀释(41~410)的重组干扰素(每孔100 μL),第1、第3组只作换液处理。培养12 h后,第1、2组每列分别加入1000TCID50的VSV(TCID50为7.32),第3组只作换液处理。培养至24 h后开始观察细胞病变,待阳性病毒对照组出现明显病变时(一般为48~60 h)记录结果[5]。以能抑制50%细胞发生病变的最高稀释度的倒数作为抗VSV的病毒活性单位,采用Reed-Muench法计算重组鸡β干扰素蛋白抗VSV的病毒活性单位。
2 结果
2.1重组鸡β干扰素表达质粒的构建 重组阳性质粒经EcoR I、Nde I双酶切鉴定,双酶切后片段在500 bp与750 bp间,与目的片段534 bp相符。阳性质粒送英潍捷基(上海)贸易有限公司测序鉴定,测序结果与优化的鸡β干扰素的序列比对分析,表明重组鸡β干扰素原核表达质粒得到成功构建。
2.2重组鸡β干扰素的诱导表达分析 重组菌E.coli/ pET-28b-ChIFN-β经IPTG诱导后,表达的蛋白通过SDS-PAGE 、Western blot分析,证实目的蛋白表达成功,且主要以包涵体的形式表达,所得重组蛋白的分子质量约21 kDa,与预测的目的蛋白大小相符,说明重组鸡β干扰素表达正确。
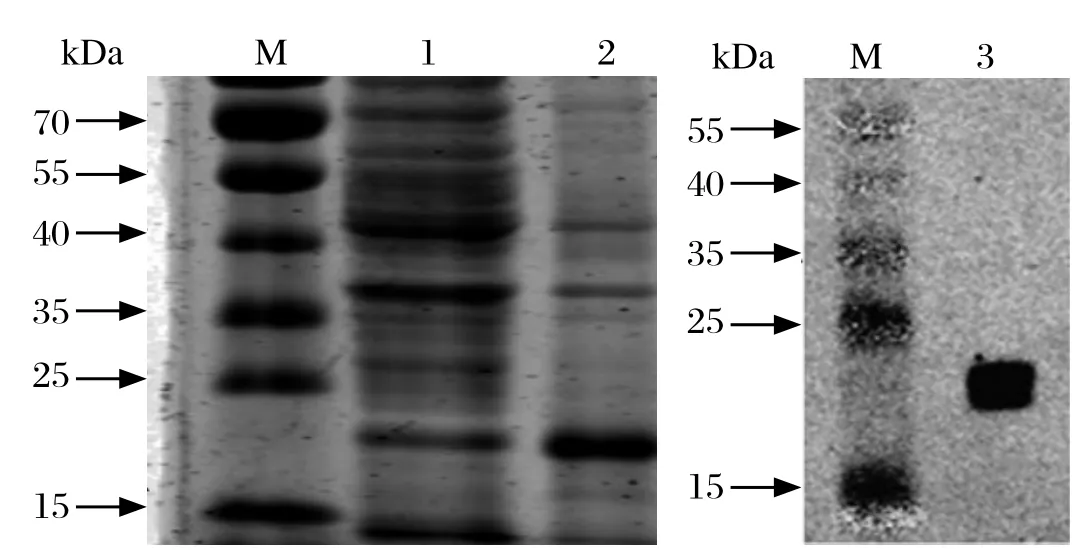
图1 重组蛋白SDS-PAGE和Western blot检测Fig. 1 SDS-PAGE and Western blot analysis of the expressed protein
2.3重组鸡β干扰素的复性、纯化结果 包涵体经过尿素变性、复性、透析、镍柱纯化后,进行SDSPAGE分析,结果显示纯化的目的蛋白的分子量约21 kDa,与预期相符。
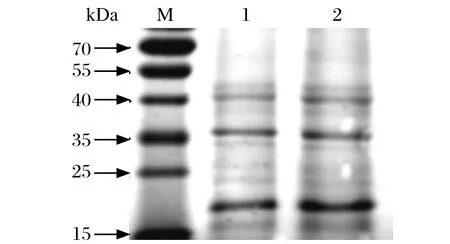
图3 纯化重组蛋白的SDS-PAGE检测Fig. 3 SDS-PAGE analysis of the expressed protein purifi ed by nickel affi nity chromatography
2.4重组鸡β干扰素的抗病毒活性测定结果 细胞病变抑制试验结果显示重组鸡β干扰素蛋白具有抑制VSV繁殖的抗病毒活性(图4),采用Reed-Muench法计算得重组鸡β干扰素蛋白抗VSV活性为2.73×106UI/mg。

图4 重组鸡β干扰素蛋白抗病毒活性Fig. 4 Antiviral activities of recombinant ChIFN-β protein in DF-1 cell lines
3 讨论
干扰素是机体天然免疫系统中重要的一员,其介导的抗病毒反应是天然免疫系统第一道防线。病毒入侵时,机体细胞可以通过细胞内外的模式识别受体对病毒进行识别,然后激活与干扰素相关的天然免疫信号通路,诱导干扰素基因的表达。表达的干扰素又可以与其他细胞上的特异性受体结合,介导细胞内抗病毒信号的转导,产生抗病毒蛋白,从而有效抵抗病毒的入侵[9-13]。自干扰素被发现以来,人类对干扰素的应用进行了多年深入的研究。人类干扰素的应用研发历史可以分为三个阶段,第一阶段是天然原型干扰素,主要采用病毒诱导离体的人白细胞和人源转化细胞系合成干扰素,然后分离纯化干扰素。其缺点是白细胞来源少;诱导出来的干扰素是各个亚型的混合物,疗效一般;有病毒污染的风险。第二阶段是重组干扰素。20世纪80年代起研究人员已探索出干扰素的克隆以及基因改造的技术,因此主要采用基因工程和重组技术大量制备人类干扰素,同时提高了制品的纯度和效价,但重组干扰素在体内的半衰期短,易被清除。第三阶段是长效干扰素的研制。在第二阶段的基础上,采用PEG化修饰、白蛋白融合技术制备,改善了药代动力学过程,提高了疗效[14]。目前人类干扰素已经大规模临床应用于治疗多种病毒性疾病,如乙型肝炎等,并取得了很好的疗效。
与人类干扰素生物学功能类似,重组鸡干扰素是通过对自身免疫系统的调节来达到抗病毒的目的。与传统的化学药物、疫苗等兽用抗病毒生物制品相比,它不会使病原产生耐药性突变和药物残留,因此近年来重组鸡干扰素的研究也越来越受到重视。目前的研究大多集中在鸡α干扰素的克隆表达以及抗病毒试验,还不具备大规模应用的条件。对于鸡β干扰素原核表达以及抗病毒活性研究也较少。
本研究通过原核表达的方式表达并纯化出了重组鸡β干扰素蛋白,采用细胞病变抑制法检测其抑制VSV繁殖的抗病毒活性,活性单位达到2.73×106UI/mg。这一结果为重组鸡β干扰素生物功能的研究及相关生物制品的研制奠定了基础。
[1] Sekellick M J, Ferranno A F, Hopkins D A, et al. Chicken interferon gene: cloning, expression, and analysis[J]. J Interferon Res, 1994, 14(2): 71-79.
[2] Digby M R, Lowenthal J W. Cloning and expression of the chicken interferon-gamma gene[J]. Interferon Cytokine Res, 1995, 15(11): 39-45.
[3] Sick C, Schultz U, Staeheli P, et al. Family of genes coding for two serologically distinct chicken interferons[J]. Biol Chem, 1996, 271(13): 7635-7369.
[4] 陈红英, 宋凌云, 崔保安, 等. 鸡α干扰素基因的克隆、原核表达及抗病毒活性测定[J]. 华北农学报, 2009, 24(1): 40-43.
[5] 戴华, 郑佳玉, 陈俊华, 等. 鸡α干扰素基因的原核表达及其活性测定[J]. 中国预防兽医学报, 2009, 31(10): 804-807.
[6] 王黎霞, 王彩霞, 徐庚, 等. 鸡干扰素-γ的原核表达与生物活性[J]. 中国兽医杂志, 2010, (3): 28-30.
[7] 何静, 张盼盼, 孙敏华, 等. 鸡α干扰素/白细胞介素18基因的融合表达及抗病毒活性研究[J]. 华南农业大学学报,2015, 36(1): 18-22.
[8] Cai M, Zhu F, Shen P. Expression and purification of chicken beta interferon and its antivirus immunological activity[J]. Protein Expr Purif, 2012, 84(1): 123-129.
[9] Rathinam V A, Fitzgerald K A. Innate immune sensing of DNA viruses[J]. Virology, 2011, 411(2): 153-162.
[10] Akira S, Uematsu S, Takeuchi O. Pathogen recognition and innate immunity[J]. Cell, 2006, 124(4): 783-801
[11] Janeway C A Jr, Medzhitov R. Innate immune recognition[J]. Annu Rev Immunol, 2002, 20: 197-216.
[12] Medzhitov R. Recognition of microorganisms and activation of the immune response[J]. Nature, 2007,449(7164): 819-826.
[13] Barbalat R, Ewald S E, Mouchess M L, et al. Nucleic acid recognition by the innate immune system[J]. Annu Rev Immunol, 2011, 29: 185-214.
[14] 赵广荣. 重组人干扰素的研究进展[J].中国生物制品学杂志, 2010, 23(2): 1384-1388.
PROKARYOTIC EXPRESSION AND ANTIVIRAL EFFECT OF CHICKEN INTERFERON- β
WU Si-yu, HUANG Jian-ni, CUI Jin, FENG Sai-xiang, OUYANG Guo-wen, XIANG Cheng-wei,GUO Yang, LIAO Ming, JIAO Pei-rong
(National and Regional Joint Engineering Laboratory for Medicament of Zoonosis Prevention and Control, College of Veterinary Medicine,South China Agricultural University, Guangzhou 510642, China)
Chicken interferon-β (ChIFN-β) gene sequence from GenBank was optimized and synthesized based on the codon preference of E.coli. The ChIFN-β gene was cloned into prokaryotic expression vector pET-28b. Analysis of SDS-PAGE and Western blot indicated that pET-28b-ChIFN-β was correctly and highly expressed in E. coli induced with IPTG. The expressed protein was purifi ed via nickel affi nity chromatography after being denatured and re-natured. The purifi ed recombinant ChIFN-β protein was able to inhibit vesicular stomatitis virus replication at 2.73×106UI/mg on DF-1 cells. The results of the present study would be benefi t to the research of chicken interferon β regarding prevention and treatment of avian viral diseases.
Chicken interferon-β; prokaryotic expression; antiviral effect
S852.42
A
1674-6422(2016)04-0059-05
2016-04-15
科技部国际合作项目(2013DFA31940);广州市科技计划项目(2013J4500030、201300000037)
吴斯宇,男,硕士研究生,预防兽医学专业
焦培荣,E-mail:prjiao@scau.edu.cn;廖明,E-mail:mliao@scau.edu.cn
