楮头红皂苷的抑菌效果和抗乙肝病毒活性
2016-09-26谢勇平李宇翔张文连申爱丽李清禄
谢勇平, 李宇翔, 张文连, 申爱丽, 李清禄
(1.福建农林大学生命科学学院,福建 福州 350002;2.福建农林大学省级动物药物工程实验室,福建 福州 350002;3.福建省疾病控制中心,福建 福州 350001)
楮头红皂苷的抑菌效果和抗乙肝病毒活性
谢勇平1,2, 李宇翔3, 张文连1, 申爱丽1, 李清禄1,2
(1.福建农林大学生命科学学院,福建 福州 350002;2.福建农林大学省级动物药物工程实验室,福建 福州 350002;3.福建省疾病控制中心,福建 福州 350001)
将楮头红醇提取物用正丁醇萃取,萃取物经硅胶柱层析和制备型高效液相色谱(PHPLC)纯化得一纯净物,通过IR、ESI-MS和13C NMR谱等分析,鉴定为呋甾烷型甾体皂苷,命名为楮头红皂苷A(SWSA),系首次从楮头红中提取得到.抑菌试验结果表明:SWSA对金黄色葡萄球菌、枯草芽孢杆菌、耶尔森氏菌和嗜水气单胞菌均有较好的抑制效果,其最小抑菌浓度分别为2.8、3.3、2.5和2.2 mg·mL-1;对大肠埃希氏菌和铜绿假单胞菌的抑制效果不明显.通过3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)试验检测SWSA对HepG2.2.15细胞的毒性,采用酶联免疫吸附试验(ELISA)法测定各组细胞培养上清液中HBsAg和HBeAg的水平,综合评价不同含量SWSA体外抗乙肝病毒(HBV)的活性.结果表明,SWSA处理 HepG2.2.15细胞后,HBsAg和HBeAg的表达均呈时间和剂量依赖性抑制,治疗指数分别为6.43和4.23,预示SWSA具有一定的体外抗HBV活性.
楮头红; 皂苷; 抑菌活性; HepG2.2.15细胞; 乙肝病毒
乙肝病毒(hepatitis B virus, HBV)感染是一个世界性的健康问题,它不仅可以导致急、慢性HBV感染,还与75%~90%的原发性肝癌相关.目前临床上用于治疗HBV感染的药物除干扰素外,还有众多化学合成药物,如核苷类似物阿糖腺苷、拉米夫定、泛昔洛韦、阿地福韦和恩他卡韦等.这些药物已在实验室和临床应用中被证实能显著抑制HBV DNA的复制或抑制HBsAg和HBeAg的表达与分泌[1-4].然而这些药物存在一定的不足,如耐药性及副作用等,停药后发生谷丙转氨酶(ALT)反跳,甚至发生重症肝炎[5],上述种种不足使得在临床应用上受到极大的限制.随着天然植物及其提取物抗病毒和调节免疫等有效成分研究的不断深入,人们发现天然药物具有对人体低毒副作用和不易产生耐药性等显著特点.针对目前病毒性肝炎治疗中的困难,寻找与证实有效天然药物已经成为临床治疗病毒性肝炎的希望与重要手段.传统中草药品种繁多,已广泛应用于临床治疗慢性乙型肝炎并取得一定疗效[6].
楮头红(SarcopyramisnepalensisWall)属野牡丹科肉穗草属,主要分布于中国的福建、台湾、四川、云南、江西、广西、广东、湖北和贵州等地[7].楮头红主治肺热咳嗽和急性肝炎,在福建民间广泛用于治疗急、慢性肝炎,疗效显著[8].药理活性研究表明,楮头红提取物具有多种药理活性,如正丁醇部位具有较强的保肝护肝、抗病毒和抑菌作用等活性[9].迄今为止,已从楮头红提取分离得到很多具有很好药理活性的物质,如β-谷甾醇、胡萝卜苷、山柰酚、槲皮素、槲皮素-3-O-β-D-葡萄糖苷、芦丁、山柰酚-3-O-β-D-葡萄糖苷[10-11]和多糖[12]等.经分离、鉴定,正丁醇部位的主要活性物质为皂苷类物质,本试验初步探讨该皂苷类物质的结构、抗乙肝病毒和抑菌活性,并测定了其最低抑菌浓度(minimum inhibitory concentration, MIC),旨在为楮头红药理活性成分的筛选和临床应用提供参考.
1 材料与方法
1.1材料
楮头红皂苷A(S.nepalensissaponin A, SWSA)为褐色粉末,由本实验室提取分离.
大肠杆菌(Escherichiacoli)、金黄色葡萄球菌(Staphyloccocusaureus)、铜绿假单胞菌(Pseudomonasaeruginosa)、枯草芽孢杆菌(Bacillussubtilis)、嗜水气单胞菌(Aeromonashydrophila)和耶尔森氏菌(Yersiniavanloghem)由福建农林大学微生物实验室提供.分别将各菌株接种至装有5 mL的营养肉汤培养基的试管中,于37 ℃培养18 h.
HBV DNA克隆转染人肝癌细胞(HepG2)的2.2.15细胞系,由美国Mount Sinai医学中心构建,北京军事医学科学院引进并保藏,引进后进行传代培养,置5% CO2的培养箱于37 ℃培养;培养基为DMEM,在培养基中添加10%胎牛血清和200 mg·mL-1G418;DMEM培养基和胎牛血清购自GIBCO公司;胰蛋白酶和L-谷氨酰胺购自Amresco公司;G418购自Promega公司;青霉素和链霉素购自中国华北制药厂;二甲基亚砜(dimethylsulfoxide, DMSO)购自Sigma公司;HBsAg和HbeAg ELISA检测试剂盒购自上海科华生物工程公司;拉米夫定购自苏州葛兰素史克制药有限公司,用DMSO适量溶解后,DMEM稀释配制成试验所需含量,置4 ℃的冰箱保存(临用前用0.22 μm滤膜过滤);其他所需化学试剂均为分析纯.
1.2SWSA的制备
楮头红全草粉末用95%乙醇于80 ℃回流浸提3次,每次3 h,合并滤液减压浓缩成浸膏.浸膏用水混悬,依次用石油醚、氯仿、乙酸乙酯及水饱和的正丁醇萃取,收集正丁醇层萃取液,减压浓缩,冷冻干燥得楮头红粗皂苷.粗皂苷经硅胶柱层析(CCl3∶CH3OH=2∶1)及制备型高效液相色谱(PHPLC)梯度洗脱,收集洗脱液冷冻干燥得褐色粉末样品.PHPLC条件为:ULtimate XB-C18色谱柱(5 μm,10 mm×250 mm);紫外检测器的检测波长分别为203和210 nm;流速为2 mL·min-1;温度为23 ℃;以乙腈与水的混合溶液(8∶92~20∶80)为流动相.
1.3SWSA结构的鉴定
样品经红外光谱、质谱和核磁共振谱进行结构表征.
1.4SWSA供试液制备
准确称取一定量的SWSA,用生理盐水溶解,过0.22 μm的微孔滤膜,除菌,配制成含量为10 mg·mL-1的皂苷供试液,密封待用.
1.5SWSA抑菌试验
1.5.1抑菌圈试验在无菌操作条件下,用移液枪吸取0.1 mL不同菌液置营养琼脂平板上,涂布均匀.每个平板上放3个蘸有供试液的滤纸片和一个蘸有庆大霉素(单位为10-4)的滤纸片,做好标记.每个菌液设3次平行.以在平板上贴有无菌蘸有供试液的滤纸片为空白对照.置37 ℃的生化培养箱中倒置培养24 h.
钻探钻井孔内安全基础性问题应包括孔壁安全和轨迹安全。孔壁安全是力学平衡和物化平衡问题,是一个多场多介质(应力场、压力场、温度场和流体场;流体、岩体、钻具)条件下的压力、应力和物化等平衡,同时各平衡相互影响,其中一项不平衡都会导致孔壁安全问题。钻孔轨迹安全是空间力学问题,是钻孔轨迹空间形态引起的孔壁与钻杆柱摩阻力对起下钻、钻进和其他孔底作业的屏蔽作用,可导致钻进过程难以掌控和起下钻遇卡等问题。
1.5.2MIC的测定供试液过0.22 μm的微孔滤膜,除菌,采用10倍和2倍稀释法测定MIC.
(1)10倍稀释法:在试管中加入1 mL营养肉汤、0.1 mL稀释好的菌液和1 mL药液.阳性对照只加菌液不加药液,阴性对照只加供试液不加菌液.
(2)2倍稀释法:依据10倍稀释法的结果,进一步确定SWSA的MIC.药液用生理盐水倍比稀释,使样品浓度的梯度分别为1∶2、1∶4、1∶8、1∶16和1∶32.
供试液置37 ℃的恒温培养振荡器培养18 h后,肉眼观察试管中的液体是否浑浊.若试管中的液体透明澄清,表明无菌生长;若试管中的液体浑浊,表明有菌生长.以肉眼所见试管中不浑浊的最低供试液含量为SWSA的MIC.
1.6药物毒性的测定
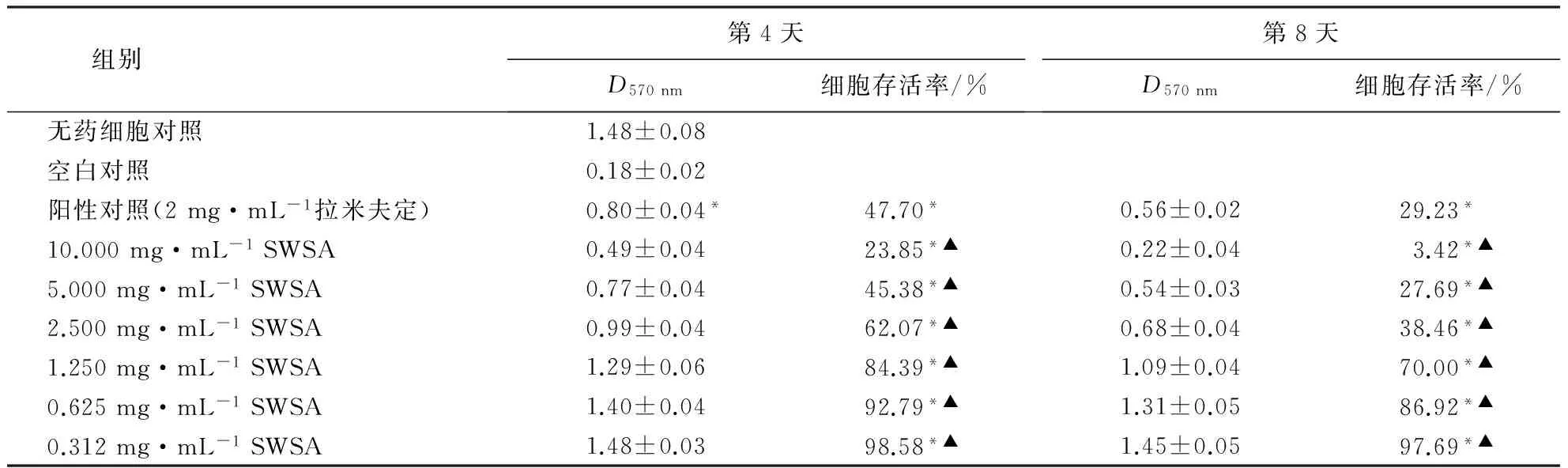
采用3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide, MTT)法测定药物毒性.取对数生长期的HepG2.2.15细胞按105个·mL-1接种于96孔培养板中,每孔0.1 mL,置于5% CO2、37 ℃的培养箱中过夜贴壁后,将供试液用完全培养基配制成相应含量 (10、5、2.5、1.25、0.625、0.312 mg·mL-1) 后对原培养基进行置换,每个含量设5个复孔,每孔0.1 mL,同时设无药细胞对照和阳性对照(2 mg·mL-1拉米夫定).加药后培养4和8 d,弃上清液用MTT染色,每孔加0.1 mL 1 mg·mL-1MTT无血清培养液,孵育4 h,弃上清液,每孔加150 μL DMSO,采用酶标仪(波长570 nm)测定各孔的光密度(D),试验重复3次.计算细胞的存活率,利用软件计算半数毒性浓度(50% toxicity concentration,TC50).
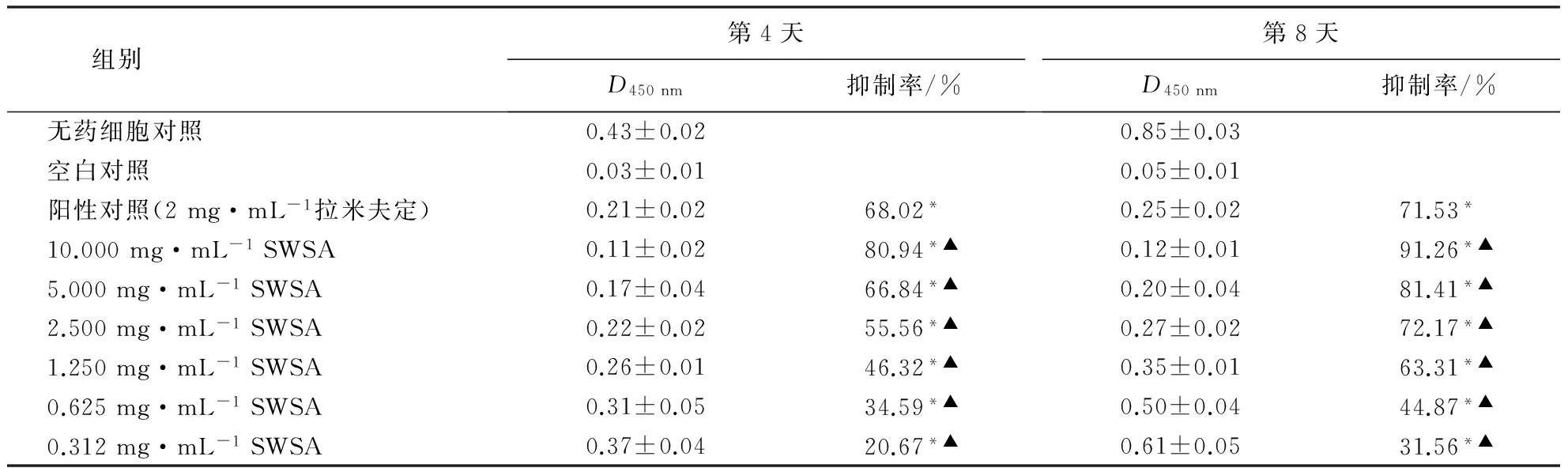
将上述方法处理的HepG2.2.15细胞进行分组试验,在药物作用2、4、6、8、10和12 d后分别吸取细胞上清液,按HBsAg和HBeAg检测试剂盒说明书操作,用酶标仪检测450 nm波长处的D,并计算对HBsAg和HBeAg的抑制率,利用软件计算半数抑制浓度(50% inhibiting concentration,IC50).
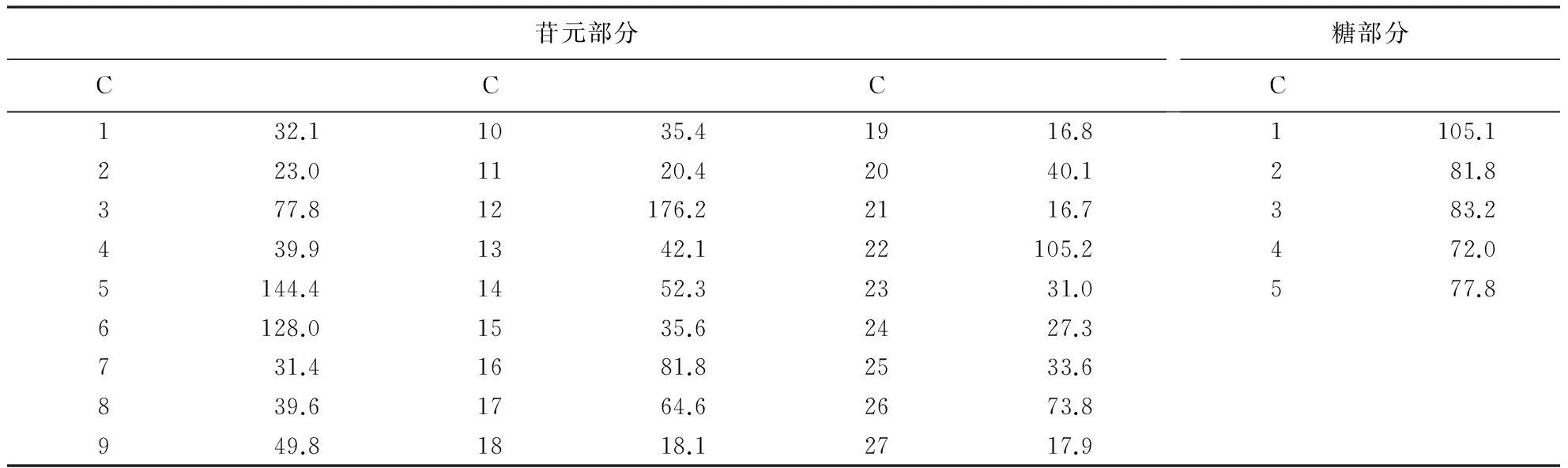
治疗指数(therapeutic index,TI)按公式计算:TI=TC50/IC50.TI>2为有效低毒,1 1.8数据处理 试验数据采用SPSS 13.0软件进行分析,结果以平均值±标准差表示,并进行多因素方差分析,P<0.05有统计学意义. 2.1SWSA的结构 红外光谱图显示,SWSA的特征吸收峰分别为3 378、1 734、1 646、1 409和1 235 cm-1.其中,3 378 cm-1为O-H伸缩振动区,1 734 cm-1为羰基,1 646 cm-1为双键的伸缩振动.ESI-MS负离子质谱准分子离子峰577(M+-H),表明本品分子质量为578,m/z 445(M+-H-132)为脱掉1个132质量单位糖的碎片.13C NMR谱中C-18、C-19、C-21和C-27的化学位移分别为18.1、16.8、16.7和17.9,表明化合物为甾体皂苷.C-5和C-6的化学位移分别为144.4和128.0,表明C-5和C-6有双键.C-12信号(δ176.2)表明C-12位连有羰基(表1).与薯蓣皂苷元[15]对应的C-26信号相比, SWSA的C-26化学位移为73.8,向低场位移,且红外光谱图上无螺缩酮特征吸收,可推测SWSA的皂苷元部分为F环开环.综上推断SWSA为呋甾烷型甾体皂苷,分子式为C32H50O9,其结构为3-O-(β-D-戊糖苷基)-19,23-三醇-12-酮,结构图如图1所示. 2.2SWSA的抑菌效果 表2表明:SWSA对嗜水气单胞菌、耶尔森氏菌、枯草芽孢杆菌和金黄色葡萄球菌作用后,产生明显的抑菌圈;对大肠埃希氏菌抑制效果不明显;对铜绿假单胞菌没有抑制作用.用10倍和2倍稀释法逐步确定SWSA对金黄色葡萄球菌、枯草芽孢杆菌、耶尔森氏菌和嗜水气单胞菌的MIC分别为2.8、3.3、2.5和2.2 mg·mL-1. 表1 SWSA的13C NMR谱数据 1)滤纸片直径为6 mm,-表示无抑菌效果. 2.3抗乙肝病毒的效果 2.3.1HepG2.2.15细胞分泌HBsAg和HBeAg的规律在试验条件下,供试HepG2.2.15细胞于第3天开始检测到有HBsAg和HBeAg的分泌,在第8天达到高峰,以后逐渐减弱,持续到第13天. 2.3.2SWSA对HepG2.2.15细胞增殖的影响MTT试验检测结果显示: 与对照组相比,拉米夫定阳性对照组和SWSA对HepG2.2.15细胞增殖的抑制呈剂量、时间依赖性 (P<0.05);与拉米夫定阳性对照组比较,SWSA的含量为5.0 mg·mL-1时对细胞增殖的抑制作用强于拉米夫定,含量为2.5 mg·mL-1时弱于拉米夫定(P<0.05)(表3). 2.3.3SWSA对HepG2.2.15细胞上清液中HBsAg和HBeAg含量的影响HepG2.2.15细胞上清液中HBsAg和HBeAg含量的检测结果(表4、5)显示:与对照组相比,拉米夫定阳性对照组和SWSA对HepG2.2.15细胞HBsAg和HBeAg两种抗原的表达均呈剂量、时间依赖性抑制;与拉米夫定阳性对照组比较,SWSA含量为2.5 mg·mL-1时对 HepG2.2.15细胞上清液中HBsAg和HBeAg表达的抑制效果均优于拉米夫定.通过对TI的分析比较,SWSA作用8 d,TI均大于2,呈有效低毒. 表3 SWSA对HepG2.2.15细胞增殖的影响1) 1)*表示与对照组比较差异显著(P<0.05);▲表示与阳性对照组比较差异显著(P<0.05). 表4 SWSA在HepG2.2.15细胞培养中对HBsAg的抑制作用1) 1)*表示与对照组比较差异显著(P<0.05),▲表示与阳性对照组比较差异显著(P<0.05);第4和8天的TI分别为1.79和6.43. 表5 SWSA在HepG2.2.15细胞培养中对HBeAg的抑制作用1) 1)*表示与对照组比较差异显著(P<0.05),▲表示与阳性对照组比较差异显著(P<0.05);第4和8天的TI分别为1.95和4.23. HepG 2.2.15细胞模型是1986年Sureau et al[16]利用电穿孔基因转移技术以重组载体pHoITHBV-1转染人肝癌细胞株HepG2,经G418筛选后获得的可产生高水平表达HBsAg和HBeAg的细胞株.HepG 2.2.15细胞模型可以稳定表达HBV基因,并支持Dane样颗粒的包装与分泌,故本试验选取该细胞模型探讨SWSA抗乙肝病毒的作用. 本试验结果表明,SWSA在设定的含量范围内与无药细胞对照组相比对HBsAg和HBeAg有明显的抑制作用,且随着SWSA含量的增加,其抑制作用增强,显示出一定的量效关系,对HBsAg和HBeAg的治疗有效低毒(TI分别为6.43和4.23).但本试验结果仅揭示了SWSA在HepG2.2.15这一细胞模型上对HBsAg和HBeAg的抑制作用,而在HBV临床感染中,受感染肝细胞HBV DNA的复制、HBsAg和HBeAg的合成均受到机体免疫功能状态及多种病理状态的影响,其变化比体外细胞水平要复杂得多.因此,还需结合体内试验来进一步证实确定,其作用机制也有待于进一步研究. [1] 余祥山.近年治疗乙肝药物的研究进展[J].中国现代临床医学,2005(4):45-46. [2] LAGGET M, RIZZETTO M. Treatment of chronic Hepatitis B [J]. Current Pharmaceutical Design, 2002,8(11):953-958. [3] GILSONR J, CHOPRA K B, NEWELL A M, et al. A placebo-controlled phase Ⅰ/Ⅱ study of adefovir dipivoxil in patients with chronic hepatitis B virus infection [J]. J Viral Hepat, 1999,6(5):387-395. [4] BACON T H. Famciclovir, from the bench to the patient-a comprehensive review of preclinical data [J]. Int J Antimicrob Agents, 1996,7(2):119-134. [5] 吴健莹,谢晨.慢性乙型肝炎抗病毒治疗药物的再评价[J].医学与哲学(临床决策论坛版),2010,31(8):39-40. [6] 周艳萌.抗乙型肝炎病毒的中药研究进展[J].时珍国医国药,2005,16(10):1 043-1 045. [7] 江苏新医学院.中药大词典(下册)[M].上海:上海人民出版社,1997:2 290. [8] 陈桂菲,叶淑玲.风柜斗草药用探讨[J].时珍国医国药,2000,11(2):129-130. [9] 廖梅, 张锦文, 张勇慧.楮头红保肝护肝活性部位筛选[J].医药导报,2010,29(5):571-572. [10] 伏晓,樊建领,巨秦豫.楮头红化学成分的分离与鉴定[J].中国药房,2012(7):638-639. [11] 张锦文,陈华栋,廖梅,等.楮头红化学成分研究[J].中国药学杂志,2011(1):17-20. [12] 朱庆银.楮头红多糖的提取、结构及其活性研究[D].福州:福建农林大学,2007. [13] FRESHNEY R I.动物细胞培养:基础技术手册[M].4版.章静波,徐存栓,译.北京:科学出版社,2004:398-402. [14] 徐叔云,卞如濂,陈修.药理实验方法学[M].3版.北京:人民卫生出版社,2002:1 757-1 758. [15] 杨如同,徐德平,唐世蓉,等.盾叶薯蓣鲜根茎中甾体皂苷的分离鉴定[J].中草药,2008,39(4):493-496. [16] SUREAU S, ROMET-LEMONNE J L, MULINS J I, et al. Production of hepatitis B virus by a differentiated human hepatoma cell line after transfection with cloned circular HBV DNA [J]. Cell, 1986,47(1):37-47. (责任编辑:施晓棠) Bacteriostasis and anti-HBV activities of saponins fromSarcopyramisnepalensis XIE Yongping1,2, LI Yuxiang3, ZHANG Wenlian1, SHEN Aili1, LI Qinglu1,2 (1.College of Life Science, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China; 2.Provincial Engineering Laboratory of Animal Pharmaceuticals, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China; 3.Fujian Center for Disease Control and Prevention, Fuzhou, Fujian 350001, China) To elucidate the pharmacological properties ofSarcopyramisnepalensisWall for clinical application, steroidal saponin monomer was extracted by n-butyl alcohol and filtered via silica gel column chromatography and preparative high performance liquid chromatography (PHPLC). Molecular structure of the monomer was identified by infrared spectroscopy (IR), electrospray ionization mass spectrometry (ESI-MS), and13C nuclear magnetic resonance (NMR), and followed by bacteriostasis and anti-HBV activities tests via filter paper method. The monomer was identified as furostan steroidal saponin and namedS.nepalensissaponin A (SWSA). SWSA had relatively strong bactericidal capacity toStaphylococcusaureus,AeromonashydrophilaandBacillussubtilis, with the minimal inhibitory concentration (MIC) being 2.8, 3.3, 2.5, 2.2 mg·mL-1, respectively. Although, its bactericidal capacity toEscherichiacoliandPseudomonasaeruginosawere relatively weak. Subsequently, anti-HBV activities of SWSA on hepatitis B virus (HBV)invitrowas evaluated by proliferation level of cell line 2.2.15 and the contents of HBsAg and HBeAg via enzyme linked immunosorbent assay (ELISA). Results showed the inhibitory effect of SWSA on HBV was both dose and time dependent, with the therapeutic index on HBsAg and HBeAg being 6.43 and 4.23. To summarize, SWSA showed inhibitory efficacy on HBVinvitroto some extent. Sarcopyramisnepalensis; saponin; antimicrobial activity; HepG2.2.15 cell; hepatitis B virus 2015-06-25 2015-12-09 福建省自然科学基金资助项目(2013J01360). 谢勇平(1978-),男,讲师.研究方向:天然产物活性成分提取.Email:xypnm@163.com.通讯作者李清禄(1957-),男,教授.研究方向:天然产物活性成分提取.Email:lql3388@126.com. R285 A 1671-5470(2016)03-0296-06 10.13323/j.cnki.j.fafu(nat.sci.).2016.03.0102 结果与分析

3 讨论
