羊附红细胞体巢式PCR检测方法的建立与应用
2016-09-25王晓星崔艳艳菅复春张忠义宁建峰张龙现王荣军宁长申
王晓星,崔艳艳,菅复春,张忠义,宁建峰,张龙现,王荣军,宁长申
(1. 河南农业大学牧医工程学院,河南 郑州 450002; 2.宜阳县动物疫病预防控制中心,河南 宜阳 471600)
羊附红细胞体巢式PCR检测方法的建立与应用
王晓星1,崔艳艳1,菅复春1,张忠义2,宁建峰2,张龙现1,王荣军1,宁长申1
(1. 河南农业大学牧医工程学院,河南 郑州 450002; 2.宜阳县动物疫病预防控制中心,河南 宜阳 471600)
为了建立一种更加准确、敏感的羊附红细胞体检测方法,根据GenBank上发表的羊附红细胞体16S rRNA基因序列(登录号:AF338268),设计内、外2对特异性引物,建立了巢式PCR检测方法。筛选该方法的最佳反应条件,并进行了特异性、敏感性、重复性试验及临床样本检测。结果表明,该方法能扩增出大小为506 bp的羊附红细胞体特异性片段,与GenBank收录的相关参考序列同源性为97.8%~99.6%;与猪附红细胞体、嗜吞噬细胞无浆体、绵羊无浆体、莫氏巴贝斯虫、吕氏泰勒虫基因组DNA均无交叉反应;DNA最低检测量为0.654 fg·μL-1;具有良好的重复性;对77份羊临床血液样品检测结果表明,羊附红细胞体感染率为71.43%,高于常规PCR和已报道的巢式PCR检测结果。
羊附红细胞体; 16S rRNA; 巢式PCR
附红细胞体病(Eperythrozoonosis)是由附红细胞体(HemotropicMycoplasma)寄生在多种动物及人的红细胞表面、血浆及骨髓内的一种人畜共患病,该病的主要临床表现为红细胞压积降低、血红蛋白浓度下降、白细胞增多、贫血、黄疸、发热等[1-3]。1934年,NEITZ等在绵羊的红细胞及周围发现有多形态的微生物寄生,命名为绵羊附红细胞体(Eperythrozoonovis)。根据其形态和生物学特性,最初把附红细胞体归类为立克次氏体类微生物(Rickettsiales)。近年来,分子生物学研究结果表明,附红细胞体16S rRNA基因序列与柔膜体纲支原体属高度同源,多数学者同意将其分类于柔膜体纲(Mollicutes),支原体目(Mycoplasmatales),支原体科(Mycoplasmataceae),嗜血性支原体属(HemotropicMycoplasma)[4-6]。目前,世界上已有30多个国家和地区报道过该病[7],中国是附红细胞体病流行最为严重的国家之一。国内外各地区报道该病感染率高低不一,这种感染率的差异可能与调查地区环境、采样季节不同以及检测方法敏感性的高低有较大关系。目前,该病的诊断方法包括形态学检查、动物试验、血清学检测、PCR技术检测等,但前三者受不明微生物、染料颗粒、感染时间、抗体水平等多种因素的影响,极易造成假阳性。本试验旨在建立灵敏度高、特异性好的巢式PCR检测方法,为羊附红细胞体的快速诊断及流行病学调查提供理论基础。
1 材料与方法
1.1主要试剂及仪器
LATaqDNA聚合酶、rTaqDNA聚合酶、基因
工程菌大肠杆菌DH5α、pMDTM18-T Vector Cloning Kit、DNA Marker DL2000购自TaKaRa公司;Genonmic DNA Purification Kit、Gel Extraction Kit 购于Promega公司;哺乳动物血液基因组DNA提取试剂盒购于上海莱枫生物科技有限公司。9700型PCR扩增仪购于Bio-Rad公司;凝胶成像分析系统购于Syngene公司。
1.2样品来源
77份羊血液样品采自河南省宜阳县某养殖户,采取颈静脉无菌采血,其中部分羊只以高热、贫血、黏膜黄染、流产(5只)等为主要临床症状。嗜吞噬细胞无浆体、绵羊无浆体、莫氏巴贝斯虫和吕氏泰勒虫阳性血液样品由河南省人兽共患病国际联合实验室保存,猪附红细胞体阳性样品由浙江省农业科学院畜牧兽医研究所馈赠,羊附红细胞体阳性样品由华中农业大学馈赠。
1.3DNA的提取
所有样品基因组DNA按照哺乳动物血液基因组DNA提取试剂盒(上海莱枫生物科技有限公司)的说明书步骤抽提DNA。
1.4引物设计与合成
利用Clustal X 2.1序列分析软件,将GenBank中的羊附红细胞体16S rRNA序列(登录号:AF338268)与其他物种同源序列进行比对,用Primer Premier 5.0软件设计2对引物,由上海生工生物工程股份有限公司合成。引物详情见表1。
1.5巢式PCR反应体系及反应条件
第一轮PCR以A1/A2为引物,对羊全血DNA进行PCR扩增,反应体系为10× LA PCR BufferⅡ(Mg2+plus) 2.5 μL,2.5 mmol·L-1dNTP Mixture 4.0 μL,引物A1/A2(25 μmol·L-1)各0.5 μL,模板1.0 μL,LATaqDNA聚合酶(5 U·μL-1)0.25 μL,用双蒸水补至25 μL。上述反应混合物于94 ℃预变性5 min后,94 ℃变性30 s、61 ℃退火30 s、72 ℃延伸1 min,30个循环,最后72 ℃总延伸7 min,4 ℃保存,预扩增产物为1 060 bp。第二轮PCR以B1/B2为引物,以相对应的第一轮PCR产物1.0 μL(1∶10倍稀释)为模板进行PCR,其中10 × PCR Buffer 2.5 μL,2.5 mmol·L-1dNTP Mixture 2.0 μL,引物B1/B2(25 μmol·L-1)各0.5 μL,rTaqDNA聚合酶(5 U·μL-1)0.15 μL,用双蒸水补至25 μL,94 ℃预变性5 min后,94 ℃变性30 s、59 ℃退火30 s、72 ℃延伸45 s,35个循环,最后72 ℃总延伸7 min,4 ℃保存,预扩增产物为506 bp。
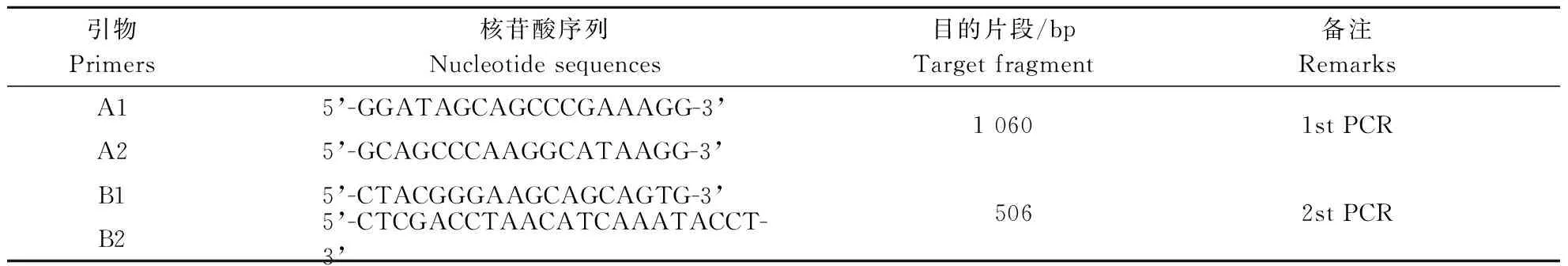
表1 M. ovis 16S rRNA基因PCR扩增引物序列Table 1 Pairs of primers used for amplification of the 16S rRNA gene of M. ovis.
1.6最适退火温度的筛选
为优化巢式PCR反应,对最适退火温度进行筛选。对外引物进行温度梯度PCR,退火温度范围为53~62 ℃。在外引物退火温度的基础上对内引物进行温度梯度PCR,退火温度范围为53~62 ℃。根据不同退火温度下目的条带的亮度及有无非特异性条带及交叉二聚体进行综合分析,确定该反应体系的最适退火温度。
1.7产物的回收、克隆及测序
用DNA凝胶回收试剂盒将PCR产物回收,将回收产物与pMDl8-T载体连接,转入大肠杆菌DH50α感受态细胞中,经蓝白斑筛选得到阳性菌斑扩大培养,阳性菌液送至生工生物工程(上海)股份有限公司测序。应用DNAStar 7.1软件和BLAST工具将测得的核苷酸序列与GenBank中的相关序列进行同源性比较。
1.8特异性试验
分别提取猪附红细胞体、嗜吞噬细胞无浆体、绵羊无浆体、莫氏巴贝斯虫和吕氏泰勒虫的基因组DNA,测定其质量浓度,并以羊附红细胞体基因组DNA质量浓度(65.4 ng·μL-1)为基准进行稀释后,作为特异性试验的模板。
1.9敏感性试验
将测定的羊附红细胞体基因组DNA质量浓度(65.4 ng·μL-1)按1∶10比例连续稀释后作为模板进行PCR扩增,检测最低DNA检测量。
1.10重复性试验
用建立的巢式PCR方法对2次采集的羊血样分别进行不同批内、批间的重复性试验,检验该方法的重复性和稳定性。
1.11临床样本检测
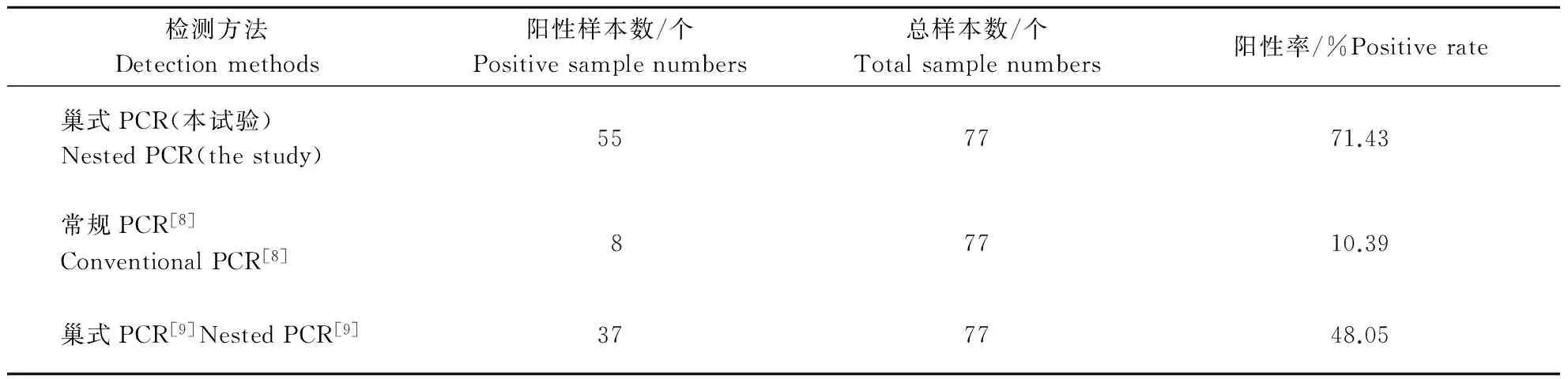
应用建立的巢式PCR方法对河南省宜阳县某养殖户散养的77份(2014年7月49份、2015年4月28份)羊血样进行检测,并与Crazziotin等[8]建立的常规PCR方法,赵晓薇等[9]建立的巢式PCR方法进行比较。检测结果通过测序排除假阳性。
2 结果与分析
2.1巢式PCR扩增
羊全血基因组DNA经外引物A1/A2,内引物B1/B2共扩增得到1条约506 bp的特异性条带(图1),与预期目的片段大小一致。
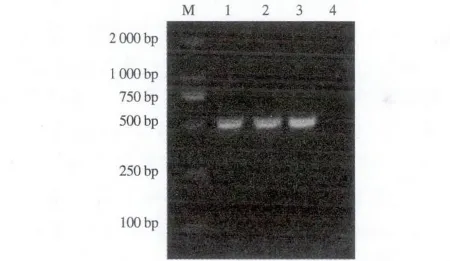
M. DNA标准 DL 2000; 1,2. PCR 产物;3. 阳性对照;4. 阴性对照。M. DNA Marker DL 2000;1,2. PCR products;3. Positive control;4. Negative control.
2.2最适退火温度的筛选
2.2.1 外引物温度梯度PCR扩增 从图2可以看出,随着退火温度的变化,产物量基本没有变化,第一轮扩增在53~60 ℃之间均出现非特异性条带,当退火温度在61~62 ℃时,无非特异性条带,故以61 ℃作为外引物的最适退火温度。
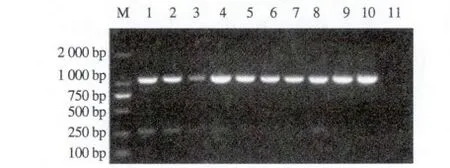
M. DNA标准DL2000;1. 53 ℃; 2. 54 ℃; 3. 55 ℃; 4.56 ℃; 5. 57 ℃; 6. 58 ℃; 7. 59 ℃; 8. 60 ℃; 9. 61 ℃; 10.62 ℃;11. 阴性对照。M. DNA Marker DL2000;1. 53 ℃; 2. 54 ℃; 3. 55 ℃; 4.56 ℃; 5. 57 ℃; 6. 58 ℃; 7. 59 ℃; 8. 60 ℃; 9. 61 ℃; 10.62 ℃;11. Negative control.
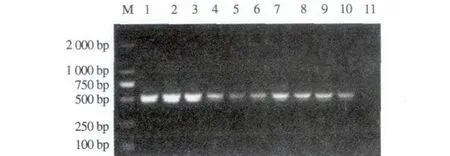
2.2.2 内引物温度梯度PCR扩增 从图3可以看出,第二轮扩增在53~62 ℃之间均出现特异性条带,但当退火温度低于57 ℃时,有少量拖尾现象,高于57 ℃时无拖带且当退火温度在59 ℃时条带最亮,故以59 ℃作为内引物的最适退火温度。
2.3序列测定及同源性分析
将测序结果与GenBank中登录号AF338268同源性为99.6%,与其他相关参考序列同源性为97.8%~99.6%。
2.4特异性试验
以A1/A2为引物进行第一轮PCR扩增后,羊附红细胞体基因组DNA和猪附红细胞体均出现1 060 bp左右的条带,而嗜吞噬细胞无浆体、绵羊无浆体、莫氏巴贝斯虫和吕氏泰勒虫则未出现条带(图4)。以B1/B2为引物进行第二轮PCR扩增后,只有羊附红细胞体基因组DNA出现506 bp左右的条带,而猪附红细胞体、嗜吞噬细胞无浆体、绵羊无浆体、莫氏巴贝斯虫和吕氏泰勒虫基因组DNA均未出现条带(图5)。
M. DNA标准DL2000;1. 53 ℃; 2. 54 ℃; 3. 55 ℃; 4.56 ℃;5. 57 ℃; 6. 58 ℃; 7. 59 ℃; 8. 60 ℃; 9. 61 ℃; 10. 62 ℃;11. 阴性对照。M. DNA标准DL2000;1. 53 ℃; 2. 54 ℃; 3. 55 ℃; 4.56 ℃; 5. 57 ℃; 6. 58 ℃; 7. 59 ℃; 8. 60 ℃; 9. 61 ℃; 10. 62 ℃;11. Negative control.
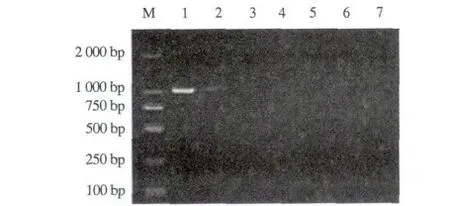
M. DNA标准DL2000;1. 羊附红细胞体;2. 猪附红细胞体; 3. 嗜吞噬细胞无浆体;4. 绵羊无浆体;5. 莫氏巴贝斯虫; 6. 吕氏泰勒虫;7. 双蒸水。M. DNA Marker DL2000; 1. M. ovis; 2.E. suis; 3. Anaplasma phagocytophilum; 4. A. ovis; 5. Babesia motasi; 6. Theileria luwenshuni; 7. ddH2O.
2.5敏感性试验
用紫外分光光度计测定提取的M.ovisDNA含量为65.4 ng·μL-1,D260/D280=1.84,说明所提取的DNA无蛋白和RNA污染。取M. ovis基因组DNA(含量65.4 ng·μL-1)按1∶10倍比稀释后作为模板进行PCR扩增,第一轮PCR可检测M.ovis基因组DNA的最大稀释倍数为1×10-4,即最低
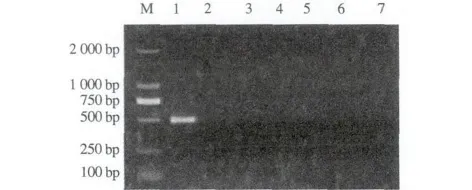
M. DNA标准DL2000;1. 羊附红细胞体;2. 猪附红细胞体;3. 嗜吞噬细胞无浆体;4. 绵羊无浆体;5.莫氏巴贝斯虫;6. 吕氏泰勒虫;7. 双蒸水。M. DNA Marker DL2000; 1. M. ovis; 2.E. suis; 3. A. phagocytophilum; 4. A. ovis; 5. B. motasi; 6. T. luwenshuni; 7. ddH2O.
可检测到6.54 pg·μL-1(图6);第二轮PCR可检测M.ovis基因组DNA的最大稀释倍数为1×10-8,即最低可检测到0.654 fg·μL-1(图7)。
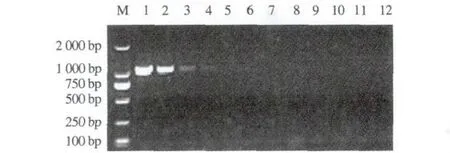
M. DNA标准DL2000;1. 65.4 ng·μL-1;2. 6.54 ng·μL-1;3. 654 pg·μL-1;4. 65.4 pg·μL-1;5. 6.54 pg·μL-1;6. 654 fg·μL-1;7. 65.4 fg·μL-1;8. 6.54 fg·μL-1;9. 0.654 fg·μL-1;10. 0.065 4 fg·μL-1;11. 0.006 54 fg·μL-1;12. 阴性对照。M. DNA Marker DL2000;1. 65.4 ng·μL-1;2. 6.54 ng·μL-1;3. 654 pg·μL-1;4. 65.4 pg·μL-1;5. 6.54 pg·μL-1;6. 654 fg·μL-1;7. 65.4 fg·μL-1;8. 6.54 fg·μL-1;9. 0.654 fg·μL-1;10. 0.065 4 fg·μL-1;11. 0.006 54 fg·μL-1;12. Negative control.
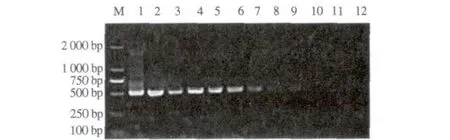
M. DNA标准DL2000;1. 65.4 ng·μL-1;2. 6.54 ng·μL-1;3. 654 pg·μL-1;4. 65.4 pg·μL-1;5. 6.54 pg·μL-1;6. 654 fg·μL-1;7. 65.4 fg·μL-1;8. 6.54 fg·μL-1;9. 0.654 fg·μL-1;10. 0.065 4 fg·μL-1;11. 0.006 54 fg·μL-1;12. 阴性对照。M. DNA Marker DL2000;1. 65.4 ng·μL-1;2. 6.54 ng·μL-1;3. 654 pg·μL-1;4. 65.4 pg·μL-1;5. 6.54 pg·μL-1;6. 654 fg·μL-1;7. 65.4 fg·μL-1;8. 6.54 fg·μL-1;9. 0.654 fg·μL-1;10. 0.065 4 fg·μL-1;11. 0.006 54 fg·μL-1;12. Negative control.
2.6重复性试验结果
用建立的巢式PCR方法,通过对不同批内、批间的羊血样进行检测,重复性检测结果均一致,说明该方法具有良好的重复性和稳定性(图8)。
2.7临床样本的检测
抽提77份羊血液样本DNA为模板进行常规PCR[8]、巢式PCR[9]扩增,比较检测结果(表2)。本试验建立的巢式PCR方法对羊附红细胞体的阳性检出率为71.43%(55/77),均高于赵晓薇等[9]建立的巢式PCR方法的检出率48.05%(37/77)和常规PCR方法检出率10.39%(8/77)。通过对阳性PCR产物测序结果分析,均为M.ovis。

M. DNA标准DL2000;1~3. PCR产物;4. 阴性对照。M. DNA Marker DL 2000; 1 to 3. PCR products; 4. Negative control.
检测方法Detectionmethods阳性样本数/个Positivesamplenumbers总样本数/个Totalsamplenumbers阳性率/%Positiverate巢式PCR(本试验)NestedPCR(thestudy)557771.43常规PCR[8]ConventionalPCR[8]87710.39巢式PCR[9]NestedPCR[9]377748.05
3 讨论
关于本病的诊断方法,国内外报道的有显微镜检查法(鲜血压片法、血涂片染色法)、血清学检测以及分子生物学诊断技术等方法[9~14]。目前国内对附红细胞体的诊断方法主要以显微镜检法为主,而该方法在操作过程中常常会引起红细胞的变形而导致假阳性结果。当免疫水平较高或药物治疗时,血液中的附红细胞体大多会被清除,镜下可见的附红细胞体很少或找不到,导致假阴性结果。本试验建立的PCR方法扩增产物序列与GenBank中相关参考序列比较同源性为97.8%~99.6%;通过提取猪附红细胞体、嗜吞噬细胞无浆体、绵羊无浆体、莫氏巴贝斯虫和吕氏泰勒虫的基因组DNA并进行扩增,结果均为阴性;且该方法DNA最低检测量为0.654 fg·μL-1,表明本试验建立的PCR方法具有良好的特异性和敏感性。
用本试验建立的巢式PCR、文献报道的巢式PCR[9]和常规PCR[8]方法分别检测77份羊临床血液样品,本试验建立的巢式PCR方法检出率最高(71.43%),明显高于巢式PCR[9](48.05%)和常规PCR[8](10.39%)的检出率;对阳性PCR产物的测序结果分析表明,3种PCR的检测结果均是可靠的。不同检测方法阳性率差异较大的原因,可能是其敏感性存在差异所致,因此临床诊断中应选用敏感性较高的检测方法。
本检测77份羊血样的巢式PCR阳性检出率高达71.43%(55/77),说明羊群存在羊附红细胞体感染,与部分羊表现明显临床症状相一致,而有的羊未呈现临床症状,可能与隐性感染状态或感染强度较低有关,因此,临床工作中应重视该病的防治。
附红细胞体病是一种人兽共患传染病。近年来,人感染附红细胞体的报道不断增多,可感染人的嗜血性支原体(附红细胞体)包括Mycoplasmahaemofelis-like、M.suis-like、M.ovis、“CandidatusMycoplasmahaemohominis”、“CandidatusMycoplasmahaematoparvum” 和M.ovis-like[15],M.ovis为感染人的优势种[16]。另据报道,M.haemofelis可感染艾滋病患者[17];目前,中国肉羊业快速发展,做好肉羊人兽共患附红细胞体病的监测与防控,为保障人畜健康和公共卫生安全具有重大意义。本试验建立的巢式PCR方法具有特异性强、敏感性高和重复性好等优点,对于M.ovis的流行病学调查和临床诊断具有重大意义。
[1] 卢新荣, 张守峰, 钟发刚. 附红细胞体研究进展[J]. 新疆农垦科技, 2011 (1): 39-42.
[2] 王德顺. 附红细胞体病病原学, 流行病学与诊断方法研究进展[J]. 口岸卫生控制, 2011 (5): 54-57.
[3] 董慧慧, 韩宁林. 人附红细胞体病的治疗进展[J]. 中医药临床杂志, 2014, 26(7): 756-758.
[4] NEIMARK H, PETERS W, ROBINSON B L, et a1. Phylogenetic analysis and description ofEperythrozooncoccoides, proposal to transfer to the genusMycopIasmaasMycoplasmacoccoidescomb. nov. and Request for an Opinion[J]. International Journal of systematic and evolutionary microbiology, 2005, 55(3):1385-1391.
[5] WILLI B, BORETTI F S, TASKER S, et al. FromHaemobartonellato hemoplasma: molecular methods provide new insights[J]. Veterinary Microbiology, 2007, 125(3): 197-209.
[6] 李国兰, 杨玉芝, 郭岭, 等. 附红细胞体研究进展[J]. 中国病原生物学杂志, 2008, 3(8): 629-630.
[7] SMITH J E, CIPRIANO J E, HALL S M. In vitro and invivoglucose consumption in swine eperythrozoonosis[J]. Journal of Veterinary Medicine, Series B, 1990, 37(1): 587-592.
[8] GRAZZIOTIN A L, SANTOS A P, GUIMARAES M S, et al.Mycoplasmaovisin captive cervids: prevalence, molecular characterization and phylogeny[J]. Veterinary Microbiology, 2011, 152(3): 415-419.
[9] 赵晓薇, 巴彩凤, 苏玉虹, 等. 羊附红细胞体巢式 PCR 检测方法的建立及临床应用[J]. 中国预防兽医学报, 2008, 30(7): 552-556.
[10] HOELZLE L E. Haemotrophic mycoplasmas: recent advances inMycoplasmasuis[J]. Veterinary Microbiology, 2008, 130(3): 215-226.
[11] 李丽, 王书全. 羊附红细胞体单管套式 PCR 检测方法的建立及初步应用[J]. 动物医学进展, 2013 (5): 87-90.
[12] SONG W, SONG Q, HE L, et al. The establishment and application of a semi-nested PCR assay for the detection ofMycoplasmaovis[J]. Small Ruminant Research, 2014, 119(1): 176-181.
[13] WILLI B,MELI M L,LÜTHY R,et al.Development and application of a universal hemoplasma screening assay based on the SYBR Green PCR principle[J].Journal of Clinical Microbiology,2009,47(12):4049-4054.
[14] OHTAKE Y, NISHIZAWA I, SATO M, et al.Mycoplasmaovisdetected in free-living Japanese serows, Capricornis crispus[J]. Journal of Veterinary Medical Science, 2011, 73(3): 371-373.
[15] MAGGI R G,COMPTON S M,TRULL C L,et al.Infection with hemotropicmycoplasmaspecies in patients with or without extensive arthropod or animal contact[J].Journal of Clinical Microbiology,2013,51(10):3237-3241.
[16] SYKES J E,LINDSAY A L,MAGGI R G,et al.Human coinfection withBartonellahenselaeand two hemotropicmycoplasmavariants resemblingMycoplasmaovis[J].Journal of Clinical Microbiology,2010,48(10):3782-3785.
[17] SANTOS A P,SANTOS R P,BIONDO A W,et al.Hemoplasma infection in HIV-positive patient,Brazil[J].Emerging Infectious Diseases,2008,14(12):1922-1924.
(责任编辑:蒋国良)
Establishmentandapplicationofanested-PCRassayfordetectionofMycoplasmaovis
WANG Xiaoxing1, CUI Yanyan1, JIAN Fuchun1, ZHANG Zhongyi2,NING Jianfeng2ZHANG Longxian1, WANG Rongjun1, NING Changshen1
(1.Engineering College of Animal Husbandry and Veterinary Science, Henan Agricultural University, Zhengzhou 450002, China; 2. Yiyang Animal Disease Control Center, Yiyang 471600, China)
To establish a nested PCR assay for detection ofMycoplasmaovis, according to the publishedMycoplasmaovis16S rRNA gene sequence in GenBank (Accession number: AF338268), two pairs of primers were designed inside and outside to establish nested PCR assay for detecting the disease caused byMycoplasmaovis. The optimum reaction conditions were screened,and the specificity, sensitivity and reproducibility of test and detection of clinical samples were carried out. The results of verification experiments showed that the targeted gene fragment was 506 bp in length and homology of nested PCR product was 97.8% to 99.6%, and this detection method had no cross reaction withEperythrozoonsuis,Anaplasmaphagocytophilum,Anaplasmaovis,Babesiamotasi,andTheilerialuwenshuni. The sensitivity reached 0.654 fg·μL-1. This method had good repeatability. The 71.43% positive rate in 77 clinical samples by the nested PCR assay was higher than that by the conventional PCR and the reported nested PCR test results.
Mycoplasmaovis; 16S rRNA; nested PCR
2016-03-01
农业部国家现代肉羊产业技术体系建设专项资金项目(nycytx-39);河南省教育厅现代畜牧业河南省协同创新中心
王晓星(1990-), 女, 河南巩义人, 硕士研究生, 主要从事人兽共患寄生虫病研究。
宁长申(1958-), 男, 河南郾城人, 教授。
1000-2340(2016)03-0506-06
S855. 99
:A
