白花野牡丹种子萌发因素初探
2016-09-25杨向娜曹翠玲
杨向娜, 曹翠玲, 金 红, 陈 曦
(1.西北农林科技大学生命科学学院,陕西 杨凌 712100; 2.深圳市中国科学院仙湖植物园,广东 深圳 518004)
白花野牡丹种子萌发因素初探
杨向娜1, 曹翠玲1, 金 红2, 陈 曦1
(1.西北农林科技大学生命科学学院,陕西 杨凌 712100; 2.深圳市中国科学院仙湖植物园,广东 深圳 518004)
以白花野牡丹(MelastomacandidumD.Don.) 种子为试验材料,采用培养皿纸上法,分别研究了不同温度处理、不同时间低温(4℃)预处理及不同体积分数硝酸盐类、赤霉素GA3和聚乙二醇PEG6000处理对种子萌发的影响。结果表明:在恒温(25 ℃)条件下种子的萌发率较室温(日平均温度16 ℃)下的高。不同时间低温预处理均可以促进黄色种子萌发,其中12 h预处理萌发率最高。在室温下,不同体积分数硝酸盐类、PEG6000和GA3处理都可以大幅增加黄色种子萌发率;而在恒温(25 ℃)下,0.1%、0.2%硝酸盐对种子萌发无影响,0.4%硝酸盐抑制种子萌发; 0.1%、0.5%、1% PEG6000处理和50、100 mg·L-1GA3处理均对种子萌发率无影响。
白花野牡丹;萌发势;萌发率;硝酸盐;GA3;PEG6000
白花野牡丹(MelastomacandidumD.Don)隶属野牡丹科野牡丹属,常绿小灌木, 是野牡丹属中的一种野生优良观赏植物,分布于热带、亚热带,中国西南、华南及东南各省区、台湾及琉球群岛均有分布[1-3]。其生长环境多属于低海拔的山坡松林下或开阔的灌草丛中,数量稀少较少见。其花瓣纯白色,花朵较大, 几乎全年可见开花结果,具有较高的观赏价值;另外,此植物全株入药,具有清热利湿、止血、消肿止痛之效,可用于治疗消化不良、痢疾、肠炎等,也可以用来治疗糖尿病。然而白花野牡丹作为一种极具开发前景的野生植物,在引种驯化、栽培繁殖过程中存在种子发芽不整齐、发芽率低、持续时间长等问题[4]。目前有关白花野牡丹种子萌发条件的研究报道极少。本研究初步探究影响白花野牡丹种子萌发的外界条件及其萌发特性,旨在为白花野牡丹的引种驯化、园艺化栽培,进一步开发利用其观赏价值提供技术依据。
1 材料与方法
1.1种子采集地概况及其物理特性
白花野牡丹野生种,采自于深圳市中科院仙湖植物园内(22°34.680′N, 114°10.304′E, 海拔122 m)。深圳属亚热带海洋性气候, 四季温和, 雨量充沛, 太阳辐射量丰富, 年平均气温22.3 ℃, 年平均降水量1 924.7 mm, 年平均降水数为2 060 h。该区域土壤类型以赤红壤分布最广,质地为砾质砂壤土。该植物在试验地长年开花,3~5月盛花期,5~6月果实数量大,果实直径为(1.28±0.15) cm,10月份果实数量较少,直径为(0.975±0.139) cm。 2012-06采集成熟果实,重量为(0.65±0.15) g·个-1(不含果皮)),收集种子,采种后用于萌发试验。试验于2014-04-01开始在西北农林科技大学植物生理实验室进行。
1.2异型种子的分离、种子形态结构的观察
1.2.1 种子分离 把白花野牡丹种子从肉质胎座上分离下来,并将其黄色和深色的种子分别装入1.5 mL离心管中,为保持种子干燥,加入干燥剂,同时做好标记。参照陈妙贤等[4]的研究,本试验种子长期贮藏5 ℃(冰箱冷藏)较为适宜,可有效提高发芽率和发芽整齐度,延长种子寿命;若从经济的角度考虑,短期 (1~3月)常温(20~25 ℃)储藏也可以。
1.2.2 形态结构观察 将干燥的种子放入1.5 mL离心管,加入蒸馏水震荡2 min快速洗去杂质后离心,再次冲洗离心,晾干,放于载玻片上,在显微镜下对红、黄2类种子的外部形态进行观察并照相。
1.3萌发条件及处理方法
1.3.1 萌发条件的设计 培养方法:采用培养皿纸上法。用滤纸将载玻片包裹好(以便将来进行显微观察)后放入90 mm培养皿内(垫有两层滤纸),用不同的溶液将滤纸充分浸润后,向其上整齐摆放种子,每个盖玻片上摆放50粒黄色种子,各处理均有3次重复。发芽期为30 d[5]。培养期间始终用相应的溶液滴加,确保培养皿内培养体系湿润。
试验基本条件:参照《国际种子检验规程》、文献报道和预备试验,确定供试种子萌发的2个温度水平,即恒温(光照培养箱恒温25 ℃培养,光照时间为12 h,光照强度为8 000 lx,以下简称25 ℃恒温)和室温(如图1,2014-04初开始,其时室外最高温度26 ℃,最低温度7 ℃左右,日平均气温在16 ℃左右,以下简称室温),于实验室内进行。对照以自来水为发芽基质,定期浇水保湿。待10 d后观察并记录,统计萌发率和萌发势。
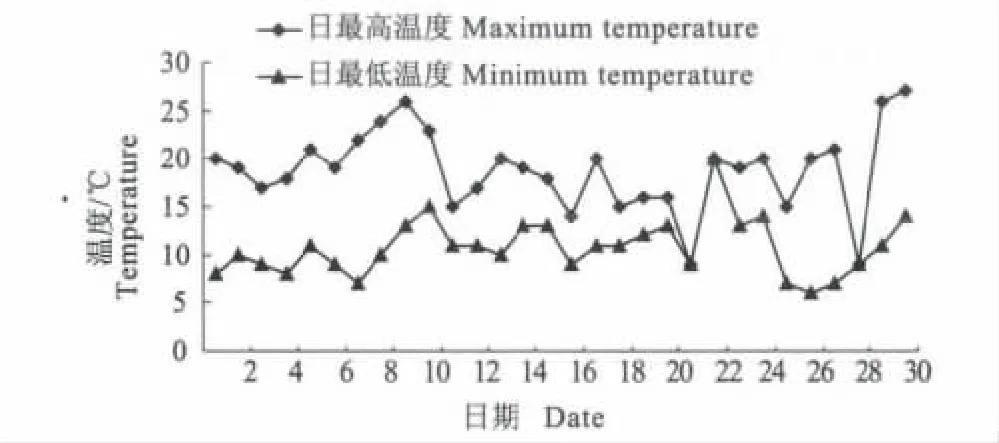
图1 2014年4月份杨凌室温日变化Fig.1 Temperature variation of Yangling in April 2014
1.3.2 低温(4 ℃)预处理 以水为发芽基质,4 ℃低温预处理6、12、24 h后,将其放至室温(由于25 ℃恒温下萌发较好,故未进行低温预处理)下培养。定期浇水保湿,待10 d后观察并记录,最终计算相应的萌发势和萌发率。
1.3.3 不同体积分数、类型硝酸盐处理 将黄色白花野牡丹种子分别摆放在用0.1%、0.2%、0.4%的KNO3、NH4NO3、NaNO3溶液饱和浸湿的滤纸上,自来水作为对照,于恒温和室温下分别培养。待10 d后种子开始萌发时进行观察记录,并统计相应的萌发率和萌发势。
1.3.4 渗透胁迫处理 将黄色白花野牡丹种子分别摆放在体积分数为0.1%、0.5%、1%的PEG6000溶液浸湿饱和的滤纸上,自来水作为对照,于恒温和室温下分别培养。待10 d后种子陆续萌发时开始观察记录,并计算相应的萌发率和萌发势。
1.3.5 GA3处理 将黄色白花野牡丹种子分别摆放在用质量浓度为50、100 mg·L-1的GA3溶液充分浸泡的滤纸上,自来水作对照,于恒温和室温分别培养。待10 d后种子陆续萌发时开始观察记录,并计算相应的萌发率和萌发势。
1.4数据统计与分析
萌发指标采用发芽率和发芽势来表示。种子萌发以胚根伸长至种子的一半为标准(长约1 mm),第10天开始每天观察计数,第30天进行末次计数,统计各处理的萌发势和萌发率[6]。
发芽势(%)=(第20天发芽种子数/供试种子数)×100%
发芽率(%)=(第30天发芽种子数/供试种子数)×100%
实验数据都是重复的平均值±标准误差,利用SPSS(16.0)进行单因素方差分析(ANOVA),对处理之间的差异性多重比较采用LSD(Least Significant Difference)分析,且进行了显著性差异分析(P<0.05)。所有图片均在Excel(2003)软件系统下完成。
2 结果与分析
2.1白花野牡丹种子的异型性及种子的外部形态结构
野牡丹属不同植物果实中都有深、浅2种颜色种子,其数量比约在1∶2。用显微镜对白花野牡丹种子外观形态进行初步观察(如图2),结果表明,白花野牡丹种子呈现出红、黄2种颜色,种子形状为类肾形、类三角形、类半圆形、类圆形。黄色种子较饱满,红色种子多数干瘪。光学显微镜下,对黄色种子外观形态进行初步观察的结果如图3,黄色种子表面上有排列略显整齐的黄褐色圆状凸起斑点。扫描电子显微镜下这些凸起为圆形或椭圆形,间隔较梳,部分有棒状足连接:种脐上中部有一小突起,顶部有一小穴。红色种子(如图4)表面纹饰为不规则的皱缩, 褶皱深,边缘部分颜色较浅,中间颜色较深,整体外部结构没有黄色种子清晰[8]。

图2 白花野牡丹种子的异型性(×4)Fig.2 Seed heteromorphism of Melastomacandidum D.Don.(×4)

图3 白花野牡丹黄色种子外观结构Fig.3 The appearance of yellow seed ofMelastoma candidum D.Don.
本研究中,同时对黄、红色2种颜色种子进行了不同的处理,但结果表明,红色种子在所有处理下均不萌发,应属于难萌发或不萌发类种子。从形态来看,红色种子不萌发可能原因是:种皮较厚、几乎不吸水,亦或是种子发育不完全、种子内部存在萌发抑制物等[7],尚需进行进一步的探索。因此,在本研究中,只对黄色种子的萌发情况进行统计分析。

图4 白花野牡丹红色种子外观结构Fig.4 The appearance of red seed ofMelastoma candidum D.Don.
2.2不同处理对白花野牡丹种子萌发的影响
2.2.1 不同温度处理对白花野牡丹种子萌发的影响 在恒温与室温下分别培养白花野牡丹黄色种子,试验结果见表1。由表1可知,黄色种子在室温下萌发势(4.00%±2.31%)、萌发率都很低(4%), 而25 ℃恒温培养下种子萌发势(26.67%±8.33%)、萌发率(66.00%±3.46%)均有较大提高,表明较高萌发温度对此种子萌发具有促进作用,但仍存在种子萌发不整齐的问题。

表1 不同温度处理对黄色种子萌发的影响Table 1 Effects of different temperature on germinationof yellow seeds
注:表中数据为均值±标准差;同列数据标有不同字母的表示差异具有显著性(LSD检验,P=0.05)。下同。
Note:Data in the table as mean±standard deviation; the same column data marked with different letters indicate differences significant(LSD test,P=0.05).The same as below.
2.2.2 低温(4 ℃)预处理对白花野牡丹种子萌发的影响 试验结果表明,白花野牡丹黄、红2类种子在4 ℃预处理不同时间后,转放至室温下培养,红色种子全部不萌发。4 ℃预处理后萌发率最高的为20.67%±2.31%;预处理6 h,其萌发率就已是对照的4倍,预处理12 h后,萌发率是对照的5倍,是所有处理中最高的。预处理24 h最低,只有13%,是对照组的3倍。可见低温预处理对此种子萌发具有一定的促进作用。从经济效益角度来看,4 ℃预处理6~10 h即可。
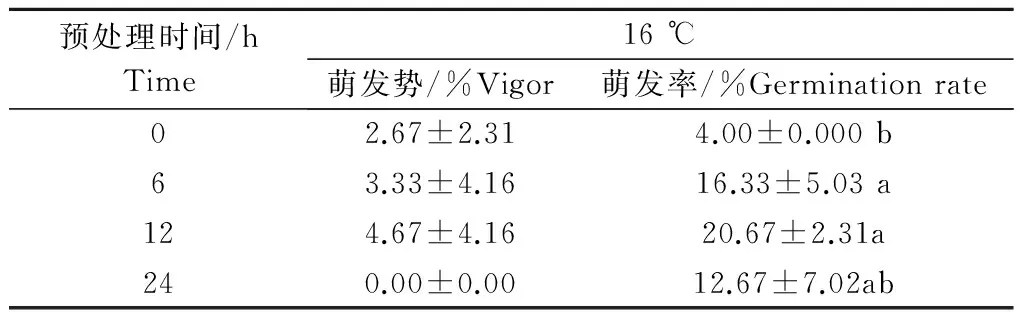
表2 4 ℃低温预处理对黄色种子萌发的影响Table 2 The effect of pretreatment of 4 ℃ ongermination of yellow seeds
2.2.3 不同体积分数、类型的硝酸盐对白花野牡丹种子萌发影响 不同体积分数、类型的硝酸盐对白花野牡丹种子萌发的影响结果见表3。
从表3可以看出,恒温培养下,所有盐处理均抑制了此种子的萌发。不论是哪种硝酸盐,随着盐体积分数的上升,其萌发率降低,且当体积分数达到0.4%时,仅仅KNO3处理的种子,还有较低的萌发率(2%),其他2种盐处理,其萌发率为0。说明25 ℃恒温条件下硝酸盐对白花野牡丹黄色种子的萌发有抑制作用。
室温下,最显著的结果是0.1%处理下,NH4NO3处理显著提高种子萌发率,是对照的近4倍,NaNO3效果明显,萌发率略高于对照。体积分数0.2%的KNO3较体积分数为0.1%的显著提高了种子萌发率,是对照的3.5倍。当盐的体积分数达到0.4%时,NH4NO3、NaNO3处理下无种子萌发,而KNO3处理下仍有少量种子萌发。表明室温下,体积分数为0.1% NH4NO3处理能提高黄色种子萌发率。
表3不同体积分数的硝酸盐对黄色种子萌发的影响
Table3Effectsofdifferentconcentrationsofnitrateongerminationofyellowseeds
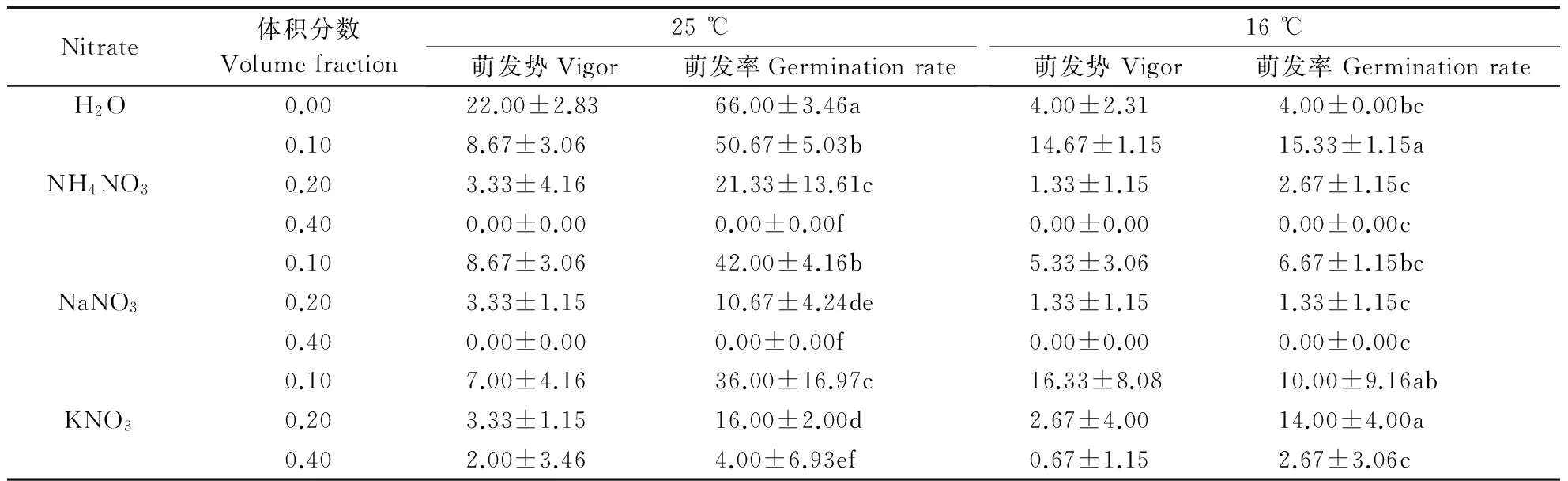
%
2.2.4 渗透胁迫对白花野牡丹黄色种子萌发的影响 试验结果(表4)表明,在25 ℃恒温下,与对照相比,0.1%PEG6000不影响种子的发芽速度;当PEG6000体积分数达到0.5%时,PEG6000明显影响了其萌发势,而当体积分数增加到1%时,其萌发势反而降低到对照水平以下。说明0.5%的渗透胁迫,能恰到好处地促进此种子发芽速度。试验结果显示(表4),25 ℃条件下0.1%PEG6000处理,对种子发芽无影响,而当PEG6000增大后,发芽率反而低于对照。说明,渗透胁迫对此种子萌发无益。

表4 不同体积分数PEG6000对黄色种子萌发影响Table 4 Effects of different volume fraction of PEG6000 on germination of yellow seeds %
从最后萌发率来看,日气温平均16 ℃时,0.1%、0.5%、1% 3种体积分数均能显著提高种子发芽率,且随体积分数提高,发芽率提高。说明较高的PEG6000能够较好调节种子内外水分交换状况,起到渗透调节作用,改善种子性能,提高其萌发能力。
25 ℃条件和日平均气温16 ℃相比,0.1% PEG处理下种子萌发率明显较高,与对照一致,达到66%。 说明黄色种子最适萌发温度为25 ℃或再高。在25 ℃或以上温度,其萌发无需PEG6000处理,只有当温度较低(16 ℃左右)时,可用0.1%PEG6000处理,可提高其萌发率。
2.2.5 GA3对白花野牡丹黄色种子萌发的影响 赤霉素(GA3)的主要生理功能是打破延存器官如种子等的休眠。本研究结果(表5)显示, 25 ℃恒温培养下,用50 mg·L-1GA3处理,黄色种子萌发势降低,萌发率也略有降低; 100 mg·L-1处理对种子萌发势和萌发率基本无影响。因此用低于或等于100 mg·L-1GA3处理白花野牡丹黄色种子,并不能促进其萌发。
当日平均气温为16 ℃时,用50、100 mg·L-1GA3处理黄色种子后,2种质量浓度均能显著提高种子的萌发势和萌发率,萌发率分别是对照的6.25倍和9倍。说明在环境温度较低的情况下,可用50~100 mg·L-1GA3提高此种子的萌发率。

表5 不同质量浓度GA3对黄色种子萌发的影响Table 5 Effects of different concentrations of GA3 on germination of yellow seeds
3 结论与讨论
温度是影响种子萌发的最主要条件。在适宜的温度下,种子萌发最快,这主要是因为温度影响酶的活性。在适宜温度下,种子内催化蛋白、或淀粉或脂肪分解的酶活性最高,而超出这个范围则使酶活性钝化;同时有研究指出,温度过低和过高会使膜透性增大、膜结合酶活性降低或导致酶变性影响细胞内外物质交换,从而影响种子萌发[9]。不同种类的植物,其种子萌发最适温度不同,这主要是由植物本身的特性所决定,也是植物长期适应环境的结果。有研究表明[4],与白花野牡丹的亲缘关系极近的多花野牡丹(MelastomaaffineD. Don),其种子发芽最适温度为26 ℃左右。由于白花野牡丹多分布于亚热带,而本研究中也证实其黄色种子在25 ℃萌发率较高,而当环境平均气温在16 ℃时,白花野牡丹种子萌发就受到了严重抑制。
在不良环境条件下,生产上常用低温(5 ℃)预处理来增强种子萌发时的抗逆性,以提高幼苗质量。与持续低温胁迫有所不同,短时间低温预处理能够引发种子萌发,这是因为种子萌发对温度变化较为敏感,短时间低温,能使种子内的不溶性物质转变为可溶性糖,但是如果时间太短,则种子内的物质来不及转化,而时间太长,种子内贮藏的物质消耗太多,不利于种子萌发[10-13]。本研究结果证实,以水为发芽基质,4 ℃低温预处理12 h后,将种子放至室温(平均气温16 ℃)下,萌发率显著提高。因此在实际中,为了提高白花野牡丹种子的萌发率,可采用此方法。当然萌发温度还可提高到25 ℃。
盐分对种子萌发的影响一般归结为渗透效应和离子效应。盐分的渗透效应是因为盐离子能引起土壤溶液渗透势降低而阻碍种子吸水,从而影响种子萌发。离子效应一方面造成离子毒害而抑制种子萌发,另一方面离子进入种子内能降低种子水势,促进种子吸水而提高萌发率[14-16]。在室内研究条件下,盐分对种子萌发的影响是渗透效应与离子效应共同作用的结果。总体来看,盐溶液浓度越高,抑制作用越明显。但轻度的NaCl胁迫可提高种子的发芽率、发芽指数,促进种子的萌发[17-18]。本试验在25 ℃恒温条件下,0.1%、0.2%硝酸盐对种子萌发有明显的抑制作用,而当其体积分数上升为0.4%时,则完全抑制了种子萌发。在平均气温为16 ℃时,0.1%的硝酸盐类可以大幅增加黄色种子萌发率,其中0.1% NH4NO3使黄色种子萌发率比水高出近4倍。
植物激素不仅对植物生长发育具有调控作用,还对一些植物种子萌发具有促进或抑制作用。其中GA可通过改变种子内在生理活性物质的分布而打破休眠[19-22]。本试验结果也证明, 在较高温度如25 ℃恒温时,GA处理对白花野牡丹黄色种子萌发无影响,而当气温平均为16 ℃时,50、100 mg·L-1GA3就能显著提高种子的萌发势和萌发率。说明在环境温度较低情况下, GA3能够发挥作用,提高此种子的萌发率。
种子含水量对种子萌发具有明显的影响,适宜的种子含水量是种子保持高活力的条件之一。但是,种子在萌发时,太过急速吸水会因细胞壁的快速膨胀而损伤胚细胞原生质体,导致种子活力下降。PEG具有降低水势的作用,因此PEG溶液可使种子吸水速度变缓,种子胚细胞得以在有水环境中慢慢启动细胞生理生化过程,为种子萌发提供基础性代谢物质,从而提高种子活力,促使幼苗生长,从而提高植物生长量或经济作物产量[23-27]。本试验结果表明,从最终萌发率来看,气温平均16 ℃时,0.1%、0.5%、1%3种体积分数的PEG6000均能显著提高种子发芽率,且随浓度提高,发芽率提高。说明较高体积分数PEG6000能够较好的调节种子内外水分交换状况,起到渗透调节作用,改善种子性能,提高其萌发能力。在25 ℃或其以上温度,其萌发无需PEG6000处理。表明低体积分数的PEG可以在低于25 ℃环境中促进这种植物的萌发,虽然萌发率不如恒温培养下的高,但这也为更广泛培育提供了一定的科学依据。
白花野牡丹种子属于较难萌发的一类种子。深色种子不萌发,可能是由于其胚发育不完全或是种皮限制严重等原因,需要进一步的探索研究。黄色种子是属于可萌发一类种子。黄色种子萌发比较合适的温度是25 ℃。如果环境温度低于16 ℃[28],即可用0.1%、0.2%的硝酸盐类, 50~100 mg·L-1GA3或0.1%~1% PEG6000溶液处理,或者通过低温(4 ℃)诱导来促进其萌发。
[1] 金红,焦根林,陈刚.白花野牡丹的开花进程、花部形态特征及访花昆虫观察[J]. 植物资源与环境学报,2015,24(2): 73-79.
[2] 刘棠瑞,廖日京.树木学:下册[M].3 版.台北: 台湾商务印书馆,1988: 697.
[3] 王志强.知本绿踪:知本国家森林游乐区植物解说手册(树木篇)[M].台北:行政院农业委员会林务局,2008: 151.
[4] 陈妙贤,朱纯,黄雪梅,等.多花野牡丹种子萌发和贮藏特性的研究[J].广东园林,2007, 29(1): 54-57.
[5] 杨景宁,王彦荣.NaCl胁迫对4种荒漠植物种子萌发的影响[J].草业学报,2012,21(5):32-38.
[6] 姚世响,油天钰,徐栋生,等.新疆干旱区植物藜的种子异型性及其萌发机理[J]. 生态学报,2010,30( 11): 2909-2918.
[7] 孙佳,郭江帆,魏朔南.植物种子萌发抑制物研究概述[J].种子,2012,31(4): 57-61.
[8] 杨利平,庄斌,苏正华,等.野牡丹属植物种子特征的初步研究[J].植物遗传资源学报,2008, 9(2):248-252.
[9] GULZAR S, KHAN M A.Seed germination of halophytic grassAeluropuslagopoides[J].Annals of Botany, 2001, 87(3): 319-324.
[10] 宋兆伟,郝丽珍,黄振英,等.光照和温度对沙芥和斧翅沙芥植物种子萌发的影响[J].生态学报,2010, 30(10): 2562-2568.
[11] 王孝宣,李树德,东惠茹,等.低温胁迫对番茄苗期和开花期脂肪酸的影响[J].园艺学报,1997,24(2):161-164.
[12] 谢顺赞,卢永奋,马春梅.低温胁迫对茄种子萌发的影响[J].长江蔬菜,2009(20):43-44
[13] LEVITT J.Response of pants to environmental stress [M].2nd ed.New York:Academic Press,1980:365-435.
[14] 闫留华,陈敏,王宝山.NaCl胁迫对2种表型盐地碱蓬种子萌发的渗透效应和离子效应研究[J].西北植物学报,2008,28(4):718-723.
[15] 阎顺国,沈禹颖,任继周,等.盐分对碱茅种子发芽影响的机制[J].草地学报,1994,2(2):12-19.
[16] MOHAMMED B, JEAN-MARIE K, STANLEY L. Osmotic and ionic effects of NaCl on germination,early seedling growth, and ion content ofAtriplexhalimus(Chenopodiaceae)[J].Canadian Journal of Botany, 2002, 80(3): 297-304.
[17] 杨景宁,王彦荣.NaCl胁迫对四种荒漠植物种子萌发的影响[J].草业学报,2012,21(5):32-38.
[18] 郭艳超,孙昌禹,王文成,等.盐胁迫对雪菊种子萌发的影响[J].中国园艺文摘,2013(12):11-13.
[19] 林多,李佳莹,赵磊.不同GA浓度处理对长白惚木种子萌发的影响[C]//2008园艺学进展(第八辑)——中国园艺学会第八届青年学术讨论会暨现代园艺论坛论文集.中国园艺学会,2008:474-476..
[20] 王非,王金侠,李强,等.GA3和IAA处理对4种铁线莲种子萌发的影响[J].草业科学, 2014,(4):672-676.
[21] 杨秀荣,刘亦学,刘水芳,等.植物生长调节剂及其研究与应用[J].天津农业科学,2007,13(1):23-25.
[22] 顾增辉,龙雅宜,张金政.应用赤霉素有机溶剂渗入法打破花卉种子休眠和促进萌发[J].种子,1992(1):55-58.
[23] 张伟峰,孙渭,李斌,等.几种化学药剂对烟草种子萌发的促进效果[J].种子, 2004,23(12): 20-23.
[24] 丁永乐,杨铁钊,郑宪滨,等. PEG对烤烟种子萌发和幼苗生理特性的影响[J].河南农业科学, 2000(1): 8-10.
[25] PLAUT Z,FEDERMAN E. A simple procedure to overcome polyethylene glycol toxicity on whole plants[J].Plant Physiol,1985,79:559-561.
[26] 洪法水,姬广民.聚乙烯醇预处理小麦种子对萌发代谢及生长的影响[J].作物学报,1997,23(2):247-251.
[27] 史锋厚,朱灿灿,沈永宝,等.PEG6000渗透处理对油松种子发芽的影响[J].浙江林学院学报,2008,25(3):289-292
[28] 张艳玲,孙守如,王兰菊,等.低温处理对芹菜种子发芽的影响[J].河南农业大学学报,1998,32(1):73-75.
(责任编辑:朱秀英)
PreliminarystudyongerminationfactorsofMelastomacandidumD.Don.
YANG Xiangna1, CAO Cuiling1, JIN Hong2, CHEN Xi1
(1.College of Life Sciences, Northwest A & F University, Yangling 712100, China; 2.Fairylake Botanical Garden, Chinese Academy of Science, Shenzhen 518004, China)
Adopting of the method of paper on the petri dish, effects of different temperature treatments, low temperature (4 ℃) pretreatment and different concentrations of nitrate, GA3and PEG6000on seed germination of theMelastomacandidumD. Don were studied. The results showed that under the non temperature treatment, the germination rate of seed at 25 ℃ was higher than at 16 ℃. Different time of low temperature pretreatment improved germination of the yellow seed, and the germination rate was the highest in 12 h pretreatment. The treatment of different concentrations of nitrate, PEG6000and GA3all increased germination rate of the yellow seed at seed germination stage; The treatment of 0.1%, 0.5%, 1% PEG6000and 50,100 mg·L-1GA3had no effect.
MelastomacandidumD.Don; vigor; germination rate; nitrate; GA3; PEG6000
2015-05-20
深圳市城管科研项目(201318)
杨向娜(1980-),女,陕西蓝田人,实验师,主要从事植物生理和养分生理方面的研究工作。
金 红(1974-),女,辽宁本溪人,高级工程师,博士。
1000-2340(2016)04-0473-06
S685.11
:A
