Ca2+/CaM参与了sHSP26增强玉米叶绿体耐干旱高温复合胁迫
2016-09-25赵玉龙李娜娜赵飞云胡秀丽
赵玉龙, 李娜娜, 赵飞云, 胡秀丽
(河南农业大学生命科学学院,河南 郑州 450002)
Ca2+/CaM参与了sHSP26增强玉米叶绿体耐干旱高温复合胁迫
赵玉龙, 李娜娜, 赵飞云, 胡秀丽
(河南农业大学生命科学学院,河南 郑州 450002)
以玉米(ZeamaysL.)品种郑单958为试验材料,利用免疫印迹等技术,确定干旱高温复合胁迫条件下,Ca2+/CaM对sHSP26的表达、叶绿体抗氧化防护酶活性的影响。结果显示:(1)高温、高温干旱复合胁迫下sHSP26的表达量明显高于对照和干旱,经CaCl2预处理后能显著增强sHSP26的表达;(2)经CaCl2预处理后,叶绿体内超氧化物歧化酶(SOD)、谷胱甘肽还原酶(GR)和抗坏血酸过氧化物酶(APX)活性显著增加,而经Ca2+螯合剂EGTA及CaM抑制剂TFP和W7处理后,这些抗氧化防护酶活性显著下降。本研究表明,在干旱高温复合胁迫条件下适宜浓度的Ca2+能够增强sHSP26的表达及提高叶绿体抗氧化防护酶活性,从而对叶绿体起到保护作用,提高植物耐热性。
干旱高温胁迫;免疫印记;sHSP26;叶绿体抗氧化防护酶
近年来,由于温室效应的影响,高温胁迫普遍存在[1],而干旱又常常与高温相伴[2],加重了植物体内蛋白质变性、生物膜破损、生理代谢紊乱。为了生存,植物会进化出相应机制适应环境的改变。植物遭受胁迫的早期,会引起多种生理代谢反应及胁迫基因的表达来适应环境[3]。在被调控的生理代谢反应中,热休克蛋白(HSPs)、Ca2+/CaM(钙调蛋白)等起着重要作用。小热休克蛋白(sHSPs),分子量为15~42 kD,其中20~40 kD 的sHSPs在高等植物中最为丰富[4-5]。HSPs是植物细胞内一种重要的分子伴侣[6],在非胁迫条件下参与细胞内蛋白质新生肽链的折叠、转运、成熟及变性蛋白质的降解,在胁迫条件下维持蛋白质的可溶状态,使解折叠的失活蛋白质重新折叠恢复活性[7-8]。最近,本课题组采用比较蛋白质组学的方法,从玉米第2片顶端新展开的叶中筛选出了正常、干旱条件下几乎不表达,仅在高温、高温干旱复合胁迫条件下表达的 sHSP17.2、sHSP17.4、sHSP26 3个sHSPs[9],且证明 sHSP26 位于叶绿体,与6个叶绿体蛋白互作,保护了PSII活性[10]。此外,XUE等[11]研究发现 sHSP26 能够增强植物对胁迫的忍耐力。
钙(Ca2+)不仅是植物生长发育必需的营养元素,而且能够作为第二信使调控生物体的生长发育。研究表明,适宜浓度的CaCl2能够增强绿玉树及黄瓜幼苗抗寒性、提高小麦耐热性、增强玉米耐盐及干旱能力[12-16];TAN等[17]研究发现CaCl2预处理能提高SOD、APX、GR活性、Fv/Fm及HSP70的表达;ZHOU[18]在研究中发现CaCl2处理能促进小麦sHSP26的合成,而EGTA、CPZ及TFP明显降低该热激蛋白的合成量。GONG等[19]研究证明Ca2+/CaM参与植株耐热性的获得。目前,Ca2+在植物适应胁迫中的作用研究,主要集中在单一胁迫因子中,在复合胁迫条件下,尤其是高温干旱复合胁迫条件下在玉米拔节期以后,Ca2+对 sHSPs 的影响研究很少。因此,本研究以郑单958新展开的第5片叶为试验材料,研究 Ca2+/CaM 在 sHSP26 增强叶绿体耐高温干旱复合胁迫中的作用,为深入了解sHSP26介导植株抵御干旱高温等非生物胁迫的生理基础提供理论依据,为培育综合抗性突出的玉米新品种提供理论依据。
1 材料与方法
1.1植物材料和胁迫处理
以玉米郑单958为试验材料,采用沙培与水培协作的方式培养。当植株第5个叶片完全展开时,对其进行不同的胁迫处理:(1)干旱胁迫是将植株置于体积分数为18 %的PEG6000溶液中进行诱导,在 28 ℃和40 %相对湿度培养8 h;(2)高温胁迫是将植株置于蒸馏水中,培养箱温度从28 ℃起以 2 ℃·h-1升至 42 ℃ 并保持1 h,共8 h;(3)高温干旱复合胁迫是使植株在干旱胁迫的同时进行高温胁迫。对照组的植株置于蒸馏水中维持育苗时环境条件。
在Ca2+诱导剂 CaCl2和鳌合剂 EGTA 以及 CaM 抑制剂 TFP、W7 的试验中,分别用10 mmol的CaCl2、10 mmol的EGTA、300 μmol的TFP、300 μmol的W7对4批植株进行预处理 8 h,然后进行干旱、高温、高温干旱复合胁迫处理。处理后,迅速取下第5个叶片,放入液氮中冷冻,随后放入-80 ℃的冰箱内备用或者直接用第5片叶进行叶绿素荧光参数测定。
1.2Westernblot检测sHSP26表达
将玉米叶片放在盛有SDS缓冲液(2% SDS, Tris-HCl pH 6.8, 20%蔗糖和2% DTT) 的研钵中充分研磨后,4 ℃、13 000 r·min-1离心10 min,然后将25 μg蛋白提取物进行12.5% SDS-PAGE凝胶电泳。电泳结束后,将凝胶中蛋白转移到聚偏二氟乙烯(PVDF)膜上,sHSP26检测一抗为抗玉米sHSP26多克隆抗体,免疫复合物用辣根过氧化物酶偶联的二抗检测,最后使用DAB染色试剂盒染色。β-肌动蛋白相对丰富度作为内参[20]。重复3次。
1.3叶绿体的提取和粗酶液的制备
叶绿体的分离按 MUNNE-BOSCH 和 ALEGRE[21]的方法。取5 g玉米叶片,加入冰冷的研磨悬浮缓冲液(2 mmol EDTA;1 mmol MgCl2;1 mmol MnCl2;0.33 mmol山梨醇;0.1 % BSA;10 mmol抗坏血酸;50 mmol HEPES-KOH,pH 7.5)。在4 ℃研磨成匀浆。用4层纱布过滤匀浆。将滤液倒入2个250 mL离心管中。3 300 r·min-1离心匀浆5 min。小心倾去上清液。加入2 mL 研磨缓冲液。置回转振荡器的冰上振动1~2 min使团块散开。将重悬浮的叶绿体加到28 %Percoll(28 %Percoll;2 mmol EDTA;1 mmol MgCl2; 1 mmolMnCl2;0.33 mmol山梨醇;0.1 % BSA;10 mmol抗坏血酸;3 % PEG6000;1 %Ficoll;50 mmol HEPES-KOH ,pH8.0) 梯度上。15 000 g离心15 min。(应该能看到2条绿色条带,上面的带是破碎叶绿体。完整叶绿体位于接近离心管底部的带中)。抽出梯度介质直到底部的条带。将每一管中叶绿体移至50 mL离心管中,用悬浮缓冲液(2 mmol EDTA;1 mmol MgCl2;1 mmol MnCl2;0.33 mmol山梨醇;5 mmol抗坏血酸;50 mmol HEPES-KOH,pH 8.0)稀释至40 mL。3 300 g离心4 min。将所有叶绿体倒入1个离心管中,稀释至40 mL,3 300 g离心2 min。1~2 mL 裂解缓冲液(1 mmol MgCl2;0.1 mmol EDTA;50 mmol磷酸钾,pH 7.8)裂解叶绿体。在对 APX 测定时,裂解液中需加入2 mmol抗坏血酸。
1.4超氧物歧化酶(SOD)的活性测定
根据 GIANNOPNLITIS等[22]方法测定SOD活性。用于测量的 3 mL 反应液中含有50 mmol 磷酸钾缓冲液(pH 7.8、2 μmol核黄素、13 mmol 甲硫氨酸、0.1 mmol EDTA、75 μmol NBT、100 μL粗酶液。试验中将混合后的反应液置于透明试管架上,在5 000 lx 的光照培养箱内光照15 min后取出试管避光,迅速测定OD560值,不加酶液的照光管为对照。
1.5谷胱甘肽还原酶(GR)的活性测定
根据SCHAEDLE等[23]方法测定GR的活性。用于测量的1 mL的反应液中含有50 mmol磷酸钾缓冲液(pH 7.0、20 mmol的EDTA、5 mmol GSSG、1.5 mmolNADPH、200 μL 粗酶液)。试验时加入粗酶液后立即测量1 min内OD340值的变化,温度在20 ℃以下。(消光系数为6.2 L·mmol-1)。
1.6抗坏血酸过氧化物酶(APX)的活性测定
根据NAKANO等[24]方法测定APX的活性。用于测量的1 mL的反应液中含有50 mmol磷酸钾缓冲液(pH 7.0、0.5 mmolASA、0.1 mmol H2O2、200 μL粗酶液和蒸馏水),试验时加入粗酶液后立即测量1 min内OD290值的变化,温度在20 ℃以下。(消光系数为2.8 L·mmol-1)。
1.7可溶蛋白含量测定
根据BRADFORD[25]的方法测定酶液中蛋白含量。用不同浓度的BSA溶液与考马斯亮蓝反应制作标准曲线,横坐标为蛋白浓度,纵坐标为光吸收值,为测定的酶液提供定量依据。将100 μL 的粗酶液加入3 mL 0.01 %考马斯亮蓝 G-250中,震荡混合均匀,同时以100 μL双蒸水替代粗酶液的反应液作为空白对照,震荡使其混合均匀,5 min后测定其在595 nm的吸光度。
1.8数据分析
酶活性及光合作用参数的试验结果是6 次试验数据的平均值。对这些平均值在α为5%的水平上进行方差分析和Duncan's多重比较。
2 结果与分析
2.1Ca2+的积累在高温胁迫条件下对玉米叶片sHSP26蛋白表达的影响
Ca2+作为植物体内重要的第二信使,直接或间接调节多种生物学功能。为了确定Ca2+是否参与了高温干旱复合胁迫诱导的sHSP26表达,玉米植株用 10 mmol CaCl2预处理后,再进行各种胁迫处理。结果如图1所示,与未用CaCl2预处理的相比,CaCl2预处理的显著增加了高温、高温干旱复合胁迫诱导的sHSP26表达。

CaCl2-CK、CaCl2-D、CaCl2-H、CaCl2-D+H分别表示对照、干旱、高温、干旱高温;CaCl2+CK、CaCl2+D、CaCl2+H、CaCl2+D+H分别表示10 mmol CaCl2预处理8 h后,再进行对照、干旱、高温、干旱高温复合胁迫处理。所用图是3次重复结果的代表图。CaCl2-CK、CaCl2-D、CaCl2-H、CaCl2-D+H are the control, drought,heat and combined drought and heat stress ; CaCl2+CK、CaCl2+D、CaCl2+H、CaCl2+D+H are the control, drought, heat and combined drought and heat stress for 8 h after 10 mmol CaCl2 pretreatment , respectively. The figure was a representation of three results.图1 Western blot分析CaCl2对干旱(D)、高温(H)、干旱高温复合胁迫 (DH) 玉米叶片中sHSP26蛋白表达的影响Fig.1 Western blot analysis of the effect of CaCl2 onsHSP26 protein expression under drought, heatand combined drought and heat stress
2.2Ca2+/CaM的积累对不同胁迫条件下玉米叶绿体抗氧化防护酶的影响
为了确定Ca2+/CaM 是否参与了高温干旱复合胁迫诱导的玉米叶绿体抗氧化防护酶活性,玉米植株分别用 Ca2+抑制剂或 CaCl2及CaM 拮抗剂 TFP、W7 预处理后,然后再进行各种胁迫处理。如图2所示,CaCl2预处理显著提高几种处理条件下SOD(图2-A)、GR(图2-B)、APX(图2-C) 活性,而Ca2+鳌合剂EGTA及CaM拮抗剂W7、TFP预处理均显著降低了几种处理条件下SOD(图2-D)、GR(图2-E)、APX(图2-F)活性,暗示了Ca2+/CaM参与了几种胁迫诱导的叶绿体抗氧化防护酶活性的提高。
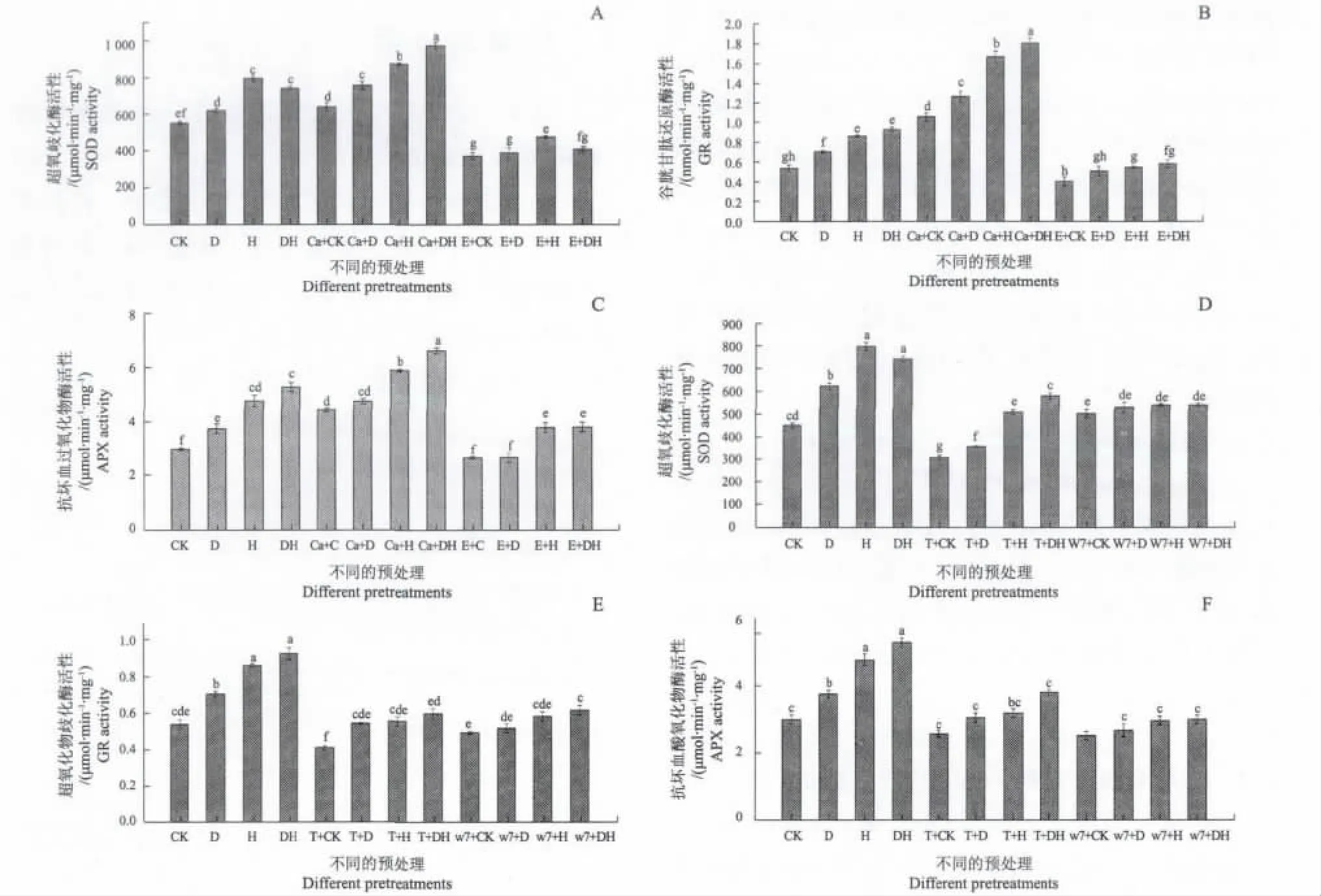
Ca+CK、Ca+D、Ca+H、Ca+DH分别表示10 mmol CaCl2预处理8 h后,再进行对照、干旱、高温、干旱高温复合胁迫处理。E+CK、E+D、E+H、E +DH分别表示10 mmol的EGTA预处理8 h后,再进行对照、干旱、高温、干旱高温复合胁迫处理。T+CK、T+D、T+H、T +DH分别表示300 μmol TFP预处理8 h后,再进行对照、干旱、高温、干旱高温复合胁迫处理。W7+CK、W7+D、W7+H、W7 +DH分别表示300 μmol W7预处理8 h后,再进行对照、干旱、高温、干旱高温复合胁迫处理。Ca+CK, Ca+D, Ca+H, Ca+DH are the control, drought, heat and combined drought and heat stress for 8 h after 10 μmol CaCl2pretreatment , respectively. E+CK, E+D, E+H, E +DH are the control, drought, heat and combined drought and heat stress for 8 h after 10 μmol EGTA pretreatment , respectively. T+CK, T+D, T+H, T +DH are the control, drought, heat and combined drought and heat stress for 8 h after 300 μmol TFP pretreatment , respectively. W7+CK, W7+D, W7+H, W7+DH are the control, drought, heat and combined drought and heat stress for 8 h after 300 μmol W7 pretreatment , respectively.图2 Ca2+诱导剂CaCl2和抑制剂EGTA,及CaM抑制剂TFP和W7对玉米幼苗叶片中抗氧化防护酶活性的影响Fig.2 Effect of pretreatment with the Ca2+ induced CaCl2 and channel inhibitor EGTA, andCaModulin inhibitor TFP and W7 on antioxidant enzymes activity of maize leaves
3 结论与讨论
植物在漫长的进化过程中,为了适应自然界存在的逆境胁迫,自身会从生理生化、分子、细胞层面发生一系列的应答反应,从而使很多基因的表达发生变化,诱导多种逆境蛋白的产生。在植物的整个生长过程,Ca2+作为一个次级信号分子,起着感应刺激和传递信号的作用。Ca2+信号是CaM一个重要信使分子。在正常情况下CaM不具备催化活性,但盐害、冻害、干旱、热激等能使细胞质内Ca2+浓度发生改变,激活CaM,诱导下游靶蛋白的表达,参与植物细胞中多种酶及生理过程的调节[26]。sHSPs能够降低热激对植物所造成的损伤,同时对受损的细胞还有一定的修复功能,并且叶绿体生成的sHSP能够减轻光抑制[27]。研究显示sHSP26与叶绿体内过氧化物酶存在互作,并且对叶绿体中的光合作用蛋白起到保护作用[10]。本研究结果显示,经CaCl2处理后,sHSP26的表达明显上调,此时产生的sHSP26作为分子伴侣能够稳定蛋白质结构,修复损伤蛋白,使植物免遭伤害,由此表明适宜浓度的CaCl2能够诱导sHSP26的表达,增强植物的抗逆性。
本研究发现,Ca2+/CaM参与高温、干旱高温复合胁迫诱导的sHSP26表达量的增加和抗氧化防护酶活性的提高。研究结果表明,在高温和干旱高温复合胁迫条件下,一方面,Ca2+/CaM作为sHSP26的上游信号分子诱导了sHSP26的表达,作为分子伴侣sHSP26使解折叠的失活蛋白质重新折叠恢复活性,从而在一定程度上缓解胁迫对植物所造成的损伤,增强植株抗逆性;另一方面,Ca2+/CaM作为sHSP26的上游信号分子增强了抗氧化防护酶活性,提高植株对活性氧及自由基的清除能力,减缓氧化胁迫对植物所造成的损伤,增强植物的抗逆性。本研究结果不仅为深入了解sHSP26及HSP类物质介导植株抵御干旱及高温等非生物逆境的生理基础提供理论依据,而且对农业生产实践具有一定的指导意义。
[1] LEE B H, WON S H, LEE H S, et al. Expression of the chloroplast-localized small heat shock protein by oxidative stress in rice[J]. Gene, 2000, 245(2): 283-290.[2] ZAHUR M, MAQBOOL A, IRFAN M, et al. Functional analysis of cotton small heat shock protein promoter region in response to abiotic stresses in tobacco using Agrobacterium-mediated transient assay[J]. Mol Biol Rep, 2009, 36(7): 1915-1921.
[3] ZHU J K. Salt and drought stress signal transduction in plants[J] . Annu Rev Plant Biol, 2002, 53: 247.
[4] FINKELSTEIN R R, GAMPALA S S, ROCK C D. Abscisic acid signaling in seeds and seedlings[J] . Plant Cell, 2002, 14(suppl 1): S15-S45.
[5] WANG W, VINOCUR B, SHOSEYOV O, et al. Role of plant heat-shock proteins and molecular chaperones in the abiotic stress response[J] . Trends Plant Sci, 2004, 9(5): 244-252.
[6] BASHA E, LEE G J, DEMELER B. E. Vierling. Chaperone activity of cytosolic small heat shock proteins from wheat[J]. Eur. J. Biochem, 2004, 271(8): 1426-1436.
[7] JAYA N, GARCIA V, VIERLING E. Substrate binding site flexibility of the small heat shock protein molecular chaperones[J]. Proc Nati Acad Sci of USA, 2009, 106(37): 15604-15609.
[8] YU J H, KIM K P, PARK S M, et al. Biochemical analysis of a cytosolic small heat shock protein, NtHSP18.3, from Nicotiana tabacum[J]. Mol Cells, 2005, 19(3): 328-33.
[9] HU X L, LI Y H, LI C H, et al. Characterization of small heat shock proteins associated with maize tolerance to combined drought and heat stress[J]. Journal of Plant growth Regulation, 2010, 29(4): 455-464.
[10] HU X L, YANG Y F, GONG F P, et al. Protein sHSP26 improves chloroplast performance under heat stress by interacting with specific chloroplast proteins in maize (ZeamaysL.)[J]. Journal of Proteomics, 2015, 115:81-92.
[11] XUE Y, PENG R, XIONG A, LI X, et al. Over-expression of heat shock protein gene hsp26 inArabidopsisthalianaenhances heat tolerance[J]. Biologia Plantarum, 2010, 54(1): 105-111.
[12] JANG L J, LI P W, LI C Z. Effection of PP333and CaCl2on cold resistant improvement of cuttings ofEuphorbiatirucalliL.[J].Hunan Forestry Science Technology, 2003, 30(3): 0020-0024.
[13] YANG N, LIU P P, BAI X M, et al. Inductive effect of abscisic acid,salicylic acid,and calcium on cold resistance of cucumber seedling[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2012, 21(8): 164-170.
[14] LIU F L,HAN R L, ZHU F R, et al. The effects of Ca2+on the photosynthesis of wheat under heat stress[J]. Acta Agriculturae BorealiSinica, 1991, 6: 15-20.[15] ZHAO C J, XUE Y W, YANG K J, et al. Effects of exogenous calcium on the ionic contents in different organs of maize seedling under salt stress[J]. Journal of Maize Science, 2012, 20(3): 68-72.
[16] LI S P, BI Y L, CHEN P Z, et al. Influence of exogenous calcium on the growth of maize under arid-stress in the area[J]. Journal of China University of Mining Technology, 2013, 42(3): 0477-0483.
[17] TAN W, MENG Q W, MARIAN BRESTIC, et al. Photosynthesis is improved by exogenous calcium in heat-stressed tobacco plant[J].Journal of plant physiology. 2011, 168(17): 2063-2071.
[18] ZHOU R G. Ca 2+ /CaM pathway of heat shock signal transduction[J]. Acta Agriculturae Boreali Sinica, 2003, 18(S1): 24-29.
[19] GONG M, LI Y J, DAI X, et al. Involvement of calcium and calmodulin in the acquisition of heat shock induced thermotolerance in maize seedlings[J]. J Plant Physiol, 1997,150 (5): 616-621.
[20] HU X L, LIU R X, LI Y H, et al. Heat shock protein 70 regulates the abscisic acid-induced antioxidant response of maize to drought and heat stress combination[J]. Plant Growth Regulation, 2010, 60(3): 225-235.[21] MUNNE BOSCH S, ALEGRE L. Drought-induced changes in the redox state of α-tocopherol, ascorbate, and the diterpene carnosic acid in chloroplasts of Labiatae species differing in carnosic acid contents[J]. Plant Physiol, 2003, 131(4): 1816-1825.
[22] GIANNOPOLITIS C N, RIES S K. Superoxide dismutase: I. Occurrence in higher plants[J] . Plant Physiol, 1977, 59(2): 309-314.
[23] SCHAEDLE M, BASSHAM J A. Chloroplast glutathione reductase[J]. Plant Physiol, 1977, 59(5): 1011-1012.[24] NAKANO Y, ASADA K. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J] . Plant Cell Physiol, 1981, 22(5): 867-880.
[25] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Anal Biochem, 1976, 72(1/2): 248-254.
[26] DU L, POOVAIAAH B W. Ca2+/calmodulin is critical for brassinosteroid biosynthesis and plant growth[J]. Nature, 2005, 437 (7059): 741-745.
[27] SCHUSTER G, EVEN D, KLOPPSTECH K, et al. Evidence for protection by heat-shock protein against photoinhibition during heat-shock [J]. The EMBO Journal, 1988, 7(1): 1-6.
[28] FRYER M J, OXBOROUGH K, MULLINEAUX P M, et al. Imaging of photo-oxidative stress responses in leaves [J]. J Exp Bot, 2002, 53(372): 1249-1254.
[29] CHEESEMAN J M. Hydrogen peroxide and plant stress: a challenging relationship [J]. Plant Stress, 2007, 1(1): 4-15.
(责任编辑:朱秀英)
Ca2+/CaMinvolvinginsHSP26protectingmaizechloroplastfromthecombinationofdroughtandheatstress
ZHAO Yulong, LI Nana, ZHAO Feiyun, HU Xiuli
(College of Life Science, Henan Agricultural University, Zhengzhou 450002, China)
Taking maize variety (ZeamaysL.) Zhengdan 958 as experimental material, we used technologies like immunoblotting and determined the effect of Ca2+/CaM on sHSP26 expression, antioxidant defense system under the combination of drought and heat stress.The main results showed that: (1) the expression of sHSP26 under heat stress or combined drought and heat stress is significantly higher than that under control and drought, and after pretreatment with CaCl2, sHSP26 expression is much higher than that of the untreated group; (2) after pretreatment with CaCl2, superoxide dismutase (SOD), glutathione reductase (GR), ascorbate peroxidase (APX) activity was significantly increased, but after pretreatment with Ca2+chelator EGTA and CaM antagonists TFP and W7, the activity of these enzymes significantly decreased. These results showed that Ca2 +/ CaM enhanced the antioxidant defense system and the expression of sHSP26, which protected maize chloroplasts from the damage caused by combined drought and heat stress, and enhanced maize endurance to stress.
combined heat and drought stress; immunoblotting test; sHSP26; chloroplast antioxidant enzyme
2015-08-12
国家自然科学基金项目(31171470);河南省高校科技创新人才支持计划(13HASTIT001ABA)
赵玉龙(1987-),男,河南禹州人,硕士研究生,主要从事玉米逆境生理研究工作。
胡秀丽(1976-),女,河南遂平人,教授,博士。
1000-2340(2016)04-0447-06
S513
:A
