木通与川木通及关木通的快速PCR鉴别△
2016-09-25崔占虎袁媛胡峻
崔占虎,袁媛,胡峻
(1.南阳市第一人民医院,河南 南阳 473010;2.道地药材国家重点实验室培育基地 中国中医科学院 中药资源中心,北京 100700)
木通与川木通及关木通的快速PCR鉴别△
崔占虎1,袁媛2*,胡峻2
(1.南阳市第一人民医院,河南 南阳 473010;2.道地药材国家重点实验室培育基地 中国中医科学院 中药资源中心,北京 100700)
目的:建立一种准确、快速、高效鉴别木通、川木通及关木通的分子鉴别方法。方法:采集不同产地的木通、川木通及关木通基原植物,所有样品进行总DNA的提取,通过对木通、川木通及关木通样品trnL-trnF片段进行扩增、测序,进行同源比对后根据其变异位点设计特异性鉴别引物,采用2步法进行PCR扩增,从而对木通、川木通及关木通进行鉴别。结果:通过对影响PCR反应时间的退火温度、变性温度、退火时间、变性时间、循环次数等因素进行优化,并对不同型号PCR仪进行考察,分别获得木通、川木通及关木通快速PCR反应程序。在PCR产物中加入SYBR Green I染料,正品显示出明亮绿色荧光,而混淆品不显示荧光。结论:快速PCR方法可以简单快速鉴别木通、川木通及关木通,为实现药材分子鉴别的现场运用提供技术支撑。
快速PCR;木通;分子鉴定;荧光检测
木通为木通科植物木通Akebiaquinata(Thunb.) Decne、三叶木通A.trifoliata(Thunb.) Koidz.或白木通A.trifoliata(Thunb.) Koidz.var.australis(Diels) Rehd.的干燥藤茎。有利尿通淋、清心除烦、通经下乳的功能,可用于淋证、水肿、心烦尿赤、口舌生疮、经闭乳少、湿热痹痛[1]。
据文献考证,古代所用木通正品是木通科的木通。清代《植物名实图考》提出毛茛科木通,即川木通,来源包括毛茛科植物小木通ClematisarmandiiFranch.或绣球藤ClematisMontanaBuch.-Ham.的干燥藤茎。然而历代中本草中未见有“关木通”的记载。直到1954年,任仁安等通过调查发现我国商品木通主要为马兜铃科植物东北马兜铃AristolochiamamshuriensisKom.的干燥藤茎[2]。其后,《中华人民共和国药典》(《中国药典》)1963年版收录了关木通,其基原为马兜铃科植物东北马兜铃;同时分别收录了木通、川木通。但因药源短缺,自1977年版至2000年版《中国药典》则将木通删去,仅收录了川木通和关木通,而医师处方和药物制剂的实用名则仍为木通,同名异物现象甚为严重。在中医药科技工作者的努力下,对木通类商品进行了系统的研究工作,《中国药典》2005年版收载木通科植物木通、三叶木通或白木通的藤茎为木通。由于历史变迁、本草记述中异物同名、同名异物和地区习惯用药等原因,商品木通存在严重的品种混乱情况。2005年版《中国药典》将木通正名后,商品木通的市场大有好转,但部分地区仍存在混淆使用的情况,必须引起充分的注意[2]。3种不同来源的商品多加工为薄片,外观上区别不大,很容易混淆不清,因此,建立一种鉴别木通、川木通和关木通的方法至关重要。
近年来,不同研究学者分别采用高效液相色谱法、近红外光谱法、紫外光谱法以及DNA条形码方法等对3种不同来源的木通进行鉴定研究[3-6],但这些方法操作比较繁琐,用时较长,不利于推广,难以适应当前中药分子鉴定技术现场运用的需要[7]。PCR作为分子生物学中应用最广泛的技术之一,随着研究和应用领域的不断增长,存在着相当巨大的改进空间。自Millus等[8]发明PCR技术以来,一些学者不断调整PCR条件对PCR技术进行改良,并提出了快速PCR概念[9-11]。
快速、准确、高通量鉴别是现代中药分子鉴别的核心需要,目前快速PCR方法已成功用于部分中药材鉴定方面的研究,如金银花、蛇类药材等中药材的真伪鉴别[12-13],本文基于位点特异性PCR技术建立了木通、川木通及关木通快速PCR鉴别方法,并引入了荧光染料法对真伪鉴别结果进行检测,可明显缩短反应时间,提高鉴别效率,为实现药材分子鉴别的现场运用提供技术支撑。
1 材料和方法
1.1 材料﹑仪器与试剂

表1 样品材料信息表
1.1.2 仪器 GeneAmp 9700型PCR扩增仪(Applied Biosystem公司);TC-512梯度PCR仪(TECHNE公司);VeritiTM96孔梯度PCR扩增仪(Applied Biosystems公司);5810 R 型高速冷冻离心机(Eppendorf公司);VORTEX-2 GENIE漩涡震荡仪(Scientific industries 公司);DYY-12型电脑三恒多用电泳仪(北京六一仪器厂);HE99X-15-1.5型电泳槽(Hoefer公司);SYNGENE凝胶成像系统(GENE公司);ZF-7A型手持式紫外灯(上海谷村电子光学仪器厂)。
1.1.3 试剂 琼脂糖(Promega公司);溴化乙啶(Fluka公司);EXTaqDNA聚合酶、SpeedStar HSTaqDNA聚合酶、DL 2000 DNA Marker(TaKaRa公司);10 000× SYBR Green I(Invitrogen公司);其他试剂均为国产分析纯。
1.2基因组总DNA的提取及PCR扩增、测序 取适量的样品(约0.03 g),研磨成细粉后,采用改良的CTAB法提取总DNA,获得的DNA于-20 ℃保存备用。选择通用引物trnL-trnF对木通、川木通和关木通样品进行扩增,反应程序见表2。反应体系总体积为20 μL,包括10×buffer缓冲液2 μL,dNTP 1.6 μL,引物各0.5 μL,EXTaq0.2 μL,DNA 0.5 μL,灭菌蒸馏水14.7 μL。PCR反应条件见表2。反应结束后在PCR体系中加入5 μL 6×loading buffer,混匀后于EB染色的1.5 %浓度琼脂糖凝胶电泳检测,SYNGENE凝胶成像系统观察、成像。选择阳性PCR产物样品进行双向测序。
1.3 基于叶绿体序列的木通、川木通及关木通鉴别引物设计
将测序所得序列去除引物序列,去除引物后的序列使用BioEdit分析软件进行分析、校对处理后,找出具有稳定差异的变异位点,进而筛选出木通、川木通及关木通的特有变异位点,根据Newton等建立的扩增阻滞突变系统原理[14],主要是由于DNA聚合酶缺乏3′-5′外切酶活性,引物的3′末端碱基不能与靶DNA正确互补配对,那么靶DNA就不能被有效地扩增,因此,依据此原理及设计引物原则,利用Primer premier 5 软件根据每种药材特有的变异位点设计3对位点特异PCR引物,设计的3对特异引物MT-F1/R1、CMT-F1/R1、GMT-F1/R1扩增后片段大小分别为456、479、463 bp,引物序列见表2。
1.4 PCR扩增条件的确定
取样品DNA用于确定快速PCR反应条件。20 μL PCR反应体系,2.0 μL 10×buffer缓冲液,1.6 μL dNTP(2.5 mmol·L-1),0.5 μL上游及下游引物(5 μmmol·L-1),0.5 μL鉴别引物F2(5 μmol·L-1),0.2 μL SpeedStar HSTaqDNA聚合酶(Takara公司),0.5 μL模板DNA,14.7 μL无菌双蒸水。PCR反应在GeneAmp 9700型PCR扩增仪上进行,初始反应程序见表2。反应结束后取PCR反应产物5 μL,加入2 μL 6× Loading buffer (Takara 公司) 混匀后于EB染色的1%琼脂糖凝胶电泳检测,SYNGENE凝胶成像系统观察、成像。

表2 实验中的引物及反应条件
1.5 条件优化
在学科促进方面,他举例,比如甲状腺手术,由于初诊等因素的影响,这项手术在普外科、耳鼻咽喉头颈外科、甲状腺专科均有开展,而病种数据分析则能从效率、质量、效益等方面直观反映出各科开展情况的差异,“如果某一个科室开展这项手术,各方面都不占优势,那理应考虑转攻别的方面,夯实学科优势。”封国生表示,正是通过这样的精细化分析,实现病种结构、成本结构的“腾笼换鸟”,真正凸显三甲综合医院的功能定位,将常见病、多发病分流到基层医疗机构。
分别利用木通、川木通及关木通特异性鉴别引物对 MT-F1/R1、CMT-F1/R1、GMT-F1/R1进行PCR反应,并考察:①退火温度:52、54、56、58、60 ℃;②PCR循环数:30、28、26、24、22个循环;③变性温度:94、92、90、88 ℃;④变性和退火时间:20、10、5、3、1 s;⑤不同PCR仪:9700型PCR仪(ABI公司),VeritiTM96孔梯度PCR扩增仪(Applied Biosystems公司),TC-512型PCR仪(TECHNE公司)。
1.6 PCR产物检测
在PCR扩增产物中加入1 μL 100× SYBR Green I于365 nm紫外波长下检测荧光,出现绿色荧光则表明存在阳性扩增产物。
2 结果分析
2.1 鉴别引物设计及验证
选择通用引物trnL-trnF对木通、川木通及关木通样品进行PCR扩增,然后通过Clustal W软件进行序列比对,根据其变异区设计3对特异引物。利用位点特异性PCR方法对特异引物进行验证,PCR结果发现通过利用木通位点特异PCR引物对木通、川木通及关木通进行扩增,木通可以扩增出一条带,而川木通及关木通则扩增不出条带。使用川木通位点特异PCR引物,川木通可以扩增出一条带,而木通及关木通则扩增不出条带。使用关木通位点特异PCR引物,关木通可以扩增出一条带,而木通及川木通则扩增不出条带。结果表明设计的3对特异引物可以用作木通、川木通及关木通之间的鉴别引物。
2.2 快速PCR反应条件的优化
由于Yap等研究表明,低温预变性(92 ℃ 1 min)即可实现PCR有效扩增[9],且本课题组前期证实94 ℃预变性1 min可以实现PCR产物的有效扩增[12-13],因此本文把PCR初始程序设计为94 ℃预变性1 min,从94 ℃变性开始,两步法,30个循环,并开展PCR反应条件的优化。在此基础上进一步依次对PCR反应过程中退火温度、PCR循环数、变性温度、变性和退火时间5个因素进行优化,并分析了不同的PCR仪对改良后PCR反应稳定性的影响。
2.2.1 木通特异引物快速PCR条件优化 凝胶电泳结果表明,对于木通特异引物,退火温度分别为54、56、58、60 ℃时,木通样品均能够扩增出目的条带,但由于60 ℃时条带较弱,因此选择58 ℃为最适退火温度;退火最适时间为10 s。大于26个循环时,木通样品均出现明显条带,但26个循环时条带较弱,因此选择28个循环为最适循环数。当变性温度高于88 ℃时,木通能够扩增出明显条带,而川木通和关木通则均不能扩增出条带,因此选择88 ℃为最适变性温度。变性时间在5 s和3 s时木通样品均有条带,3 s时条带亮度明显减弱,因此选择5 s为最适变性时间(见表3)。
2.2.2 川木通特异引物快速PCR条件优化 对于川木通特异引物,退火温度分别为54、56、58、60 ℃时,川木通样品均能够扩增出目的条带,但由于60 ℃时条带较弱,因此选择了58 ℃为最适退火温度;最适退火时间为5 s。大于24个循环时,川木通样品均出现明显条带,但24个循环时条带较弱,因此选择26个循环为最适循环数。当变性温度高于88 ℃时,川木通能够扩增出明显条带,而木通和关木通则均不能扩增出条带,因此选择88 ℃为最适变性温度。变性时间在5 s和3 s时川木通样品均有条带,3 s时条带亮度明显减弱,因此选择5 s为最适变性时间(见表3)。
2.2.3 关木通特异引物快速PCR条件优化 对于关木通特异引物,退火温度分别为54、56、58、60 ℃时,关木通样品均能够扩增出目的条带,但由于58 ℃时条带最亮,因此选择了58 ℃为最适退火温度;最适退火时间为10 s。大于26个循环时,关木通样品均能够扩增出条带,但26个循环时关木通条带较弱,因此选择28个循环为最适循环数。当变性温度高于88 ℃时,关木通能够扩增出明显条带,而木通和川木通则均不能扩增出条带,因此选择88 ℃为最适变性温度。变性时间在5 s和3 s时关木通样品均有条带,3 s时条带亮度明显减弱,因此选择5 s为最适变性时间(见表3)。
综合以上优化结果可以得出,木通、川木通及关木通快速PCR反应的反应参数基本相同,因此,为了能够在同一时间、同一台PCR仪中完成PCR扩增过程,达到快速检测的目的,本实验最终确定的木通、川木通及关木通快速PCR反应的反应参数均为88 ℃预变性1 min后,88 ℃ 5 s,58 ℃ 10 s,28个循环,并对该反应条件使用不同PCR仪对木通、川木通及关木通样品进行快速PCR扩增,结果表明:最终优化得到的木通、川木通及关木通快速PCR反应反应参数使用GeneAmp 9700型PCR扩增仪、VeritiTM96孔梯度PCR扩增仪、TC-512梯度PCR仪扩增、电泳检测后均可获得样品的特异性目的条带,其中木通特异性引物PCR扩增结果见图1A,川木通特异性引物PCR扩增结果见图1B,关木通特异性引物PCR扩增结果见图1C。
2.3 快速PCR反应荧光检测
分别选择优化的木通、川木通及关木通快速PCR反应参数,在确保3种药材的所有样品DNA均无降解情况下,对3种药材进行快速PCR扩增,在扩增产物中加入1 μL 100× SYBR Green I,在365 nm紫外波长下进行荧光检测。结果表明,使用木通特异鉴别引物扩增,所有木通样品显示出明亮绿色荧光,而川木通、关木通均不发出荧光;使用川木通特异鉴别引物扩增,川木通样品显示出明亮绿色荧光,而木通、关木通均不发出荧光,同样,使用关木通特异鉴别引物扩增,关木通样品显示出明亮绿色荧光,而木通、川木通均不发出荧光,见图2。

表3 PCR条件优化
注:+表示亮带,△表示暗带,-表示无带。
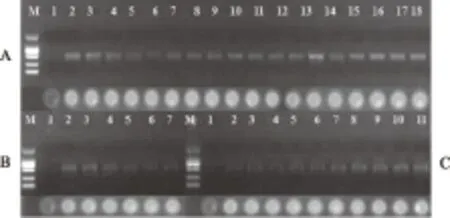
注:A.木通快速PCR产物凝胶电泳及荧光检测结果,M.DL 2000 Marker,1.阴性对照,2.三叶木通(湖南衡东),3.三叶木通(湖南临澧),4.三叶木通(重庆梁平),5.三叶木通(甘肃徽县),6.木通(重庆万州),7.木通(安徽含山),8.木通(重庆彭水),9.木通(安徽凤阳),10.木通(安徽梅山),11.白木通(重庆黔江),12~14.白木通(湖南株洲),15~18.白木通(湖南慈利);B.川木通快速PCR产物凝胶电泳及荧光检测结果,M.DL 2000 Marker,1.阴性对照,2.川木通(重庆綦江),3.川木通(重庆南川),4.川木通(重庆江津),5.川木通(重庆石柱),6.川木通(重庆浑平),7.川木通(重庆黔江区);C.关木通快速PCR产物凝胶电泳及荧光检测结果,M.DL 2000 Marker,1.阴性对照,2~6.东北马兜铃(吉林抚松),7~11.东北马兜铃(吉林靖宇)。图1 木通、川木通及关木通快速PCR产物凝胶电泳及荧光检测结果

注:1.木通,2.三叶木通,3.白木通,4.川木通,5.东北马兜铃,6.阴性对照。图2 木通、川木通及关木通快速PCR荧光检测结果
3 讨论
本实验主要针对木通、川木通及关木通3种药材,建立快速PCR鉴别方法,经DNA提取、PCR扩增、荧光检测3个步骤,在同一台PCR仪内可同一时间完成3种药材真实性快速鉴别,有利于实现中药材分子鉴别的现场运用。针对木通、川木通及关木通三者之间的快速鉴别,本文建立的位点特异性PCR方法,具有易于检测且快速的特点,相比刘美子等使用的DNA条形码鉴定方法而言[4],该方法无需测序,通过凝胶电泳胶图可直接、快速地反应出检测结果。而使用荧光染色快速检测技术,则无需凝胶电泳检测,通过加入荧光染料在紫外灯下观察是否有荧光便可快速鉴别药材真伪,因此,将传统的凝胶电泳检测结果方法改为荧光染料快速染色的方法,可最终缩短检测时间,提高检测效率[15],该鉴别方法对于木通、川木通及关木通3种药材之间的鉴别显示出较大的优势。
经典PCR鉴定技术虽然拥有准确、专属性强、重现性好等特点,但由于其自身操作相对复杂、单次反应耗时较长,难以用于中药材现场鉴别。常规PCR反应时间大约为2~3 h,而本文采用的2步法快速PCR技术,即预变性与变性同一温度,退火与延伸同一温度,因此要求特异引物的Tm值尽可能接近常规PCR延伸温度72 ℃,2步反应的温度值相差越小,则PCR反应越短,检测时间越短。同时,可在确保PCR反应灵敏度和特异性的前提下,尽可能大地缩短PCR过程中变性、退火和延伸时间,提高检测效率。目前快速PCR方法已在一些临床检验和司法检测中得到广泛应用[16-21]。因此,快速PCR技术可以通过对经典PCR反应进行条件优化,结合荧光检测技术,操作简单、检测结果准确,在中药材的鉴定中具有很强优势,也适用于中药材快速检测试剂盒的开发,有助于实现中药材现场准确、快速鉴定。
然而,传统鉴别药材真伪或质量评价的检测方法大多较为单一。近来,Wu等研究通过将DNA 条形码、实时荧光定量PCR及UHPLC-HR-MS 3种检测方法相结合,分析了来自46个物种的158份马兜铃科样品和来自33个物种的131份容易与马兜铃科物种混淆的样品,证实来自马兜铃科的大多数样本中都含有有毒的马兜铃酸[22]。此次研究者提出的整合鉴定系统可以为中草药产品提供高效可靠的检测系统,值得今后中药鉴定学者们的借鉴。同时,在此基础上,如何达到中药材的现场准确、快速鉴定,今后仍有待进一步研究。
[1] 国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2015:63-64.
[2] 任仁安.商品木通的生药鉴定[J].药学学报,1954,2(1):23.
[3] 孙萍,罗国安.LC-MS 鉴定木通、川木通与关木通[J].中药材,2004,27(12):898-901.
[4] 刘美子,李美妮,姚辉,等.川木通与其混伪品和近缘种的ITS2条形码分子鉴定[J].环球中医药杂志,2011,4(6):446-450.
[5] 谢丽莎,谈远锋.紫外光谱组法鉴别三种不同科属的木通[J].上海中医药杂志,2004,38(9):58-59.
[6] 李睿,樊夏雷,周小华,等.关木通、川木通和三叶木通的近红外漫反射光谱鉴别[J].中国医药工业杂志,2008,42(12):933-936.
[7] 袁媛,蒋超,黄璐琦.中药材分子鉴别现场运用的策略与实践[J].中国中药杂志,2013,38(16):2553-2555.
[8] MULLIS K B,FALOONA F A,SCHARF S J,et al.Specific enzymatic amplification of DNAinvitro:the polymerase chain reaction[J].Cold Spring Harb Sym,1986,51(1):263-273.
[9] YAP E P,MCGEE J O.Short PCR product yields improved by lower denaturation temperatures[J].Nucleic Acids Res,1991,19(7):1713.
[10] WITTWER C T,FILLMORE G C,GARLING D J.Minimizing the time required for DNA amplification by efficient heat transfer to small samples[J].Anal Biochem,1990,186(2):328-331.
[11] WITTWER C T,GARLING D J.Rapid cycle DNA amplification:time and temperature optimization[J].Biotechniques,1991,10(1):76-83.
[12] 陈康,蒋超,袁媛,等.快速PCR方法在蛇类药材真伪鉴别中的应用[J].中国中药杂志,2014,39(19):3673-3677.
[13] 蒋超,侯静怡,黄璐琦,等.快速PCR方法在金银花真伪鉴别中的应用[J].中国中药杂志,2014,39(19):3668-3672.
[14] NEWTON C R,GRAHAM A,HEPTINSTALL L E,et al.Analysis of any point mutation in DNA.The amplification refractory mutation system (ARMS)[J].Nucleic Acids Res,1989,17(7):2503-2516.
[15] 杨文超,张晓东.快速PCR研究进展[J].中国生物工程杂志,2007,27(4):99-103.
[16] LEE H Y,PARK M J,KIM N Y,et al.Rapid Direct PCR for ABO Blood Typing[J].J Forensic Sci,2011,56(1):179-182.
[17] WERNIKE K,BEER M,HOFFMANN B.Rapid detection of foot-and-mouth disease virus,influenza A virus and classical swine fever virus by high-speed real-time RT-PCR[J].J Virol Methods,2013,193(1):50-54.
[18] ZHANG L,DANG F,KAJI N,et al.Fast extraction,amplification and analysis of genes from human blood[J].J Chromatogr A,2006,1106(1-2):175-180.
[19] WHEELER E K,HARA C A,FRANK J,et al.Under-three minute PCR:probing the limits of fast amplification[J].Analyst,2011,136(18):3707-3712.
[20] FRENCH D J,ARCHARD C L,ANDERSEN M T,et al.Ultra-rapid DNA analysis using HyBeaconTMprobes and direct PCR amplification from saliva[J].Mole cell probes,2002,16(5):319-326.
[21] BERGAMO E,CHIAPOLONO G,LIGNITTO L,et al.Evaluation of fast PCR reagents for rapid and sensitive detection of human herpesvirus 8[J].J Virol Methods,2012,181(1):125-130.
[22] WU L,SUN W,WANG B,et al.An integrated system for identifying the hidden assassins in traditional medicines containing aristolochic acids[J].Sci Rep,2015,5:11318-11327.
AuthenticationofMutong,Chuan-MutongandGuan-MutongbyRapidPCR
CUI Zhanhu1,YUANYuan2*,HUJun2
(1.NanyangFirstPeople'sHospital,Nanyang473010,China;2.StateKeyLaboratoryofDao-diHerbsBreedingBase,NationalResourceCenterforChineseMateriaMedica,ChinaAcademyofChineseMedicalSciences,Beijing100700,China)
Objective:To establish an accurate,rapid and efficient method for authenticating Mutong,Chuan-Mutong and Guan-Mutong by using PCR amplification of specific alleles.Methods:The samples of Mutong,Chuan-Mutong and Guan-Mutong were collected.The total DNA of the samples has been extracted,andtrnL-trnFsequence from Mutong,Chuan-Mutong and Guan-Mutong was amplified by PCR and sequenced directionally.These sequences were aligned by using Clustal W.specific primers were designed and amplified by two-steps PCR amplification method.Results:The rapid PCR methods for authenticating Mutong,Chuan-Mutong and Guan-Mutong were established by optimizing the denatured and annealing temperature,cycle numbers,and etc.When 100×SYBR Green I was added in the PCR product,strong green fluorescence was visualized under 365 nm UV lamp whereas adulterants without.Conclusion:The results indicated that the rapid PCR method can identify Mutong,Chuan-Mutong and Guan-Mutong rapidly.This study provides the technical support for authentication of Chinese medicinal materials.
Rapid PCR;Akebiae Caulis;molecular authentication;fluorescence
2016-05-23)
中医药行业专项(201407003)
*
袁媛,副研究员,研究方向:中药功能基因组及中药分子鉴定;Tel:(010)64014411-2847,E-mail:y_yuan0732@163.com
10.13313/j.issn.1673-4890.2016.12.006
