生石花种子萌发及幼苗生长最优条件的筛选
2016-09-24范丽楠张宗申刘平武
范丽楠,张宗申,刘平武*
(1.广西大学农学院,亚热带农业生物资源保护与利用国家重点实验室,广西南宁 530004;2.大连工业大学生物工程学院,辽宁大连116034)
生石花种子萌发及幼苗生长最优条件的筛选
范丽楠1,张宗申2,刘平武1*
(1.广西大学农学院,亚热带农业生物资源保护与利用国家重点实验室,广西南宁 530004;2.大连工业大学生物工程学院,辽宁大连116034)
[目的]优化生石花种子萌及幼苗生长的条件,以提高其种子萌发率。[方法]采用MS、1/2MS、3/4MS等培养基为生石花生长基质,比较不同培养基中种子萌发率和幼苗生长情况,在此基础上进行光照时间、激素配比和浸泡时间的筛选。[结果]1/2MS培养基最适合生石花种子萌发及幼苗生长。16 h为最优光照时间;不同因素影响由大到小依次为浸泡时间、GA浓度、IAA浓度、NAA浓度及6-BA浓度。其中,GA浓度与浸泡时间对种子萌发有显著影响,且0.1 mg/mL的GA浓度以及4 h的浸泡时间为最优组合。[结论]该研究为生石花组织培养快繁技术研究奠定基础。
生石花;培养基;种子萌发;激素;光照时间
生石花(Lithops)是番杏科生石花属多年生小型肉质植物,未开花前的形态像石头半埋在地下,又名石头花。因其形态独特,色彩斑斓,株型小巧,高度肉质,叶形、叶色、花色都富于变化,而栽培又有一定难度,成为目前很受欢迎的观赏性植物[1]。生石花主要产于南非和纳米比亚的温暖、干旱和阳光充足的地区,生长适宜温度为20~24 ℃[2-4]。
生石花作为多肉植物的一种,其繁殖方式以种子繁殖为主,很少采用分株无性繁殖。生石花的种子细小,直径一般为0.1~0.5 mm。除种子发芽力、休眠期外,空气、水分、温度等外部环境条件是种子萌发的关键因素[5]。添加植物激素如细胞分裂素、吲哚乙酸、赤霉素等对种子萌发也有较好的促进作用,此外有些种子的萌发还受到光照的影响[6-8]。自植物组织培养技术发展以来,植物组织培养技术在作物、花卉、药用植物等脱毒、快繁方面得到了广泛应用[9-10]。笔者优化不同培养基类型、激素成分及光照等生石花种子萌发的条件,以期为后续生石花组织培养快繁技术研究奠定基础。
1 材料与方法
1.1材料生石花种子购自某市场。将种子进行分装,50颗一份装入1 mL离心管中,共39份。
1.2试验方法
1.2.1种子表面消毒。将烧杯、枪头、无菌水等灭菌后与生石花种子、培养基等一起置于超净工作台紫外杀菌30 min后,按以下步骤进行种子表面消毒:无菌水冲洗3次→70%乙醇浸泡30 s→无菌水冲洗3次→升汞消毒液浸泡10 min→无菌水冲洗4~5次备用。
1.2.2不同培养基种子的萌发差异。采用MS[11]、1/2 MS、3/4 MS和B5[12]4种培养基,以蛭石为基质作为对照组,进行种子萌发差异研究。分别配制500 mL 4种培养基,所有培养基中均添加25 g/L白砂糖和5 g/L琼脂,pH 5.8。高温高压灭菌20 min,每种培养基倒15个平板,静置1 d后备用[13]。
从分好的种子中取出10管,共500粒种子,2管一组,其中一组100粒播种至基质中。各培养基分别选10个平板,利用移液器吸头吸取消毒处理过的生石花种子,均匀接种至培养基上,每个平板接种10~20粒种子,接种后置于25 ℃培养室。
1.2.3不同光照时间种子的萌发差异。利用1/2 MS培养基进行光照试验,将光照培养室内温度设定为25 ℃,保持24 h光照。各处理用报纸遮盖以控制光照时间,光照时间分别为0、8、16、24 h。
1.2.4不同激素及浓度浸泡处理种子的萌发差异。将IAA、GA、NAA、6-BA[14-16]4种不同激素按0、0.1、0.2、0.4、0.8 mg/mL 5种不同浓度水平及浸泡1、2、4、8、10 h不同时间水平进行正交试验(表1)。每种处理浸泡1份生石花种子,以种子萌发率为指标。
1.3数据分析不同培养基因素、不同光照因素处理后1~3 d每天记录种子萌发率,其后每3 d记录一次,共记录至第30天,第30天测量根长、茎的高度以及直径作为判断生长情况的指标。生石花种子萌发率计算公式:
萌发率=( 测定时间内正常发芽的种子数/播种种子总数)× 100%
(1)
发芽势=(日发芽种子数达到最高峰时正常发芽的种子数/供试种子数)× 100%
(2)
运用WPS2016(金山)对以上数据进行整理和做图,SAS 9.1.3(SAS Institute)对数据进行方差分析并对平均数进行比较(新复极差法-Duncan’s法)。

表1 正交试验设计
2 结果与分析
2.1不同培养基对生石花种子萌发及幼苗生长的影响
2.1.1不同培养基对种子萌发率的影响。由图1和表2可知,各处理种子萌发率趋势大致相同,生石花种子在第3天左右开始陆续萌发,到第18天萌发率趋于平稳。由最终萌发率(第30天)可见,使用培养基作为基质生石花的萌发率均高于对照。各培养基萌发率以1/2 MS培养基最高,为88%,其他依次为3/4 MS(83%)、MS(80%)、B5(78%)、对照(68%)。而对于使用相同的MS培养基作为萌发基质,其
浓度越稀,萌发率越高,高浓度MS培养基相对低浓度MS培养基对生石花的萌发存在抑制作用。B5培养基在播种3 d左右萌发率高于其他培养基,但约第12天后萌发率增长减缓并趋于平稳,导致1/2 MS培养基在第5~6天超过B5培养基,3/4 MS培养基在第10~11天超过B5培养基,MS培养基在约第19天超过B5培养基。
此外,利用培养基萌发普遍比对照萌发速度快、生长整齐度较好,1/2 MS培养基的种子萌发率最优,整体高于其他培养基。各培养基在第9天萌发速率最高,以1/2 MS发芽势最高,B5和3/4 MS次之,对照最低。

图1 不同培养基对生石花种子萌发率的影响Fig.1 Effects of culture medium on the germination rate of Lithops seeds
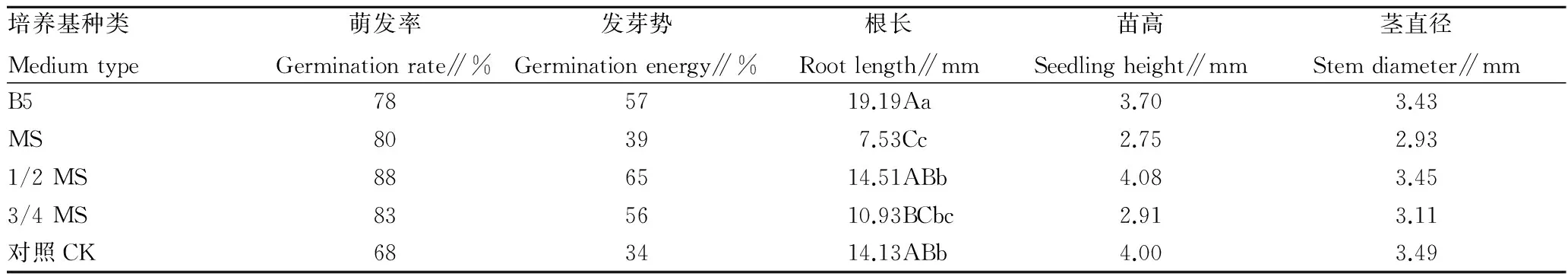
培养基种类Mediumtype萌发率Germinationrate∥%发芽势Germinationenergy∥%根长Rootlength∥mm苗高Seedlingheight∥mm茎直径Stemdiameter∥mmB5785719.19Aa3.703.43MS80397.53Cc2.752.931/2MS886514.51ABb4.083.453/4MS835610.93BCbc2.913.11对照CK683414.13ABb4.003.49
注:同列不同小写字母表示处理间差异显著(P<0.05),不同大写字母表示处理间差异极显著(P<0.01)。
Note:Different lowercases indicated significant differences(P<0.05); different capital letters indicated extremely significant differences(P<0.01).
2.1.2不同培养基对生石花幼苗生长的影响。培养基类型对生石花生长的影响主要表现为对根长的影响,对苗高及茎直径则无显著影响。方差分析结果表明,不同培养基对生石花根的生长有极显著差异,B5培养基中生石花幼苗的平均根长最长,且与1/2 MS和对照差异显著,与3/4MS和MS培养基差异极显著(表2)。观察发现,对照组、1/2 MS培养基以及B5培养基中幼苗根部的须根较多,表明1/2 MS及B5培养基较适合生石花生根并吸收营养。
综上,1/2MS培养基最利于生石花种子萌发,对其根系发育也有较好的促进作用,B5培养基则有利于生石花根系的发育。
2.2光照时间对生石花种子萌发及幼苗生长的影响
2.2.1光照时间对种子萌发的影响。由表3可知,光照时间对种子萌发的影响较小,不同光照时间的种子萌发率均在74%~80%,当光照时间增加至16 h时种子萌发率最高为80%,而24 h时萌发率最低为74%。
2.2.2光照时间对幼苗生长的影响。由表3可知,光照时间对生石花根的生长无显著影响,不同光照条件下平均根长均在14.00~15.00 mm,根系较发达,须根较多;光照时间对生石花的苗高、茎直径以及幼苗形态等有极显著影响。光照时间越长,其苗高越短,茎直径越大,整株苗的颜色越深。其中,0 h光照苗高最高,茎直径最短,植株细长,顶端叶片颜色为黄色,茎部分呈白色(图2A);8 h光照较无光照苗高矮2 mm,且差异极显著,茎直径略大但无显著差异,植株细长,顶端叶片呈黄绿色,整株苗颜色呈白绿色;16 h光照无论苗高和茎直径与0、8 h均有极显著差异,个体矮壮,长势整齐,整体呈绿色(图2B);24 h光照较16 h无论苗高和茎直径均有极显著差异,苗高最矮,茎直径最长,植株矮壮,顶端叶片呈深绿色,茎呈绿色。为了保证其正常发育,控制光照时间为16 h。
注:同列不同小写字母表示处理间差异显著(P<0.05),不同大写字母表示处理间差异极显著(P<0.01)。
Note:Different lowercases indicated significant differences(P<0.05); different capital letters indicated extremely significant differences(P<0.01).
2.3激素配比及浸泡时间对生石花种子萌发的影响由表4可知,各因素最优水平为0 mg/mL IAA+0.1 mg/mL GA+0.8 mg/mL NAA+0.1或0.2 mg/L 6-BA以及4 h的浸泡时间。方差分析结果表明,除浸泡时间和GA浓度外,其他因素对种子萌发率无显著影响。根据表4以及因素水平选取的原则即主要因素选最优水平,次要因素权衡利弊综合考虑,其最优条件为0 mg/mL IAA+0.1 mg/mL GA+0 mg/mL NAA+0 mg/mL 6-BA以及4 h的浸泡时间,即26号为最优条件,与12号相比无显著差异,均可有效提高种子萌发率至94%。
3 结论与讨论
(1)生石花种子萌发和幼苗生长培养基的选择。该研究结果表明,不同培养基的种子萌发率均优于对照,且不同培养基间种子萌发率也存在差异。通过比较培养基中种子的萌发率、幼苗的根和茎生长情况,确定1/2 MS培养基最适合生石花种子萌发与幼苗生长,这与前人通常采用1/2MS培养基作为其他植物种子萌发培养基的结果一致[17-19]。进一步比较MS、3/4MS和1/2MS培养基诱导生石花种子萌发及幼苗生长的结果发现,MS培养基稀释倍数越大越适合生石花种子萌发和幼苗生长。该试验结果表明,18 d前生石花的种子萌发率和发芽势B5培养基均大于MS培养基,其后MS培养基种子萌发率大于B5培养基,最终MS培养基萌发率高于B5培养基2%,差别较小。但B5培养基中生石花根长、苗高和苗直径均优于MS培养基,根系的发达程度极显著优于MS培养基,利用B5培养基进行生石花种子萌发和幼苗生长总体优于MS培养基。如果将B5培养基进行稀释,有可能获得1/2MS新的种子萌发和生长培养基。以上推测正在设计试验进一步验证。
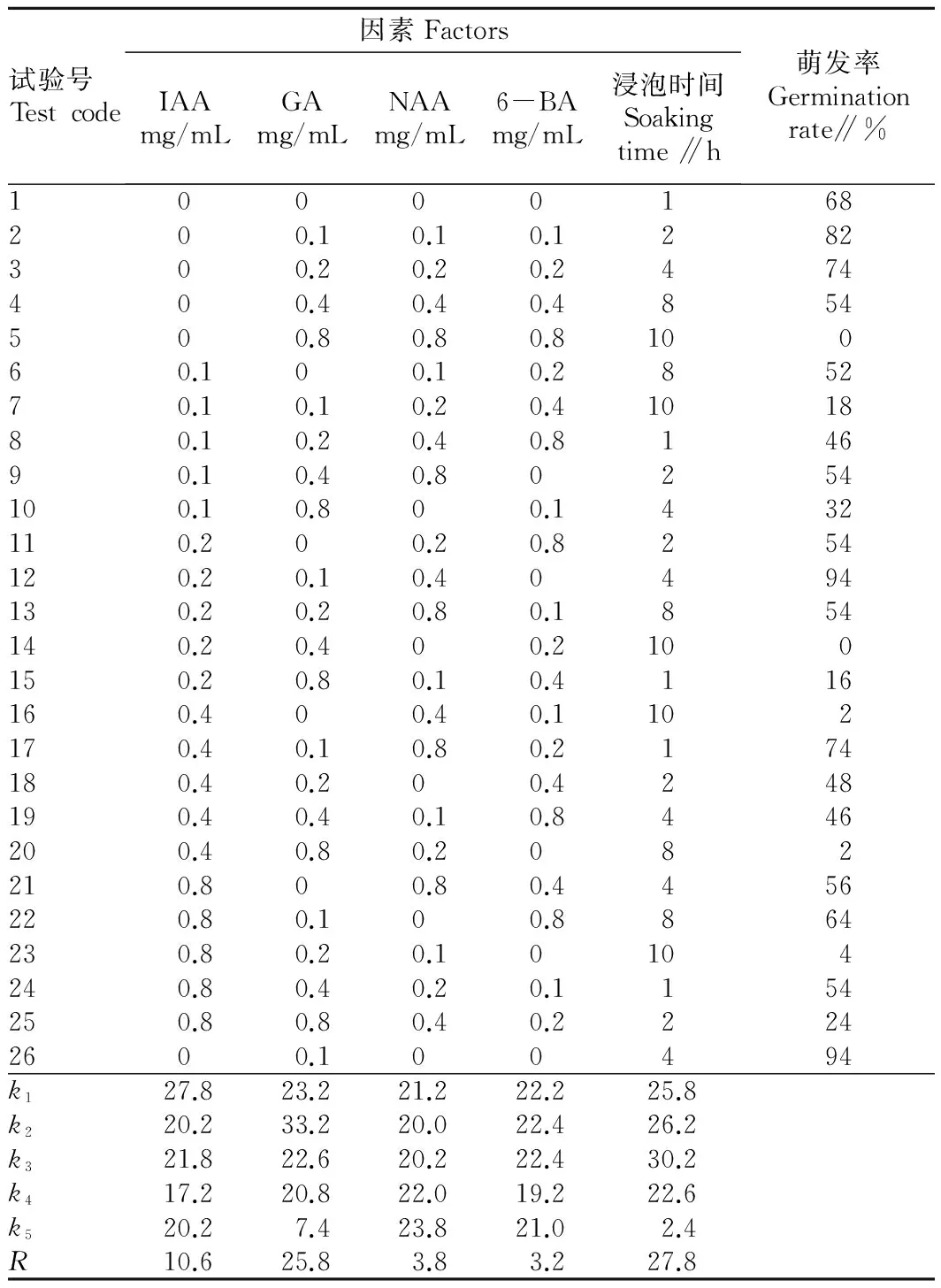
表4 正交试验结果
(2)生石花种子萌发和幼苗生长光照时间的选择。作为原产地为南非热带地区的观赏植物,生石花接受的光照时间以及强度更长更剧烈,这也造就了其植株矮小、茎部粗壮、叶片深绿等的形态特点,植株太高或茎部太细均是缺乏光照的表现。通过对比不同光照时间下的种子萌发率及幼苗生长情况,发现无光照会导致生石花幼苗生长过于细长,叶片发黄,生石花仅靠根部吸收培养基内营养物质生存,不利于其生长;24 h光照时间下,由于光合作用一直进行,使其叶片生长过快成圆盘状,茎部过短,幼苗整体太过矮小,同样不利于其生长;而16 h光照时间下,无论植株形态或根生长情况都符合正常观赏要求,且符合自然规律。最终确定16 h为最优光照时间。
(3)激素对生石花种子萌发的影响。研究发现,0.1~0.3 mg/mL GA和IAA 以及0.025 mg/mL 6 -BA对羊草种子的萌发有促进作用[20],用1.5 mg/mL的GA、0.05 mg/mL的6-BA 及0.1 mg/mL IAA 浸种可有效提高香椿种子发芽率[21],但对于药用紫苏而言,高浓度的6-BA 和NAA有明显抑制作用,GA则有促进作用[22]。该试验结果表明,浸泡时间和GA浓度是影响生石花种子萌发最大的因素(差异达显著水平),其次是IAA浓度(有差异但未达显著水平),而NAA浓度及6-BA浓度对种子萌发率的影响最小。最优组合为0 mg/mL IAA+0.1 mg/mL GA+0 mg/mL NAA+0 mg/mL 6-BA及4 h的浸泡时间。GA对种子萌发有促进作用,与前人研究结果一致[20-22]。而6-BA、IAA以及NAA对生石花种子萌发率无显著影响,与前人的研究结果不一致[20-21],可能是由于物种不同,种子萌发过程对激素的敏感程度不同。
[1] 谢维荪.多肉植物栽培原理与品种鉴赏[M].上海:上海科学技术出版社,2011:132-140.
[2] 民生,维荪.仙人掌类及多肉植物[M].北京:中国经济出版社,1991.
[3] 殷立娟,李美荣.中国C4植物的地理分布与生态学研究[J].生态学报,1997(4):27-28.
[4] 刘与明,张淑娟.珍稀多肉植物种质资源组培保存和快速繁殖技术[J].园林科技,2012,27(6):36-38.
[5] 唐安军,龙春林,刀志灵.种子休眠机理研究概述[J].云南植物研究,2004,26(3):241-251.
[6] 贾忠奎,管玄玄,郝跃,等.玉兰亚属植物种子预处理及播种技术研究进展[J].林业实用技术,2009(1):3-6.
[7] 张勇,薛林贵,高天鹏,等.荒漠植物种子萌发研究进展[J].中国沙漠,2005,78(5):87.
[8] 牛文昊,赵岩.不同激素前处理对薄荷种子萌发的影响[J].安徽农业科学,2012,40(21):10857-10858,10869.
[9] 盛玉婷.植物组织培养技术及应用进展[J].安徽农学通报,2008,9(9):52.
[10] 王泉,左志宇,宋晓涛,等.百合科多肉植物美吉寿的组织培养与快速繁殖[J].植物生理学通讯,2008,44(1):123-124.
[11] MURASHIGE T,SKOOG F.A revised medium for rapid growth and bio assays with tobacco tissue cultures[J].Physiologia plantarum,1962,15(3):473-497.
[12] GAMBORG O L,MILLER R A,OJIMA K.Nutrient requirements of suspension cultures of soybean root cells[J].Experimental cell research,1968,50(1):151-158.
[13] 刘志文,陈阳,侯英敏.不同培养基和培养条件对脱毒马铃薯快繁生长的影响[J].中国农学通报,2011,27(24):179-182.
[14] 周安佩,李连芳,刘东玉,等.发芽环境、微波辐射和激素浸泡对云南松种子发芽的影响[J].种子,2012(9):26.
[15] 王荣青.赤霉素浸种处理对茄种子萌发的影响[J].上海农业学报,2001,17(3):61-63.
[16] 熊国胜,李家洋,王永红.植物激素调控研究进展[J].科学通报,2009(18):56.
[17] 陶茸,师尚礼,李玉珠,等.种子处理对扁蓿豆种子在1/2MS培养基上发芽率的影响[J].草原与草坪,2011,31(3):69-72.
[18] 丁兰,张丽,郭柳,等.濒危植物佛手参种子的非共生萌发及种苗的快速繁殖[J].植物生理学报,2014(1):77-82.
[19] 赵玉芬,储博彦,尹新彦,等.大花萱草杂交种子试管内萌发及快繁技术研究[J].种子,2013,32(1):121-123.
[20] 马红媛,梁正伟,黄立华,等.4种外源激素处理对羊草种子萌发和幼苗生长的影响[J].干旱地区农业研究,2008,26(2):69-73.
[21] 康冰,陈彦生.GA3、6-BA及IAA对香椿种子发芽及幼苗生长的影响(简报)[J].植物生理学通讯,2001,37(5):399-400.
[22] 张春平,何平,何俊星,等.不同处理对药用紫苏种子萌发特性的影响[J].中草药,2010(8):1361-1365.
Screening of Different Mediums and Hormone Concentrations for Seed Germination and Growth Conditions ofLithops
FAN Li-nan1, ZHANG Zong-shen2, LIU Ping-wu1*
(1. School of Aonomy, Guangxi University,State Key Laboratory for Conservation and Utilization of Subtropical Agro-bioresources, Nanning, Guangxi 530004; 2. School of Biological Engineering, Dalian Polytechnic University, Dalian, Liaoning 116034)
[Objective] To optimize the seed germination condition ofLithops, and to enhance the germination rate of seeds using MS culture medium to replace soil as growth medium ofLithops. [Method] Compared with the seed germination rate, root growth and seedling growth in different culture mediums, we screened the illumination time, hormone proportion and soaking time. [Result] 1/2 MS culture medium is the most suitable culture medium for the germination and growth ofLithopsseeds. Illumination for 16 h was the optimal time. The factors influencing degree from big to small was soaking time, GA concentration, IAA concentration and 6-BA concentration. Among them, GA concentration and soaking time had significant effects on seed germination. And 0.1 mg/mL GA and 4 h soaking time were the optimal combination. [Conclusion] This research provides basis for the rapid propagation technique ofLithopstissue culture.
Lithops; Culture medium; Seed germination; Hormone; Illumination time
范丽楠(1990- ),女,山东黄县人,硕士研究生,研究方向:作物种子技术与良种繁育。*通讯作者,研究员,博士,硕士生导师,从事油菜分子生物学研究。
2016-05-18
S 603.6
A
0517-6611(2016)18-123-04
