评估HPV16/18阳性直接转诊阴道镜在宫颈癌筛查中的价值
2016-09-24赵敏伊杨筱凤
张 倩,曹 頔,魏 星,赵敏伊,王 丽,李 扬,杨筱凤
(西安交通大学第一附属医院妇产科,陕西 西安 710061)
评估HPV16/18阳性直接转诊阴道镜在宫颈癌筛查中的价值
张倩,曹頔,魏星,赵敏伊,王丽,李扬,杨筱凤
(西安交通大学第一附属医院妇产科,陕西 西安 710061)
目的评估西安地区人乳头瘤病毒HPV16/18阳性者直接转诊阴道镜在宫颈癌筛查中的价值。方法对2011年1月至2015年6月期间在西安交通大学第一附属医院妇科就诊的西安地区女性生殖道2 089例HPV-DNA分型检测结果为HPV16/18阳性者行阴道镜检测。结果2 089例HPV16/18阳性直接转诊阴道镜者中,HPV16占84.49%,HPV18占15.51%。HPV16(HPV18)在轻度上皮内瘤变(CINⅠ)、中度上皮内瘤变(CINⅡ)、重度上皮内瘤变(CINⅢ)和宫颈癌(CC)中的感染率分别为8.78%(10.19%)、9.07%(5.86%)、9.46%(2.47%)和8.50%(4.63%)。宫颈组织病变程度越重,HPV16/18感染比例越高,绝对危险度越大。HPV16感染率在不同年龄组随着宫颈病变级别的加重呈上升趋势。HPV16对CINⅡ+(CINⅢ+)灵敏度为91.91%(93.24%),特异度为17.96%(17.21%),阳性预测值为27.03%(17.96%),阴性预测值为87.04%(92.90%);HPV18对CINⅡ+(CINⅢ+)灵敏度为8.09%(6.76%),特异度为82.04%(82.79%),阳性预测值为12.96%(7.10%),阴性预测值为72.97%(82.04%)。结论HPV16/18感染与宫颈癌及癌前病变发生风险相关。在高级别宫颈病变诊断价值方面,HPV16/18具有高灵敏度和特异度。HPV16/18阳性者直接转诊阴道镜是可行和科学的。
人乳头瘤病毒;宫颈上皮内瘤变;宫颈癌;灵敏度;特异度
[Key words]human papillomavirus (HPV); cervical intraepithelial neoplasias (CIN); cervical cancer (CC); sensitivity; specificity
高危型人乳头瘤病毒(high-risk human papillomavirus, HR-HPV)持续感染是引起宫颈癌(cervical cancer,CC)及其癌前病变宫颈上皮内瘤变(cervical intraepithelial neoplasia, CIN)的必要因素,HPV16/18可引起世界范围内70%的宫颈癌[1]。因此宫颈癌的筛查模式逐渐由传统的以“细胞学检查”为主的三阶梯模式向以“HPV检测”为主的“H(HPV)-C(细胞学)-H(组织学)”策略转变。2015年1月,美国阴道镜及宫颈病理协会/美国癌症协会(American Society for Colposcopy and Cervical Pathology/The American Cancer Society, ASCCP/SGO)发布了新的宫颈癌筛查临时指南,提倡以高危HPV检测作为宫颈癌筛查的首选方案,推荐对HPV16/18阳性者直接行阴道镜检查[2]。本研究以该指南为依据,评估西安地区HPV16/18阳性者直接转诊阴道镜在宫颈癌筛查中的价值,从而为本地区女性宫颈癌筛查策略提供理论依据。
1对象和方法
1.1研究对象
2011年1月至2015年6月期间在西安交通大学第一附属医院妇科就诊的西安地区女性生殖道HPV16/18阳性直接转诊阴道镜者2 207例,失访118例,实际研究2 089例。平均年龄(39.3±10.33)岁(16~79岁)。
1.2 HPV-DNA分型检测
采用医用核酸分子快速导流杂交基因分型试剂盒(潮州凯普生物科技有限公司)对宫颈细胞样本中的HPV-DNA进行检测,可检出高危型13种(HR-HPV-16、18、31、33、35、39、45、51、52、56、58、59、68),低危型5种(LR-HPV-6、11、42、43、44)以及中国人群常见亚型(53、66、CP8304)。具体方法按说明进行。
1.3宫颈组织学检测
HPV16/18阳性者行阴道镜检查,有可疑病变时行多点活检。根据宫颈上皮内瘤变(Cervical Intraepithelial Neo ̄plasia, CIN)诊断宫颈病变级别。
1.4诊断价值指标
以病毒和病理学诊断的符合率来判定。灵敏度是指将实际有病的人正确地判定为阳性的能力,特异度是指将实际无病的人正确地判定为阴性的能力,阳性预测值是指筛检试验阳性者患目标疾病的可能性,阴性预测值是指筛检试验阴性者不患目标疾病的可能性。相应的计算公式分别为:灵敏度=真阳性/(真阳性+假阴性)×100%;特异度=真阴性/(真阴性+假阳性)× 100%;阳性预测值=真阳性/(真阳性+假阳性)×100%;阴性预测值=真阴性/(真阴性+假阴性)×100%。
1.5统计学方法
采用SPSS18.0统计软件进行分析,计数资料以例数(率)形式表示,采用卡方检验,以P<0.05为差异有统计学意义。
2结果
2.1人乳头瘤病毒16/18感染与宫颈病变的关系
对2 089例生殖道HPV16/18阳性者直接转诊阴道镜检查。阴道镜结果为炎症或正常宫颈者1 382例(66.15%),CINⅠ者188例(9.00%),CINⅡ者179例(8.57%),CINⅢ者175例(8.38%),CC者165例(7.90%)。HPV16/18在不同宫颈病变组织中感染率不同。HPV16在CINⅠ、CINⅡ、CINⅢ和CC中的感染率分别为8.78%、9.07%、9.46%和8.50%,HPV18感染率分别为10.19%、5.86%、2.47% 和4.63%,见图1。HPV16/HPV18感染率越高,宫颈组织病变程度越重,绝对危险度越大,见表1。

表1 HPV16/18感染与宫颈病变的关系[n(%)]
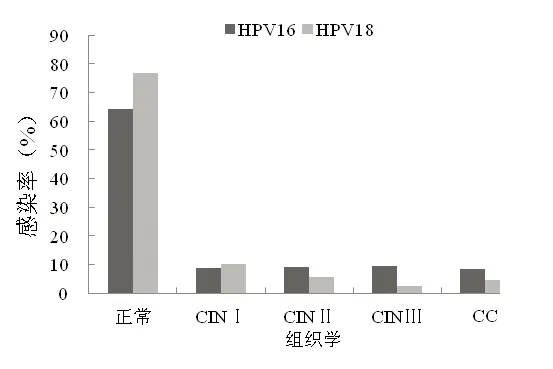
图1不同宫颈病变组织中HPV16/18感染分布
Fig.1The prevalence of HPV16/18 infection in different cervical lesion tissues
2.2人乳头瘤病毒16/18感染在不同年龄段各宫颈病变中的分布
HPV16/18感染率在不同年龄段各宫颈病变组织中分布不同。<30岁组中,HPV16感染率在CINⅠ、CINⅡ、CINⅢ、CC中分别为80.49%、84.00%、93.33%、100.00%,HPV18感染率分别为19.51%、16.00%、6.67%、0.00%。30~39岁组中,HPV16感染率分别为89.66%、91.38%、97.06%、82.35%,HPV18感染率分别为10.34%、8.62%、2.94%、17.65%。40~49岁组中,HPV16感染率分别为81.67%、90.00%、95.52%、90.54% ,HPV18感染率分别为18.33%、10.00%、4.48%、9.46%。≥50岁组中,HPV16感染率分别为72.41%、88.46%、92.00%、92.54%,HPV18感染率分别为27.59%、11.54%、8.00%、7.46%,见表2。

表2 HPV16/18感染在不同年龄段各宫颈病变组织中的分布[%(n/N)]
2.3人乳头瘤病毒16/18感染对高级别宫颈病变组织的诊断价值
在2 089例阴道镜检查结果中,CINⅡ及以上病变者共519例。HPV16/18感染在高级别宫颈病变中的诊断价值指标有差异。其中HPV16对CINⅡ+(CINⅢ+)灵敏度为91.91%(93.24%),特异度为17.96%(17.21%),阳性预测值为27.03%(17.96%),阴性预测值为87.04%(92.90%);HPV18对CINⅡ+(CINⅢ+)灵敏度为8.09%(6.76%),特异度为82.04%(82.79%),阳性预测值为12.96%(7.10%),阴性预测值为72.97%(82.04%)。提示在诊断高级别宫颈病变方面,HPV16具有高灵敏度,HPV18具有高特异度(表3)。

表3 HPV16/18感染对高级别宫颈病变组织的诊断价值[%(n/N)]
注:阳性预测值(positive predictive value,PPV);阴性预测值(negative predictive value,NPV)。
3 讨论
3.1宫颈癌筛查现状
2012年,美国癌症协会/美国阴道镜及宫颈病理学会/美国临床病理学(American Cancer Society /The American Society For Colposcopy And Cervical Pathology /American Society of Clinical Pathologists , ACS/ASCCP/ASCP) 更新的宫颈癌前病变和宫颈癌筛查指南对适龄女性提倡使用细胞学和HPV的筛选策略,首次提出HPV16/18阳性者直接转诊阴道镜,并考虑将HPV检测作为未来主要筛查方法[3]。随后,数项关于不同宫颈癌筛查方案的大型研究结果陆续发布,这些研究均显示,相较于细胞学检测,HR-HPV检测作为宫颈癌首选方案具有同等或更高的效力[4-6]。2015年ASCCP最新制定的临时指南也倡导以高危HPV检测作为宫颈癌筛查的首选方案[2]。今年CSCCP成立后国内也提出符合目前国情的宫颈癌筛查策略:先行高危型HPV检测,再行细胞学分流。即在HPV阳性的人群中,根据型别不同分为两种策略:HPV16/18 阳性者可不做细胞学,直接转诊阴道镜;其他非HPV16/18的阳性者,通过细胞学检查分流[2]。本研究基于该筛查策略首次针对HPV16/18阳性者直接转诊阴道镜,评价这一策略在本地区人群宫颈癌筛查中的价值。
3.2人乳头瘤病毒16/18感染情况
HPV16是最常见的HPV感染型别。Wang等[7]研究通过评估1 336例浸润性宫颈癌患者HPV感染情况,发现HPV16感染率为50.6%,HPV18为7.3%,即HPV16感染率约是7倍。之前的研究结果也发现HPV16为最常见的感染型别,其感染率为11.67%,约为HPV18感染率的5倍[8]。本研究发现在2 089例HPV16/18感染者中HPV16占84.49%,HPV18占15.51%,HPV16感染率几乎为HPV18的5.4倍。
Wright等[9]等通过分析HR-HPV感染率在不同宫颈病变级别中的分布情况,发现 HPV16在CINⅠ、CINⅡ、CINⅢ和CC中的感染率分别为12.8%、29.7%、51.2%和35.0%,HPV18感染率分别为5.8%、 3.1%、 5.3%和50.0%。Monsonego 等[10]研究发现HPV16在CINⅠ、CINⅡ、CINⅢ和CC中的感染率分别为9.8%、18.7%、42.6%和16.7%,HPV18感染率分别为4.5%、2.2%、9.3% 和50.0%。本研究发现HPV16在CINⅠ、CINⅡ、CINⅢ和CC中的感染率分别为8.78%、9.07%、9.46%和8.50%,HPV18感染率分别为10.19%、5.86%、2.47%和5.63%,提示HPV16/18感染与宫颈癌及癌前病变发生风险相关,该结果与其他研究结果一致[11-12]。需要强调的是,本研究中66.16%的HPV16/18阳性者宫颈活检组织学正常,提示进行HR-HPV检测的目的在于防癌而非防毒,前期的研究也证实在陕西地区妇女中大部分HR-HPV会在初次感染后8.10个月自然清除[13]。
3.3人乳头瘤病毒16/18在不同年龄段各宫颈病变中的分布情况
HPV16/18感染率在不同年龄段各级别宫颈病变组织中分布亦有差异。本研究中30岁以上女性,HPV16感染率在CIN病例中随着年龄的增长而降低,HPV18感染率则随着年龄的增长而增高。如CINⅠ中,HPV16感染率在30~39岁、40~49岁、≥50岁这几个年龄组中分别为89.66%、81.67%、72.41%,HPV18相应组别感染率分别为10.34%、18.33%、27.59%,与Wright 等[9]结果一致。本研究还发现HPV16感染率在各年龄组随着宫颈病变程度的加重而呈上升趋势。如30岁以下女性中,HPV16 感染率在CINⅠ、CINⅡ、CINⅢ和CC中分别为80.49%、84.00%、93.33%和100.00%,50岁以上女性中HPV16感染率分别为72.41%、88.46%、92.00%和92.54%。所有年龄段不同宫颈病变组织中,HPV18感染率均不如HPV16感染率高,但在CC病例中,HPV18感染仍具有举足轻重的作用。如在30~39岁组中,HPV18感染率在CC中为17.65%,提示HPV18感染筛查的重要性。值得注意的是,7位年龄小于30岁的宫颈癌女性,均为HPV16阳性,提示本地区有必要对年龄小于30岁女性进行HR-HPV筛查。
3.4 人乳头瘤病毒16/18阳性在高级别宫颈病变中的诊断价值
Castle 等[5]研究发现HPV16/18分型检测对CINⅡ+(CINⅢ+)的灵敏度为51.8%(59.5%)。Wright 等[6]研究发现HPV16/18主要筛查策略对CINⅡ+(CINⅢ+)灵敏度为69.1%(76.1%),特异度为94.0%(93.5%)。本研究发现HPV16对CINⅡ+(CINⅢ+)灵敏度为91.91%(93.24%),特异度为17.96%(17.21%),阳性预测值为27.03%(17.96%),阴性预测值为87.04%(92.90%);HPV18对CINⅡ+(CINⅢ+)灵敏度为8.09%(6.76%),特异度为82.04%(82.79%),阳性预测值为12.96%(7.10%),阴性预测值为72.97%(82.04%)。提示在诊断高级别宫颈病变方面,HPV16具有高灵敏度,HPV18具有高特异度,说明对HPV16/18阳性者直接转诊阴道镜是科学的。
综上所述,在2 089例HPV16/18阳性直接转诊阴道镜者中,HPV16占84.49%,HPV18占15.51%,HPV16感染率是HPV18的5.4倍。HPV16/18感染与宫颈癌及癌前病变发生风险相关。在年龄小于30岁的7例宫颈癌患者中,HPV16感染率为100%。在高级别宫颈病变诊断价值方面,HPV16/18具有高灵敏度和特异度。
[1]Castle P E, Maza M.Prophylactic HPV vaccination: past, present, and future[J].Epidemiol Infect,2016, 144(3):449-468.
[2]Huh W K, Ault K A, Chelmow D,etal. Use of primary high-risk human papillomavirus testing for cervical cancer screeing: interim clinical guidance[J].Gynecol Oncol, 2015,136(2): 178-182.
[3]Saslow D, Solomon D, Lawson H W,etal. American Cancer Society, American Society for Colposcopy and Cervical Pathology, and American Society for Clinical Pathology screening guidelines for the prevention and early detection of cervical cancer[J].Am J Clin Pathol,2012,137(4):516-542.
[4]Cox J T, Castle P E, Behrens C M,etal. Comparison of cervical cancer screening strategies incorporating different combinations of cytology, HPV testing, and genotyping for HPV 16/18: results from the ATHENA HPV study[J]. Am J Obstet Gynecol,2013,208(3):184.e1-184.e11.
[5]Castle P E, Stoler M H, Wright T C Jr,etal. Performance of carcinogenic human papillomavirus (HPV) testing and HPV16 or HPV18 genotyping for cervical cancer screeing of women aged 25 years and older. A subanalysis of the ATHENA study[J]. Lancet Oncol, 2011, 12(9): 880-890.
[6]Wright T C, Stoler M H, Behrens C M.etal. Primary cervical cancer screening with human papillomavirus: End of study results from the ATHENA study using HPV as the first-line screening test[J].Gynecol Oncol,2015,136(2):189-197.
[7]Wang L, Wu B, Li J.etal. Prevalence of human papillomavirus and its genotype among 1 336 invasive cervical cancer patients in Hunan province,central south China[J]. J Med Virol, 2015,87(3): 516-521.
[8]马茜,侯萌,杨筱凤.西安交通大学第一附属医院8 581名妇女生殖道人乳头瘤病毒感染筛查[J].中国医学科学院学报,2014,36(3):277-282.
[9]Wright T C Jr, Stoler M H, Behrens C M,etal. The ATHENA human papillomavirus study: design, methods, and baseline results[J].Am J Obstet Gynecol, 2012, 206(1): 46.e1-46.e11.
[10]Monsonego J, Cox J T, Behrens C,etal. Prevalence of high-risk human papilloma virus genotypes and associated risk of cervical precancerous lesions in a large U.S. screening population:Data from the ATHENA trial[J]. Gynecol Oncol, 2015,137(1): 47-54.
[11] Khanna A, Patel S, Gong Y,etal. The efficacy of HPV 16/18 genotyping in predicting CIN2+ in women with HPV+/Pap- results[J]. J Am Soc Cytopathol, 2014, 3(5):S1-S2.
[12]Schiffman M, Burk R D, Boyle S,etal. A study of genotyping for management of human papillomavirus positive, cytology negative cervical screening results[J]. J Clin Microbiol, 2015, 53(1): 52-59.
[13]张倩,曹頔,马茜,等.760名女性生殖道高危型人乳头瘤病毒感染自然转归规律及影响因素[J].中国医学科学院学报,2015,37(5): 534-540.
[专业责任编辑:安瑞芳]
Value of HPV16/18 positive transfer directly to colposcopy in cervical cancer screening
ZHANG Qian, CAO Di, WEI Xing, ZHAO Min-yi, WANG Li, LI Yang, YANG Xiao-feng
(Department of Obstetrics and Gynecology, First Affiliated Hospital of Xi’an Jiaotong University, Shaanxi Xi’an 710061, China)
Objective To evaluate the value of HPV16/18 infection transfer directly to colposcopy in cervical cancer screening in Xi’an region. MethodsDuring the period of January 2011 to June 2015, totally 2 089 women in Xi’an area who visiting the gynecology department in the First Affiliated Hospital of Xi’an Jiaotong University and diagnosed with HPV16/18 positive tested by HPV-DNA genotyping technology were transferred to colposcope detection. Results Among these patients, the prevalence of HPV16 and HPV18 infection was 84.49% and 15.51%, respectively. The rate of HPV16 infection in cervical intraepithelial neoplasiasⅠ (CIN Ⅰ), CINⅡ, CIN Ⅲ and cervical cancer (CC) was 8.78%, 9.07%, 9.46% and 8.50%, respectively, and that of HPV18 was 10.19%, 5.86%, 2.47% and 4.63%, respectively. The higher level of cervical lesions, the higher infection rate of HPV16/HPV18, and the higher absolute risk. The rate of HPV16 infection increased with the severity of cervical lesion among different age groups. The sensitivity of HPV16 infection for detecting CINⅡ+ and CIN Ⅲ+ was 91.91% and 93.24%, respectively, the specificity was 17.96% and 17.21%, respectively, the positive predictive value was 27.03% and 17.96%, respectively, and the negative predictive value was 87.04% and 92.90%, respectively. Accordingly, the sensitivity, specificity, positive predictive value and negative predictive value of HPV18 infection for detecting CINⅡ+ and CIN Ⅲ+ was 8.09% and 6.76%, 82.04% and 82.79%, 12.96% and 7.10%, and 72.97% and 82.04%, respectively. Conclusion HPV 16/18 infection is associated with the risk of cervical cancer and precancerous lesions. The HPV16/18 test has good sensitivity and specificity for the detection of high grade cervical lesions. It’s feasible and scientific for women who are infected with HPV16/18 turned to colposcopy.
2015-09-03
张倩(1988-),女,在读硕士研究生,主要从事妇科肿瘤与免疫的研究。
杨筱凤,教授。
10.3969/j.issn.1673-5293.02.031
R711.7
A
1673-5293(2016)02-0237-04
