黑龙江省稻瘟病生理小种及品种资源抗性鉴定
2016-09-23王敬国刘化龙郭丽颖姜思达许天宇赵宏伟邹德堂
辛 威,王敬国,孙 健,刘化龙,郭丽颖,姜思达,许天宇,赵宏伟,邹德堂
(东北农业大学 农学院,黑龙江 哈尔滨 150030)
黑龙江省稻瘟病生理小种及品种资源抗性鉴定
辛威,王敬国,孙健,刘化龙,郭丽颖,姜思达,许天宇,赵宏伟,邹德堂
(东北农业大学 农学院,黑龙江 哈尔滨150030)
为了明确黑龙江省水稻品种资源稻瘟病抗性,挖掘优异种质资源,适时了解黑龙江省生理小种群体变化特征。采用中国生理小种命名方法,通过苗期喷雾接菌鉴定,将2013-2014年黑龙江省的稻瘟病菌株划分为7个群42个生理小种,优势小种为ZD5和ZD7,出现频率分别为19.77%和12.21%,总频率为31.98%;通过苗期抗病性表现,筛选出宽抗谱品种14份,这些品种携带2~7个抗稻瘟病基因,绥粳12+合江23(Pi9、Pi20、Pi33、Pi54、Pik)、牡丹江26+龙粳31(Pi9、Pi20、Pi33、Pi54、Pita、Pik)、牡丹江26+合江23(Pi9、Pi20、Pi33、Pi54、Pik)等29个在抗稻瘟病育种生产上将具有较好防病效果的组合,并且能够聚合多个抗性基因,提高抗性水平、拓宽抗谱;其中龙粳31与其他9个品种的配对组合均为最优组合,对稻瘟病具有较高抗性;这14份宽抗谱品种是抗稻瘟病育种较好的抗源材料;部分品种如垦稻15、龙粳23和牡丹江25,仅携带2个本研究鉴定的基因,这些品种可能是携带未知抗性基因的新抗源,可作为进一步鉴定和寻找抗性基因的试验材料。
稻瘟病;生理小种;种质资源;稻瘟病抗性;抗性基因
稻瘟病是由子囊菌(Magnaporthegrisea(Hebert)Barr)引发的水稻真菌性病害[1]。据报道,至今为止稻瘟病遍及世界各大水稻主产区,其中以亚洲和非洲病情较为严重。在稻瘟病流行年份,重病地区一般会造成水稻减产10%~20%,部分地区甚至颗粒无收[2],我国年发病面积在380万hm2以上,每年因此损失的水稻产量也达10亿kg[3]。黑龙江省水稻种植面积约占东三省总种植面积的60%,为我国重要的粳稻主产地[4]。近年来,由于黑龙江省水稻种植面积的扩大,种植品种结构简单,导致水稻稻瘟病大面积爆发,尤其是在2005,2006年为近10年病害最严重的2年,平均年发病面积在66.7万hm2以上,给黑龙江省稻米生产造成巨大经济损失[5-6]。目前防治稻瘟病的有效措施是合理的选育和利用抗病品种,但是由于稻瘟病菌具有遗传多样性和复杂的田间种群结构,易产生致病性分化,从而导致一些抗病水稻品种难以具有持久抗病性[7]。因此,对稻瘟病生理小种群体变化特征及其致病力状况的实时监控,明确已知水稻品种资源稻瘟病抗性基因分布情况,对于培育广谱持久抗稻瘟病品种至关重要。
挖掘抗稻瘟病水稻品种资源,并通过分子标记辅助育种方法聚合稻瘟病抗性基因培育抗病品种,是稻瘟病抗性育种的重要途径。目前,已至少报道了100多个稻瘟病抗病基因;已经成功克隆了22个稻瘟病抗病基因[8],如Pi5[9]、Pi9[10]、Pi20[11]、Pi33[12]、Pi54[13]、Pib[14]、Pita[15]、Pik[14]等稻瘟病抗性基因的特异性分子标记已被开发出来,为水稻品种资源抗病性的筛选、鉴定和分子标记辅助抗病育种打下了坚实基础。已经有一批含Pita、Pib、Pik、Pi9、Piz、Pi1、Pi2和Pi5等抗性基因的种质相继从稻种资源中鉴定出[16-21];通过分子标记辅助的方法,也育成了多个聚合抗性基因的抗稻瘟病材料[22-25]。黑龙江省水稻种质资源非常丰富,在稻瘟病抗性品种资源鉴定方面的有关报道相对较少。本试验通过稻瘟病菌株温室接种,研究黑龙江省稻瘟病生理小种组成、分布及225份水稻品种资源的稻瘟病抗性和抗病基因分布,旨在全面、准确地掌握黑龙江省稻瘟病菌生理小种的基本特征,明确黑龙江省水稻品种资源的稻瘟病抗性及抗性基因分布情况,为品种的改良和合理布局以及育种工作者选配亲本提供理论依据。
1 材料和方法
1.1试验材料
中国统一的生理小种鉴别品种,特特普、珍龙13、四丰43、东农363、关东51、合江18、丽江新团黑谷;供试的225份水稻品种均来自黑龙江省,以上品种由东北农业大学水稻研究中心保存。
1.2供试菌株及孢子悬浮液的制备
2013-2014年秋在黑龙江省哈尔滨、牡丹江、佳木斯、绥化、齐齐哈尔、鸡西等地区采集的稻瘟病菌标样在湿润的滤纸片上培养,利用震落法[26]分离纯化得到单孢菌株,在PDA培养基上培养。培养7 d后转入装有高粱粒的锥形瓶中进行产孢,待菌丝密布高粱粒表面,用无菌水冲洗去除高粱粒表面菌丝,并用纱布包裹没有菌丝的高粱粒在恒温培养箱中保湿培养2 d,用无菌水洗下孢子,制成孢子悬浮液,镜检孢子浓度,100倍显微镜下孢子含量每个视野为20~30个。
1.3接菌鉴定
稻瘟病菌接菌鉴定于2015年4月10日在东北农业大学温室内进行。将生理小种鉴别材料和黑龙江省水稻品种浸种、催芽,3~4 d后播种在水稻育苗盘中,每个品种每穴播15粒,3次重复。旱育秧苗,待秧苗长至3叶1心时,按每100株30 mL均匀喷雾孢子悬浮液,接种后置于28 ℃恒温、相对湿度95%的条件下黑暗保湿处理24 h,使稻瘟病生理小种充分侵染供试品种以利于发病。
1.4生理小种鉴定与发病级别
接种后7 d,待其充分发病后依照国际水稻研究所9级制标准调查发病状况(表1);并根据稻瘟病生理小种命名标准[27],对生理小种分类命名。
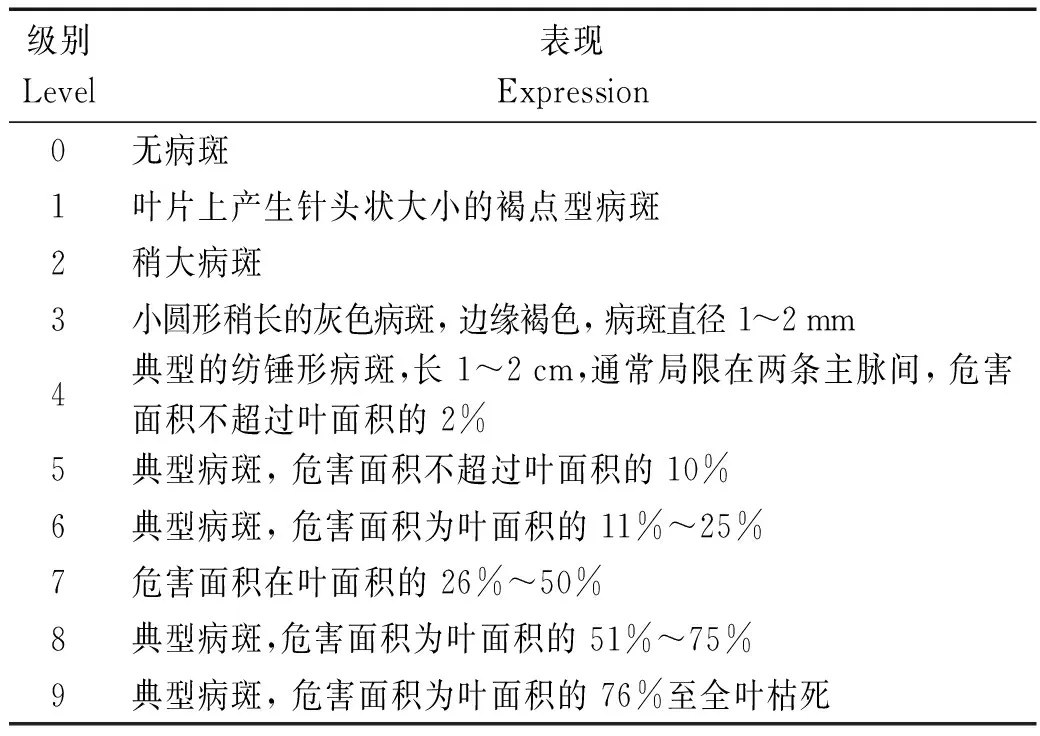
表1 国际水稻研究所9级制标准
1.5抗稻瘟病基因检测
采用CTAB法[28]提取225份水稻品种DNA。所用稻瘟病抗性基因的引物序列等相关信息见表2,引物序列由华大基因有限公司合成。PCR体系:DNA模板1.5 μL+10×PCR缓冲液1 μL+Mg2+0.75 μL+SSR引物1.5 μL+dNTP 0.15 μL+Taq酶0.1 μL+ddH2O 5 μL。反应条件为:94 ℃预变性,5 min;94 ℃变性,30 s,55 ℃退火,30 s,72 ℃延伸,30 s,35个循环;72 ℃延伸5 min,4 ℃保存。PCR产物用1%琼脂糖凝胶电泳检测,电压120 V,电泳20 min。运用紫外凝胶成像仪拍照、观察和记录试验结果。

表2 用于扩增抗性基因的PCR引物
1.6统计分析
其中,Xi为在相应群体内生理小种的频率,n为该群体的菌株数目。
稻瘟病生理小种致病率计算(PF):PF=(感病水稻品种数/供试水稻品种数)×100%。
致病力类型包括:强致病力(PF≥70%)、较强致病力(50%≤PF<70%)、中等致病力(20%≤PF<50%)和弱致病力(PF<20%)[30]。
联合毒性系数(VAC)和联合抗病性系数(RAC)计算[31]:VAC=对供试品种均有毒力的生理小种数/供试生理小种总数;RAC=对供试品种均无毒力的生理小种数/供试生理小种总数。
2 结果与分析
2.12013-2014年黑龙江省稻瘟病生理小种的组成与优势小种的分布
根据稻瘟病生理小种命名标准,将2013-2014年在黑龙江省各大稻区收集的172个稻瘟病菌株,划分为7个群共42个生理小种,分别为ZA群18个生理小种,ZB群10个生理小种,ZC群6个生理小种,ZD群4个生理小种,ZE群2个生理小种,ZF群1个生理小种和ZG群1个生理小种等。鉴出率达32.31%,由此可知,在2013-2014年黑龙江省的稻瘟病生理小种多样性组成极为复杂。其中ZD群和ZA群所占的比例分别为36.05%和35.47%,为优势种群;优势小种为ZD5和ZD7,出现频率分别为19.77%和12.21%,总频率为31.98%。
哈尔滨地区的38个菌株被划分为20个小种,优势小种为ZD5和ZD7,出现频率分别为21.05%和13.16%;牡丹江地区的32个菌株被划分为20个小种,优势小种为ZD5和ZB21、出现频率分别为21.88%和12.50%;佳木斯地区的27个菌株被划分为12个小种,优势小种为ZD5出现频率分别为33.33%;绥化地区的30个菌株被划分为18个小种,优势小种为ZD5、 ZD7和ZA53,出现频率分别为13.33%,13.33%,10.00%;齐齐哈尔地区的27个菌株被划分为17个小种,优势小种为ZD7、ZD5和ZA61,出现频率分别为18.52%,11.11%,11.11%;鸡西地区的18个菌株被划分为12个小种,优势小种为ZD7、ZD5和ZA29,出现频率分别为22.22%,16.67%,11.11%(表3)。从表3中可以得出,各个地区间稻瘟病生理小种的群体结构略有差异,其中优势小种ZD5在6个地区均有分布。
2.2黑龙江省稻瘟病生理小种的多样性分析
黑龙江省稻瘟病生理小种多样性分析结果见表3。黑龙江省稻瘟病菌株被划分为42个生理小种,其多样性指数(H)为0.92,结果表明在2013-2014年黑龙江省稻瘟病生理小种群体结构非常复杂。6个地区稻瘟病生理小种多样性指数(H)分别为0.91,0.91,0.83,0.96,0.91,0.88。在不同地区的生理小种多样性水平有所差异,其中绥化地区稻瘟病生理小种群体结构最为复杂,多样性指数(H)高达0.96;相对而言,佳木斯地区稻瘟病生理小种多样性指数(H)仅为0.83。说明其群体结构相对较为简单。
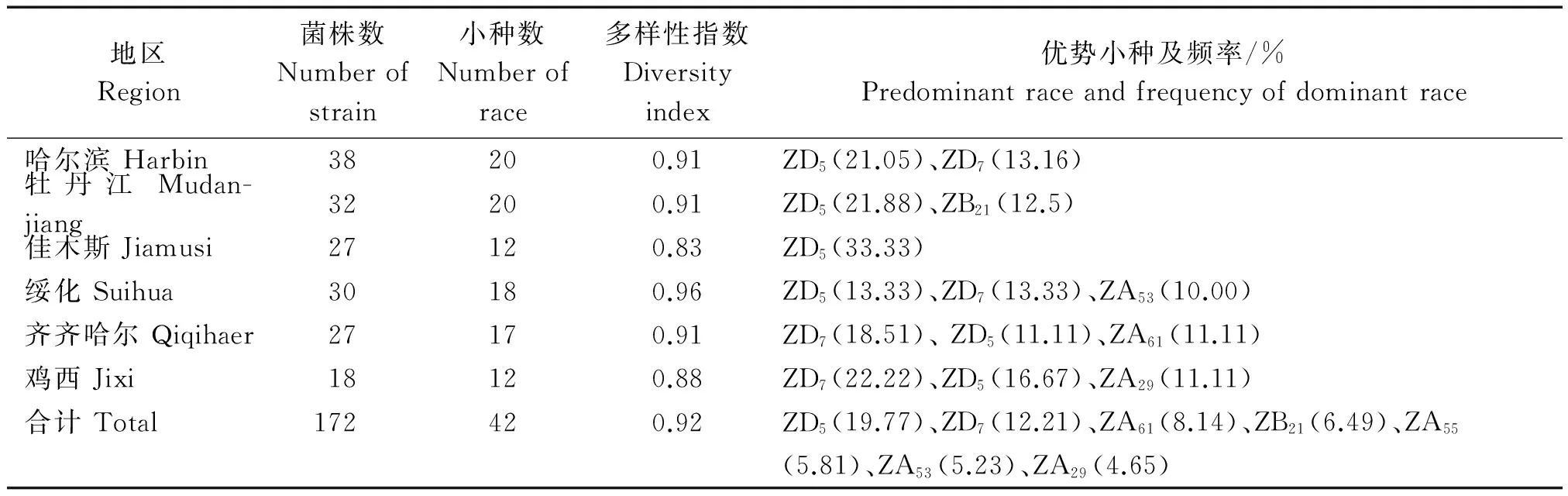
表3 2013-2014年黑龙江省不同地区稻瘟病生理小种分布
2.3稻瘟病菌生理小种致病力分析
42个生理小种对黑龙江省225份品种的致病力分析(表4)。研究结果表明,42个生理小种的致病率为12.95%~73.23%,其中,强致病力生理小种有3个(ZD5、ZB21、ZB25);较强致病力生理小种有13个(ZA9、ZA29、ZA37、ZA49、ZA55、ZA61、ZB5、ZB19、ZC9、ZC13、ZC15、ZD7、ZG1);中等致病力生理小种有24个(ZA1、ZA7、ZA11、ZA13、ZA17、ZA25、ZA41、ZA45、ZA53、ZA57、ZA63、ZB1、ZB9、ZB13、ZB17、ZB29、ZB31、ZC3、ZC5、ZD1、ZD3、ZE1、ZE3、ZF1);弱致病力生理小种有2个(ZA33、ZC1)。结果表明,黑龙江省水稻品种对大部分生理小种的抵抗能力较弱,说明这些生理小种具有较强致病力,并且优势小种也具有较强的致病力。
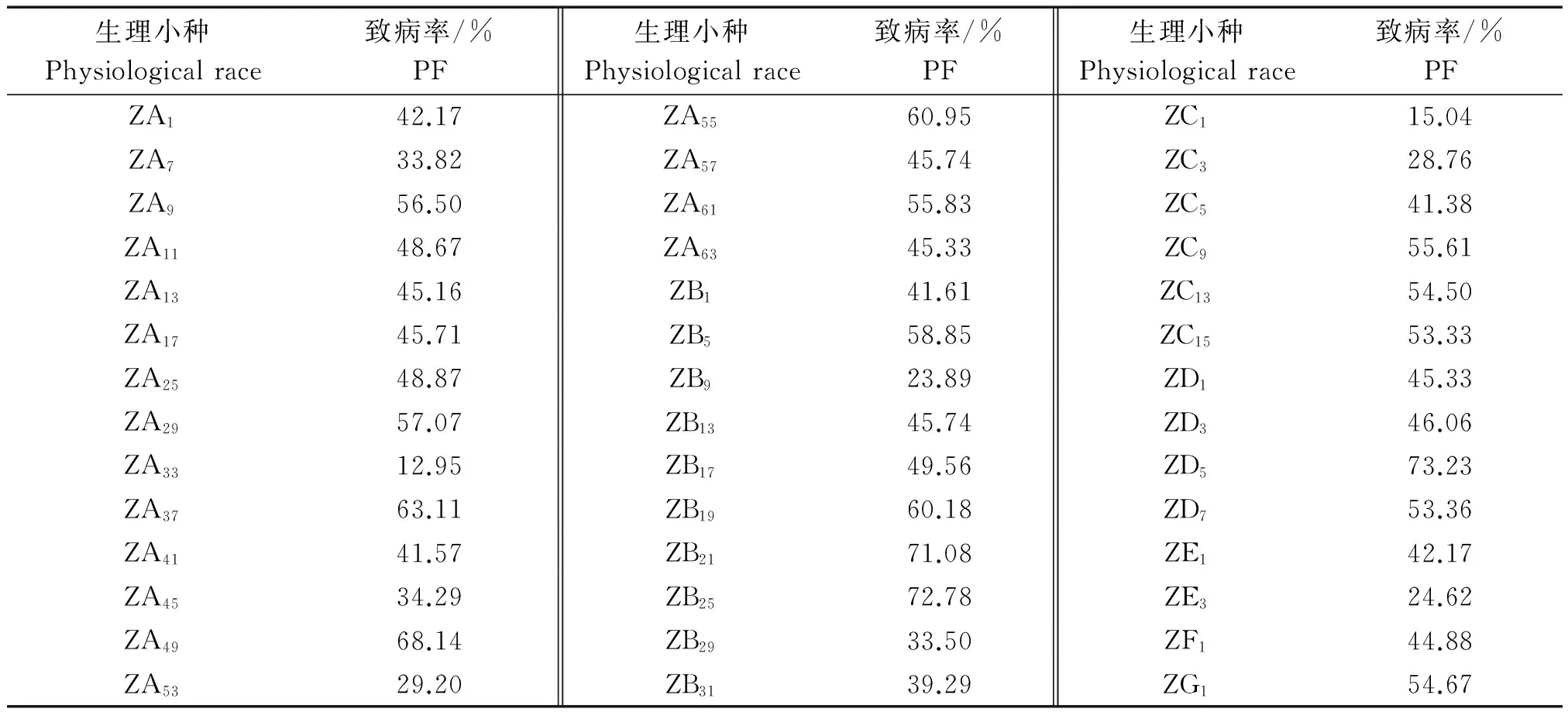
表4 2013-2014年黑龙江省42个生理小种的致病率
注:强致病力(PF≥70%)、较强致病力(50%≤PF<70%)、中等致病力(20%≤PF<50%)和弱致病力(PF<20%)。
Note:Forte pathogenicity (PF≥70%),Piu forte pathogenicity(50%≤PF<70%),Medium pathogenicity (20%≤PF<50%)and feeble pathogenicity (PF<20%).
2.4黑龙江省水稻品种资源苗期的稻瘟病抗性
42个稻瘟病生理小种对225份水稻品种资源苗期的抗病性表现(表5),255份水稻品种资源的抗谱为10.53%~95.00%,当抗谱值高时,生理小种对受体品种的致病几率小,即品种的抗谱宽,抗病性较好。其中窄抗谱品种有41份,占供试品种的18.22%。这些品种的抗谱为10.53%~47.37%,应当提高其抗病能力,延长利用年限;中等抗谱品种有170份,占供试品种的75.56%,其抗谱为50.00%~89.47%,这些品种在生产上应该慎重推广。宽抗谱品种有14份,抗谱为90.00%~95.00%,这14份黑龙江省水稻品种含有2~7个稻瘟病抗性基因,是稻瘟病抗性育种较好的抗源材料。部分宽抗谱品种如垦稻15、龙粳23和牡丹江25,仅携带2个本试验鉴定的基因,这些品种可能是携带未知抗性基因的新抗源,可作为进一步挖掘广谱持久抗稻瘟病基因的试验材料。
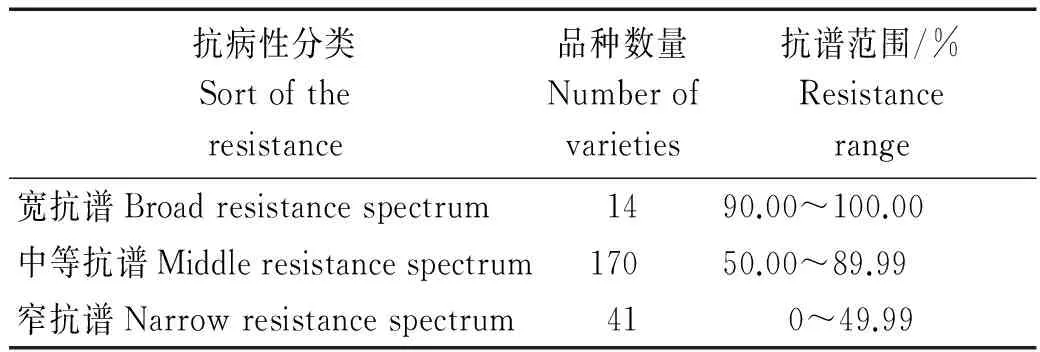
表5 225份黑龙江省水稻品种资源抗病性
2.5黑龙江省水稻品种资源的稻瘟病抗病基因分布
对225份黑龙江省水稻品种资源进行分子标记检测。携带Pi5、Pi9、Pi20、Pi33、Pi54、Pib、Pita、Pik抗性基因的供试材料依次为33份(14.67%)、154份(68.44%)、196份(87.11%)、174份(77.33%)、142份(63.11%)、21份(9.33%)、47份(20.89%)和129份(57.33%)。在225份供试材料中,8个抗性基因的分布以Pi20和Pit33居多,而Pib和Pi5较少。
2.6抗病基因数量与黑龙江省水稻品种苗期抗病性
在检测的8个抗性基因中,225份黑龙江省水稻品种含有的抗性基因数量为0~7个。表6显示,含有7个抗病基因的品种有1份(垦稻14),没有检测到抗病基因的品种有1份(丽江新团黑谷),其余品种含2~6个抗病基因,其抗病性表现以中等抗谱居多。另外,试验注意到含有5个抗病基因的品种也有10份抗病性表现差,可能是抗病基因的表达受遗传背景的影响。含有2个抗性基因的品种中也有3份抗病性表现良好。但是,总体上,供试材料的抗病性随着其抗病基因数目的增多呈上升趋势;如表7所示,这14份苗期稻瘟病抗病性表现突出的品种大部分都含有4~7个抗病基因,只有3个品种含有2个抗病基因。
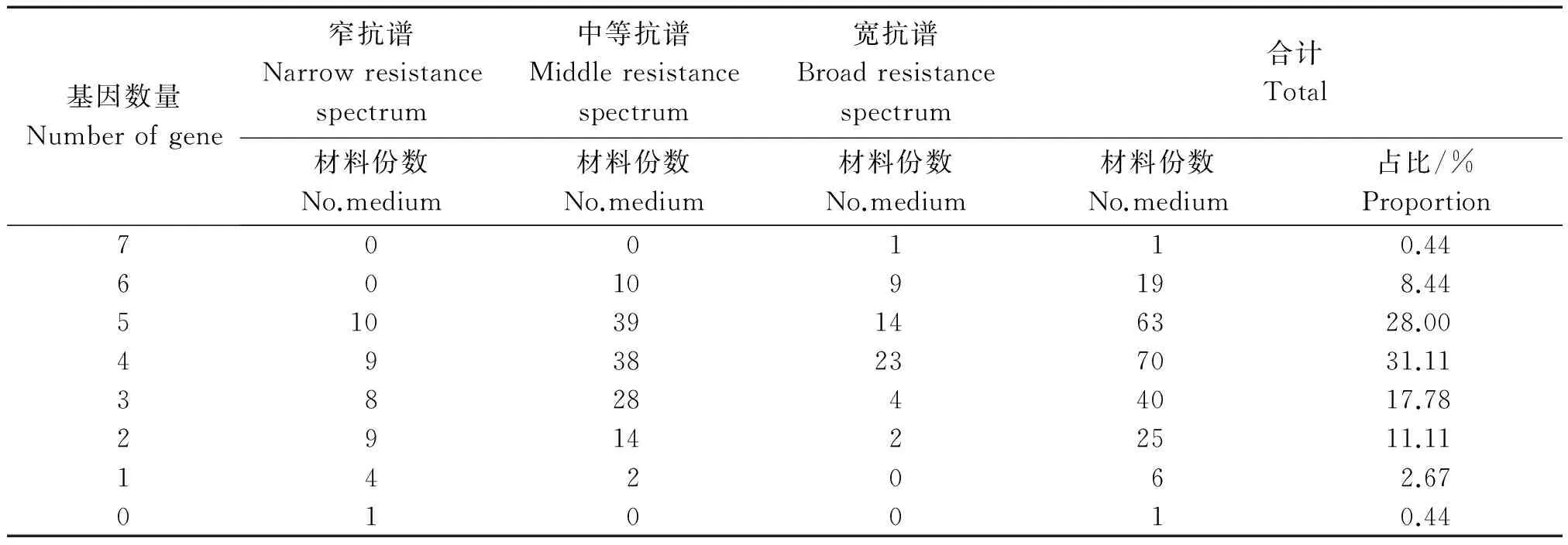
表6 抗性基因数量与品种资源抗病性
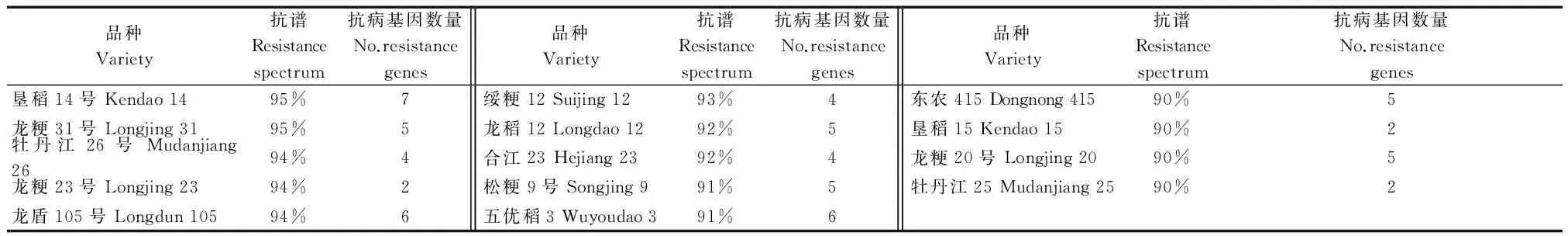
表7 宽抗谱水稻材料的抗病性及抗病基因数量
2.7联合致病性分析
结合225份黑龙江省品种资源苗期的抗病性表现,选出绥粳12、牡丹江26、龙盾105、龙粳20、龙粳31、东农415、松粳9、龙稻12、合江23和五优稻3号10份抗病材料。根据潘汝谦等[31]的标准选择最优组合,表8中对10份抗病性较好品种(抗谱≥20%)每2个搭配组合后的RAC和VAC进行模拟可知,最优组合有绥粳12+合江23、牡丹江26+龙粳31、牡丹江26+合江23等29个,这样的搭配组合对稻瘟病具有较好防病效果;其中龙粳31与其他9个材料的配对组合均为最优组合,对稻瘟病具有较高抗性,对于其中的组合绥粳12+龙粳20、牡丹江26+龙稻12、绥粳12+龙粳20、龙盾105+龙稻12、东农415+合江23,其组合的VAC为0.05,这些组合只对部分生理小种表现高抗;对于组合绥粳12+龙盾105、龙盾105+松粳9、东农415+龙稻12,其RAC比较低,这些组合的稻瘟病抗性只受其中1个品种影响,对稻瘟病的抗性并不能得到较大的提升,因此,后两类组合在生产上要谨慎应用。其中龙粳31与其他9个材料的配对组合均为最优组合,同时龙粳31的抗谱为95%,表明龙粳31是优良的稻瘟病抗源品种,并且对黑龙江省水稻种质资源的稻瘟病抗性改良具有重大意义。

表8 10份水稻品种的RAC和VAC
注:左下三角为RAC;右上三角为VAC 。
Note:Lower left triangle for RAC;Upper right triangle for VAC.
3 讨论
3.1黑龙江省稻瘟病生理小种群体变化特征
适时了解稻瘟病生理小种群体变化特征及其致病力状况,明确已知水稻品种资源对稻瘟病的抗性水平,对于培育广谱持久抗性品种至关重要。2005-2007年生理小种组成包括7群31个生理小种,优势种群为ZA群和ZD群出现频率分别是33.58%和24.63%[32],2007-2011年生理小种组成包括7群31个生理小种,优势种群为ZA群和ZD群出现频率分别是34.8%和31.1%[33],2012年生理小种组成包括7群38个生理小种,优势种群为ZA群和ZD群出现频率分别是43.85%和33.85%[34],本试验研究结果表明2013-2014年生理小种组成包括7群42个生理小种,优势种群为ZD群和ZA群出现频率分别是36.05%和35.47%。可见黑龙江省稻瘟病生理小种组成日趋复杂;2005-2014年优势群均为ZA群和ZD群,并且优势种群ZD群较稳定且出现频率呈逐年上升趋势,逐渐取代了ZA群体的最优势地位。最优势种群由ZA群向ZD群转移可能是因为黑龙江省水稻遗传基础狭窄,抗病基因单一,导致对稻瘟病生理小种产生定向选择作用;ZD群的优势小种ZD5对225份品种资源的致病率高达73.23%,表明其致病力强,能够对黑龙江省大部分水稻品种造成危害。因此迫切需要培育广谱持久抗稻瘟病品种,通过聚合多个抗病基因从而达到提高品种的抗性、拓宽抗谱和延长使用时间的目的;与此同时,还需要以3-5年为周期,对稻瘟病菌进行周期性普查鉴定[35],系统的掌握稻瘟病生理小种群体变化特征及其致病力状况,为稻瘟病抗性基因合理利用,品种合理布局提供理论依据。
3.2种质资源鉴定及联合致病力
迄今为止,已经有许多水稻种质资源稻瘟病抗性鉴定的相关研究,然而,黑龙江省的水稻品种资源抗病性鉴定的研究较少。因此,本试验通过稻瘟病菌株温室接种的方法,在研究黑龙江省稻瘟病生理小种组成、分布的基础上,对黑龙江省225份品种资源的稻瘟病抗谱和抗病基因分布进行研究,旨在明确黑龙江省品种资源的稻瘟病抗性及抗性基因分布情况,发掘抗谱广、抗性强而持久的抗稻瘟病资源。目前,已经有许多具有广谱抗性的抗源材料被人们鉴定出来,并且已经对其中一部分抗源材料进行了抗稻瘟病基因定位,如世界上公认的非洲持久抗稻瘟病品种,对我国具有代表性的强致病力菌株均具有优良抗性,在非洲地区仍然具有持久抗性[36]。国内的沈瑛等[37]利用强制病力菌株,接种我国很多杂交稻以及籼、粳品种,鉴定出对其供试生理小种表现出广谱抗性的4个品系(春江25、春江68、品969和源珍116等);四川省黄富等[38]历经20年,系统地对世界各地的4万余份种质资源的稻瘟病抗性进行了鉴定,鉴定出200多份具有广谱抗性的种质资源,累计推广面积达27.50万hm2,有效地控制了稻瘟病的流行;张锦花等[39]运用自然鉴定的方法对130份水稻育种材料进行稻瘟病抗性鉴定,鉴定了一些具有良好抗病性的材料,表明稻瘟病抗性资源丰富。本试验根据供试材料对本地区42个生理小种的抗病性表现,初步筛选出宽抗谱 (90.00%~95.00%)品种14份,其中部分品种(东农415、龙粳31、松粳9)抗病性水平与郭丽颖等[34]的研究保持一致,中等抗谱(50.00%~89.47%)品种170份,而窄抗谱(10.53%~47.37%)品种只有41份。表明黑龙江品种资源中蕴含优良的抗源材料。本试验结合225份黑龙江省种质资源苗期的抗谱及其抗病基因型,选出绥粳12、牡丹江26、龙盾105、龙粳20、龙粳31、东农415、松粳9、龙稻12、合江23和五优稻3号10份抗病材料,进行联合致病力分析得出,29个在抗稻瘟病育种生产上将具有较好防病效果的组合,这些组合还能够聚合多个抗性基因,提高抗性水平,拓宽抗谱;其中龙粳31与其他9个材料的配对组合均为最优组合,对稻瘟病具有较高抗性,对黑龙江省抗稻瘟病育种意义重大。
3.3稻瘟病抗性基因的合理利用
目前,人们通过大量的研究对稻瘟病的致病机理和抗性机制有了深入的了解。然而,由于稻瘟病生理小种群体结构变异速度快以及田间种植环境的复杂性,许多具有优良抗性的品种种植几年后,其抗病性难以继续保持。因此,挖掘具有广谱持久抗稻瘟病的抗病基因资源,并通过分子标记辅助选择育种的方法聚合多个抗病基因,培育出具有广谱持久抗稻瘟病的水稻品种,成为水稻抗稻瘟病育种的关键。在本试验检测的8个抗性基因中,Pi20、Pi33、Pi9、Pi54基因在供试品种中出现的频率分别为87.11%,77.33%,68.44%和63.11%,这些基因在黑龙江省水稻品种中分布广泛。Pita与Pita-2是一对紧密连锁或等位的抗性基因[40],我国部分区域的稻种资源抗病基因鉴定结果表明Pita的频率较高[17-18,41],Pik基因的频率较低[21]。本试验检测到携带Pita基因的供试品种比例为20.89%,携带Pik基因的供试材料比例为57.33%,与前人研究结果差异较大。原因可能是不同地区检测的水稻群体数量差别大,且黑龙江地区水稻品种的抗性遗传基础相对狭窄[34,42]。这说明水稻品种的抗瘟遗传基础具有明显的地域特征。Pib基因在供试品种中出现的比例为9.33%,属于低频率出现的基因,与部分水稻稻瘟病抗性基因的鉴定结果大致相同[17-18,41]。这8个抗病基因对我国稻瘟病生理小种均具有广谱抗性[16,43-44];这些广谱抗性基因的发掘与应用将有利于缩短稻瘟病抗病育种周期,从而提高育种效率。在本试验中,供试品种的抗病性随着其抗病基因数目的增多呈上升趋势。此外,研究结果表明携带抗病基因数量相同的水稻品种对稻瘟病生理小种的抗性水平并不一致,说明其稻瘟病抗性不仅仅是抗病基因的累加,还是这些基因之间相互作用的结果。
2013-2014年黑龙江省的稻瘟病菌株可划分为7个群42个生理小种,优势小种为ZD5和ZD7,出现频率分别为19.77%和12.21%,总频率为31.98%;通过苗期抗病性表现,筛选出宽抗谱品种14份,这14份黑龙江省水稻品种含有2~7个抗稻瘟病基因,是稻瘟病抗性育种较好的抗源材料。部分宽抗谱品种如垦稻15、龙粳23和牡丹江25,仅携带2个本研究鉴定的基因,这些品种可能是携带未知抗性基因的新抗源,可作为进一步挖掘广谱持久抗稻瘟病的试验材料。总体上,供试品种的抗病性随着其抗病基因数目的增多呈上升趋势;联合致病性分析结果表明:绥粳12+合江23、牡丹江26+龙粳31、龙盾105+龙粳31等29个在抗稻瘟病育种生产上将具有较好防病效果的组合;其中龙粳31与其他9个材料的配对组合均为最优组合,对稻瘟病具有较高抗性,对黑龙江省抗稻瘟病育种意义重大。
[1]Zhang Q.Strategies for developing Green super rice[J].Proceedings of the National Academy of Sciences of the United States of America,2007,104(42):16402-16409.
[2]张海英,刘勇,刘冬成,等.差异显示法分离水稻抗稻瘟病相关基因[J].遗传学报,2005,7:719-725.
[3]殷得所,夏明元,李进波,等.抗稻瘟病基因Pi9的STS连锁标记开发及在分子标记辅助育种中的应用[J].中国水稻科学,2011,1:25-30.
[4]孙强,张三元,张俊国,等.东北水稻生产现状及对策[J].北方水稻,2010,2:72-74.
[5]辛明远,王险峰,关成宏.2005年黑龙江省稻瘟病大发生与防治调查分析[J].现代化农业,2006,9:7-8.
[6]靳学慧,郭永霞,郑雯,等.黑龙江省稻瘟病发生特点及2007年发生趋势的分析[J].北方水稻,2007,2:57-61.
[7]凌忠专,雷财林,王久林.稻瘟病菌生理小种研究的回顾与展望[J].中国农业科学,2004,12:1849-1859.
[8]Ashkani S,Rafii M Y,Shabanimofrad M,et al.Molecular progress on the mapping and cloning of functional genes for blast disease in rice (OryzasativaL.):current status and future considerations[J].Critical Reviews in Biotechnology,2016,36(2):353-367.
[9]Yi G,Lee S K,Hong Y K,et al.Use of Pi5(t) markers in marker-assisted selection to screen for cultivars with resistance to Magnaporthe grisea[J].Theoretical and Applied Genetics,2004,109(5):978-985.
[10]Liu G,Lu G,Zeng L,et al.Two broad-spectrum blast resistance genes,Pi9(t) andPi2(t),are physically linked on rice chromosome 6[J].Molecular Genetics and Genomics,2002,267(4):472-480.
[11]Imbe T,Oba S,Yanoria M J T,et al.A new gene for blast resistance in rice cultivar,IR24[J].Rice Genet Newsl,1997,14:60-62.
[12]Berruyer R,Adreit H,Milazzo J,et al.Identification and fine mapping ofPi33,the rice resistance gene corresponding to theMagnaporthegriseaavirulence geneACE1[J].Theoretical and Applied Genetics,2003,107(6):1139-1147.
[13]Ramkumar G,Srinivasarao K,Mohan K M,et al.Development and validation of functional marker targeting an InDel in the major rice blast disease resistance genePi54 (Pikh)[J].Molecular Breeding,2011,27(1):129-135.
[14]Fjellstrom R,Conaway-Bormans C A,Mcclung A M,et al.Development of dna markers suitable for marker assisted selection of three genes conferring resistance to multiple pathotypes[J].Crop Science,2004,44(5):1790-1798.
[15]Hittalmani S,Parco A,Mew T V,et al.Fine mapping and DNA marker-assisted pyramiding of the three major genes for blast resistance in rice[J].Theoretical and Applied Genetics,2000,100(7):1121-1128.
[16]时克,雷财林,程治军,等.稻瘟病抗性基因Pita和Pib在我国水稻主栽品种中的分布[J].植物遗传资源学报,2009,1:21-26.
[17]杨杰,杨金欢,王军,等.稻瘟病抗病基因Pita和Pib在中国水稻地方品种中的分布[J].华北农学报,2011,26(3):1-6.
[18]李进斌,王甜,许明辉.云南地方稻种抗稻瘟病基因Pi-ta和Pi-b的鉴定[J].中国水稻科学,2012,5:593-599.
[19]Roychowdhury M,Jia Y L,Jackson A,et al.Analysis of rice blast resistance genePi-zin rice germplasm using pathogenicity assays and DNA markers[J].Euphytica,2012,184(1):35-46.
[20]郝鲲,马建,程治军,等.水稻抗稻瘟病基因资源与分子育种策略[J].植物遗传资源学报,2013,3:479-485.
[21]Imam J,Alam S,Mandal N P,et al.Molecular screening for identification of blast resistance genes in North East and Eastern Indian rice germplasm (OryzasativaL.) with PCR based makers[J].Euphytica,2014,196(2):199-211.
[22]王军,杨杰,陈志德,等.利用分子标记辅助选择聚合水稻抗病基因Pi-ta、Pi-b和Stv-bi[J].作物学报,2011,37(6):975-981.
[23]Jiang H C,Feng Y T,Bao L,et al.Improving blast resistance of Jin 23B and its hybrid rice by marker-assisted gene pyramiding[J].Molecular Breeding,2012,30(4):1679-1688.
[24]Chen H Q,Chen Z X,Ni S,et al.Pyramiding three genes with resistance to blast by marker assisted selection to improve rice blast resistance of Jin 23B[J].Chinese Journal of Rice Science,2008,1:5.
[25]徐未未.分子标记辅助培育水稻万金B抗稻瘟病近等基因系与基因聚合系[D].湛江:广东海洋大学,2013.
[26]张书建,何月秋.介绍一种简单的真菌单孢子分离法[J].云南农业大学学报,2003,3:315-316.
[27]全国稻瘟病菌生理小种联合试验组.我国稻瘟病菌生理小种研究[J].植物病理学报,1980,10 (2):71-82.
[28]Doyle J J.Isolation of plant DNA from fresh tissue[J].Focus,1990,12:13-15.
[29]Chen D,Zeigler R S,Leung H,et al.Population structure ofPyriculariagriseaat two screening sites in the Philippines[J].Phytopathology,1995,85(9):1011-1020.
[30]杨秀娟,阮宏椿,杜宜新,等.福建省稻瘟病菌致病性及其无毒基因分析[J].植物保护学报,2007,4:337-342.
[31]潘汝谦,康必鉴,黄建民,等.毒力频率和联合致病性在水稻抗瘟性鉴定中的应用[J].华南农业大学学报,1999,04:10-14.
[32]张俊华,孙洪利,刘洋大川,等.黑龙江省稻瘟病菌生理小种鉴定[J].植物保护,2009,3:137-140.
[33]王桂玲,宋成艳,刘乃生,等.2007~2011年黑龙江省稻瘟病菌生理小种鉴定[J].黑龙江农业科学,2012,11:58-61.
[34]郭丽颖,赵宏伟,王敬国,等.黑龙江省稻瘟病菌生理小种鉴定和主栽水稻品种抗病性及遗传多样性分析[J].核农学报,2015,8:1444-1454.
[35]雷财林,王久林,凌忠专.稻瘟病菌生理小种的变化动态[J].作物杂志,1996,4:35-37.
[36]李瑶,聂元元,蔡耀辉,等.水稻稻瘟病抗性基因及其分子标记辅助选择育种研究进展[J].江西农业学报,2011,9:72-75.
[37]沈瑛,Adreit H,朱旭东,等.中国部分杂交稻和常规早籼、晚粳品种(系)的抗瘟性[J].中国农业科学,2004,3:362-369.
[38]黄富,程开禄,罗庆明,等.四川省水稻抗稻瘟病育种现状及发展方向[J].植物保护学报,2001,4:371-374.
[39]张锦花,赵明富,施碧红,等.全球水稻分子育种亲本材料在福建的稻瘟病抗性评价[J].分子植物育种,2008,5:843-852.
[40]Hayashi K,Yoshida H,Ashikawa I.Development of PCR-based allele-specific and InDel marker sets for nine rice blast resistance genes[J].Theoretical and Applied Genetics,2006,113(2):251-260.
[41]谢倩凤,郭建夫,杨仕华,等.82份水稻种质资源的稻瘟病抗性评价与抗性基因鉴定[J].广东农业科学,2015,14:31-35.
[42]刘华招.抗病基因Pi-ta在骨干亲本及其衍生品种的传递[J].植物遗传资源学报,2013,4:699-703.
[43]何秀英,王玲,吴伟怀,等.水稻稻瘟病抗性基因的定位、克隆及育种应用研究进展[J].中国农学通报,2014,6:1-12.
[44]朱小丽,陶跃之,周波.水稻抗稻瘟病基因的复等位分布特征及其在基因挖掘中的应用[J].浙江农业学报,2015,10:1789-1796.
Physiological Races of Rice Blast in Heilongjiang Province and Species Identification of Resistance to Resource
XIN Wei,WANG Jingguo,SUN Jian,LIU Hualong,GUO Liying,JIANG Sida,XU Tianyu,ZHAO Hongwei,ZOU Detang
(College of Agriculture,Northeast Agricultural University,Harbin150030,China)
Blast resistance of rice varieties in Heilongjiang Province in order to clear resource,mining germplasm resources,timely understanding of groups of physiological variation of Heilongjiang Province.Useing the Chinese name of physiological races method,by spraying bacteria identification at the seedling stage.The races of rice blast in Heilongjiang Province from 2013 to 2014 can be divided into 7 groups of 42 physiological races,in which the dominant races were ZD5and ZD7,and frequency of occurrence was 19.77% and 12.21%,respectively.The total frequency was 31.98%.The result of resistance test in seedling showed that 14 accessions had broad resistance spectrum,these accessions with 2-7 rice blast resistance genes has been identified,The 29 combinations,such as suijing 12 and Hejiang 23 (Pi9,Pi20,Pi33,Pi54,Pik),Mudanjiang 26 and Longjing 31 (Pi9,Pi20,Pi33,Pi54,Pita,Pik) and Mudanjiang 26 and Hejiang 23 (Pi9,Pi20,Pi33,Pi54,Pik) and so on had better effect of blast resistance on breeding production.These comparisons have the quality of,enhancing the level of resistance and broadening the spectrum of resistance.The combinations interfered with Longjing 31 and other 9 materials had better resistance to rice blast.14 accessions were base materials for multiple resistance genes aggregated in breeding.There may be other unknown genes or new genes in some of the broad spectrum resistant materials,such as Kendao 15,Longjing 23 and Mudanjiang 25 which are containing 2 genes identified in this study,can be used as the test materials in further identification and finding resistance genes.
Rice blast;Physiological race;Germplasm resources;Blast resistance;Resistance gene
2016-04-10
黑龙江省重大科技招标项目(GA14B102-02)
辛威(1991-),男,黑龙江绥化人,在读硕士,主要从事水稻遗传育种研究。
邹德堂(1965-),男,黑龙江哈尔滨人,教授,博士,博士生导师,主要从事水稻遗传育种研究。
S435.11
A
1000-7091(2016)04-0130-08
10.7668/hbnxb.2016.04.022
