人工合成六倍体小麦的ISSR位点遗传多样性分析
2016-09-23杨在君彭正松魏淑红廖明莉
罗 琴,杨在君,彭正松,魏淑红,廖明莉
(西华师范大学,西南野生动植物资源保护教育部重点实验室,四川 南充 637009)
人工合成六倍体小麦的ISSR位点遗传多样性分析
罗琴,杨在君,彭正松,魏淑红,廖明莉
(西华师范大学,西南野生动植物资源保护教育部重点实验室,四川 南充637009)
为了解人工合成六倍体小麦品种的遗传多样性,选用了100条ISSR引物对11份人工合成小麦和3个普通小麦材料(TP、HTS-1、CS)进行了遗传多样性分析。筛选出了42条引物可用于遗传多样性分析,其中有24条引物对供试材料具有较强的鉴别能力。42条引物共扩增出了273个条带,每条引物扩增出的条带数是3~12,平均每条为6.5,同时检测到在14份小麦试材中有170(占62.3%)个等位变异位点,引物等位变异数为1~11,平均每个位点出现4.5个等位变异。42条引物扩增产物的多态性信息量(PIC)为0.499~0.879,平均为0.767,多数引物扩增的多态性信息量在0.800左右。14份材料间的遗传相似系数为0.663~0.934,平均为0.790。根据材料间的遗传相似系数聚类,14个材料被聚为3类,其中聚为第2类的试材最多。本研究表明,14份小麦材料遗传相似性较大,亲缘关系较近,但参试材料总体遗传多样性水平较高。聚类分析结果与试材系谱及亲本来源相吻合。结果表明ISSR标记技术可应用于物种的鉴别、遗传多样性研究和遗传图谱构建。
人工合成六倍体小麦;遗传多样性;ISSR;聚类分析
物种的遗传多样性越高,对环境改变的适应能力也就越强,那么就越容易扩展其分布范围及拓展新的环境,即便是占优势的无性繁殖物种也不能例外[1-2]。自1949年起,我国的小麦经历了多次更换品种,每经过一次更换小麦的生产都将出现较大突破[3]。近年来,尽管对小麦的品质或对某一产区小麦的遗传多样性进行了许多研究,但其遗传改良进度仍然较慢,育种亲本的品质或较少的种类可能是出现此现状的原因,加之长期的定向选择造成了种质资源基础逐渐变窄,从而阻碍了遗传基础的拓宽以及种质资源的创新[4-6],也有可能是因为目前进行综合研究的亲本材料较少,导致了研究者对当前亲本材料的遗传变异缺乏完全的了解[7]。因此,通过种质资源创新和品种改良来提高小麦的产量,已经成为全球众多育种学家追求的目标[8]。远缘杂交技术是小麦进行遗传改良的有效途径。一些学者采用此途径已经培育出具有较强的抗病、抗逆的人工合成六倍体小麦(Synthetic hexaploid wheat)品种[9-13]。人工合成六倍体小麦是利用四倍体小麦如硬粒小麦(Durum wheat,2n=4x=28,AABB)与节节麦(Ae.tauschiiCoss,2n=2x=14,DD)进行人工杂交,获得F1单倍体,携带有A、B、D染色体组(2n=3x=21,ABD),再用秋水仙碱处理该单倍体得到六倍体小麦[14]。目前,人工合成六倍体小麦是利用优良基因的重要桥梁资源之一,对其优良基因的挖掘和利用成为全球小麦育种学者关注的热点问题[15]。
简单序列重复区间扩增多态性 (Inter-simple sequence repeat,ISSR),是Zietkiewicz等[16]以基因组中微卫星序列设计含锚定碱基的寡聚核苷酸链为基础设计引物,其长度几乎都在15~24 bp[17],串联重复及几个非重复的锚定碱基是由1~4个碱基组成,这使得引物能够与基因组DNA中SSR的5′或3′末端结合,让位于反向排列、间隔不大的重复序列间的DNA片段能顺利进行PCR扩增,故该分子标记是以SSR及PCR反应为基础发展起来的一种新的标记技术[18-19]。PCR产物通过聚丙烯酰胺或琼脂糖凝胶电泳检测,经硝酸银或溴化乙锭(EB)染色来检测扩增的DNA片段多态性,DNA片段的多态性能够反映出基因组相应区域DNA的多态性[20]。ISSR标记技术由于结合了SSR和AFLP的高多态性、较好精确度以及RAPD的通用性等优点[21],所以近几年来生物学家们非常重视此项技术,同时已将其广泛应用于许多植物遗传研究中[22]。
本试验通过ISSR标记对11份人工合成六倍体小麦和3个普通小麦材料的遗传多样性进行了分析,为研究小麦不同材料鉴别、基因定位、遗传多样性分析及拓宽小麦种质资源提供一定的理论依据。
1 材料和方法
1.1供试材料
小麦三雌蕊突变体(TP)、小麦雄蕊同源转化为雌蕊突变体(HTS-1)和中国春(CS)由西南野生动植物资源保护教育部重点实验室保存。人工合成小麦Syn-SAU-1、Syn-SAU-3、Syn-SAU-16、Syn-SAU-32和Syn-SAU-59由四川农业大学刘登才研究员提供。人工合成小麦Elite2-2、Elite2-6、Elite2-10、Elite2-21、Elite2-33 和Syn769由四川省农科院生物技术与核技术研究所杨武云研究员提供。人工合成小麦的系谱见表1。

表1 人工合成小麦系谱
1.2DNA提取
小麦种子在27 ℃黑暗条件下萌发,待长出根后,在光照下培养5~7 d,取幼嫩叶片,按照Biotechnology 公司的多糖多酚植物DNA提取试剂盒提取小麦叶片基因组DNA。
1.3PCR扩增与琼脂糖凝胶电泳
由上海生物工程公司合成Nagaoka等[23]的100条ISSR引物序列。PCR反应总体系为10 μL,其中包括5 μL 2×TaqPCR MasterMix,3 μL ddH2O,1 μL(10 ng/μL)ISSR引物,1 μL DNA。PCR反应程序为:94 ℃预变性3 min后进入循环,循环为:94 ℃变性30 s,50~60 ℃退火30 s(退火温度根据具体引物而定),72 ℃延伸 1 min,共35个循环。循环完成后72 ℃继续延伸5 min,最后4 ℃保存。PCR扩增产物用1.5%的琼脂糖凝胶电泳检测。
1.4数据分析

2 结果与分析
2.1ISSR分子标记多态性分析
选用Nagaoka 等[23]的100条ISSR引物对11份人工合成小麦和3个普通小麦材料(TP、HTS-1、CS)进行PCR扩增,其中42条引物能够得到重复性较好的条带,且具多态性(表2)。因此,选取了这42条ISSR引物进行遗传多样性分析。14份材料共扩增出273个条带,每条引物扩增出的条带数是3~12,平均为6.5,其中引物UBC836扩增的条带数最多,为12条,最少的只有3条,分别为UBC840、UBC858和UBC888;共检测到170(占62.3%)个等位变异位点,等位变异位点数为1~11,平均等位变异位点4.5个,不同引物扩增的谱带多态性具有明显的差异。引物UBC873等位变异频率最低(20%),引物UBC840、UBC845、UBC849、UBC854和UBC858的等位变异频率达100%,变幅较大。按照Anderson等[24]的方法计算了42条高效引物对14份供试材料的位点多态性信息量(PIC)的值。PIC值为0.499~0.879,平均为0.767,变化范围比较大,其中引物UBC836检测到11个等位位点变异,PIC值最高,PIC值在0.800以上的几乎占50%,某些引物的PIC值偏低,如UBC824(0.508)和UBC888(0.499),某个等位变异频率较高,可能是其优异等位变异在长期育种过程中被选择并保留下来[25]。图1为引物UBC879的扩增结果。总体而言,42条引物在材料间多态性较高。从表2中还可看出引物的等位变异位点数与多态信息量不一致,与马艳明[18]的研究结果一致,其原因可能与标记数量或种质本身的遗传基础有关[26]。 42条引物中有24条引物在12份供试材料(Syn-SAU-16和Elite2-21无特异性条带)中能扩增出特异性条带(表3)。结果表明,这42条ISSR引物能够用于小麦不同材料的鉴别,有利于进一步对小麦种质资源进行遗传多样性分析等研究[27]。

表2 ISSR-PCR扩增产物多态性
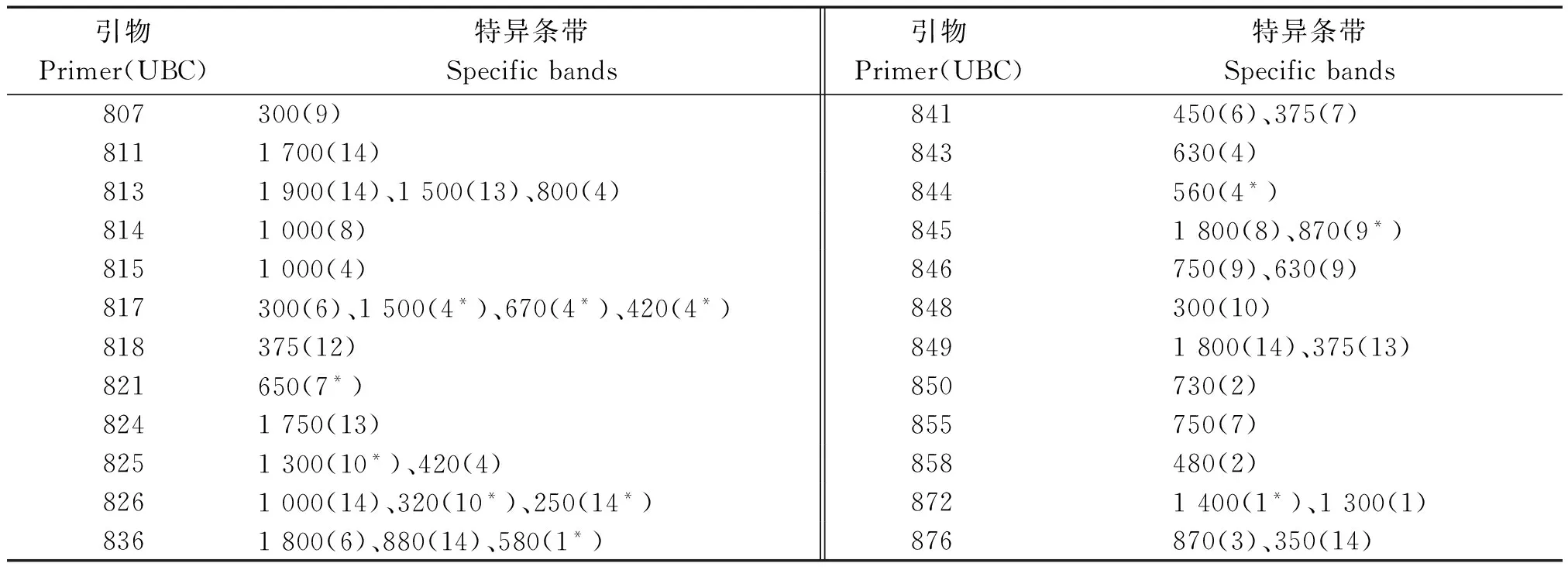
表3 特异性条带统计结果
注:括号外数字表示特异条带的大小(bp),括号内的数字是供试材料的编号。“*”.特异缺失条带。编号:1.TP;2.HTS-1;3.Syn-SAU-1;4.Syn-SAU-3;5.Syn-SAU-16;6.Syn-SAU-32;7.Syn-SAU-59;8.Elite2-2;9.Elite2-6;10.Elite2-10;11.Elite2-21;12.Elite2-33;13.Syn769;14.CS。图1、表4同。
Note:The figures out of brackets mean the molecular weights of the specific bands(bp) and the figures in brackets are the numbers of materials studied.Symbols of “*” mean specific missing bands.Number:1.TP;2.HTS-1;3.Syn-SAU-1;4.Syn-SAU-3;5.Syn-SAU-16;6.Syn-SAU-32;7.Syn-SAU-59;8.Elite2-2;9.Elite2-6;10.Elite2-10;11.Elite2-21;12.Elite2-33;13.Syn769;14.CS.The same as Fig.1,Tab.4.
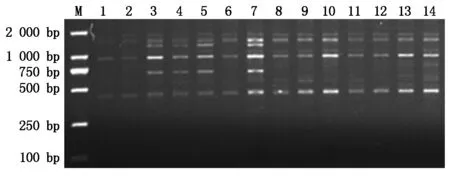
M.2 000 bp Markers。
2.2遗传差异分析
利用分析软件NTSYS2.1计算各材料间的遗传相似系数(GS),14份小麦材料的遗传相似系数矩阵见表4。遗传相似系数(GS)为0.663~0.934,平均为0.790,遗传相似性变化较大且较高。在这些材料中,Syn-SAU-1与Syn-SAU-16间的遗传相似性最高,遗传距离最小,GS值高达0.934,说明亲缘关系最近;TP、HTS-1和CS之间的GS值(>0.802)高于它们与人工合成小麦之间的GS值(<0.802),表明前三者之间的遗传相似性更高;Syn-SAU-3与Elite2-10、 Elite2-21及TP的GS值分别为0.663,0.674,0.681,CS与Syn-SAU-1、Syn-SAU-3、Syn-SAU-16及Syn-SAU-32之间的GS值也均小于0.700,则表明它们两两之间的遗传距离较大,亲缘关系较远;且Syn-SAU-3与Elite2-10之间的GS值最小(0.663),遗传距离最大,即两者之间的亲缘关系最远。
2.3聚类分析
利用ISSR遗传相似性矩阵按UPGMA方法进行聚类分析,构建了各供试材料的亲缘关系图(图2)。聚类结果显示,遗传相似系数为0.663~0.934。当遗传相似系数为0.73时,供试材料可聚为2个大类,除了Syn-SAU-1、Syn-SAU-3、Syn-SAU-16及Syn-SAU-59被聚为第2大类外,其余材料都被聚为第1大类。在不同的遗传相似性水平上,第1大类又可分为不同的亚类,当遗传相似性系数为0.75时,可分为2个亚类,第1亚类包括TP、HTS-1和CS,都来源普通地方品种,其余的为第2亚类,都为人工合成小麦;在0.78水平上,可分为3个亚类,第2亚类的Syn-SAU-32单独又聚为1类,其余聚为1类,它们之间亲本材料来源差异较大。当遗传相似性系数为0.93时,供试的14份小麦材料可被全部区分开。由聚类结果显示,人工合成小麦中部分材料间亲本来源或地理环境相同,造成材料间亲缘关系较近,遗传相似度偏高,被聚为1类,如第2亚类中除Syn-SAU-32外的其他人工合成小麦,它们均是由CMMYT的硬粒小麦-节节麦人工合成的材料;被聚为第2大类的Syn-SAU-1、Syn-SAU-3及Syn-SAU-59之间的二倍体亲本均是来自中东的节节麦(AS60),然而Syn-SAU-1与Syn-SAU-16的四倍体亲本均为圆锥小麦,故两者又被聚为其中的1个小类。由此可见,ISSR分子标记可以准确地确立各供试材料之间的遗传差异和亲缘关系。
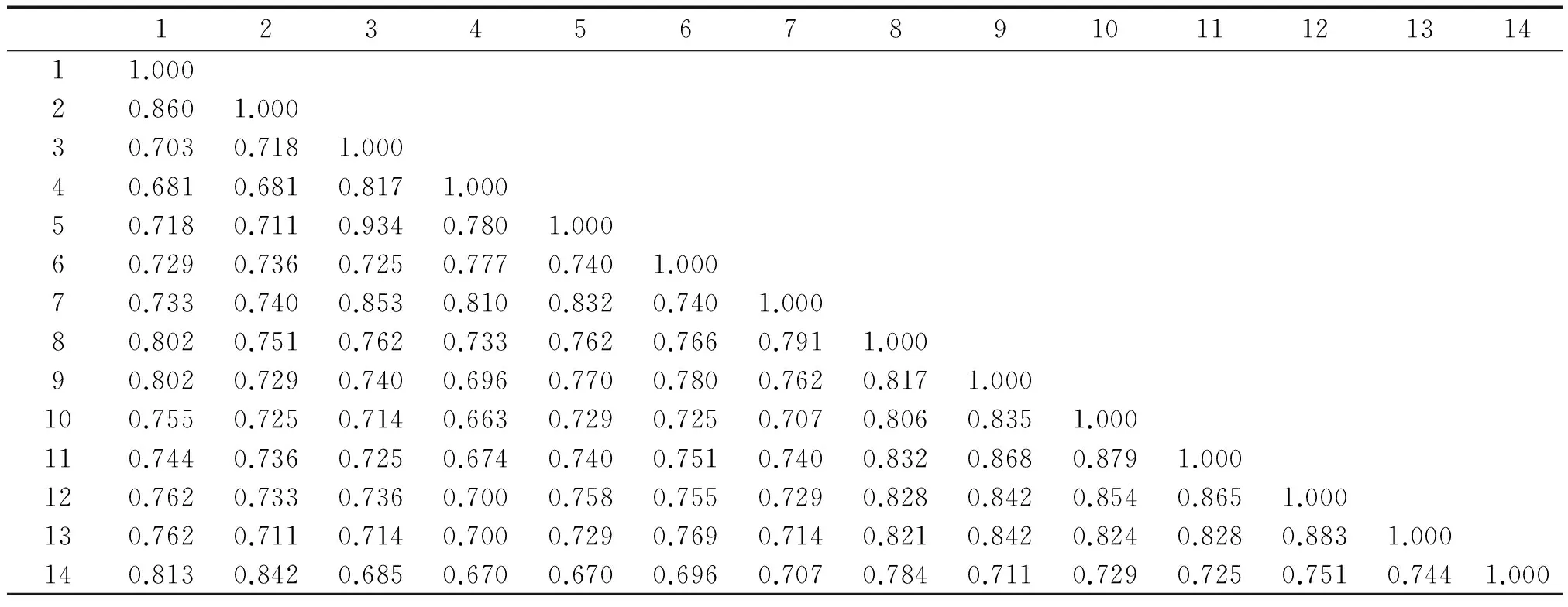
表4 14份小麦材料的遗传相似系数矩阵
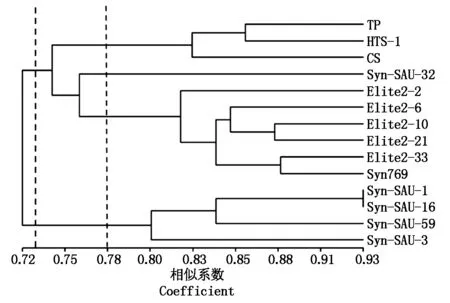
图2 14个小麦材料的ISSR标记聚类结果
3 讨论
3.1ISSR标记多态性位点研究
ISSR是一项以PCR为基础的分子标记技术,自诞生以来,由于其具有丰富的多态性信息含量、高的灵敏度、重复性好及技术简单等诸多优点,已被广泛应用于品种鉴定、种质资源以及遗传多样性等方面的研究[20,28-30]。张述义等[31]利用筛选出的11条引物对33株供试菌株进行ISSR-PCR扩增,多态性位点比例达86.7%。沈程文等[32]选用15条ISSR引物对30份广东茶树品种进行PCR扩增,多态性比率为96.89%。季志仙等[33]对罗文彬等[34]通过进一步改进和简化的研究,针对性选出其中的6条ISSR引物对17份浙江省甘薯品种资源进行了分析,多态性比率明显提高了40.66%(50.25%与90.91%)。朱岩芳[35]对8个近亲小麦品种选用100条ISSR引物进行扩增,筛选出6条多态性ISSR引物可用于品种的鉴别。本试验选用与朱岩芳[35]相同的100条ISSR引物对11份人工合成六倍体小麦和3份普通小麦材料(TP、HTS-1、CS)进行PCR扩增,多态性水平为20%~100%,平均62.3%。由此可见,ISSR分子标记应用于不同的研究对象,多态性相差较大,原因可能是选取的材料之间遗传差异不同,或者引物选取随机性,某些引物序列能否在该材料中扩增出来等[36-37]。本试验还得出筛选出的42条多态性引物中有24条引物能够扩增出特异性条带或特异性缺失条带,这一结论与朱岩芳[35]报道一致,可用于不同材料的鉴定,但本试验筛选出多态性引物更多,可能与供试材料之间的亲缘关系远近有关。
3.2参试小麦材料的遗传多样性与亲缘关系研究
14份材料间的遗传相似系数平均为0.790,最大的为0.934,遗传相似性较大。部分材料间遗传相似系数较低(低于0.700),可为种质资源创新提供较好的背景材料。但大多数材料之间的遗传相似性较大,几乎均在0.800左右,尤其是Syn-SAU-1与Syn-SAU-16的GS高达0.934,究其原因可能是亲本来源相对狭窄,且部分参试材料共用亲本,故有待于进一步拓宽遗传基础。聚类结果显示,由于材料之间的二倍体或四倍体亲本的不同被聚为3个亚类,由于各自独特的地理气候环境,农科院从CIMMYT引进的人工合成小麦、四川农业大学培育出的人工合成小麦及我国的3份普通小麦材料分别被聚为一类,可说明材料的遗传相似性与地理来源有一定的关联。但Syn-SAU-32与其他来自四川农业大学的人工合成小麦材料没有聚在一起,其原因是它们之间二倍体亲本的不同,二倍体亲本在多倍化过程中D基因组序列对新物种基因组的形成具有重要的调节作用[38]。杨松杰等[39]采用SSR标记对117份人工合成六倍体小麦后代衍生群体在DNA水平上进行了遗传多样性分析,检测到A、B、D基因组的多态信息量,D基因组表现最低;聚类分析显示D基因组遗传相似系数最高,Syn-SAU-32的聚类结果与此研究相吻合。同时杨松杰等[39]的聚类结果显示材料之间的亲缘关系能够反映出(基因型间)系谱信息,遗传相似性能够反映品种间的亲缘关系[40],但本试验还发现,地理环境越相似,GS值越大,遗传差异越小,亲缘关系就越近,相反,地理环境相差越大,亲缘关系就越远。此结果可表明地理生态环境对小麦种质的遗传变异影响很大。郭郁频等[41]和张雪等[42]的研究中也显示,地形地貌的差异也可以使植物基因发生变异。
3.3SSR与ISSR分析小麦遗传多样性的比较及其利用
采用的标记技术和材料若不同,所得出的结论也可能不尽相同。刘路平等[43]对2011-2012年度国家黄淮冬麦区42个小麦品种(系)的遗传差异情况进行了分析,研究结果表明,每个SSR位点多态性信息指数(PIC)为0.09~0.77,平均为0.53;品种间遗传相似系数(GS)为0.15~0.88,平均为0.52,可见部分参试品种具有较大遗传差异,为亲本利用提供了一定的参考信息。杨松杰等[39]采用微卫星标记分析的研究结果表明,人工合成六倍体小麦衍生后代高代群体系的A、B、C基因组PIC值A>B>C,且遗传差异较高,遗传相似系数较低,具有较高的遗传多样性水平,还得出可以通过人工合成六倍体小麦的基因库改良现代小麦,拓宽遗传基础,降低生物和非生物之间胁迫的程度。本试验结果表明,14份材料的PIC值为0.499~0.879,遗传相似系数为0.663~0.934,其中的3个普通小麦材料与人工合成小麦之间的遗传差异较大,可为小麦种质资源的创新提供一定的参考价值,同时也可应用于他们之间进一步的基因定位和分子图谱构建等领域[44],但总体遗传多样水平较高。所以,针对某种材料采用特定的分子标记方法分析遗传多样性显得尤为重要。
本试验以11份人工合成六倍体小麦和3份普通小麦材料(TP、HTS-1、CS)为对象,选用了100条ISSR引物对其进行了遗传多样性分析,分析结果表明,42条引物可以明显扩增出稳定多态性的条带,其中24条引物对参试材料具有较强的鉴别能力。42条引物共扩增出了273个条带,有170(占62.3%)个条带发生等位变异;42条引物扩增产物的多态性信息量PIC为0.499~0.879,平均为0.767,多数引物扩增的多态性信息量在0.800左右。14份材料间的遗传相似系数为0.663~0.934,平均为0.79。利用UPGMA法进行聚类分析,14份材料被聚为3类,地理环境相近的材料容易聚在一起。聚类结果显示出11份人工合成小麦与3个普通小麦之间的遗传相似性较小,可为种质资源创新提供参考依据,同时可应用于基因定位、连锁遗传分析以及遗传图谱构建等方面的研究。
[1]黄敏,王奇志.中国入侵严重地区假臭草遗传多样性研究[D].泉州:华侨大学,2014.
[2]黎丽倩,李妮亚,刘强.入侵海南和广东的外来植物假臭草遗传多样性的ISSR分析[J].生态学杂志,2014,33(3):611-617.
[3]庄巧生.中国小麦品种改良及系谱分析[M].北京:中国农业出版社,2003:2-30.
[4]余马.人工合成六倍体小麦遗传图谱构建及重要育种目标性状QTL定位研究[D].雅安:四川农业大学,2013.
[5]郝晨阳,王兰芬,张学勇,等.我国育成小麦品种的遗传多样性演变[J].中国科学C辑,2005,35(5):408-415.
[6]苏集华,王莉,秦金燕,等.小麦和拟斯卑尔脱山羊草(AegilopsspeltoidesTausch.)异源 融合体形成的技术体系建立[J].核农学报,2013,27(11):1610-1616.
[7]赵军海,冯国华,刘东涛,等.小麦育种亲本材料遗传多样性的SSR分析[J].麦类作物学报,2009,29(6):982-986.
[8]汤永禄,朱华忠,李朝苏,等.利用人工合成六倍体小麦育成的新品种川麦42的生态适应性及产量潜力研究[J].西南农业学报,2007,20(2):275-280.
[9]Schachtman D P,Lagudah E S,Munns Rana.The expression of salt tolerance fromTriticumtauschiiinhexaploid wheat[J].Theoretical and Applied Genetics,1992,84:714-719.
[10]Limin A E,Fowler D B.Inheritance of cold hardiness inTriticumaestivum×synthetic hexaploid wheat crosses[J].Plant Breeding,1993,110:103-108.
[11]Del Blanco I A,Rajaram S,Kronstad W E.Agronomic potential of synthetic hexaploid wheat-derived populations[J].Crop Science,2001,41:670-676.
[12]邓新贤.抗条锈病新小种小麦品系的抗性鉴定,遗传分析及SSR分子标记[D].重庆:西南大学,2013.
[13]任强,刘慧娟,陈洋,等.人工合成小麦CI191抗条锈病基因的鉴定及分子标记定位[J].作物学报,2010,36(5):721-727.
[14]Mujeeb-Kazi A R V,Roldan S.Conservation of the genetic variation ofTriticumtauschii(Coss)Schmalh.(Aegilopssquarrosaauct.non L.)in synthetic hexaploid wheats(T.turgidumL.S.lat.×T.tauschii;2n=6x=42,AABBDD)and its potential utilization for wheat improvement[J].Genetic Resources and Crop Evolution,1996,43(2):129-134.
[15]Zhang X Z,Zhao B,Chen L,et al.Molecular mapping of powdery mildew resistance genes in wheat line 91260[J].Journal of Triticeae Crops,2015,35(8):1067-1075.
[16]Zietkiewicz E,Rafalski A,Labuda D.Genome fingerprinting by simple sequence repeat (SSR)-anchored polymerase chain reaction amplification[J].Genomics,1994,20(2):176-183.
[17]马艳明,刘志勇,王浩,等.新疆孜然种质资源的ISSR标记分析[J].新疆农业科学,2008,45(1):70-74.
[18]马艳明.黄淮麦区小麦品种(系)的遗传多样性分析[D].泰安:山东农业大学,2004.
[19]邱天,庞劲松.小麦异源多倍体中亲本基因组相互作用产生快速基因组变异的ISSR标记分析[J].东北师大学报,2011,43(2):0124-0128.
[20]张立荣,刘大群,徐大庆,等.小麦ISSR分析初探[J].河北农业大学学报,2004,27(1):001-0013.
[21]丁海燕,梁晨,赵洪海,等.山东省小麦禾谷孢囊线虫rDNA-ITS序列特征和基于ISSR的遗传多样性分析[J].植物病理学报,2015,45(3):326-336.
[22]张瑜,黄琳凯,张新全,等.柳枝稷种质资源遗传多样性的ISSR分析[J].草业学报,2013,22(6):213-222.
[23]Nagaoka A,Ogihara Y.Applicability of inter-simple sequence repeats Polymorphisms in wheat for use as DNA markers in comparison to RFLP and RAPD markers[J].Theoretical and Applied Genetics,1997,94(5):597-602.
[24]Anderson J A,Churchill G A,Autrique J E,et al.Optimizing parental selection for genetic linkagemaps[J].Genome,1993,36:181-186.
[25]曹廷杰,谢菁忠,吴秋红,等.河南省近年审定小麦品种基于系谱和SNP标记的遗传多样性分析[J].作物学报,2015,41(2):197-206.
[26]Ali M L,Rajewski J F,Baenziger P S,et al.Assessment of genetic diversity and relationship among a collection of US sweet sorghum germplasm by SSR markers[J].Molecular Breeding,2008,21(4):497-509.
[27]李莹莹.牡丹CDDP分子标记引物筛选及多态性分析[J].核农学报,2013,27(8):1099.
[28]Ammiraju J,Dholakia B B,Santra D K,et al.Identification of inter simple sequence repeat (ISSR) markers associated with seed size in wheat[J].Theoretical and Applied Genetics,2001,102(5):726-732.
[29]Wang Z Y,Liao L,Yuan X E,et al.Genetic diversity analysis of Cynodon dactylon (bermudagrass) accessions and cultivars from different countries based on ISSR and SSR markers[J].Biochemical Systematics and Ecology,2013,46:108-115.
[30]王惠梅,吴国林,江绍琳,等.基于SSR和ISSR的鄱阳湖流域野生菰资源的遗传多样性分析[J].植物遗传资源学报,2015,16(1):133-141.
[31]张述义,李新凤,韦晓艳,等.33 株尖孢镰刀菌遗传多样性的ISSR分析[J].生态学杂志,2013,32(5):1195-1202.
[32]沈程文,黄建安,赵世浩,等.利用SRAP和ISSR标记分析广东茶树种质资源的遗传多样性[J].核农学报,2010,24(5):948-955.
[33]季志仙,王美兴,范宏环,等.基于ISSR指纹的甘薯食用品种的遗传多样性分析[J].核农学报,2014,28(7):1197-1202.
[34]罗文彬,蔡南通,邱永祥,等.甘薯种质资源遗传多样性的ISSR分析[J].西北农林科技大学学报:自然科学版,2008,36(10):110-114.
[35]朱岩芳.农作物品种分子标记鉴定及指纹图谱构建研究[D].杭州:浙江大学,2013.
[36]Ahmad F,Slinkard A E.Genetic-relationships in the genus cicer l as revealed by polyacrylamide-gel electrophoresis of seed storage proteins[J].Theoretical and Applied Genetics,1992,84(5/6):688-692.
[37]Labdi M,Robertson L D,Singh K B,et al.Genetic diversity and phylogenetic relationships among the annual Cicer species as revealed by isozyme polymorphism[J].Euphytica,1996,88(3):181-188.
[38]王变银,翟军,郝元峰,等.对人工合成小麦的微卫星变异分析[J].作物学报,2011,37(8):1491-1496.
[39]杨松杰,杨武云.人工合成六倍体小麦后代衍生群体遗传多样性检测[J].分子植物育种,2008,6(2):268-276.
[40]刘岩,程须珍,王丽侠,等.基于SSR标记的中国绿豆种质资源遗传多样性研究[J].中国农业科学,2013,46(20):4197-4209.
[41]郭郁频,任永霞,张颖超,等.早熟禾种质资源ISSR遗传多样性分析[J].中国草地学报,2014,36(3):28-46.
[42]张雪,刘青松,师文贵,等.25份无芒雀麦种质资源遗传多样性的ISSR分析[J].草地学报,2014,36(3):104-120.
[43]刘路平,朱传杰,简俊涛,等.黄淮麦区小麦新品种(系)的遗传多样性分析[J].类作物学报,2013,33(6):1128-1133.
[44]王晓波,马传喜,何克勤,等.小麦2D染色体上多酚氧化酶(PPO)基因STS标记的开发与应用[J].中国农业科学,2008,41(6):1583-1590.
Evaluation of Genetic Diversity in Synthetic Hexaploid Wheats Using ISSR Markers
LUO Qin,YANG Zaijun,PENG Zhengsong,WEI Shuhong,LIAO Mingli
(China West Normal University,Key Laboratory of Southwest China Wildlife Resources Conservation,>Ministry of Education,Nanchong637009,China)
In order to understand the genetic diversity of synthetic hexaploid wheats,100 ISSR primers were used to detect the genetic diversity among 11 synthetic hexaploid wheats and three common wheat line (TP,HTS-1 and CS).The results indicated that 42 ISSR primers can be amplified clear bands,24 out of 42 primers had stronger ability to discriminate synthetic hexaploid wheats materials.All the 42 ISSR primers amplified 273 bands,per primer ranged from 3 to 12,with an average of 6.5.Among which 170 (62.3%) allelic variations were detected,the number of allelic variations per primer ranged from 1 to 11,with an average of 4.5.The value of allelic polymorphism information content (PIC) ranged from 0.499 to 0.879,on the average of 0.767 per primer,most of them over 0.800.The value of genetic similarity (GS) indexes of 14 materials based on the ISSR data varied from 0.663 to 0.934,with an average of 0.790.Cluster analysis showed that all of them in this study could be clustered into three groups,second group of which are more than any others.Cluster analysis revealed that genetic similarity of 14 materials were high,which suggested that the 14 materials had a near relationship.But overall the genetic diversity in the synthetic hexaploid wheats was relatively large.The cluster analysis also reflected the difference of pedigree and parental origin.All of these indicated that ISSR molecular marker technology can also be used to identification of breeds,evaluation of genetic diversity and construction of genetic maps in wheats.
Synthetic hexaploid wheats;Genetic diversity;ISSR;Cluster analysis
2016-03-20
国家自然科学基金项目(31301319;31540041)
罗琴(1991-),女,四川宜宾人,在读硕士,主要从事小麦遗传育种研究。
杨在君(1981-),男,四川南充人,副教授,博士,主要从事小麦遗传育种研究。
彭正松(1964-),男,四川南充人,教授,博士,主要从事小麦遗传育种研究。
S512.03
A
1000-7091(2016)04-0119-07
10.7668/hbnxb.2016.04.020
