番茄褪绿病毒CP基因克隆、序列分析及原核表达
2016-09-23迟胜起张剑峰
韩 磊,迟胜起,张剑峰
(青岛农业大学 农学与植物保护学院,山东 青岛 266109)
番茄褪绿病毒CP基因克隆、序列分析及原核表达
韩磊,迟胜起,张剑峰
(青岛农业大学 农学与植物保护学院,山东 青岛266109)
为制备番茄褪绿病毒(Tomatochlorosisvirus,ToCV)抗血清,以番茄病叶为试验材料,提取总RNA,根据ToCVCP基因设计特异性引物,利用RT-PCR方法克隆目的基因,构建原核表达载体pET32a-ToCVCP,在大肠杆菌Rosetta (DE3)菌株中表达CP蛋白。结果表明:ToCVCP基因(GenBank登录号:KT809400)全长774 bp,编码257个氨基酸,与GenBank中其他地区分离物核苷酸序列同源性为97.2%~99.6%,推导的氨基酸序列同源性为97.3%~100.0%。核苷酸序列保守位点占全部位点的91.3%,氨基酸序列保守位点占全部位点的88.3%,表明不同地理来源的番茄褪绿病毒的CP基因保守性较高。将ToCVCP基因克隆到原核表达载体pET-32a(+)上,并在体外条件下诱导表达出融合蛋白。SDS-PAGE分析表明,转 pET32a-ToCVCP载体的大肠杆菌Rosetta (DE3)菌株表达了分子量约33 kDa的重组蛋白。该重组蛋白在37 ℃,1.0 mmol/L IPTG、诱导6 h,表达量最大。
番茄褪绿病毒;外壳蛋白基因;原核表达;基因克隆
番茄褪绿病毒(Tomatochlorosisvirus,ToCV)往往能引起番茄老叶叶片黄化,叶边缘区域轻微卷曲,新生叶片起初没有症状,但随着病害的发展,叶脉间逐渐坏死,叶片变脆[1]。番茄褪绿病毒病发病初期与某些缺素症状相似,往往被认为是营养失调所致。1998年,该病毒在美国佛罗里达州首次发现[2],2004年在我国台湾首次发现并报道了ToCV[3],随后在国内多个省市的温室番茄植株上检测出了ToCV的发生[4-7]。
番茄褪绿病毒属于长线形病毒科(Closteroviridae)毛形病毒属(Crinivirus),其基因组为正义单链RNA分子,5′端有甲基化帽子结构,3′端无Ploy(A)尾巴[8]。不能通过汁液摩擦传播,可由粉虱传播。ToCV可以侵染茄科、菊科、藜科、苋科、番杏科、夹竹桃科及白花丹科等多种植物[9]。其中以茄科寄主数目最多,如:番茄[10]、甜椒[11]、马铃薯[12]等。单独或与其他病毒复合侵染,可造成严重的经济损失。
当前,国内对ToCV的鉴定多采用RT-PCR方法,未见应用血清学检测的报道,尚未发现有商用ELISA检测试剂盒,因此制备高纯度的ToCV抗血清十分必要。利用原核表达技术为基础制备抗血清,克服了通过提纯的病毒粒子为抗原制备抗血清的弊端,而且能够获得表达量大且特异性高的抗血清。本试验构建了原核表达载体pET32a-ToCVCP,并转化到大肠杆菌Rosetta (DE3)菌株中进行诱导表达,优化了原核表达条件,为制备ToCV高效价抗血清奠定了基础。
1 材料和方法
1.1试验材料
毒源采自山东省青岛市,由青岛农业大学病毒学实验室保存。试剂:大肠杆菌DH5α、大肠杆菌Rosetta(DE3)、质粒pET-32a(+)由本实验室保存;TaqDNA聚合酶、M-MLV反转录酶、T4DNA 连接酶、IPTG、RNAiso Plus、pMD18-T载体等购自TaKaRa公司;DNA回收试剂盒、质粒快速提取试剂盒购自北京鼎国生物技术有限公司;各种限制性内切酶购自Fermentas公司;其他试剂均为国产分析纯。
1.2引物设计
根据 GenBank 中 ToCVCP基因的序列,利用Primer Premier 5.0软件设计了一对特异性引物P1/P2,序列见表1。
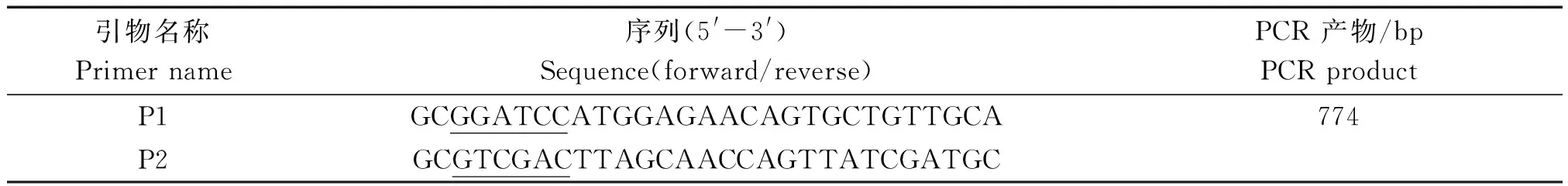
表1 引物信息
注:下划线处分别为BamH Ⅰ、SalⅠ酶切位点。
Note:The underlined wereBamH Ⅰ,SalⅠ endonuclease sites.
1.3总RNA提取
称取番茄病叶0.1 g,加液氮研磨成粉末,采用TaKaRa公司的RNAiso plus试剂提取总RNA,具体操作参考使用说明书。
1.4RT-PCR扩增
cDNA合成反应体系(10 μL):DEPC水3 μL、RNA模板2 μL、下游引物P2(10 μmol/L)0.5 μL,70 ℃保温10 min,立刻放置于冰上冷却2 min,再依次加入5×M-MLV Buffer 2 μL、dNTP Mixture(各2.5 mmol/L) 2 μL、M-MLV (200 U/μL) 0.25 μL、RNasin(40 U/μL) 0.25 μL。42 ℃保温1 h,70 ℃ 15 min,4 ℃ 5 min,-20 ℃保存备用。
PCR反应体系(25 μL):ddH2O 17 μL、10×PCR Buffer 2.5 μL、dNTP Mixture(各2.5 mmol/L) 2 μL、cDNA 2 μL、上游引物P1(10 μmol/L) 0.5 μL、下游引物P2(10 μmol/L) 0.5 μL、Taq酶(TaKaRa)(5 U/μL) 0.5 μL。扩增条件为94 ℃预变性3 min;循环参数:94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,循环30次;循环结束后72 ℃延伸10 min。取3 μL PCR产物经1.0%琼脂糖凝胶电泳检测,凝胶成像仪上观察结果。
1.5CP基因序列测定及分析
PCR产物经回收纯化后,与pMD18-T载体16 ℃过夜连接。将连接产物转化到DH5α感受态细胞中,通过菌液PCR筛选阳性克隆pMD18-ToCVCP,委托上海生工生物工程有限公司进行测序。序列与NCBI数据库进行Blast比对分析,用DNAMAN 6.0软件进行序列比对分析,并采用MEGA 5.1软件构建系统发育树。
1.6原核表达载体的构建和鉴定
用BamH Ⅰ和SalⅠ双酶切阳性重组质粒pMD18-ToCVCP和原核表达载体pET-32a(+)。然后在T4DNA 连接酶的作用下,构建重组表达载体pET32a-ToCVCP,转化大肠杆菌DH5α感受态细胞,经菌液PCR筛选阳性菌落,提取重组质粒,经酶切鉴定后送上海生工生物工程有限公司进行测序。
1.7CP蛋白原核表达及SDS-PAGE分析
将重组质粒pET32a-ToCVCP转入大肠杆菌Rosetta(DE3),挑取单菌落,接种至含100 μg/mL氨苄青霉素LB培养基中,37 ℃活化过夜,按1∶100比例接种于含氨苄青霉素的LB培养基中,37 ℃、200 r/min培养3~4 h,至OD600达到0.4~0.5时,分别加入不同浓度的(0.6,0.8,1.0,1.2 mmol/L)IPTG,继续培养。8 000 r/min 离心2 min收集菌体,加入适量的ddH2O悬浮,通过SDS-PAGE电泳检测表达情况。
2 结果与分析
2.1ToCVCP基因扩增及克隆
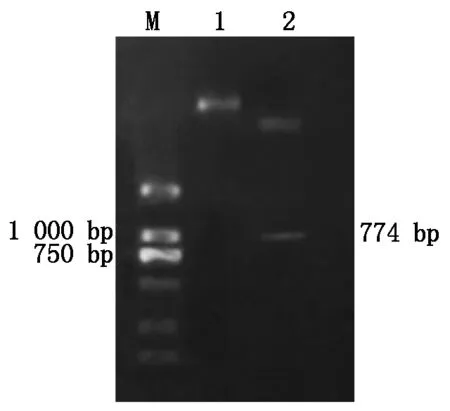
以总RNA为模板,利用特异性引物(P1/P2)进行RT-PCR扩增,得到了1条约774 bp 的特异性条带(图1)。将扩增出的目的片段回收纯化,与pMD18-T载体连接后委托上海生工公司测序。
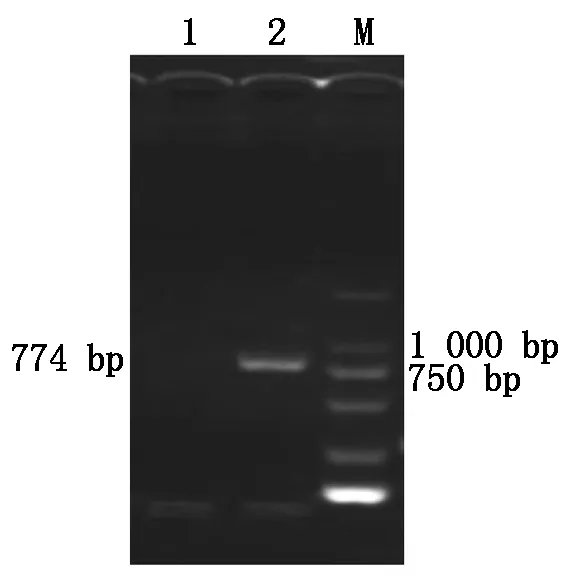
1.阴性对照;2.RT-PCR 产物;M.DL2000 Marker。
2.2ToCVCP基因的序列分析
克隆得到的ToCV青岛分离物CP基因(GenBank登录号:KT809400),片段全长774 bp,编码257个氨基酸,分子量约28 kDa。其中含有 227个A、210个T、149个C、188个G,各碱基在CP基因中的百分比分别是29.3%,27.1%,19.3%,24.3%(图2)。将获得的ToCVCP基因序列,进行Blast比对分析发现,各分离物间核苷酸序列的同源性为97.2%~99.6%。利用DNAMAN 6.0软件将ToCV青岛分离物与33个标明采集区域的ToCVCP基因序列分析对比后发现,保守位点707个,占全部位点的91.3%;变异位点67个,占全部位点的8.7%;没有缺失和插入。而且在整个开放阅读框中,3′端的同源性要好于5′端(图3)。将ToCV青岛分离物CP基因推导的氨基酸序列进行比对后发现,同源性为97.3%~100.0%,保守位点227个,占全部位点的88.3%;变异位点30个,占全部位点的11.7%。结果表明,不同地理来源的番茄褪绿病毒的CP基因保守性较高。
经Blast比对分析发现,ToCV青岛分离物CP基因核苷酸序列与GenBank中ToCV登录号分别为KP335046.1、KP217196.1、KP137099.1、KP114534.1、KC887999.1、AB513443.1(分别表示中国、中国、韩国、韩国、中国、日本分离物)的同源率最高,达99.6%。与DQ136146.1(西班牙分离物)的同源率最低,为97.2%。氨基酸序列与GenBank中ToCV登录号为YP293703.1(美国分离物)的同源性达100%。与AAZ77652.1(西班牙分离物)的同源率最低,为97.3%。采用MEGA 5.1软件用Neighbour-joining方法构建ToCVCP基因核苷酸序列系统发育进化树(图4)。从构建的系统发育进化树可以看出,中国、日本、美国、巴西、以色列、希腊、韩国等分离物在一个分支上,而西班牙、法国等分离物在另一个大的分支上。青岛地区分离物CP基因序列与中国、韩国、日本、美国距离较近,与巴西、以色列、希腊距离稍远。

图2 ToCV CP基因核苷酸序列
2.3原核表达载体的鉴定
重组质粒经菌液PCR鉴定后,得到了约为774 bp的特异性片段(图5)。回收纯化质粒,用BamH Ⅰ和SalⅠ双酶切阳性重组质粒pET32a-ToCVCP,酶切片段大小也为774 bp目的片段(图6),表明CP基因已连接至pET-32a(+)原核表达载体上。

图3 不同ToCV分离物CP基因核苷酸序列5′端和3′端比对
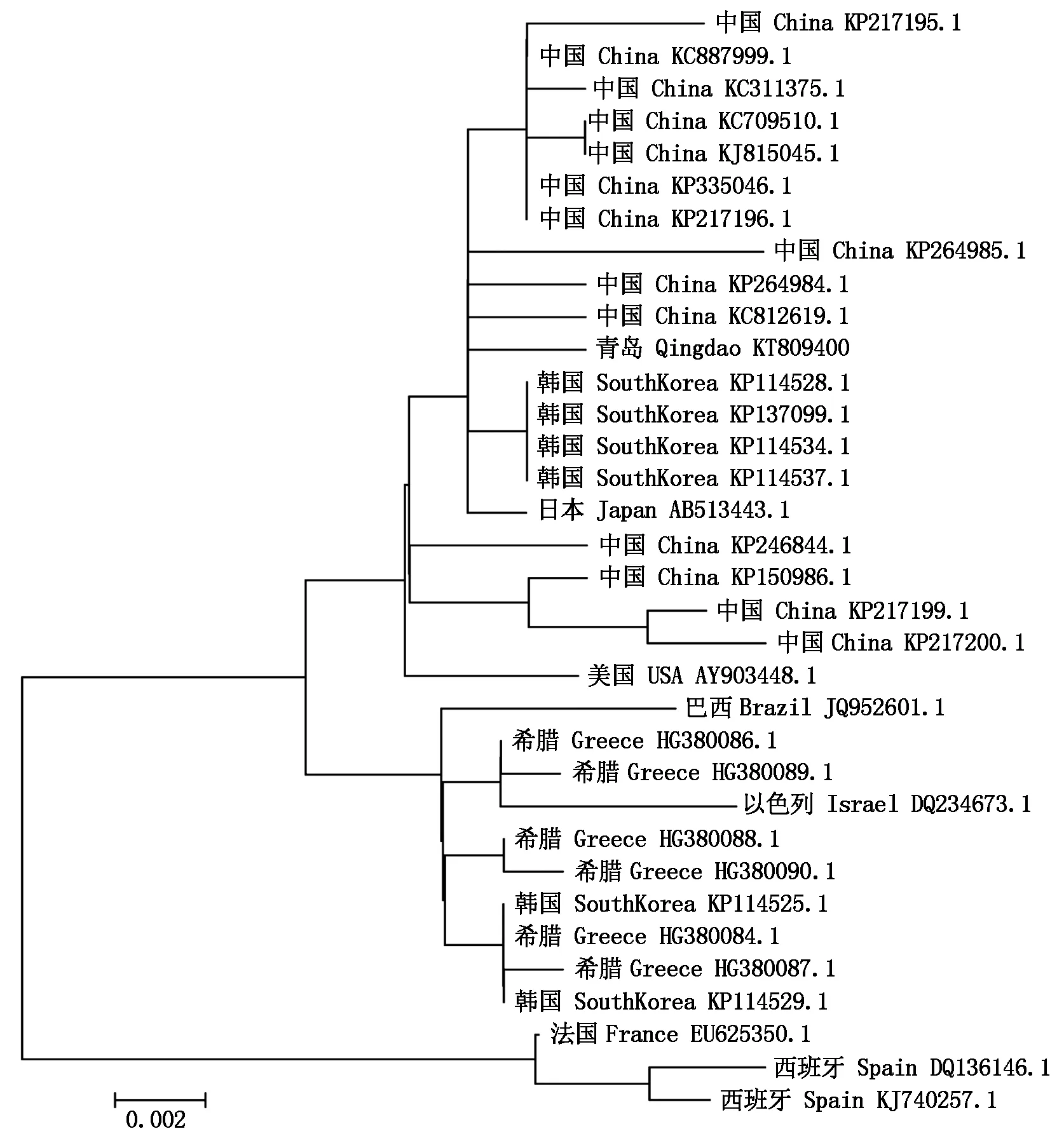
图4 ToCV青岛分离物与其他分离物CP基因核苷酸序列系统发育树
2.4体外诱导表达及SDS-PAGE分析
通过优化原核表达诱导条件,结果表明,1.0 mmol/L IPTG、37 ℃诱导6 h,重组质粒pET32a-ToCVCP在大肠杆菌Rosetta (DE3)菌株中的蛋白表达量最高。经SDS-PAGE电泳显示,在约33 kDa处诱导出一个特异性的融合蛋白,与预期大小基本一致(图7)。表明ToCVCP基因在Rosetta (DE3)菌株中得到了正确的表达。
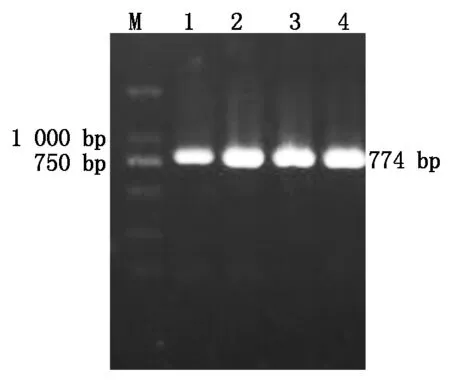
M.DL2000标记;1~4.PCR鉴定。
M.DL2000标记;1.pET32a-ToCVCP重组质粒;
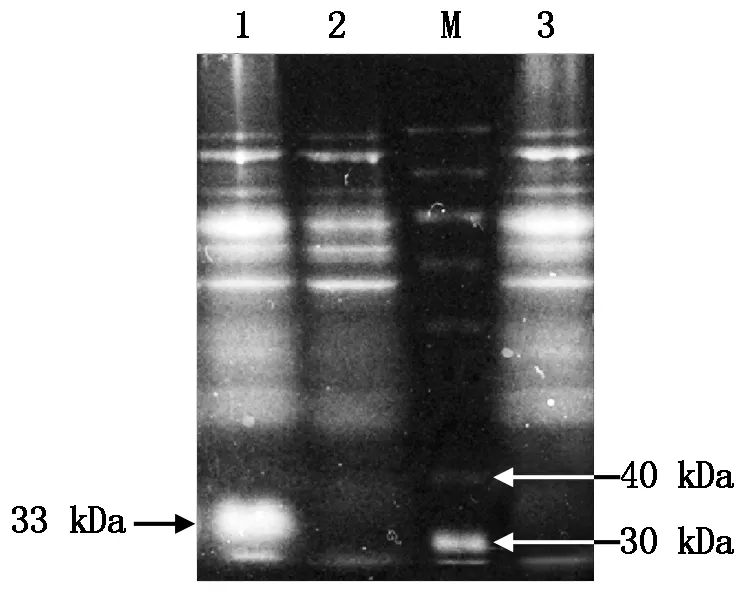
M.蛋白质Marker;1.IPTG诱导的重组载体;2.未经IPTG诱导的重组载体;3.经IPTG诱导的空载体。
3 讨论
病毒的外壳蛋白在寄主症状、病毒长距离和细胞间运输、病毒的介体传播、病毒的免疫原性等方面起着重要的作用。Adams等[13]报道,病毒的CP基因核苷酸序列变异情况能够反映出全基因组的变异情况。本试验利用RT-PCR方法成功克隆了ToCV的外壳蛋白基因,并在核酸水平进行了分析鉴定。结果表明,该序列大小为774 bp,编码257个氨基酸。ToCV病毒CP基因与 GenBank 中不同分离物核苷酸同源性为97.2%~99.6%,推导的氨基酸同源性为97.3%~100.0%,核苷酸保守位点占全部位点的91.3%。表明不同地理的番茄褪绿病毒的CP基因虽然存在差异,但整体有较高的保守性,且在整个开放阅读框中,3′端的同源性要好于5′端。其推导的氨基酸序列也具有相似的结论。构建的系统发育树表明,ToCV青岛地区分离物CP基因序列(GenBank登录号:KT809400)与中国、韩国、日本、美国等分离物的关系较近,说明该分离物或许源于上述国家。
血清学检测技术仍然是目前病毒检测中应用最为广泛的技术,具有简便、快速、批量检测样品等优点,其中制备高效价、特异性强的抗血清是关键的一步。传统的方法是利用提纯病毒粒子,以其作为抗原免疫动物,获得的抗血清中含有抗体。这种方法缺点是会引起非特异性反应,且大多数植物病毒粒子很难得到提纯。ToCV病毒能通过粉虱进行传播,而且在植物寄主上还能与多种病毒复合侵染,因此,通过提纯病毒粒子作为抗原制备抗体存在困难。目前,利用原核表达的方法,在大肠杆菌中诱导表达病毒外壳蛋白,以表达的融合蛋白作为抗原制备特异性抗体能达到很好的免疫效果[14]。Jacquemond等[15]成功应用血清学的检测技术检测ToCV。近年来,国内关于病毒检测方面的报道,如苹果茎沟病毒[16]、李矮缩病毒[17]、水稻黑条矮缩病毒[18]、番茄黑环病毒[19]、番茄黄化曲叶病毒[20]、黄瓜花叶病毒[21]、甘薯褪绿斑病毒[22],均采用了原核表达的方法获得抗原制备抗血清,因此,本试验克隆ToCV外壳蛋白基因,成功构建了原核表达载体,以37 ℃、1.0 mmol/L IPTG、诱导6 h条件下可获得高效表达的外壳蛋白,为制备ToCV特异性抗血清及其血清学检测的研究提供了参考依据。
[1]周涛,杨普云,赵汝娜,等.警惕番茄褪绿病毒在我国的传播和危害[J].植物保护,2014,40(5):196-199.
[2]Wisler G C,Li R H,Liu H Y,et al.Tomatochlorosisvirus:a new whitefly-transmitted,Phloem-limited,bipartite closterovirus of tomato[J].Phytopathology,1998,88(5):402-409.
[3]Tsai W S,Shih S L,Green S K,et al.First report of the occurrence ofTomatochlorosisvirusandTomatoinfectiouschlorosisvirusin Taiwan[J].Plant Disease,2004,88(3):311.
[4]Zhao R N,Wang R,Wang N,et al.First report ofTomatochlorosisvirusin China[J].Plant Disease,2013,97(8):1123.
[5]Karwitha M,Feng Zhike,Yao Min,et al.The complete nucleotide sequence of the RNA 1 of a Chinese isolate ofTomatochlorosisvirus[J].Journal of Phytopathology,2014,162(6):411-415.
[6]Zhao Liming,Li Gang,Gao Ying,et al.Molecular detection and complete genome sequences ofTomatochlorosisvirusisolates from infectious outbreaks in China[J].Journal of Phytopathology,2014,162(10):627-634.
[7]高利利,孙国珍,王勇,等.天津地区番茄褪绿病毒的分子检测和鉴定[J].华北农学报,2015,30(3):211-215.
[8]King A M,Adams M J,Carstens E B.Virus taxonomy:ninth report of the internationalcommittee on taxonomy of viruses[M].Amsterdam:Elsevier Academic Press,2011.
[9]Wintermantel W M,Wisler G C.Vector specificity,host range,and genetic diversity ofTomatochlorosisvirus[J].Plant Disease,2006,90(6):814-819.
[10]赵黎明,李刚,刘永杰,等.侵染番茄的番茄褪绿病毒山东泰安分离物的分子鉴定和序列分析[J].植物保护,2014,40(5):34-39.
[11]赵汝娜,王蓉,师迎春,等.侵染甜椒的番茄褪绿病毒的分子鉴定[J].植物保护,2014,40(1):128-130.
[12]Freitas D,Nardin I,Shimoyama N,et al.First report ofTomatochlorosisvirusin potato in Brazil[J].Plant Disease,2012,96(4):593-594.
[13]Adams M J,Antoniw J F,Fauquet C M.Molecular criteria for genus and species discrimination within the family Potyviridae[J].Archives of Virology,2005,150(3):459-479.
[14]王健华,王运勤,吉训聪,等.植物病毒检测技术研究进展[J].热带农业科学,2005,25(3):71-75.
[15]Jacquemond M,Verdin E,Dalmon A,et al.Serological and molecular detection ofTomatochlorosisvirusandTomatoinfectiouschlorosisvirusin tomato[J].Plant Pathology,2009,58(2):210-220.
[16]怀晓,周颖,张瑞,等.苹果茎沟病毒外壳蛋白基因的克隆、原核表达及抗血清制备[J].植物保护学报,2010,37(5):436-440.
[17]陈立伟,宗晓娟,王文文,等.李矮缩病毒外壳蛋白基因克隆及原核表达研究[J].中国农学通报,2012,28(12):177-181.
[18]宋云枝,姜雅元,毕吕杰,等.水稻黑条矮缩病毒外壳蛋白基因的克隆、原核表达及抗体制备[J].植物保护学报,2014,41(1):35-40.
[19]魏晓棠,李伟涛,陈宏,等.番茄黑环病毒外壳蛋白基因的克隆与原核表达[J].江西农业大学学报,2013,35(4):727-731.
[20]胡京昂,郭竞,崔杏春,等.番茄黄化曲叶病毒郑州分离物外壳蛋白基因的克隆与序列分析[J].河南农业科学,2013,42(9):87-90.
[21]田兆丰,裘季燕,丁翠珍,等.黄瓜花叶病毒番茄蕨叶分离物外壳蛋白基因的克隆和序列分析[J].华北农学报,2007,22(4):203-209.
[22]乔奇,秦艳红,张德胜,等.甘薯褪绿斑病毒外壳蛋白的分子变异及其特异抗血清制备[J].植物病理学报,2014,44(6):634-640.
Cloning,Sequence Analysis and Prokaryotic Expression of Coat Protein Gene ofTomatochlorosisvirus
HAN Lei,CHI Shengqi,ZHANG Jianfeng
(College of Agronomy and Plant Protection,Qingdao Agricultural University,Qingdao266109,China)
In order to prepare the special antiserum ofTomatochlorosisvirus(ToCV),the total RNA of tomato leaves infected with ToCV were extracted.According to the coat protein gene of ToCV,specific primers were designed to amplify the coding region of coat protein by RT-PCR,the prokaryotic expression vector pET32a-ToCVCPwas constructed and the recombinant protein was expressed inE.coliRosetta (DE3).The results showed that the ToCVCPgene(NCBI:KT809400)owned 774 bp nucleotides,encoding 257 amino acids.The similarity of nucleotide and predicted protein were 97.2%-99.6% and 97.3%-100.0%,respectively,compared with theCPgene of other ToCV isolates registered in GenBank.The nucleotide sequence of conserved sites accounted for 91.3% of all loci,the amino acid sequence conserved sites accounted for 88.3% of all loci,indicated that the geographical origin of different ToCVCPgene had a relative higher conservative property.The ToCVCPgene was subcloned into the expression vector pET-32a(+) and the fusion protein was expressedinvitro.SDS-PAGE analysis showed that a specific recombinant protein of approximately 33 kDa was produced in the Rosetta (DE3) with the prokaryotic expression vector pET32a-ToCVCPin 37 ℃with 1.0 mmol/L IPTG for 6 hours.
Tomatochlorosisvirus;Coat protein gene;Prokaryotic expression;Gene cloning
2016-06-11
山东现代农业产业技术体系薯类创新团队项目(SDAIT-10-011-06)
韩磊(1990-),男,山东枣庄人,在读硕士,主要从事植物病理学研究。
迟胜起(1970-),男,山东海阳人,副教授,博士,主要从事植物病理学研究。
张剑峰(1964-),男,内蒙古呼和浩特人,教授,博士,主要从事植物病理学研究。
Q78;S641.03
A
1000-7091(2016)04-0057-06
10.7668/hbnxb.2016.04.010
