两种拟南芥CBF2基因突变体的鉴定与分析
2016-09-23刘晓东焦彬彬代培红苏秀娟
刘晓东,刘 超,焦彬彬,代培红,苏秀娟,李 月
(1.新疆农业大学 农学院,新疆农业大学农业生物技术重点实验室,新疆 乌鲁木齐 830052;2.上海出入境检验检疫局,上海 200135)
两种拟南芥CBF2基因突变体的鉴定与分析
刘晓东1,刘超1,焦彬彬2,代培红1,苏秀娟1,李月1
(1.新疆农业大学 农学院,新疆农业大学农业生物技术重点实验室,新疆 乌鲁木齐830052;2.上海出入境检验检疫局,上海200135)
低温是主要的逆境胁迫之一,限制了作物的地理分布和产量。筛选理想的抗冻靶基因用于分子育种对于稳定农业生产具有重要意义。CBF调节子在植物抗冻反应中扮演主要的角色,CBF2是CBF调节子的组成成分之一,在抗冻反应中扮演负调控的作用。采用qRT-PCR和常规农艺性状测定法对2种CBF2基因突变体cbf2-1和cbf2-2进行了多项指标的鉴定,结果发现在这2种突变体中CBF2基因的表达存在不同程度的缺陷,cbf2-1中CBF2基因受低温诱导表达,但表达量与对照相比,明显下降;而cbf2-2中CBF2基因诱导表达的效应完全丧失。抗冻性检测结果显示CBF2基因的表达量越低,其突变体植株的抗冻性越强,同时冷胁迫后冷响应的下游基因表达量也越高,更重要的是,虽然这2种CBF2基因突变体抗冻性明显增强,但与野生型植株相比,其开花时间和单株种子产量并没有明显变化。以上结果表明CBF2是一种可以利用基因组编辑技术进行作物抗冻育种的理想候选靶基因,可以利用最新的基因组编辑技术进行作物抗冻育种研究。
拟南芥;CBF2;抗冻;负调控
低温显著地限制了植物的地理分布和生长季节,对作物的产量和品质产生不利影响。植物为了生存,在长期进化过程中产生了一套复杂的基于低温响应信号转导途径的调控机制,以增强自身的抗冻性。转录因子在逆境信号传导中起重要作用。其通过特定功能结构域结合下游抗逆基因的启动子,诱导或抑制目的基因表达,使植物在生理生化方面对逆境做出适应性调整,最终通过代谢调控,阻止细胞发生损伤,增强植物的抗逆性,包括抗冻性[1]。
DREB/CBF(Dehydration-responsive-element-binding protein/C-repeat binding factors )蛋白,属于APETALA2(AP2)转录因子家族,可识别下游调控基因启动子上的CRT/DRE(C-repeat/dehydration-responsive element)元件,进而调控靶基因的表达[2-3]。CBF通路是拟南芥抗冻调控机制中了解最清楚的一个途径[4-5],在抗冻反应中扮演主要的角色,也称CBF调节子[3]。该调节子包括3个转录因子基因,分别是CBF1、CBF2和CBF3[6],也分别称为DREB1b、DREB1c和DREB1a[3],这3个基因中任何一个过量表达都能改变上百个低温响应基因的表达,提高植物的抗冻性[7-9]。这3个基因在拟南芥基因组上以串联的方式连接在一起,在低温处理几分钟后就能被诱导表达[10-11]。然而他们自身的启动子上并不包含低温诱导的CRT/DRE元件[12]。到目前为止,CBF调节子提高抗冻性的分子机制并不完全清楚,已研究发现涉及抗冻蛋白基因的表达[13-14]和一系列低分子量冷冻保护剂的合成[15-17]。
拟南芥CBF1、CBF2和CBF3之间氨基酸序列相似性高达85%,而且这3个基因超表达后都能提高拟南芥的抗冻性[16],然而进一步研究发现,他们的功能并不相同。首先CBF1和CBF3受低温诱导表达的时间早于CBF2,而且发现CBF2负调控了CBF1和CBF3基因的表达[18],但CBF1或CBF3并没有负调控其他2个CBF基因;其次CBF1和CBF3功能缺陷突变体的抗冻性明显减弱,这与它们超表达后抗冻性增强的结果相呼应[12]。然而CBF2功能缺陷突变体cbf2的抗冻性却显著提高,并且发现可能是通过同时提高CBF1和CBF3基因的表达量增强了植物的抗冻性[17]。与CBF1或CBF3组成型过量表达结果不同的是,CBF1或CBF3过量表达后,植株的抗冻性明显提高但生长发育受到严重抑制[16,19-20],而cbf2突变体的抗冻性也显著提高,但植株正常的生长发育并没有受到任何明显影响[18]。上述研究结果揭示出CBF2在植物抗冻反应中的负调控功能。本试验鉴定了2种CBF2功能不同缺陷程度的突变体,进一步研究CBF2与植物抗冻性之间的关系以及在作物抗冻育种中的潜在价值。结果发现CBF2功能缺陷程度较高的突变体,植株的抗冻性更强,而且生长发育以及单株种子产量并没有受到明显影响。试验结果表明,CBF2可以作为作物抗冻育种的候选靶基因。
1 材料和方法
1.1试验材料
1.1.1植物材料野生型拟南芥(Arabidopsisthaliana,Columbia ecotype)为新疆农业大学农业生物技术重点实验室保存。CBF2(At4G25470)基因的T-DNA插入突变体Salk_009689和Salk_073208购自拟南芥资源中心(ArabidopsisBiological Resource Center)。
1.1.2生化试剂Easy Pure Plant Genomic DNA Kit、Easy Pure RNA Kit、TransScript First-Strand cDNA Synthesis SuperMix、TransStart Top Green qPCR SuperMix、EasyTaqDNA Polymerase、dNTP、DNA标准分子量均购自北京全式金生物技术有限公司,其他生化试剂均为国产分析纯。引物合成由上海杰李生物技术有限公司完成。
1.2试验方法
1.2.1植物培养将野生型Col-0和突变体拟南芥种子用6%次氯酸钠消毒5 min后,用无菌水清洗5次,播种到1/2MS 培养基中,于4 ℃黑暗处理3 d,然后转到22 ℃,14 h光照/10 h黑暗,光照强度6 000~8 000 lx的环境中培养7 d。将其移栽到蛭石∶泥炭土∶珍珠岩=6∶3∶1比例混合的培养土中继续培养。
1.2.2拟南芥AtCBF2突变纯合体的鉴定将拟南芥新鲜幼苗叶片置于液氮中研磨,按照Easy Pure Plant Genomic DNA Kit操作步骤提取叶片基因组DNA。根据http://signal.salk.edu/网站上查到Salk_009689和Salk_073208的T-DNA插入位点信息,设计基因特异引物LP和RP与T-DNA的LBal,引物序列见表1。以基因组DNA为模板,分别以LP1/RP1和LBal/RP为组合引物进行PCR扩增,以野生型Col-0和突变体拟南芥基因组DNA为模板,采用EasyTaqDNA聚合酶扩增,扩增为20 μL体系:ddH2O 14 μL、10×Easy Taq Buffer 2 μL、2.5 mmol/L dNTP 2 μL、10 μmol/L正反向引物各0.5 μL、模板0.5 μL、EasyTaqDNA聚合酶 0.5 μL。PCR反应条件为:94 ℃预变性3 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,35个循环后72 ℃延伸10 min,PCR产物在1%的琼脂糖凝胶电泳上检测有无目的条带。
1.2.3野生型拟南芥和CBF2突变纯合体低温胁迫后基因转录水平分析将在上述培养条件下生长20 d的野生型Col-0和突变体拟南芥幼苗,进行冷胁迫处理。处理方法为:拟南芥苗置于盛有水(4 ℃低温预冷)的大烧杯中,放置于4 ℃培养箱,持续光照。于上述处理的0,1,3,6,12,24 h采集叶片样品,迅速置于液氮冷冻,按照Easy Pure RNA Kit操作步骤提取RNA,按照TransScript First-Strand cDNA Synthesis SuperMix进行cDNA合成。利用http://www.idtdna.com/Scitools/Applications/Primerquest/在线引物设计软件进行基因qRT-PCR引物的设计,以拟南芥ACT2为内参基因(表1)。根据TransStart Top Green qPCR SuperMix 说明书操作,反应体系为cDNA 1 μL、10 μmol/L正反向引物各0.5 μL、Top Green qPCR Mix 10 μL、Passive Reference Dye 0.4 μL,超纯水补至20 μL。利用ABI7500实时定量PCR仪进行PCR扩增,反应条件为95 ℃ 30 s;95 ℃ 5 s,58 ℃ 30 s,72 ℃ 30 s,40个循环;72 ℃ 30 s。数据采用2-ΔΔCT法分析。以看家基因ACT2为内参进行校正比较,检测CBF2基因在低温处理0,4 h 2个时间点的表达水平,同时检测下游基因在0 ,1,3,6,12,24 h 6个时间节点的表达水平。
1.2.4拟南芥植株冷冻胁迫后苗期表型分析将在上述培养条件生长20 d的野生型Col-0和突变体拟南芥幼苗,置于可控低温培养箱中,参照文献[18]方法进行低温胁迫处理,然后植株转移到上述正常的生长条件,恢复生长7 d,统计成活率。
1.2.5拟南芥开花时间和单株种子量测定将同批种植的野生型和cbf2突变体植株移栽至土壤中继续生长,生长条件为22 ℃,14 h光照/10 h黑暗,记录各单株第1朵花开放的时间。另外种子开始成熟后1个月,以3株苗为1个样本,收集所有种子,然后在干燥箱中室温干燥7 d后,采用称重法测定单株种子量,设置3个重复,分析突变体种子量是否与野生型种子量存在差异。
1.2.6数据统计所有试验结果均为3次重复的平均值±标准误差。采用Microsoft Excel 2007软件对数据进行整理和方差分析;采用SPSS v19.0软件进行差异显著性检验。

表1 引物序列
2 结果与分析
2.1T-DNA插入纯合突变体的鉴定
根据TAIR(http://www.arabidopsis.org/)提供的信息,SALK_009689和SALK_073208突变体T-DNA的插入位点分别为CBF2基因转录起始位点上游180,30 bp的启动子区内(图1)。
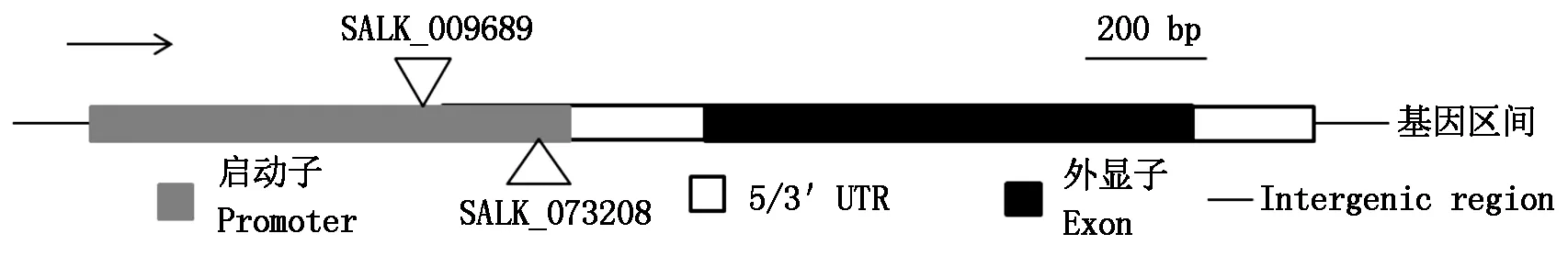
图1 拟南芥CBF2基因结构及其突变体示意图
使用http://signal.salk.edu/tdnaprimers.2.html提供的SALK_009689和SALK_073208 T-DNA插入位点两侧的正向引物SALK_009689-LP和SALK_073208-LP及反向引物SALK_009689-RP和SALK_073208-RP,以候选植株的基因组DNA为模板,进行PCR鉴定。若植株无T-DNA插入即野生型,突变体LP/RP引物可扩增出约1 000 bp的特异条带,若植株为插入纯合体,由于插入较大片段的T-DNA,超出了PCR的扩增能力,则无扩增条带,若植株为杂合体,LP/RP引物可以扩增出1 000 bp的DNA片段,同时用T-DNA边界引物LBa1和RP引物组合,会扩增出535~835 bp大小的DNA片段。
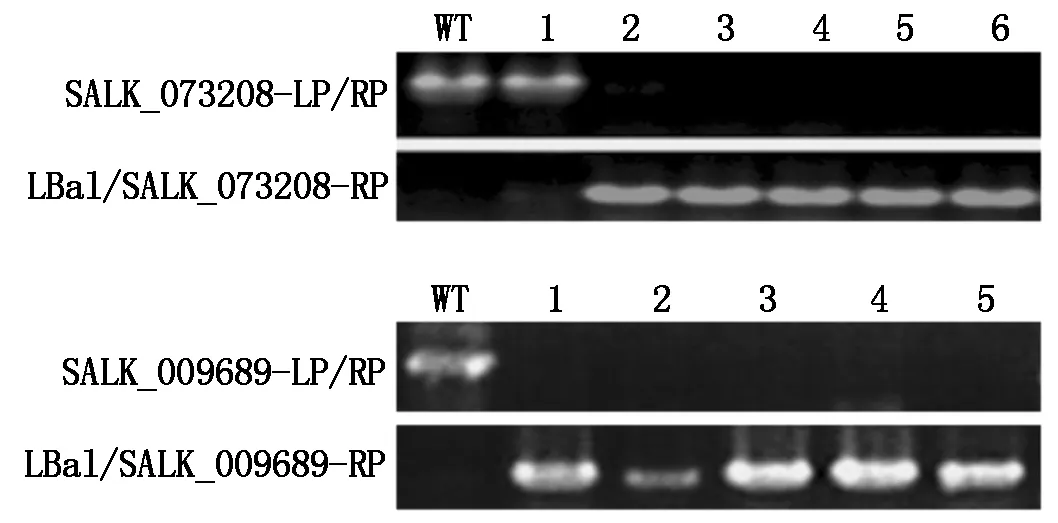
图2 SALK_073208和SALK_009689纯合突变体PCR鉴定
如图2所示为SALK_073208突变体的PCR鉴定结果是1号植株和野生型(WT)植株结果一致,即用LP/RP引物有扩增条带,而T-DNA边界引物LBa1/RP未扩增出条带,表明没有T-DNA插入。2,3,4,5,6号植株用LP/RP引物未扩增出目的条带,同时用T-DNA边界引物LBa1/RP扩增出目的片段,表明这5个植株为T-DNA插入纯合突变体。SALK_009689突变体PCR鉴定结果为5株苗均为T-DNA插入纯合突变体。SALK_009689和SALK_073208的纯合突变体分别命名为cbf2-1和cbf2-2。
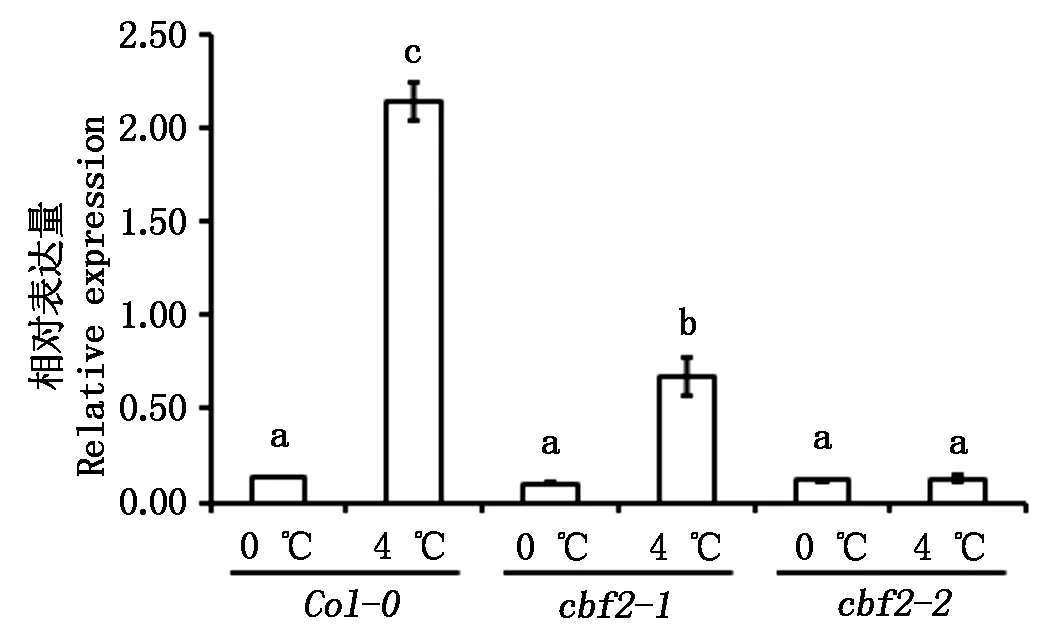
2.2纯合突变体中CBF2基因的表达
在基因启动子区域中插入一段T-DNA会影响基因表达水平下调或者不表达。为了检测CBF2基因在野生型拟南芥和纯合突变体中的表达情况,对这些植株进行了4 ℃低温胁迫处理,分别于0,4 h 2个时间点检测基因的表达。如图3所示,在正常生长条件下,CBF2基因在2种突变体与野生型拟南芥植株中均有低水平表达。在低温处理4 h时,野生型植株CBF2基因大量诱导表达,但在cbf2-1和cbf2-2突变体中CBF2基因的诱导表达水平显著降低,且在cbf2-2突变体中表达量下降最显著,与0 h基本一致。以上结果表明,启动子区T-DNA的插入抑制了CBF2基因的诱导表达,而cbf2-2突变体中CBF2基因的低温诱导表达效应基本丧失。
2.3拟南芥植株冷冻胁迫后苗期表型分析
Novillo等[18]发现CBF2基因突变后,植株的抗冻性显著增强。试验鉴定了2种CBF2基因T-DNA插入突变体,结果表明,这2种突变体导致CBF2基因的表达存在不同程度的缺陷。因此,与野生型一起,将CBF2基因3种不同表达量的遗传材料进行了进一步的抗冻表型分析。结果发现植株的抗冻性与CBF2基因的表达量呈现明显的负相关。随着基因表达量的逐渐减弱,抗冻性也显著增强(图4)。成活率的统计也进一步验证了表型的观察结果,野生型Col-0的成活率为50%,cbf2-1突变体成活率为70%,cbf2-2突变体成活率为91%,2种突变体的成活率均显著性高于野生型,而cbf2-2突变体的抗冻性显著高于cbf2-1(图4)。以上结果进一步证明了CBF2基因是一个抗冻负调控基因。
柱状图上的不同字母表示差异达到显著水平(P<0.05)。图4同。
2.4下游耐逆基因的表达分析
Novillo等[18]的研究结果还发现,CBF2基因突变后提高了下游一系列耐逆相关基因的表达。因此,cbf2-2突变体中这些耐逆基因的表达是否也显著高于cbf2-1。为此本试验挑选了4个耐逆基因COR15A、KIN1、DREB2A、LTI78进行了表达验证分析。将野生型和2种突变体材料于4 ℃处理,分别于0,1,3,6,12,24 h 6个时间节点采集叶片,提取RNA,进行qRT-PCR分析。结果如图5所示,这4个基因的表达趋势基本一致,即在0 ,1 ,3 h的表达量很低,在6 h后基因的表达量开始明显增加。2种突变体中上述4个耐逆基因的表达量都显著高于野生型,同时cbf2-2突变体中这些耐逆基因的表达高于cbf2-1。以上结果呈现出植株抗冻性与CBF2基因的表达量存在明显的负相关性。

图4 cbf2突变体植株抗冻性和成活率分析
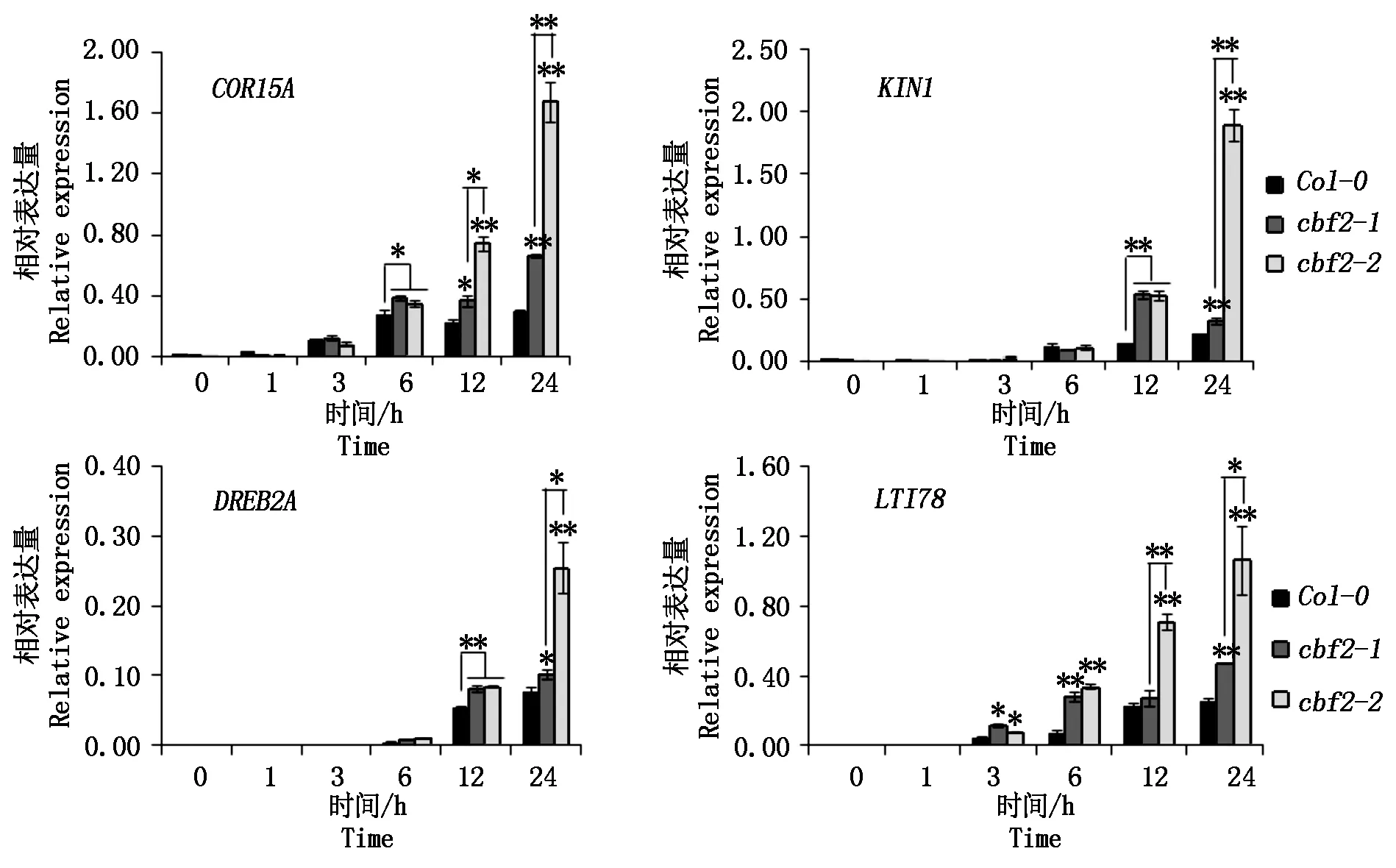
*.差异显著(P<0.05);**.差异极显著(P<0.01)。
2.5cbf2突变体开花时间和单株种子量测定
抗逆性的增加往往会抑制植株的各种生产性状[16-17],进而阻碍抗逆育种的推广应用。开花时间和单株种子产量是评价植株生产性状的2个重要指标,因此对这2个指标进行测定。结果显示,无论是开花时间还是单株种子量,cbf2突变体植株与野生型之间并没有明显差异。表明拟南芥cbf2基因突变后,开花时间和种子产量这2个重要性状都没有受到明显影响(图6)。

图6 cbf2突变体开花时间(A)和单株种子量(B)分析
3 讨论
DREB1/CBF转录因子广泛存在于各种植物中,除了拟南芥外,还包括具有冷适应能力的植物,如油菜和大麦;不具有冷适应能力的植物,如番茄和水稻,以及大豆、葡萄等[21]。在拟南芥基因组中有6个DREB1/CBF基因,分别命名为DREB1A/CBF3、DREB1B/CBF1、DREB1C/CBF2、DREB1D/CBF4、DDF1/DREB1F和DDF2/DREB1E。其中只有CBF1、CBF2和CBF3 这3个基因受低温胁迫高水平诱导表达[3,10],它们组成一个CBF调节子,开启了一系列与低温适应有关基因的表达,这些基因的启动子包含有CRT/DRE元件。其中CBF1和CBF3基因的过量表达都能增强植物的抗冻性,同时其对应的功能缺陷突变体都表现出抗冻性减弱。不仅如此组成型表达CBF1或CBF3的转基因植株还表现出对干旱和高盐胁迫的耐受性[22]。由于CBF1和CBF3对多种逆境抗性的功能表现,因此DREB1/CBF基因在各种植物中被广泛克隆,同时也被广泛地用于各种作物抗逆性的遗传改良[21]。然而组成型表达CBF1和CBF3基因,却常常导致植株发育迟缓,生长不正常,并严重地影响了DREB1/CBF基因在育种中的应用。随后的研究发现使用诱导型启动子,可以有效减弱组成型表达所带来的负面效应[22]。但是由于转基因所产生的生物安全性问题引起社会极大的争议,严重地阻碍了转基因作物,尤其是转基因粮食作物的市场推广。
在植物体内有许多调控抗逆性的基因,除目前普遍使用的正调控基因外,还存在一些负调控基因,这些基因突变,功能丧失后,植物的抗逆性也明显增强,如ERA1[23]、ASG2[24]、SAD1[25]、GGB[26]和DST[27]等,而且一些突变体的生长发育与野生型相比并没有明显改变,其中CBF2就属于这类基因。研究发现CBF2基因的突变,显著提高了CBF1和CBF3基因的表达,并且被定时定量地控制,且没有一直持续地高水平表达,这样低温来袭时,既提高了抗冻相关基因的表达,又有效地避免了由此带来的副作用,植物的生长发育没有受到明显抑制[18]。本研究鉴定了2种在CBF2基因启动子区存在T-DNA插入的纯合突变体。T-DNA在启动子区的插入显著抑制了CBF2基因的诱导表达,其中在cbf2-2突变体中,CBF2基因的诱导表达效应几乎完全丧失。通过对这2种CBF2功能不同缺陷程度的突变体研究发现,植株的抗冻性与CBF2基因表达量呈明显的负相关,CBF2基因表达量越弱,其植株的抗冻性越强,而且下游相关抗冻功能基因的表达也越高。更重要的是,这2种突变体抗冻性增强但植株开花时间和单株种子产量并没有受到明显改变,即使是cbf2-2突变体也是如此。开花时间和单株种子产量是农作物的2个重要农艺性状,因此以上结果暗示着CBF2可以作为作物抗冻育种的候选理想靶基因。
在大多数作物中都存在CBF的同源基因[21],其中是否也拥有CBF调控子结构,是否也存在这种抗冻负调控基因。因此,有必要进一步开展相关的研究工作,克隆作物中可能存在CBF2类的抗冻负调控基因,然后通过基因功能互补分析,验证筛选出对应的抗冻负调控基因,最后采用基因组编辑技术[28]敲除该基因并验证其抗逆功能,创制出具有更高抗冻能力且其他农艺性状正常的植株,为作物抗冻育种提供优良的亲本材料。同时可以有效避免转基因育种面临的生物安全性评价和生产监管问题[29]。
[1]Pagter M,Arora R.Winter survival and deacclimation of perennials under warming climate:physiological perspectives[J].Physiologia Plantarum,2013,147(1):75-87.
[2]Zhao C,Lang Z,Zhu J K.Cold responsive gene transcription becomes more complex[J].Trends in Plant Science,2015,20(8):466-468.
[3]Park S,Lee C M,Doherty C J,et al.Regulation of the arabidopsis CBF regulon by a complex low-temperature regulatory network[J].The Plant Journal:for Cell and Molecular Biology,2015,82(2):193-207.
[4]Thomashow M F.Molecular basis of plant cold acclimation:insights gained from studying the CBF cold response pathway[J].Plant Physiology,2010,154(2):571-577.
[5]Knight M R,Knight H.Low-temperature perception leading to gene expression and cold tolerance in higher plants[J].The New Phytologist,2012,195(4):737-751.
[6]Mckhann H I,Gery C,Berard A,et al.Natural variation in CBF gene sequence,gene expression and freezing tolerance in the Versailles core collection ofArabidopsisthaliana[J].BMC Plant Biology,2008,8:105.
[7]Fowler S,Thomashow M F.Arabidopsis transcriptome profiling indicates that multiple regulatory pathways are activated during cold acclimation in addition to the CBF cold response pathway[J].The Plant Cell,2002,14(8):1675-1690.
[8]Maruyama K,Sakuma Y,Kasuga M,et al.Identification of cold-inducible downstream genes of the Arabidopsis DREB1A/CBF3 transcriptional factor using two microarray systems[J].Plant Journal,2004,38(6):982-993.
[9]Vogel J T,Zarka D G,Van buskirk H A,et al.Roles of the CBF2 and ZAT12 transcription factors in configuring the low temperature transcriptome of Arabidopsis[J].The Plant Journal:for Cell and Molecular Biology,2005,41(2):195-211.
[10]Gilmour S J,Zarka D G,Stockinger E J,et al.Low temperature regulation of the Arabidopsis CBF family of AP2 transcriptional activators as an early step in cold-induced COR gene expression[J].Plant Journal,1998,16(4):433-442.
[11]Medina J,Bargues M,Terol J,et al.The arabidopsis CBF gene family is composed of three genes encoding AP2 domain-containing proteins whose expression is regulated by low temperature but not by abscisic acid or dehydration[J].Plant Physiology,1999,119(2):463-470.
[12]Novillo F,Medina J,Salinas J.Arabidopsis CBF1 and CBF3 have a different function than CBF2 in cold acclimation and define different gene classes in the CBF regulon[J].Proceedings of the National Academy of Sciences of the United States of America,2007,104(52):21002-21007.
[13]Steponkus P L,Uemura M,Joseph R A,et al.Mode of action of the COR15a gene on the freezing tolerance of Arabidopsis thaliana[J].Proceedings of the National Academy of Sciences of the United States of America,1998,95(24):14570-14575.
[14]Hughes S L,Schart V,Malcolmson J A,et al.The importance of size and disorder in the cryoprotective effects of dehydrins[J].Plant Physiology,2013,163(3):1376-1386.
[15]Cook D,Fowler S,Fiehn O,et al.A prominent role for the CBF cold response pathway in configuring the low-temperature metabolome of Arabidopsis[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(42):15243-15248.
[16]Gilmour S J,Fowler S G,Thomashow M F.Arabidopsis transcriptional activators CBF1,CBF2,and CBF3 have matching functional activities[J].Plant Molecular Biology,2004,54(5):767-781.
[17]Kaplan F,Kopka J,Sung D Y,et al.Transcript and metabolite profiling during cold acclimation of Arabidopsis reveals an intricate relationship of cold-regulated gene expression with modifications in metabolite content[J].The Plant Journal:for Cell and Molecular Biology,2007,50(6):967-981.
[18]Novillo F,Alonso J M,Ecker J R,et al.CBF2/DREB1C is a negative regulator of CBF1/DREB1B and CBF3/DREB1A expression and plays a central role in stress tolerance in Arabidopsis[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(11):3985-3990.
[19]Gilmour S J,Sebolt A M,Salazar M P,et al.Overexpression of the arabidopsis CBF3 transcriptional activator mimics multiple biochemical changes associated with cold acclimation[J].Plant Physiology,2000,124(4):1854-1865.
[20]Jaglo-ottosen K R,Gilmour S J,Zarka D G,et al.Arabidopsis CBF1 overexpression induces COR genes and enhances freezing tolerance[J].Science,1998,280(5360):104-106.
[21]Akhtar M,Jaiswal A,Taj G,et al.DREB1/CBF transcription factors:their structure,function and role in abiotic stress tolerance in plants[J].Journal of Genetics,2012,91(3):385-395.
[22]Li Feng,Han Yangyang,Feng Yanan,et al.Expression of wheat expansin driven by the RD29 promoter in tobacco confers water-stress tolerance without impacting growth and development[J].Journal of Biotechnology,2013,163(3):281-291.
[23]Manmathan H,Shaner D,Snelling J,et al.Virus-induced gene silencing of Arabidopsis thaliana gene homologues in wheat identifies genes conferring improved drought tolerance[J].Journal of Experimental Botany,2013,64(5):1381-1392.
[24]Dutilleul C,Ribeiro I,Blanc N,et al.ASG2 is a farnesylated DWD protein that acts as ABA negative regulator in Arabidopsis[J].Plant,Cell & Environment,2016,39(1):185-198.
[25]Daszkowska-golec A,Wojnar W,Rosikiewicz M,et al.Jarmolowski a.arabidopsis suppressor mutant of abh1 shows a new face of the already known players:ABH1(CBP80)and ABI4-in response to ABA and abiotic stresses during seed germination[J].Plant Molecular Biology,2013,81(1/2):189-209.
[26]Johnson C D,Chary S N,Chernoff E A,et al.Protein geranylgeranyltransferase I is involved in specific aspects of abscisic acid and auxin signaling in Arabidopsis[J].Plant Physiology,2005,139(2):722-733.
[27]Cui Longgang,Shan Junxiang,Shi Min,et al.DCA1 Acts as a transcriptional co-activator of DST and contributes to drought and salt tolerance in rice[J].PLOS Genetics,2015,11(10):e1005617.
[28]Chen Kunling,Gao Caixia.Targeted genome modification technologies and their applications in crop improvements[J].Plant Cell Reports,2014,33(4,SI):575-583.
[29]Huang Sanwen,Weigel D,Beachy R N,et al.A proposed regulatory framework for genome-edited crops[J].Nature Genetics,2016,48(2):109-111.
Analysis and Identification of Two CBF2 Gene Mutants in Arabidopsis
LIU Xiaodong1,LIU Chao1,JIAO Binbin2,DAI Peihong1,SU Xiujuan1,LI Yue1
(1.College of Agronomy,Xinjiang Agricultural University,Key Laboratory of Agricultural Biological Technology,Urumqi830052,China;2.Shanghai Entry-Exit Inspection and Quarantine Bureau,Shanghai200135,China)
Cold stress is one of the major abiotic stress,which limits the geographical distribution and yield of crops.CBF regulon plays a major role in freezing tolerance.CBF2,one of the components of the CBF regulon,has a negative role in freezing tolerance.In this study,two SALK mutants whose T-DNA insertion are both within the promoter ofCBF2 gene,cbf2-1 andcbf2-2 were identified by qRT-PCR method.Results showed that the level ofCBF2 gene expression in the two mutants reduced.CBF2 gene expression was induced by low temperature incbf2-1 mutnat.However,the degree of induction was lower incbf2-1compared with the control.The effect of induction by low temperature was lost incbf2-2.Analysis of freezing tolerance showed that the less degree of induction,the stronger freezing tolerance of plants and the higher the expression of downstream cold-responsive genes.More important thing was that although freezing resistance of the twoCBF2 gene mutants were improved,their flowering time and seed yield per plant did not change significantly compared with the wild type plants.All the results indicate thatCBF2 may be an ideal candidate target gene for crop breeding of freezing tolerance by genome editing technology.
Arabidopsis;CBF2;Freezing tolerance;Negative regulation
2016-03-20
国家自然科学基金项目(31470289)
刘晓东(1975-),男,新疆乌鲁木齐人,副教授,博士,主要从事植物抗逆分子生物学研究。
李月(1984-),女,河南许昌人,讲师,博士,主要从事棉花分子生物学研究。
Q78
A
1000-7091(2016)04-0019-07
10.7668/hbnxb.2016.04.004
