大豆疫霉病拮抗内生真菌的鉴定与筛选
2016-09-23刘永政孙立杰宋佳宇张玉琦赵静博肖佳雷
刘永政,边 爽,孙立杰,宋佳宇,董 慧,张玉琦,赵静博,肖佳雷
(东北农业大学生命科学学院,黑龙江哈尔滨 150030)
接下表
大豆疫霉病拮抗内生真菌的鉴定与筛选
刘永政,边 爽,孙立杰,宋佳宇,董 慧,张玉琦,赵静博,肖佳雷*
(东北农业大学生命科学学院,黑龙江哈尔滨 150030)
[目的]筛选出拮抗致病大豆疫霉的真菌菌株,为深入研发生物菌剂提供依据。[方法]采用平板对峙法测定40 株野生大豆真菌对疫霉菌的抑制作用。[结果]供试的40 株菌株,不同菌株间菌落型态差异较大。从光滑程度分析,36份菌落表面不光滑,3份表面光滑并显浅黄色;从菌落颜色分析,正面以白色为主,其次是黄色和粉色;反面则以紫色为主,其次为黑色和绿色;从菌落生长型态分析,大多数菌落呈白色絮状突起或羊毛状菌丝;11株野生大豆内生真菌的抑菌率变化幅度为62%~81%,80%以上共1株Y4-S(Ⅰ),75%~80%共2株,70%~75%共3株,其余5株均低于70%。抑菌率从大到小依次为Y4-S(Ⅰ)、Y5-r(Ⅱ)-1、Y6R-15-1、Y1-r-3和Y5R4、Y6S-26、Y5LB、Y5r-12、Y2-5(Ⅱ)、Y2-S、Y5R18-2-1。 [结论]最强拮抗菌株Y4-S(Ⅰ)、Y5-r(Ⅱ)-1、Y6R-15-1显微型态相似,呈枝状,有隔,初步判断可能来源同一属,具体属种需要进一步判断。
大豆疫霉病;野生大豆;内生真菌;拮抗菌株
大豆疫霉根腐病是严重影响世界大豆生产的毁灭性病害之一[1-2]。该病害危害面积大,毁灭性强,每年使大豆减产10%左右,且严重降低大豆的品质[3]。目前,由于大豆疫霉具有很高的小种变异性,单一抗性品种的有效期短,对大豆疫霉根腐病的危害不能达到较高的防治效果;化学防治杀菌剂不能对所有的小种有效,农药残留大、污染环境;各种栽培措施虽可减轻损失但不能完全控制该病害[4]。采用微生物菌剂,研发生物农药的生物防治则是目前解决大豆疫霉病的重要措施。野生大豆内生真菌相对于栽培大豆附生内生真菌具有更稳定的生存环境,具有丰富的抗逆资源,因此,把拮抗性野生大豆内生真菌作为生防菌及外源基因载体更易于发挥作用,创造出新的可利资源[5-6]。鉴于此,笔者选用原生境野生大豆中分离的40株内生真菌,采用平板对峙法进行了大豆疫霉病的拮抗内生真菌菌株鉴定与筛选,以期为研发生物菌剂提供重要的内生真菌资源。
1 材料与方法
1.1材料
1.1.1供试菌株。 大豆疫霉病菌为生理1号小种,由东北农业大学大豆研究所提供;野生大豆内生真菌40株,由东北农业大学生命科学学院植物生物工程研究室提供,主要分布黑龙江省不同区、市及县,菌株名称及来源见表1。
1.1.2培养基。PDA培养基:马铃薯 200 g,葡萄糖 20 g,琼脂 20 g,蒸馏水1 L,pH 7.0。将土豆去皮切成小块,用蒸馏水煮沸30 min,经纱布过滤,收集滤液,将称量好的蔗糖加入,用搅拌器搅拌均匀,加入定量的稀释好的含有蔗糖的土豆汁,121 ℃、0.1 kPa灭菌20 min。
加富 PDA培养基:马铃薯块 200 g,葡萄糖 10 g,牛肉膏3 g,蛋白胨5 g,氯化钠5 g,磷酸二氢钾2 g,硫酸镁1 g,琼脂20 g,蒸馏水1 L,pH 7.0。
1.2方法
1.2.1菌株活化。将得到的内生真菌接种到PDA平板培养基上,于26 ℃下培养,24 h后开始不断观察直到有明显的菌落形态,及时进行照片记录和菌落形态描述(包括菌落颜色、菌丝形态等一系列特征)。真菌菌落外观形态特征采集采用日本佳能 60D相机(18~200 mm IS),技术参数为:APS-C规格数码单反,1 800万有效像素,10倍光学变焦。
1.2.2对峙试验。采用平板对峙法检测野生大豆内生真菌对病原真菌的拮抗效果。第1步,筛选对病原真菌有拮抗作用的菌株,挑取内生真菌菌丝接种于平板中央,然后将4种不同的致病真菌接种于四周,28 ℃黑暗培养5 d。观察有无拮抗作用。第2步,检测具有拮抗作用的内生真菌对病原真菌作用的强弱,挑取病原真菌接种于中央,内生真菌接种于两侧,28 ℃黑暗培养5 d后测量抑菌圈大小[7]。
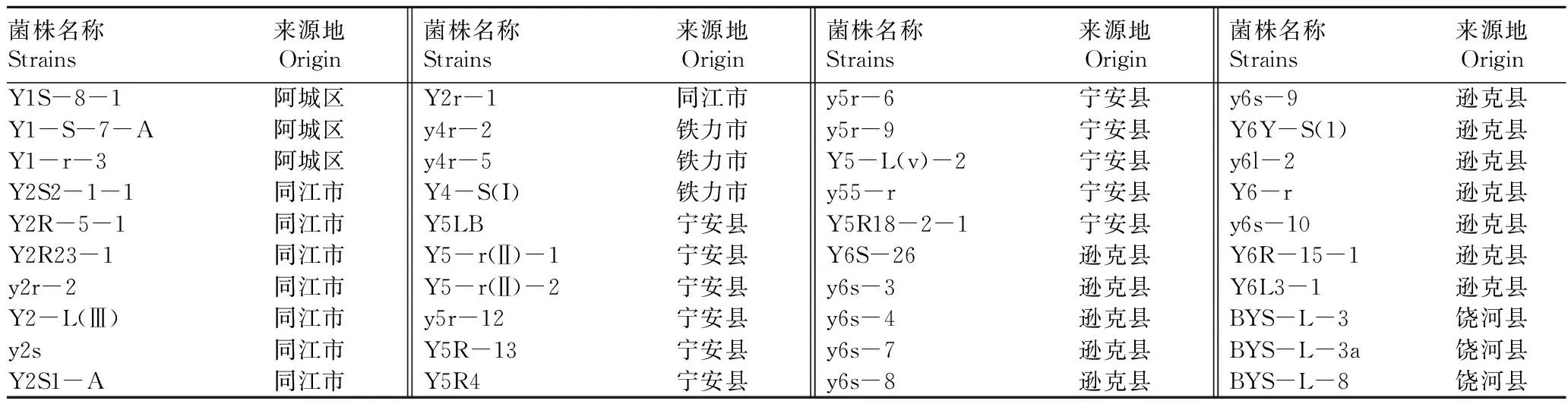
表1 野生大豆内生真菌名称及来源
1.2.3指标测定。
1.2.3.1抑菌圈直径。在对峙法中形成明显抑菌现象后,测量两菌落中心连线上病原菌的菌落直径,求各重复的平均值,以此评价拮抗菌对各个被测菌的抑菌效果。
1.2.3.2拮抗菌株直径。垂直于大豆内生真菌中心连线上的病原菌落直径,求各重复的平均值,以此作为对照病原菌的菌落直径。
1.2.3.3抑菌率。拮抗真菌对于病原菌的拮抗程度。抑菌率=(对照病原菌的菌落直径-处理病原菌的菌落直径) /对照病原菌的菌落直径[8]。
1.2.4显微观察。 将挑选出的具有拮抗效果的内生真菌进行继代培养。接种活化的对应内生真菌到PDA平板上,26 ℃下培养3~4 d,将灭过菌的载玻片斜插入到已活化菌株平板的培养基上,26 ℃下培养48 h,让菌丝自然爬到载玻片上后取出载玻片进行显微观察。应用正立生物显微镜Axioskop 2 plus FL(德国蔡司公司),在40倍放大倍数下观察菌丝形态。
2 结果与分析
2.1不同内生真菌菌落特征表2统计分析表明,不同菌株间菌落型态差异较大。从光滑程度分析,40份材料中有36份菌落表面不光滑,3份表面光滑并显浅黄色,1份污染;从菌落颜色分析,正面以白色为主,其次为黄、粉色;反面则以紫色为主,其次为黑、绿色;从菌落生长型态分析,大多数菌落呈白色絮状突起或羊毛状菌丝。菌株Y2-L(Ⅲ)和y6s-8表面分泌浅黄色蜡状物质,疑是油,具体成分待定。
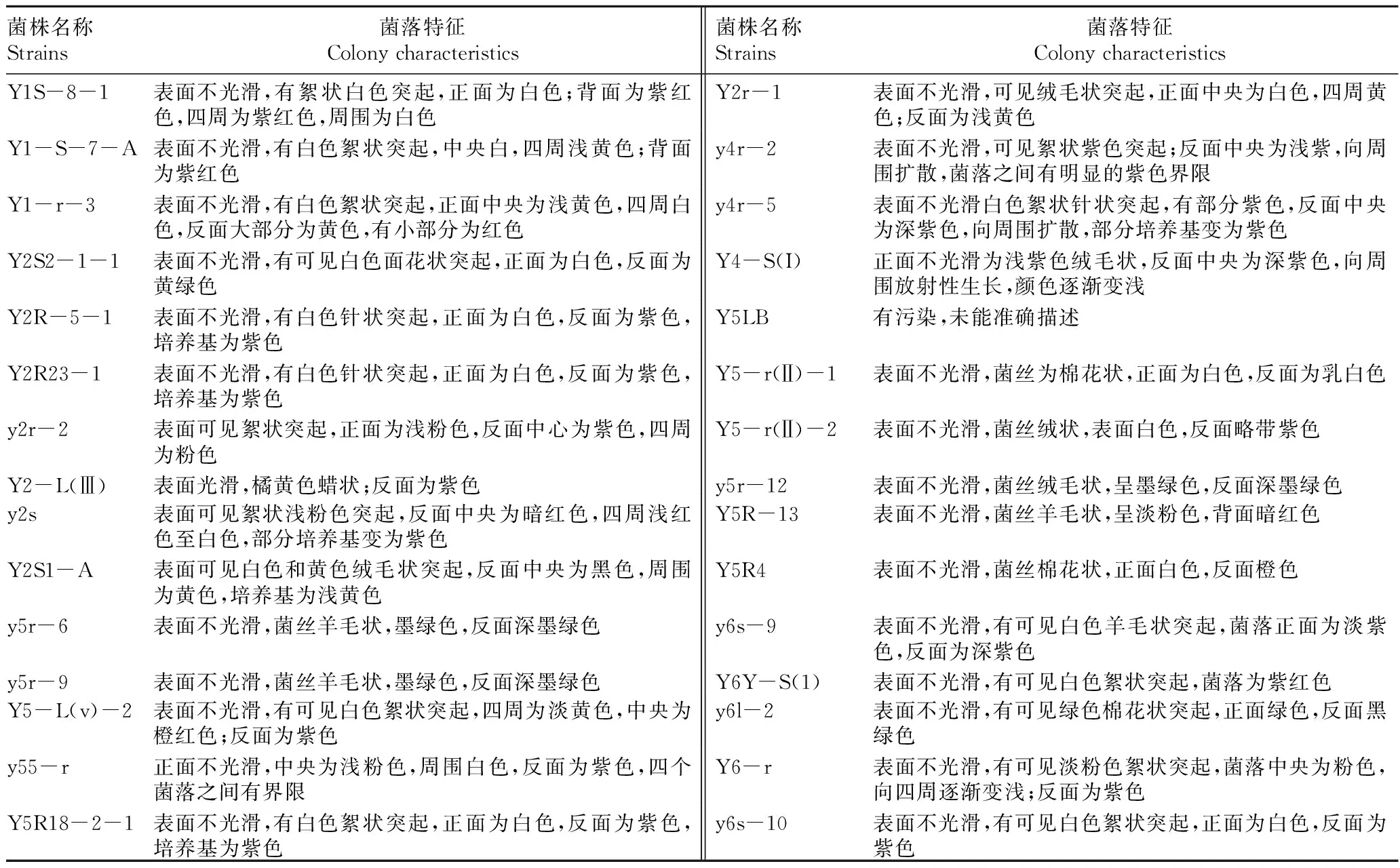
表2 不同菌株菌落型态特征统计
接下表
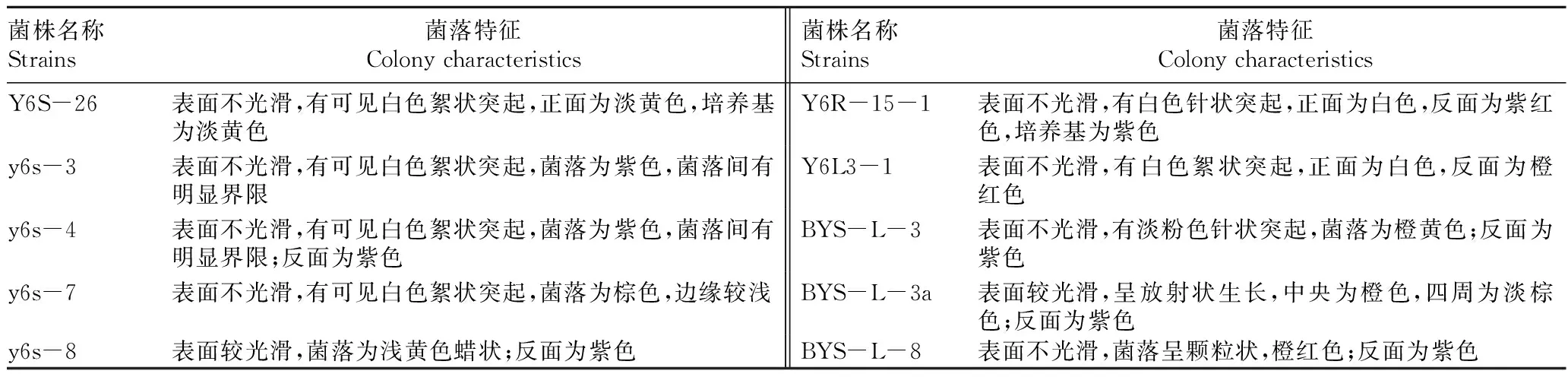
续表2
2.2大豆疫霉病拮抗内生真菌菌株鉴定与筛选将40株已活化的内生真菌分别接种了单对排布的对峙培养基,共有11种表现出了对大豆疫霉的拮抗作用。表3表明,11株野生大豆内生真菌的抑菌率变化幅度为62%~81%,80%以上共1株Y4-S(Ⅰ),75%~80%共2株,70%~75%共3株,其余5株均低于70%。抑菌率从大到小依次为Y4-S(Ⅰ)、Y5-r(Ⅱ)-1、Y6R-15-1、Y1-r-3和Y5R4、Y6S-26、Y5LB、Y5r-12、Y2-5(Ⅱ)、Y2-S、Y5R18-2-1。从来源地分析,牡丹江宁安县野生大豆内生真菌具有拮抗功能的菌株较多,其次为同江市和逊克县,进一步表明黑龙江省大豆主产区的野生大豆具有较好的抗大豆疫霉病作用。
2.3拮抗菌株的菌落特征及显微观察图1表明,3株具有拮抗作用野生大豆内生真菌不仅来源地不同,而且来自于野生大豆的不同器官。Y4-S(Ⅰ)菌株分离器官为叶片,菌落正面不光滑,为浅紫色绒毛状,反面中央为深紫色,向周围放射性生长,颜色逐渐变浅;Y5-r(Ⅱ)-1菌株分离器官根,表面不光滑,菌丝为棉花状,正面为白色,反面为乳白色;Y6R-15-1分离器官茎,表面不光滑,有白色针状突起,正面为白色,反面为紫红色,培养基为紫色。显微结构分析,3株拮抗内生真菌的型态相似,呈枝状、有隔,初步判断可能来源统一属,具体属种需要进一步判断。
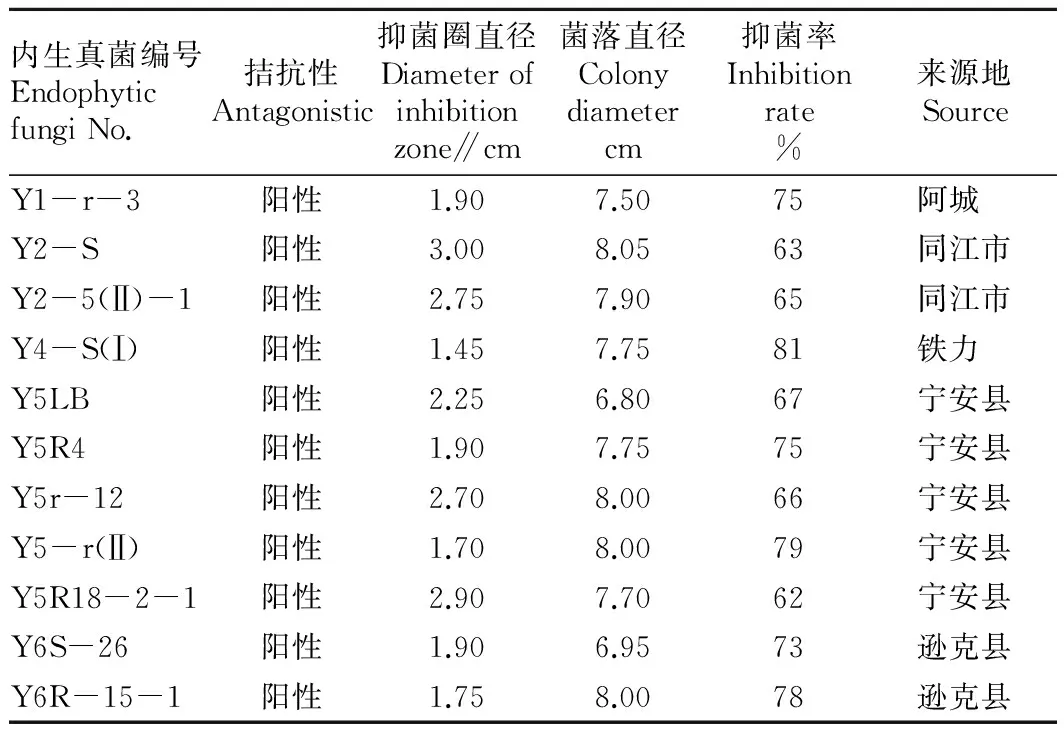
表3 拮抗菌株的相关测量数据
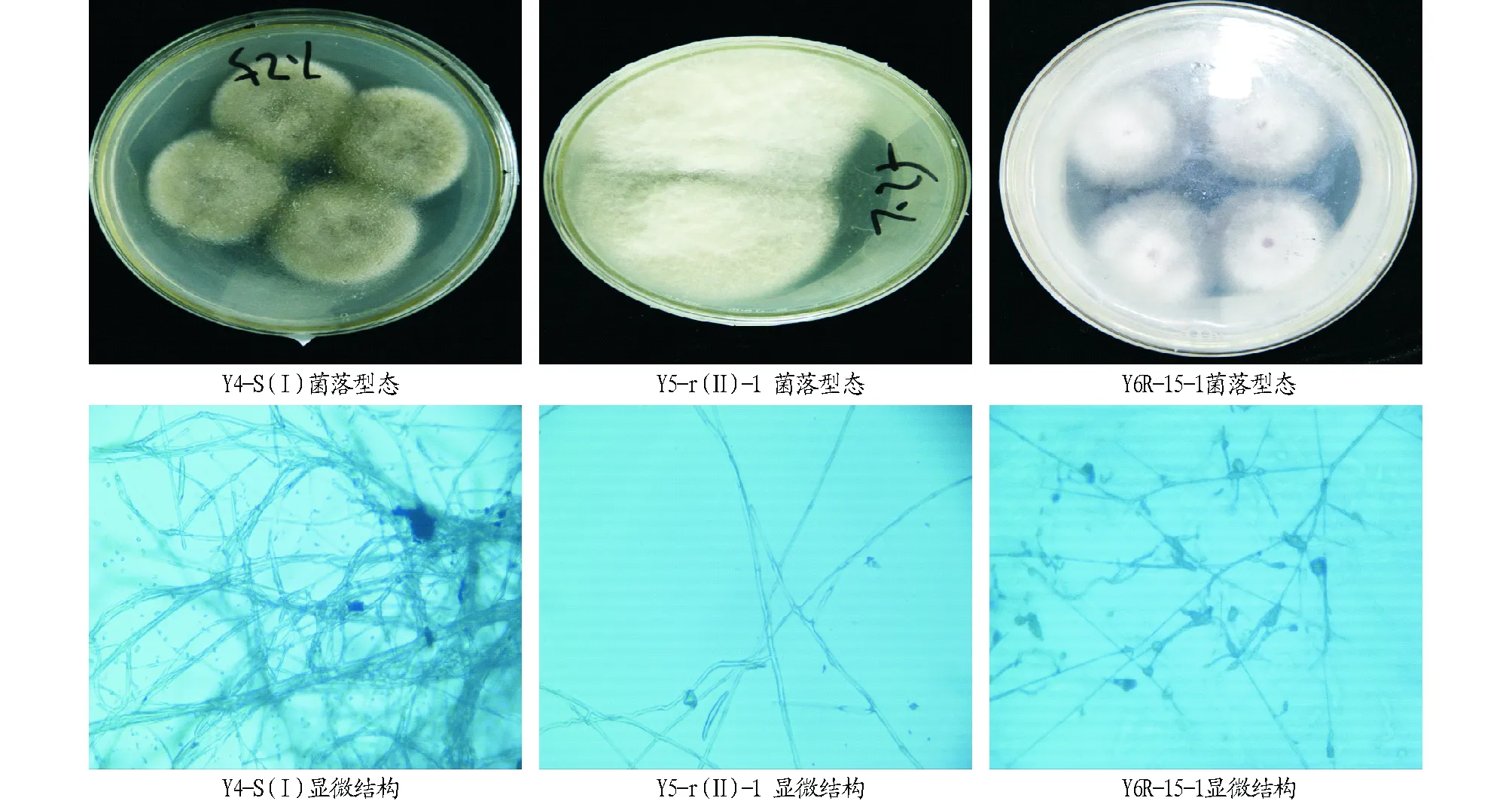
图1 拮抗菌株型态和显微结构特征(40×)Fig.1 Morphology and microstructure of antagonistic strains(40×)
3 结论
从不同地区采集野生大豆根、茎、叶器官,分离获得内生真菌,对大豆疫霉病进行拮抗筛选,筛选出拮抗菌11株,即Y4-S(Ⅰ)、Y5-r(Ⅱ)-1、Y6R-15-1、Y1-r-3和Y5R4、Y6S-26、Y5LB、Y5r-12、Y2-5(Ⅱ)、Y2-S、Y5R18-2-1,菌株间菌落生长型态差异较大,而菌株的显微结构极为相似,可能属于同一种属。这些拮抗真菌具有遗传多样性,为大豆生产中病害的生物防治提供了新的菌种来源。
[1] 马淑梅,邵红涛,韩新华.黑龙江大豆栽培品种和新品系对疫霉病抗性评价及抗病基因分析[J].中国农学通报,2013,29(30):191-196.
[2] 王伟威,魏崃,丁俊杰,等.大豆品种(系)对不同疫霉菌生理小种的抗性研究[J].大豆科学,2014,33(4):559-562.
[3] 徐鹏飞,姜良宇,李文滨,等.黑龙江省大豆品种对大豆疫霉根腐病抗性评价及抗性基因推导[J].中国油料作物学报,2011,33(5):521-526.
[4] 王光华,周克琴,张秋英,等.拮抗细菌BRF-1对几种植物病原真菌的抗生效果[J].中国生物防治,2003,19(2):73-77.
[5] 张淑珍,徐鹏飞,靳立梅,等. 野生大豆对大豆疫霉根腐病抗感反应及聚类分析[J].东北农业大学学报,2009,40(11):1-6.
[6] 李丽艳,蒋继志,郭文.致病疫霉拮抗细菌的筛选及抑菌作用研究[J].安徽农业科学,2011,39(24):14671-14675.
[7] 高同国,李术娜,张冬冬,等.大豆根腐病生防细菌优势菌株的筛选、鉴定及生防效果验证[J].大豆科学,2015,34(4):661-665.
[8] 谢晶.植物病原菌拮抗微生物的筛选、鉴定及拮抗机理研究[D].成都:四川大学,2004.
Identification and Screening of Endophytic Fungi againstPhytophthorasojae
LIU Yong-zheng, BIAN Shuang, SUN Li-jie, XIAO Jia-lei*et al
(College of Life Science, Northeast Agricultural University, Harbin, Heilongjiang 150030)
[Objective] Screening of antagonistic phytophthora pathogenic fungal strains provide the basis for further research and development of biological agents. [Method] Forty strains of fungus were tested. The inhibitory effect of wild soybean fungi on the wild soybean was determined by the method of plate confrontation. [Result] Among the tested 40 strains colony morphology are quite different from each other. On the analysis of smoothness, there are thirty-six colonies whose surface is not smooth, while three colonies appear smooth and pale yellow; On the analysis of colony colors, the front side is mainly white, followed by yellow and pink while, and the back side is mainly purple, followed by black and green; On the analysis of colony growth pattern, most of the colonies appear white flocculent protrusions or wool like hyphae.The inhibitory rates of 11 strains of wild soybean endophytic fungus are 62%-81%, with one strain of Y4-S (I)more than 80%, two strains in 75%-80%, three strains in 70%-75%, and the remaining five strains are less than 70%.Inhibition rate in descending order is Y4-S(Ⅰ), Y5-r(Ⅱ)-1,Y6R-15-1,Y1-r-3,Y5R4, Y6S-26, Y5LB, Y5r-12, Y2-5(Ⅱ),Y2-S,Y5R18-2-1. [Conclusion] The strongest antagonistic effect of strains are Y4-S (Ⅰ), Y5-r(Ⅱ)-1 and Y6R-15-1.They have similar microscopic form as dendritic, and they have separated. After a preliminary judgment, they may be a genus of unity, but their specific species require further judgment.
Phytophthorasojae; Wild soybean; Endophytic fungi; Antagonistic strains
黑龙江省自然基金项目(C2015008);黑龙江省哈尔滨市人才专项(2015RQQXJ019);国家青年基金项目(31101171);东北农业大学创新项目SPIT(201610224154)。
刘永政(1994- ),男,黑龙江牡丹江人,本科生,专业:生物工程。*通讯作者,副研究员,博士,从事作物遗传育种及高产栽培生理研究。
2016-06-20
S 565.1
A
0517-6611(2016)22-166-03
