变异链球菌自诱导物2信号分子的体外合成与活性检测
2016-09-23张鹰李明勇霍丽孟媛
张鹰 李明勇 霍丽 孟媛
解放军第451医院口腔科 西安 710054
变异链球菌自诱导物2信号分子的体外合成与活性检测
张鹰李明勇霍丽孟媛
解放军第451医院口腔科西安 710054
目的利用分子生物学的相关技术体外合成具有良好生物学活性的自诱导物2(AI-2)信号分子,为进一步研究S-核糖高半胱氨酸裂解酶(LuxS)/AI-2信号系统对于变异链球菌和口腔生物膜的致病性、耐药性的调节机制奠定基础。方法构建稳定高效的LuxS和S-腺苷高半胱氨酸核苷酶(Pfs)原核表达载体,异丙基β-D-1-硫代吡喃半乳糖苷(IPTG)诱导表达目的蛋白,并进行镍柱层析分离纯化与鉴定。利用纯化表达的LuxS蛋白和Pfs蛋白体外合成AI-2信号分子,以哈维氏弧菌菌株BB170作为报告菌株,通过生物发光效应检测体外合成的变异链球菌AI-2信号分子的生物活性,并以此间接检测LuxS蛋白和Pfs蛋白的生物学活性。结果体外合成的AI-2可诱导哈维氏弧菌菌株BB170强烈发光。以变异链球菌UA159标准株菌液中自然生成的AI-2为对照,体外合成AI-2诱导发光效果强于菌液。结论体外合成的AI-2具有良好的生物学活性,获得了高效表达、可溶性的LuxS和Pfs重组蛋白。
变异链球菌;密度感应系统;自诱导物2;S-核糖高半胱氨酸裂解酶蛋白
[Abstract]ObjectiveThis study aimed to produce bioactive autoinducer-2(AI-2) in vitro via molecular biological techniques,as well as provide a basis for further study on the cariogenic virulence regulation mechanism of AI-2 in Streptococcus mutans. MethodsEffective prokaryotic recombinant systems for the expression and purification of S-ribosylhomocysteinase(LuxS) and S-adenosylhomocysteine nucleosidase(Pfs) proteins were constructed. After induction by isopropyl β-D-1-thiogalactopyranoside,expressing products were purified with the Ni-NTA spin column. AI-2,which is an informational molecule in quorum sensing,was produced in vitro using purified LuxS and Pfs. The bioactivity of AI-2 was tested by Vibrio harveyi BB170 luminescence bioassay,which indirectly proved the bioactivities of purified LuxS and Pfs. ResultsAI-2 produced in vitro could significantly induce the luminescence of Vibrio harveyi. Furthermore,its luminous intensity was much higher than that induced by the AI-2 produced naturally by a bacterial colony of Streptococcus mutans UA159. ConclusionAn efficient expression system for soluble recombinant proteins of LuxS and Pfs was established. The highly active AI-2 was manufactured,which could provide essential materials for further research.
[Key words]Streptococcus mutans;quorum sensing;autoinducer-2;S-ribosylhomocysteinase
群体感应(quorum sensing,QS)是使用可溶性小分子在细胞间进行信号传递,根据种群密度调节细胞生理行为的过程。自诱导物2(autoinducer-2,AI-2)介导的QS是唯一被革兰氏阳性和阴性菌共用的QS系统,AI-2合成酶S-核糖高半胱氨酸裂解酶(S-ribosylhomocysteinase,LuxS)广泛分布于多种细菌,是一种跨种群交流的通用语。此外,LuxS还是细菌活化甲基循环的组成部分[1-4]。
LuxS/AI-2信号系统一直是QS研究的热点,luxS基因的同源序列存在于大部分口腔致病菌的基因中,变异链球菌是人类龋齿的主要致病菌,AI-2信号分子对其致龋性和毒力具有十分关键的调控功能。本研究构建组氨酸标签(His)-LuxS 和His-S-腺苷高半胱氨酸核苷酶(S-adenosylhomocysteine nucleosidase,Pfs)融合蛋白的原核表达载体,得到高浓度高纯度的活性LuxS和Pfs,人工体外合成AI-2,并利用哈维氏弧菌的生物发光效应检测AI-2活性。为明确AI-2分子特性,区分LuxS/AI-2系统代谢效应和QS效应,找出AI-2的变异链球菌受体,进一步研究AI-2介导的QS机制提供必要条件。
1 材料和方法
1.1材料
1.1.1菌株与质粒变异链球菌菌株UA159(四川大学口腔疾病研究国家重点实验),质粒pET-28a (Novagen公司,德国),大肠杆菌菌株BL21(DE3)(解放军军事医学科学院基础医学研究所),哈维氏弧菌菌株BB170(解放军军事医学科学院基础医学研究所)
1.1.2材料与试剂Taq DNA聚合酶(北京天为时代科技有限公司),限制性内切酶EcoRⅠ、XhoⅠ(Promega生物技术有限公司,美国),T4 DNA连接酶(纽英伦生物技术公司,美国),树脂型TM基因组DNA提取试剂盒、基因组DNA纯化试剂盒、Cycle-Purekit纯化回收试剂盒(北京赛百盛基因技术有限公司),Gen Extract质粒小量提取试剂盒(北京道普生物科技有限公司),IPTG(Sigma公司,美国),蛋白纯化镍柱树脂(Qiagen公司,德国),离心柱聚合酶链反应(polymerase chain reaction,PCR)产物纯化试剂盒(Promega生物技术有限公司,美国)、琼脂糖凝胶DNA回收试剂盒、DNA纯化回收试剂盒,S-腺苷高半胱氨酸(S-adenosylhomocysteine,SAH)(北京赛驰生物科技有限公司),TPY液体培养基,LB培养基。
1.2方法
1.2.1重组质粒pET-28a-luxS与pET-28a-pfs的构建与鉴定根据GENBANK提供变异链球菌基因组工程测序结果中luxS和pfs序列,在Dnaman引物设计软件的辅助下设计引物:扩增luxS基因所用上游引物为luxS1(5'-CCG GAATTC ATGACAAAAGAAGTT-3'),下游引物为luxS2(5'-CCGCTCGAGT TTACACTAGATGACG-3'),扩增pfs基因所用上游引物为pfs1(5'-CCG GAATTC ATGAAAATTGGAA-3'),下游引物为pfs2(5'-CCGCTCGAGT TCATTGGTCTAAGAT-3')。
在两者上游引物中引入EcoRⅠ酶切位点,在下游引物中引入XhoⅠ酶切位点及其相应的保护碱基[5-8]。
以变异链球菌菌株UA159菌体为模板,扩增目的基因,PCR产物测序,EcoRⅠ和XhoⅠ双酶切上述剩余的纯化产物,连接到同样酶切处理的pET-28a载体上,转化至大肠杆菌BL21中,提取质粒,PCR酶切鉴定,测序鉴定阳性克隆。
1.2.2LuxS和Pfs蛋白在大肠杆菌中的表达纯化与定量重组质粒pET-28a-luxS与pET-28a-pfs转化进入大肠杆菌菌株BL21(DE3),接种于5 mL LB培养基,37 ℃摇床200 r·min-1培养8 h,取450 mL LB培养基,加入卡那霉素2 mL(50 μL卡那霉素/ 100 mL LB),添加摇好的菌液,37 ℃剧烈振荡2~3 h,使光密度(optical density,OD)值达到0.4~0.5,再加入1 mol·L-1IPTG 45 μL,使其浓度大约为0.1 mmol·L-1,37 ℃摇3 h后离心收集。收集所得蛋白加4.5 mL镍柱结合缓冲液重悬,按45~60 kU·g-1菌体加溶菌酶,30 ℃中水浴15 min,冰浴中超声裂解菌体,12 000 r·min-1离心4 min,吸取上清经小滤器滤掉杂志,加入镍柱使His-LuxS于镍柱充分结合,洗去杂蛋白后洗脱目的蛋白,加入超滤管(截流量5 000),6 000 r·min-14 ℃离心30 min,弃去外液后再加磷酸缓冲盐溶液(phosphate buffer saline,PBS)重复超滤3次,滤去盐离子、小分子蛋白质等杂质。
吸取少量上清进行十二烷基磺酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate-polya-crylamide gel electrophoresis,SDS-PAGE)。
蛋白样本取2 μL与蒸馏水按1:50、1:100和1:200体积比稀释,各取40 μL加入96孔板;蛋白定量用10、25、50、100、200 μg 分子量标准和蒸馏水分别取40 μL,加入96孔板,Lowry法根据OD值绘制标准曲线。
1.2.3检测体外合成的AI-2诱导生物发光效应制备变异链球菌对数生长中期无细胞上清液作为阳性对照组:变异链球菌对数生长中期无细胞上清液按照1、10、50、100、500倍稀释,所得稀释液各取20 μL+1:5 000稀释哈维氏弧菌菌株BB170的菌液180 μL。阴性对照组为PBS液200 μL;实验组:体外合成的AI-2按照1、10、50、100、500倍稀释,所得稀释液各取20 μL+1:5 000稀释BB 170菌液 180 μL。
将各组样本加入96孔板,30 ℃摇床175 r·min-1孵育1 h,闪烁记数器检测发光量的每分钟闪烁次数(count per minute,CPM)。
2 结果
2.1luxS和pfs的克隆及表达载体的构建
针对变异链球菌luxS、pfs基因构建原核表达载体,经PCR鉴定,重组载体均有与预期目的基因大小相同的插入片段(图1、2),测序结果证实插入片段均为正确全长基因。

图1 pET-28a-luxS表达载体菌落的PCR电泳图Fig1 Electrophoretogram of pET-28a-luxS positive clones' PCR identification
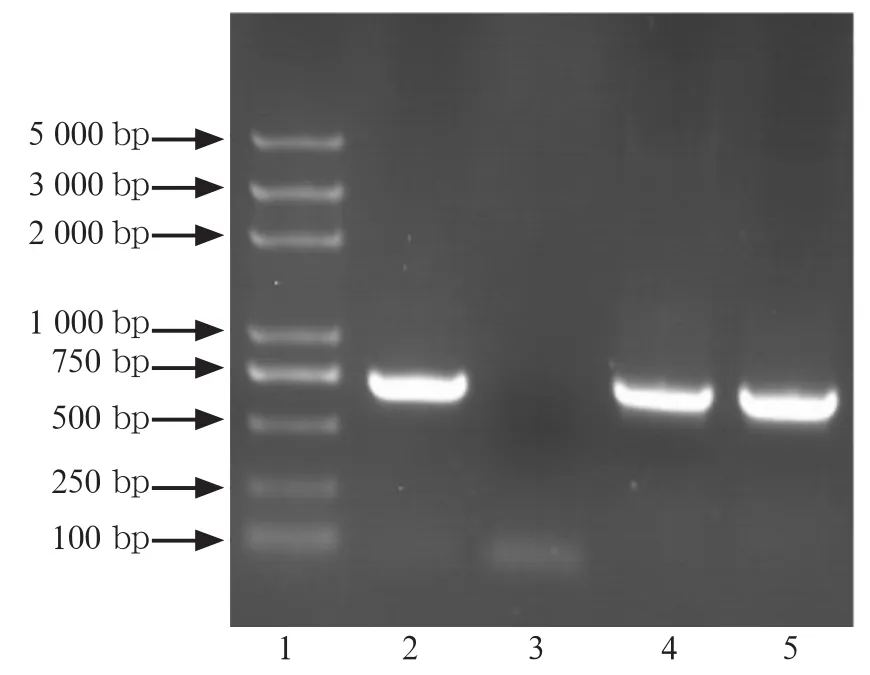
图2 pET-28a-pfs表达载体菌落的PCR电泳图Fig2 Electrophoretogram of pET-28a-pfs positive clones' PCR identification
2.2变异链球菌His-LuxS与His-Pfs的诱导表达与纯化
SDS-PAGE分析显示:经IPTG诱导后,对表达的上清蛋白经镍柱组氨酸标签捕捉(HisTrap)方法纯化。
根据图3、4可知,在预期位置上,重组质粒pET-28a-pfs、pET-28a-luxS形成了和设想具有同样分子量的蛋白表达条带,意味着在大肠杆菌BL21中,目的片段的表达是理想的。在可溶性方面,研究重组蛋白可发现,两种重组蛋白均倾向于上清表达,具有良好的可溶性。且与Ni-NTA柱结合良好,经过镍柱后的穿透液中未见明显的目的蛋白条带,纯化效率较高。

图3 Ni-NTA纯化His-LuxS蛋白Fig3 Purification of His-LuxS using Ni-NTA

图4 Ni-NTA纯化His-LuxS蛋白Fig4 Purification of His-LuxS using Ni-NTA
2.3His-LuxS和His-Pfs的蛋白定量
Lowry法检测LuxS和Pfs蛋白浓度:以牛血清白蛋白为标准绘制标准曲线。将LuxS和Pfs蛋白样本做1:50、1:100、1:200梯度稀释,由标准曲线求得蛋白浓度(图5)。按标准曲线计算得LuxS蛋白含量约为60 g·L-1,Pfs蛋白含量约为3 g·L-1。

图5 Lowrry法蛋白定量标准曲线Fig5 Standard curve for detecting target protein concentration
2.4AI-2的体外合成及活性检测
当纯化的重组蛋白LuxS和Pfs与SAH同时作用后,其反应液经过滤,按照1、10、50、100、500倍稀释的体外合成AI-2和变异链球菌对数生长中期无细胞上清液都能激发哈维氏弧菌菌株BB170产生发光反应,其中AI-2溶液激发的发光反应更强烈:以无细胞的磷酸钠缓冲液发光值为空白基数,体外合成的AI-2诱发的荧光度约为基数的8 200倍,而变形链球菌上清中的AI-2诱发的荧光度约为基数的780倍(图6)。

图6 体外合成AI-2生物活性Fig6 Bioactivity of in vitro synthesized AI-2
3 讨论
自然界中细菌很少以独立的形式存在,多种细菌常常聚集在一起以菌落或生物膜的形式生存,且细菌间的交流以某一通用信号转导通路为媒介。借助生成拥有复杂结构的牙菌斑生物膜,口腔中的各种共生菌得以拥有一个适宜的外界环境,以供生存所需。现今,相关研究发现luxS基因同源序列普遍存在于多种口腔致病细菌,如戈登氏链球菌、牙龈卟啉菌、变异链球菌等中,在利用QS体系控制某些生理活动的同时,在牙菌斑内细菌间,LuxS/AI-2信号分子也扮演着信息传递者的角色[9]。LuxS/AI-2同时具有代谢及密度感应功能,其中任一方面出现问题,均能造成生理功能或致病性方面的改变[10]。
目前尚不明确大部分细菌中AI-2的体内调节和与相邻细菌间的交流规律,只有少数几种病菌如沙门氏菌、大肠杆菌、弧菌已有较深入的研究。牙周病、龋病的发生和口腔牙菌斑息息相关,深入研究AI-2信号通路对于探究QS系统与致龋性基因的关系大有裨益,可为研发针对QS系统的相关拮抗、治疗药物提供指导,进而对牙菌斑的生成加以抑制,达到预防、治疗龋病及牙周病的目的。
现阶段,国内外针对LuxS/AI-2的研究主要是通过luxS基因敲除技术观察细菌突变株在侵袭性、毒力等方面的变化,但LuxS不仅参与群体感应,还在细胞中心代谢扮演重要角色,细菌毒力的变化究竟是由哪种效应决定的尚不明了,对于AI-2和LuxS蛋白酶自身的作用及AI-2合成过程中受哪些因素的调控也鲜有提及。
此外,LuxS蛋白酶作为合成AI-2的关键性蛋白酶,同时也是激活甲基循环的重要组成部分,其催化机制和调控因子皆不清楚[11]。本次研究结果显示,体外合成的AI-2与变异链球菌菌液中AI-2均可诱导哈维氏弧菌菌株BB170发光,且体外合成AI-2诱导效果强于菌液。证明了体外合成的AI-2具有良好的生物学活性,可以进一步开展后续实验研究AI-2对变异链球菌侵袭性和转录水平的影响。
同时体外合成的AI-2成功诱导生物发光也间接证明了,本实验构建的表达载体可以大量表达生物学活性良好的LuxS和Pfs蛋白,有助于进一步对其功能、结构晶体进行分析。为研究这两种QS系统关键酶的调控机制打下了基础,使在维持LuxS活化甲基基团代谢作用的前提下单独研究AI-2分子的调控作用成为可能,对进一步明确QS系统在变链菌中的作用机制和降低口腔生物膜的致病性、耐药性有着重要意义。
[1]He Z,Liang J,Tang Z,et al. Role of the luxS gene in initial biofilm formation by Streptococcus mutans[J]. J Mol Microbiol Biotechnol,2015,25(1):60-68.
[2]王玉霞,高丽,江文欣,等. 变形链球菌LuxS调控功能的甲基代谢机制研究[J]. 中华口腔医学杂志,2014,49(9):530-534. Wang YX,Gao L,Jiang WX,et al. Methyl-metabolism contributes to the luxs regulation of streptococcus mutans[J]. Chin J Stomatol,2014,49(9):530-534.
[3]Rajan R,Zhu J,Hu X,et al. Crystal structure of S-ribosylhomocysteinase(LuxS) in complex with a catalytic 2-ketone intermediate[J]. Biochemistry,2005,44(10):3745-3753.
[4]Galante J,Ho AC,Tingey S,et al. Quorum sensing and biofilms in the pathogen,Streptococcus pneumonia[J]. Curr Pharm Des,2015,21(1):25-30.
[5]Ajdić D,McShan WM,McLaughlin RE,et al. Genome sequence of Streptococcus mutans UA159,a cariogenic dental pathogen[J]. Proc Natl Acad Sci USA,2002,99(22):14434-14439.
[6]Merritt J,Kreth J,Shi W,et al. LuxS controls bacteriocin production in Streptococcus mutans through a novel regulatory component[J]. Mol Microbiol,2005,57(4):960-969.
[7]Zhu H,Shen YL,Wei DZ,et al. Cloning and characterizations of the Serratia marcescens metK and pfs genes involved in AI-2-dependent quorumsensing system[J]. Mol Cell Biochem,2008,315 (1/2):25-30.
[8]Zhu H,Sun SJ,Dang HY. PCR detection of Serratia spp. using primers targeting pfs and luxS genes involved in AI-2-dependent quorum sensing[J]. Curr Microbiol,2008,57(4):326-330.
[9]Maeda K,Nagata H,Ojima M,et al. Proteomic and transcriptional analysis of interaction between oral microbiota Porphyromonas gingivalis and Streptococcus oralis[J]. J Proteome Res,2015,14(1):82-94.
[10]Xavier KB,Bassler BL. Regulation of uptake and processing of the quorum-sensing autoinducer AI-2 in Escherichia coli[J]. J Bacteriol,2005,187(1):238-248.
[11]Silva AJ,Parker WB,Allan PW,et al. Role of methy-lthioadenosine/S-adenosylhomocysteine nucleosidase in Vibrio cholerae cellular communication and biofilm development[J]. Biochem Biophys Res Commun,2015,461(1):65-69.
(本文编辑张玉楠)
Biosynthesis of autoinducer-2 and determination of its bioactivity in vitro
Zhang Ying,Li Mingyong,Huo Li,Meng Yuan.(Dept. of Stomatology,The 451st Hospital of People's Liberation Army,Xi'an 710054,China)
R 37
A
10.7518/gjkq.2016.05.007
2015-11-12;[修回日期]2016-06-16
张鹰,主治医师,博士,Email:naotaka@sohu.com
李明勇,副主任医师,博士,Email:yfy1114@163.com
