艾灸对ApoE-/-动脉粥样硬化小鼠肝脏病理及脂质代谢的作用研究
2016-09-22于梦芸黄薰莹赵百孝
于梦芸 哈 略 黄 畅 黄薰莹 赵百孝
(北京中医药大学,北京,100029)
艾灸对ApoE-/-动脉粥样硬化小鼠肝脏病理及脂质代谢的作用研究
于梦芸哈略黄畅黄薰莹赵百孝
(北京中医药大学,北京,100029)
目的:观察艾灸对载脂蛋白基因敲除(ApoE-/-)动脉粥样硬化(Atherosclerosis,AS)小鼠肝脏病理及血脂相关指标的影响。方法:48只8周龄ApoE-/-小鼠随机分为3组:模型对照组(n=16)、艾灸组(n=16)、西药组(n=16),16只同龄C57BL/6小鼠作为正常对照,固定器固定正常组、模型组小鼠及艾灸组,并对艾灸组小鼠关元穴(RN4)进行艾灸,西药组采用辛伐他汀悬液灌胃(2.8 mg/kg),各组小鼠每天干预20 min,连续干预12周,每周干预6 d,于12周末检测小鼠血清的总胆固醇(TC)、三酰甘油(TG)和低密度脂蛋白胆固醇(LDL-C)及高密度脂蛋白胆固醇(HDL-C)含量,以油红“O”染色法观察各组小鼠肝脏病理形态变化。结果:各组小鼠血清TC含量呈正常组<西药组<艾灸组<模型组的趋势,艾灸组及西药组血清TG含量较模型组显著降低(P<0.05),西药组、艾灸组小鼠血清LDL含量显著低于模型组(P<0.01;P<0.05),各组小鼠血清HDL含量呈正常组>西药组、艾灸组>模型组的趋势,西药组和艾灸组之间无统计学意义。油红染色可见艾灸组和西药组较模型组肝细胞肿胀程度明显减轻,少量炎细胞浸润及少量红染脂肪滴。结论:艾灸可以降低ApoE-/-小鼠血清TC、TG、LDL含量,升高HDL含量,并对AS过程中的肝脏病理有显著的良性调节作用,可以通过调节脂代谢的途径,改善AS。
艾灸;动脉粥样硬化;脂质代谢
动脉粥样硬化(Atherosclerosis,AS)是众多心血管疾病的主要病理基础。其病变的发生发展是许多因素综合作用的结果,涉及到多种发病机制,是一个复杂多变的病理过程。AS的本质是一类在大、中型动脉部位发生的,大量脂质和胆固醇聚集并生成纤维斑块的慢性炎性反应性疾病[1]。长期以来的研究认为,脂质代谢紊乱是动脉粥样硬化发生发展的重要因素。大量关于脂代谢影响动脉粥样硬化机制研究显示,脂质代谢异常,主要表现为血浆胆固醇过高,是导致动脉粥样硬化损伤的重要危险因素。导致动脉粥样硬化的脂蛋白主要包括乳糜微粒(CM),极低密度脂蛋白(VLDL),残粒脂蛋白和低密度脂蛋白(LDL),在动脉内膜局部损伤后,血浆脂质进入动脉内膜,这些脂蛋白可以在血管壁内聚集,在内膜下间隙沉积并且导致脂质的沉积和早期动脉粥样硬化病变的产生[2]。此外,过多的LDL被氧化修饰,形成ox-LDL可导致血管内皮细胞激活,巨噬细胞泡沫化和早期的动脉粥样硬化脂质条纹的产生。脂质代谢异常还包括血浆HDL水平下降,引起胆固醇逆运转能力减退[3]。所以,降脂疗法成为抗动脉粥样硬化的主要战略,尤其是对LDL的良性调节,更是能起到早期防止AS的作用。目前临床上采用的最常见常见的降脂药物是他汀类药物,它是一种一类羟甲戊二酰辅酶A还原酶(HM-CoA)抑制剂,能够抑制HM-CoA的还原,阻断胆固醇酯的合成及其他一些机制,最终实现降低血脂防治AS的作用[4-6]。然而长期的药物控制,不仅使患者身体产生一定的不良反应,也给患者的生活带来极大的不便,因此,寻求补充替代疗法通过降血脂、调节胆固醇的途径来防治AS就势在必行;艾灸是中华传统医学的重要组成部分,一直以其经济、安全、便捷等特点服务于医疗行业。大量的研究已经证实,艾灸可以通过调节血脂而发挥对抗动脉粥样硬化的作用[7-10]。本实验以ApoE-/-小鼠作为AS动物模型,以温和灸作为干预手段,观察艾灸对动脉粥样硬化小鼠肝脏病理变化及血清总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白(LDL-C)、高密度脂蛋白胆固醇(HDL-C)的作用,探讨艾灸通过调节脂代谢以起到防止动脉粥样硬化的作用。
1 实验材料
1.1实验动物本实验选用8周龄载脂蛋白E基因敲除小鼠(ApoE-/-小鼠)作为动脉粥样硬化模型,同龄相同遗传背景非转基因小鼠C57BL/6作为空白对照。小鼠均购自于北京大学医学部实验动物科学部。ApoE-/-小鼠采用高脂饲料(购自北京维通利华实验动物有限公司,含15%猪油、2%胆固醇、0.05%胆酸),C57BL/6常规饲料喂养。所有小鼠均可自由进食饮水;饲养环境温度为(22±2)℃,湿度为50%~60%左右。采用人工控制室内照明,保持12 h光照(8:00—20:00)和黑暗(20:00—次日8:00)交替循环。
1.2主要试剂和仪器1)细艾条:规格φ0.5 cm×20 cm,购自河南南阳汉医艾绒有限公司;2)小鼠固定器:规格150 mm×65 mm×50 mm,可固定小鼠头、尾、四肢部位,底板处设有小孔,可暴露腹部,购自上海华岩仪器设备有限公司;3)罗氏MODULARP800全自动生化分析仪;4)辛伐他汀:购自广东杭州默沙东制药有限公司;5)小鼠灌胃针:规格:12号总长40 mm弯针,购自北京百诺威生物科技有限公司;6)低温离心机,德国ZK380型;7)超低温冰箱,日本三洋公司产;8)总胆固醇(TC)试剂盒,三酰甘油(TG)试剂盒,低密度脂蛋白胆固醇(LDL-C)试剂盒,高密度脂蛋白(HDL-C)试剂盒,购自北京北化康泰临床试剂有限公司;9)LEICA CM1850冰冻切片机;10)Leica冰冻组织包埋剂;11)Leica HI1220烤片机;12)Leica ST5020全自动组织脱水机;13)显微镜:Nikon E200光学显微镜;14)拍照系统:佳能450D相机。
2 实验方法
2.1动物分组及处理48只8周龄ApoE-/-小鼠随机分为3组:模型对照组,艾灸组,西药组,每组16只。16只同龄相同遗传背景C57BL/6作为空白对照。适应性喂养1周后,进行实验干预。干预方法如下:
正常组:将小鼠放入固定器,固定小鼠头、尾、四肢部位。
模型组:将小鼠放入固定器固定,固定小鼠头、尾、四肢部位。
西药组:将小鼠抓取,采用辛伐他汀悬液灌胃2.8 mg/kg(1次/d)。
艾灸组:将小鼠放入固定器固定,固定器底板处设有小孔,暴露腹部关元穴,将小鼠放入固定器后架起,点燃艾条放置小鼠腹部下方,使灸火透过固定器底部小孔传至小鼠腹部关元穴。
所有干预20 min/次,1次/d,6 d/周,共12周,在干预12周末牺牲小鼠,取血。
2.2取材及检测末次干预后,禁食不禁水12 h。小鼠麻醉后,采用眼球摘除法,从眼眶静脉丛采集血液标本约1.5~2 mL,置于离心管中,静置1 h后,离心15 min(4 ℃ 1 500 r/min)。离心后将血清保存于-20 ℃冰箱中备用。然后剖开腹部,取出肝脏,冲洗后放入入4%多聚甲醛中固定24 h,做油红“O”染色。
采用罗氏MODULAR P800全自动生化分析仪检测TC、TG和LDL-C及HDL-C含量。

3 结果
3.1各组小鼠血清TC、TG、LDL、HDL含量见表1、表2。

表1 各组小鼠TC、TG、含量比较
注:与模型组相比*P<0.05;**P<0.01。
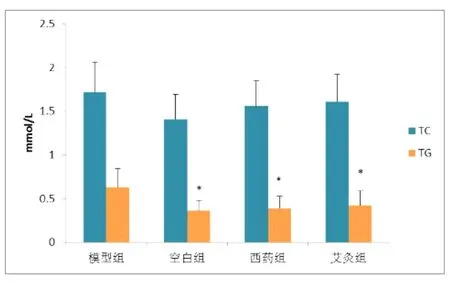
图1 各组小鼠TC、TG、含量比较
注:与模型组相比*P<0.05;**P<0.01。
各组小鼠血清TC含量呈正常组<西药组<艾灸组<模型组的趋势,但组间比较无统计学意义,各组小鼠血清TC含量差异不显著。
各组小鼠血清TG含量呈正常组<西药组<艾灸组<模型组的趋势。与正常组相比,模型组小鼠血清TG含量显著高于正常组(P<0.05);与模型组相比,西药组、艾灸组小鼠血清TG含量显著低于模型组(P<0.05;P<0.05);西药组和艾灸组之间无统计学意义。

表2 各组小鼠LDL、HDL含量比较
注:与模型组相比*P<0.05;**P<0.01。

图2 各组小鼠LDL、HDL含量比较
注:与模型组相比*P<0.05;**P<0.01。
3.2各组小鼠肝脏病理形态见图3~图6。

图3 1)空白组(X20) 图4 2)模型组(X20)

注:肝细胞排列紧密整齐,细胞核被染为蓝色,未见红染脂滴,无染色阳性细胞。 注:肝索肝窦排列紊乱,肝细胞肿胀变性明显,肝窦受压变窄,炎细胞浸润,可见明显的红染脂滴。

图5 3)西药组(X20) 图6 4)艾灸组(X20)

注:肝细胞索排列有序,肝细胞肿胀程度明显减轻,汇管区血管充血,少量炎细胞浸润,少量红染脂肪滴。 注:肝细胞索排列有序,肝细胞肿胀程度明显减轻,汇管区血管充血,少量炎细胞浸润,少量红染脂肪滴。
各组小鼠血清LDL含量呈正常组<西药组<艾灸组<模型组的趋势。与正常组相比,模型组小鼠血清LDL含量显著高于正常组(P<0.01);与模型组相比,西药组、艾灸组小鼠血清LDL含量显著低于模型组(P<0.01;P<0.05);西药组和艾灸组之间无统计学意义。
各组小鼠血清HDL含量呈正常组>西药组、艾灸组>模型组的趋势。与正常组相比,模型组小鼠血清HDL含量显著低于正常组(P<0.05);与模型组相比,艾灸组、西药组小鼠血清HDL含量与模型组无统计学意义(P>0.05)。
4 讨论
长期以来,众多研究者多AS的形成机制展开了深入的研究,而脂质代谢紊乱被认为是AS形成过程中的重要诱因和病理基础。通常表现为TC、TG、LDL、VLDL水平的升高、HDL水平下降,以及其他相关脂蛋白水平异常(如ox-LDL,ApoA-I)。血浆过量的脂质,可在动脉内膜局部损伤后进入动脉内膜,在血管壁内聚集,在内膜下间隙沉积并且导致脂质的沉积和早期动脉粥样硬化病变的产生[11]。
胆固醇进入人体后,与载脂蛋白相结合而存在于血浆中。而大部分存在于LDL。当血浆中LDL含量升高,可以破坏血管内皮细胞的静息状态,造成内皮细胞的损伤,从而表达黏附因子,吸附单核细胞向血管内皮聚集,从而转化为巨噬细胞。完成转化后的巨噬细胞可以对LDL通过摄取、内降解的形式,适当调节血浆胆固醇水平。正常情况下巨噬细胞通过细胞表面LDL-R摄取LDL,LDL受体在脂蛋白的摄取中发挥重要作用[12],当细胞内胆固醇水平过高时,细胞表面的LDL-R表达下降,以减轻对LDL的摄取,此过程为负反馈调节机制,以维持细胞内的胆固醇平衡[13]。同时LDL很容易被体内活性氧等细胞因子通过氧化修饰、蛋白水解等形式,形成氧化低密度脂蛋白(ox-LDL),ox-LDL可以与巨噬细胞表面的清道夫受体特异性结合,进入巨噬细胞[14]。在这个过程当中,ox-LDL快速的、无限制的进入巨噬细胞,超过巨噬细胞自身降解能力,导致巨噬细胞转化成为泡沫细胞。泡沫细胞不断堆积,逐渐形成脂肪条纹,这就是AS的早期形成过程。有研究表明,动脉粥样硬化斑块中的脂质中,80%来源于泡沫细胞。
HDL是一种球形脂蛋白,由脂质和脂蛋白组成。HDL负责接受细胞流出的胆固醇,并将胆固醇运转至肝脏,通过胆酸的形式排出。这个过程,被称作是胆固醇逆转运。HDL、ApoA-I等通过负责胆固醇的逆转运,具有抵抗何减轻动脉粥样硬化的作用[15]。而动脉粥样硬化中,常表现血浆HDL、ApoA-I水平下降,出现胆固醇的清除障碍。血清中HDL的水平降低,会破坏内环境中的抗炎和抗氧化功效。HDL可以诱导胆固醇结晶的持续凋亡和降解,而LDL和VLDL都不具备这样的作用。这都说明HDL除了参与胆固醇逆转运以后,还可以直接降解胆固醇结晶[16-19]。
因此,在本研究中检测了ApoE-/-小鼠血清TC、TG、LDL、HDL的含量,并观察了小鼠肝脏病理的变化,以评估艾灸及艾烟干预的降血脂效果。
本次实验观察发ApoE-/-小鼠血清TG、LDL、HDL三项指标与正常C57BL/6小鼠差异明显,ApoE-/-小鼠TG、LDL含量较正常小鼠升高,而HDL含量较正常小鼠下降,这与文献报道ApoE-/-小鼠可出现自发性脂代谢紊乱相一致,并说明脂质代谢紊乱是ApoE-/-小鼠发生动脉粥样硬化的机制之一。
而在艾灸对TC这项指标作用的观察中,各组小鼠之间血清含量无明显差异,虽然从数值观察上可以看出,模型ApoE-/-小鼠血清TC含量较正常组略有升高,但是不足以形成统计学差异。这一现象说明本次实验中ApoE-/-小鼠并未出现明显的TC改变,这可能是由于本次实验小鼠的病变并不十分严重,未达到显著水平,可能是造模时间还不够长,也有可能是实验采用的模型小鼠自身特点,不易在和TC指标上发生改变。
在对TG、LDL两项指标的观察发现,ApoE-/-小鼠在艾灸和西药干预后,可以出现显著变化,艾灸及西药干预3个月,可以显著降低ApoE-/-小鼠血清TG、LDL含量。对HDL这项指标的观察发现,艾灸和西药干预未能引起ApoE-/-小鼠血清HDL含量的明显改变,尽管从数字上观察,艾灸和西药干预HDL含量升高,但不足以形成统计学差异。
中医学认为,动脉粥样硬化是一种本虚标实之证,与古籍记载中的“脉痹”病理特点较为一致。“本虚”为机体功能减弱,气虚、阳虚;“标实”为“痰、浊、瘀”等病理产物堆积。艾灸具有温阳补气、行气活血的功效。选取关元穴施灸,可以达到补虚扶阳,温通血脉的作用,增强机体的气化功能,一方面使代谢恢复正常,减少病理产物的产生;另一方面,通过其行气活血的功效,促进“痰、浊、瘀”等病邪的排出。
本研究表明,艾灸可以降低ApoE-/-小鼠血清TC、TG、LDL含量,升高HDL含量,并对AS过程中的肝脏病理有显著的良性调节作用,可以通过调节脂代谢的途径,改善ApoE-/-小鼠的AS进程。温和灸还可以作为AS潜在患者及患者预防和治疗的常用手段,可避免长期药物治疗带来的肝毒性、肌肉损害和神经系统疾病[20],操作简便,值得推广。
[1]Lusis AJ.Atherosclerosis[J].Nature,2000,407(6801):233.
[2]Ross R,Harker L.Hyperlipidemia and atherosclerosis[J].Science,1976,193(4258):1094.
[3]Navab M,Reddy S T,Lenten B J V,et al.The role of dysfunctional HDL in atherosclerosis[J].Journal of Lipid Research,2009,50(Suppl):S145-149.
[4]Nawawi H,Osman N S,Annuar R,et al.Soluble intercellular adhesion molecule-1 and interleukin-6 levels reflect endothelial dysfunction in patients with primary hypercholesterolaemia treated with atorvastatin[J].Atherosclerosis,2003,169(2):283-291.
[5]Plosker G L,Wagstaff A J.Fluvastatin:a review of its pharmacology and use in the management of hypercholesterolaemia[J].Drugs,1996,51(3):433-459.
[6]Haria M,Mctavish D.Pravastatin.A reappraisal of its pharmacological properties and clinical effectiveness in the management of coronary heart disease[J].Drugs,1997,53(2):299-336.
[7]邓柏颖,谢感共,罗本华,等.功能保健灸治疗高脂血症48例疗效观察[J].新中医,2002,34(9):48-49.
[8]李国鹏,任惠娟.针灸对女性更年期综合征高密度脂蛋白亚组分和其他脂质含量的影响[J].南京中医学院学报,1992,8(4):237.
[9]沈菁.隔药饼灸对兔高脂血症合并动脉粥样硬化TXB<2>/6-keto-PGF<1α>的调控作用[D].长沙:湖南中医药大学,2005.
[10]钱小路,鲍春龄,侯文光,等.隔药饼灸治疗更年期综合征合并高血脂疗效观察[J].河北中医,2010,32(10):79-81.
[11]Ross R,Harker L.Hyperlipidemia and atherosclerosis[J].Science,1976,193(4258):1094.
[12]Zhou X,He W,Huang Z,etc.Genetic deletion of low density lipoprotein receptor impairs sterol-induced mouse macrophage ABCA1 expression.A new SREBP1-dependent mechanism[J].J Biol Chem,2008,283(4):2129.
[13]Goldstein JL,Brown MS.The LDL receptor[J].Arterioscler Thromb Vasc Biol,2009,29(4):431.
[14]Ashraf MZ,Gupta N.Scavenger receptors:Implications in atherothrombotic disorders[J].Int J Biochem Cell Biol,2011,43(5):697.
[15]江一清.现代冠心病学[M].北京:人民军医出版社,2001.
[16]Robbins G,Wen H,Ting J Y.Inflammasomes and Metabolic Disorders:Old Genes in Modern Diseases[J].Molecular Cell,2014,54(2):297-308.
[17]Ordovas-Montanes J M,Ordovas J M.Cholesterol,Inflammasomes,and Atherogenesis[J].Current Cardiovascular Risk Reports,2012,6(1):45-52.
[18]Junji W,Christina C S,Yunan M,et al.Proteomic profiling following immunoaffinity capture of high-density lipoprotein:association of acute-phase proteins and complement factors with proinflammatory high-density lipoprotein in rheumatoid arthritis[J].Arthritis & Rheumatology,2012,64(6):1828-1837.
[19]Duewell P,Kono H,Rayner KJ,et al.NLRP3 inflamasomes are required for atherogenesis and activated by cholesterol crystals that form early in disease[J].Nature,2010,464(7293):1357-1361.
[20]杨永革,王占庆,姜楠,等.他汀类药物的不良反应[J].医药导报,2011,30(6):817-820.
(2016-06-28收稿责任编辑:洪志强)
Effects of Moxibustion on Liver Pathology and Lipid Metabolism in Apolipoprotein E-deficient Mice
Yu Mengyun, Ha Lue, Huang Chang,Huang Xunying,Zhao Baixiao
(BeijingUniversityofChineseMedicine,Bejing100029,China)
Objective:To observe the intervention effects of moxibustion on liver pathology and lipid metabolism in ApoE-/-mice with atherosclerosis. Methods: Forty-eight ApoE-/-mice (8 weeks old) were randomly divided into model group (n=16), moxibustion group (n=16), and medicine group (n=16). Sixteen same age C57BL/6 mice were used as blank controls. Mice in the blank control and model control group were fixed without any treatment. Mice of the moxibustion groups received both fixation and moxibustion on Guanyuan (RN4). Medicine group received simvastatin suspension (2.8 mg/kg) by intragastric administration. All the manipulations were given 20 min each day, 6 days each week, 12 weeks totally. Contents of total cholesterol (TC), triglyceride (TG) and low density lipoprotein cholesterol (LDL-C) and high-density lipoprotein cholesterol (HLD-C) were determined by colorimetric method. Liver pathological changes of mice in each group were observed by oil red “O” staining method. Results: TC content of mice in each group was normal group
Moxibustion; Atherosclerosis; Lipid metabolism
国家自然科学基金项目(编号:81373730);国家青年自然基金项目(编号:81403449);国家自然科学基金项目(编号:81574068);国家国际科技合作专项项目(编号:2011DFA31370)
于梦芸,硕士研究生,研究方向:艾灸的作用机理研究,电话:(010)64286737,E-mail:1185706947@qq.com
赵百孝(1963.03—),博士,教授,博士研究生导师,北京中医药大学针灸推拿学院院长,研究方向:艾灸作用与原理,Tel:(010)64286737,E-mail:baixiao100@vip.sina.com
R245.81
A
10.3969/j.issn.1673-7202.2016.08.007
