艾灸对动脉粥样硬化小鼠炎性反应因子及MMP-9的实验研究
2016-09-22赵百孝
哈 略 赵百孝
(北京中医药大学针灸推拿学院,北京,100029)
专题——艾灸疗法的作用机制及创新应用
艾灸对动脉粥样硬化小鼠炎性反应因子及MMP-9的实验研究
哈略赵百孝
(北京中医药大学针灸推拿学院,北京,100029)
目的:观察艾灸对ApoE-/-小鼠主动脉内肿瘤坏死因子(TNF-α)、白细胞介素-10(IL-10)及基质金属蛋白酶9(MMP-9)的影响,并从抑制炎性反应,稳定动脉粥样硬化斑块等角度探讨艾灸在防治动脉粥样硬化中的机制。方法:将48只采用高脂饮食喂养的载脂蛋白E基因敲除小鼠(ApoE-/-小鼠)作为动脉粥样硬化模型,并随机分为3组:艾灸组,模型组,药物对照组。并将16只同龄相同遗传背景的C57BL/6小鼠作为空白对照组。空白组、模型组小鼠每天常规抓取、固定,并放置假艾灸装置。艾灸组小鼠每天抓取固定,并艾灸膻中穴。药物组小鼠每天采用辛伐他汀0.28 mg/100 g灌胃,所有干预20 min/d,6 d/周,干预14周后牺牲,取材检测。Elisa法测定主动脉内TNF-α、IL-10、MMP-9的含量。油红“O”染色观察胸主动脉病理改变。结果:1)与模型组相比,艾灸组,药物组小鼠主动脉内TNF-α、MMP-9含量明显降低(P<0.05),艾灸组,药物组之间无明显差异;与模型组相比,药物组IL-10水平明显升高有统计学意义(P<0.05),艾灸组小鼠主动脉内IL-10呈升高趋势,但无统计学意义。2)胸主动脉病理改变:与空白组相比,模型组胸主动脉可见明显的AS斑块,内膜破坏,中膜增厚,平滑肌细胞破坏变性,管腔变狭窄。相比于模型组,艾灸组及药物组主动脉病变明显减轻。结论:1)艾灸可以有效缓解动脉粥样硬化病变,抑制动脉粥样硬化斑块生长;2)艾灸可以抑制体内炎性反应,并具有稳定斑块的作用
艾灸;斑块稳定;动脉粥样硬化;炎性反应因子
近年来,心血管疾病,包括冠心病、缺血性坏死、腹主动脉瘤及众多脑卒中、心力衰竭导致的死亡事件,已成为人类的首要威胁,而上述疾病的共同病理基础均和动脉粥样硬化(Atherosclerosis,AS)有关。随着我国老龄化社会的到来,生活水平的提高及饮食结构的改变,AS造成的心脑血管事件已成为我国人民的主要死亡原因之一。AS是一种发生在大中动脉附近的、以脂质堆积、斑块形成为特点的慢性病理过程,临床上,AS的存在是多种心脑血管疾病发生发展的基础。因此,探索AS的发病机制、研究其病理过程中的重要致病因素,可以指导临床更好的控制心脑血管疾病。
在解释AS发病机制的众多假说中,脂质浸润假说长期占主导地位。这一现象一度持续了半个世纪[1]。1999年,ROSS在他先前提出的损伤反应假说的基础上,进一步完善其理论,认为AS的病理过程是一种慢性炎性状态,炎性反应贯穿AS的始终[2]。虽然目前公认LDL是AS的重要始动因素,但在过去的20多年,免疫和炎性反应机制越来越受到人们的重视[2-3],越来越多的研究也充分证实了炎性反应在AS过程中扮演着重要角色,这也是现阶段AS相关研究的重要切入点。
目前,临床上用于控制AS的药物主要包括降血脂药物,如苯氧酸类、烟酸类及他汀类;抗氧化剂及抗血小板聚集药等,但长期使用这些药物,人体会产生不同程度的不良反应。因此,寻求更加安全的补充替代疗法,也成为了对抗AS的必要途径之一。
艾灸疗法作为中医疗法的重要组成部分,长期在人民的医疗和养生领域发挥着重要作用,国内相关研究及本课题组前期研究均证明,艾灸可以通过调节脂肪、胆固醇代谢等途径和抑制炎性反应等环节来抑制AS的病理发展。因此,本实验旨在观察艾灸对AS模型小鼠主动脉病理、炎性因子及基质金属蛋白酶的作用,探讨艾灸在AS过程中的抗炎机制及其稳定斑块的作用。
1 实验材料
1.1实验动物本实验选用8周龄健康雄性载脂蛋白E基因敲除小鼠(ApoE-/-小鼠)作为AS模型,同龄相同遗传背景非转基因野生C57BL/6小鼠作为空白对照。小鼠均购于北京维通利华实验动物有限公司。ApoE-/-小鼠采用高脂饲料喂养,(饲料购自北京维通利华实验动物有限公司,含15%猪油、2%胆固醇、0.05%胆酸),C57BL/6小鼠采用常规饲料喂养。所有小鼠均可自由进食饮水;饲养环境温度为(23±2)℃,湿度为50%~60%左右。采用人工控制室内照明,保持12 h光照(8:00—20:00)和黑暗(20:00—次日8:00)交替循环。
1.2主要试剂和仪器1)特制细艾条:规格φ0.5 cm×20 cm,购自河南南阳汉医艾绒有限公司;2)辛伐他汀购自广东杭州默沙东制药有限公司;3)小鼠固定器:规格150 mm×65 mm×50 mm,可固定小鼠头、尾、四肢部位,底板处设有小孔,可暴露胸部,购自上海华岩仪器设备有限公司;4)小鼠灌胃针:规格:12号总长40 mm弯针,购自北京百诺威生物科技有限公司;5)低温离心机,德国ZK380型;6)超低温冰箱,日本三洋公司产;7)电子天平,河南爱博科技发展有限公司LEICA CM1850冰冻切片机;8)Leica RM2235石蜡切片机;9)Leica冰冻组织包埋剂;10)Leica HI1220烤片机;11)Leica ST5020全自动组织脱水机;12)显微镜:Nikon E200光学显微镜;13)拍照系统:佳能450D相机;14)Olympus bx51显微镜;15)肿瘤坏死因子(TNF-α)酶联免疫吸附测定(Elisa)试剂盒,购武汉华美生物工程有限公司,产品编号(CSB-E04741m);白细胞介素10(IL-10)酶联免疫吸附测定(Elisa)试剂盒,购武汉华美生物工程有限公司,产品编号(CSB-E04594m);基质金属蛋白酶9(MMP9);酶联免疫吸附测定(Elisa)试剂盒,购武汉华美生物工程有限公司,产品编号(CSB-E08007m)。
2 实验方法
2.1动物分组及处理将48只8周龄ApoE-/-小鼠随机分为3组:模型对照组,西药组,艾灸组,每组16只。16只C57BL/6作为空白对照。适应性喂养1周后,开始进行实验干预。干预14周后,牺牲取材,检测指标。
2.2干预方法空白组:将小鼠抓取、放入固定器,固定小鼠头、尾、四肢部位(1次/d)。
模型组:将小鼠抓取、放入固定器,固定小鼠头、尾、四肢部位(1次/d)。
西药组:将小鼠抓取,采用辛伐他汀悬液灌胃2.8 mg/kg(1次/d)。
艾灸组:将小鼠抓取,放入固定器固定,固定小鼠头、尾、四肢部位。固定完成后将固定器后架起,固定器底部设有小孔,暴露胸部膻中穴,点燃艾条并放置在小鼠胸部下方,使热力通过固定器底部小孔传至小鼠胸部膻中穴。在艾灸过程中,不断调整艾条高度,使艾灸的温度基本保持恒定。艾灸干预20 min/次,1次/d,6 d/周,共14周,在干预14周末牺牲小鼠,取材。
2.3取材及检测末次干预后,禁食不禁水12 h。每组随机选取8只小鼠,测量体重后,用3.5%的水合氯醛0.1 mL/10 g腹腔注射麻醉后,迅速剖开胸部,暴露心脏,心脏取血后,使用20 mL注射器经心尖偏左3~4 mm处进针,插入左心室,并剪开右心耳,灌注4 ℃ 0.9% NaCl溶液20~30 mL,待肺部、肝脏、肾脏颜色明显变白,流出液体澄清后,从主动脉弓起,沿脊柱分离主动脉,冲洗,取出主动脉。滤纸吸干后称重100 mg,制成10%动脉匀浆3 000 r/min离心10 min后取上清,保存于-80 ℃待测。剩余8只取出主动脉后立即使用PBS缓冲液反复冲洗数次,放入4%多聚甲醛中固定24 h。选取胸腔主动脉部位做油红“O”染色。
胸主动脉油红“O”染色:
1)组织包埋与切片:固定后,进行梯度蔗糖脱水,10%蔗糖2 h,20%蔗糖2 h,30%蔗糖直至组织沉底后取出,滤纸吸干残余液体,投入LEICA冰冻组织包埋剂中浸泡5 min使气泡排尽,使组织立于包埋台,LEICA包埋剂包埋后立即速冻,使用LEICA CM1850冰冻切片机在恒温-20 ℃环境下进行6 μm冰冻切片,切片后自然风干,准备油红“O”染色。
2)油红“O”染色:切片蒸馏水浸洗5 min;60%异丙醇浸泡1 min;油红“O”染色液浸染5 min,自来水冲洗掉残余染色液;放入异丙醇内分化至脂滴周边组织无色后水洗终止。苏木素复染3 min;氨水返蓝后甘油封片指甲油封固后自然风干。
采用酶联免疫吸附法(ELISA)测定主动脉匀浆中的TNF-α、IL-10、MMP9,具体操作步骤如下:
1)将各种试剂移至室温(18~25 ℃)环境中平衡,按前述方法配制试剂,备用。
2)加样:分别设标准品孔、待测样本孔。每孔分别加100 μL标准品或待测样本,轻轻晃动混匀,覆上板贴,37 ℃孵育2 h。
3)弃去液体,甩干,不用洗涤。
4)每孔加生物素标记抗体工作液100 μL,覆上新的板贴,37 ℃孵育1 h。
5)弃去孔内液体,甩干,洗板3次。每次浸泡2 min,200 μL/孔,甩干。
6)每孔加HRP-链酶亲和素工作液100 μL,覆上新的板贴,37 ℃孵育1 h。
7)弃去孔内液体,甩干,洗板5次。每次浸泡2 min,200 μL/孔,甩干。
8)每孔加底物溶液90 μL,覆上新的板贴,37 ℃避光孵育15~30 min。
9)依序每孔加终止溶液50 μL,终止反应。
10)在反应终止后5 min内用酶标仪在450 nm波长依序测量各孔的光密度(OD值)。
11)以标准品的浓度为横坐标,OD值为纵坐标做标准曲线。根据样本OD值,计算出相应的浓度。计算所得数值除以蛋白浓度为每mg蛋白中含有的样品浓度。

3 结果
3.1主动脉病理形态见图1~图4。

图1 空白组(×10)
注:血管完好,内皮细胞完整,内膜未见增厚,管腔大小正常,未见AS斑块形成,细胞形态正常。
3.2主动脉炎性反应因子及基质金属蛋白酶9(MMP-9)水平
3.2.1各组主动脉匀浆中TNF-α的含量比较各组主动脉匀浆中TNF-α水平呈空白组<艾灸组<西药组<模型组的趋势。模型组小鼠主动脉内TNF-α含量显著高于空白组(P<0.01)。与模型组相比,艾灸组、西药组小鼠主动脉内TNF-α含量显著低于模型组(P=0.022,0.003);艾灸组与西药组相比,TNF-α水平无统计学意义(P=0.377)。

图2 模型组(×10)
注:可见主动脉壁有明显的斑块形成,内皮细胞破裂、内膜增厚明显,弹力纤维断裂,中膜增厚、平滑肌细胞增生。粥样硬化斑块形成、斑块内可见较多脂肪滴,管腔狭窄。
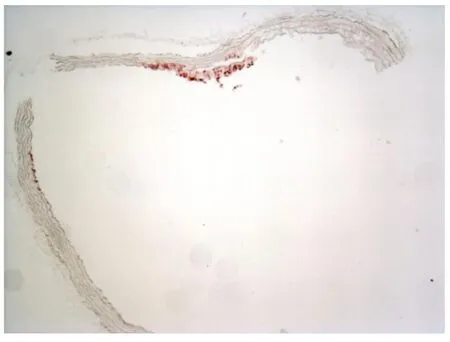
图3 西药组(×10)
注:有斑块形成,但病变较轻,内皮细胞被破坏,但内膜、中膜增厚不明显,弹力纤维未断裂,中膜完整。斑块内有明显脂滴形成。
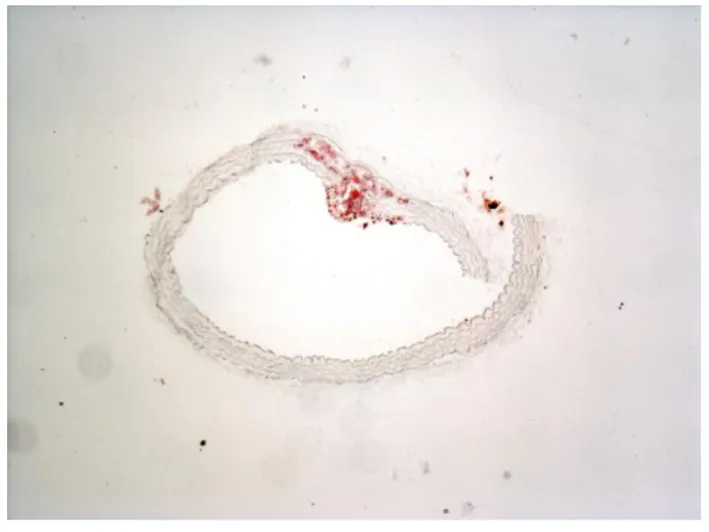
图4 艾灸组(×10)
注:有斑块形成,斑块内可见明显脂滴,内膜细胞被破坏,中膜增厚,部分中膜被破坏,弹力纤维断裂。
3.2.2各组主动脉匀浆中IL-10的含量比较各组主动脉匀浆中IL-10水平呈正常组>西药组>艾灸组>模型组的趋势。与正常组相比,模型组小鼠血清IL-10含量显著低于正常组(P<0.01);与模型组相比,西药组小鼠主动脉内IL-10含量显著升高(P<0.01),艾灸组含量升高无统计学意义,但统计学显示有一定的升高趋势(P=0.053)。
表1 各组主动脉内TNF-α含量对比
注:与模型组相比*P<0.05;**P<0.01。

图5 各组主动脉内TNF-α含量对比(pg/mg)
注:与模型组相比*P<0.05;**P<0.01。

表2 各组主动脉内IL-10含量对比
注:与模型组相比*P<0.05;**P<0.01。
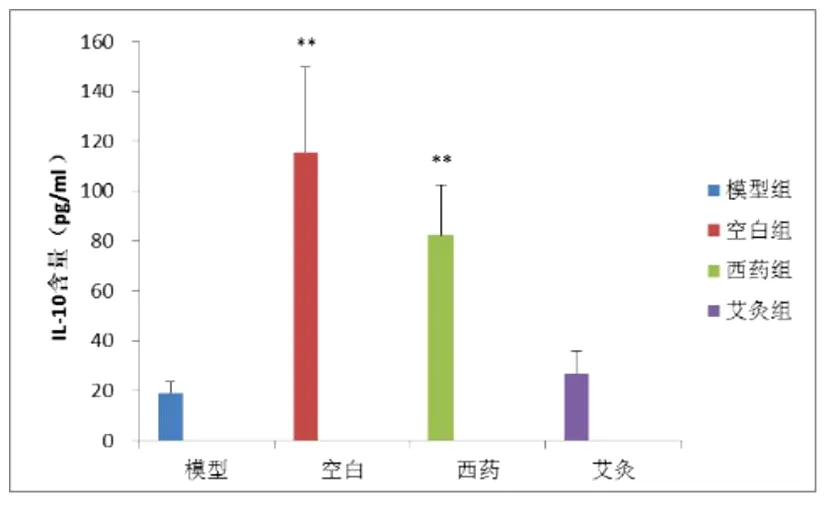
图6 各组主动脉内IL-10含量对比(pg/mL)
注:与模型组相比*P<0.05;**P<0.01。
3.2.3各组中动脉匀浆中MMP-9的含量比较各组主动脉内MMP-9含量表现为:空白组<艾灸组<西药组<模型组。模型组小鼠主动脉内MMP-9含量显著高于空白组(P<0.01)。与模型组相比艾灸组、西药组小鼠主动脉内MMP-9含量显著低于模型组(P=0.015,0.003);艾灸组与西药组相比,MMP-9水平无统计学意义(P=0.515);具体数据见表3、图7。
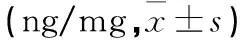
表3 各组小鼠主动脉内MMP-9含量比较
注:与模型组相比*P<0.05;**P<0.01。

图7 各组小鼠主动脉内MMP-9含量比较(ng/mg)
注:与模型组相比*P<0.05;**P<0.01。
4 讨论
TNF-α是肽介质家族的一员,具有很强的促炎特性,在适应性免疫、细胞增殖及凋亡的过程中扮演着重要角色。很多细胞都可以分泌TNF-α,如:巨噬细胞,单核细胞,平滑肌细胞及纤维母细胞。TNF-α在AS中对脂质具有质量与数量的双重影响,脂质的这种持续被修饰,可推进AS的不断进展。其对脂质代谢的影响主要是通过降低胆固醇7α-羟化酶[4]及脂蛋白脂酶的分泌,及刺激肝脏生成三酰甘油[5-7]来实现的;而在炎性反应过程当中,TNF-α参与了AS过程当中的全部阶段,而AS过程中的每个阶段都伴有不同程度的炎性反应,TNF-α还可与其他炎性反应因子,趋化因子一起形成协同作用,参与介导内皮细胞黏附分子的表达,血小板聚集,炎性反应细胞的激活和聚集,以及血管壁内部的炎性反应级联反应,从而推动AS的发展[6,8]。在AS的早期病变,TNF-α通过下调NO分泌、介导VCAM-1及ICAM-1而诱导平滑肌细胞增值[9]、上调各种趋化因子、半胱天冬酶,使内皮损伤不断加重。而在AS发展阶段,TNF-α通过不断诱导各种炎性反应因子的分泌,加重AS过程中的炎性反应级联反应。在AS的后期,TNF-α又能上调基质金属蛋白酶MMP的含量,降低斑块稳定性,从而增加急性心血管事件的发生的几率[10]。
白细胞介素10(IL-10)作为一种抗炎因子,主要由巨噬细胞及Th2亚型的T淋巴细胞分泌,它的主要功能包括抑制巨噬细胞活性、MMP和促炎因子的表达。研究表明持续的炎性反应刺激巨噬细胞分泌IL-10,从而抑制各种炎性反应因子的表达,如:IL-1、TNF-α、IL-8,并且诱导IL-1受体拮抗剂的增多[11-12]。同时,IL-10对MCP-1的抑制作用[13],也被认为是其对抗AS病理变化的重要机制。这2个指标,是AS过程中的典型炎性反应因子,一定程度上反映了炎性反应的活跃程度。在本实验中,艾灸对TNF-α及IL-10的良性调节作用证明,艾灸膻中穴可以对小鼠AS过程产生广泛的抗炎作用。
人类AS过程中,当出现纤维帽变薄、SMC减少、脂类核心扩大、钙化、基质重组等特征时,斑块就会不稳定[14],从而为急性心血管事件的发生创造条件。当斑块受到外力时,承受其机械应力的部位就是纤维帽,主要有胶原纤维、蛋白多糖、弹性蛋白组成。纤维帽的完整性与抗机械力的作用于EMC密不可分;而胶原纤维是构成EMC的核心物质,有SMC合成,MMPs降解。MMPs升高后,对胶原纤维的分解作用加强,导致纤维帽变薄,再加上血流动力学的应激变化,最终使斑块发生破裂,故认为MMPs增多与斑块不稳定性密不可分[14-15]。MMP-9主要由中性粒细胞、巨噬细胞分泌,分泌的形式是前酶原形式。可以直接作用于血管内皮基底膜IV型胶原,导致其分解。本实验观察艾灸对ApoE-/-小鼠MMP-9的影响,在国内尚属首例,结果表明,与模型组相比,艾灸能显著降低主动脉内MMP-9的含量,提示艾灸在促进斑块稳定性上有积极的干预效果。但由于MMP-9受多种细胞因子影响,艾灸对其调控的具体机制还不得而知,可能是基于其对其他炎性反应因子的抑制,影响MMP-9的分泌,或者是另外单独的调控通道,这有待下一步更细致的研究。
艾灸,作为一种中医外治法。一般我们认为其起效因素主要有以下3点:1)艾燃烧生成物本身的药理作用;2)艾灸燃烧产生的物理作用,光热效应;3)经络穴位自身的调控作用。
首先我们来看下穴位的功效,在本研究中,所选用的膻中穴主治上焦病症,是经络腧穴理论中的重要穴位之一,对其进行刺激,可以增强上焦的气化功能,乃至全身的气化功能,促进水谷的输布,减少痰、瘀等病理产物的形成和堆积。而穴位本身所具有的宽胸理气,行气活血的功效,可以增强AS过程中有害因子的代谢和输送,保护内皮细胞,改善病理环境,这是穴位自身的功效。
温热刺激是艾灸疗法的主要作用机制之一,其温通经脉、活血化瘀的功效也正是通过温热刺激的方式来实现的,炎性反应过程中的红、肿、痛等特征也符合中医理论中“瘀”的表现,而艾灸正是通过活血化瘀的作用来疏通血脉,使局部或者机体内瘀滞的气血得以流通,改善组织代谢,调节微循环,促进病理产物的排除。施灸局部是艾灸作用的直接对象,是艾灸温通效应启动机制的关键环节。在本研究中,艾条点燃后直接放置于胸部穴位,热力可以穿透胸腔,直达心脉,因此,除了穴位本身的治疗作用以外,艾灸的温热效应是本次研究的重要渠道。
艾燃烧生成物是艾灸的起效因素之一,研究组前期观察不同浓度艾烟对大鼠血清VCAM-1、ICAM-1、hs-CRP的作用,结果表明三种浓度的艾烟均能降低这三种指标的水平[16]。而对AS模型的ApoE-/-小鼠,艾烟能抑制其血清中黏附分子、趋化分子,炎性反应因子的表达,在AS过程中发挥其抗炎的作用[17]。本次实验,虽然没有单独设立艾烟干预组进行对比,但艾烟在治疗过程中的作用也不可忽视。另外,课题组前期证明,艾烟可以通过嗅觉通路通路至下丘脑海马,起到抑制ROS、TNF-α,抑制炎性反应;艾烟本身含有大量的挥发油和芳香物质,笔者设想,艾烟能通过嗅觉通路进入颅内,影响脑内活动,调节交感神经系统,通过心丛神经,作用于心血管系统,可能也是其起效途径之一,此假设还需要进一步实验验证。
[1]Libby P,Ridker P M,Libby P,et al.Inflammation and Atherothrombosis:From Population Biology and Bench Research to Clinical Practice[J].Journal of the American College of Cardiology,2005,48(9):A33-A46.
[2]Liuzzo G.Atherosclerosis:an inflammatory disease[J].Rays,2001,26(4):115-126.
[3]Christian W,Alma Z,Peter L.The multifaceted contributions of leukocyte subsets to atherosclerosis:lessons from mouse models[J].Nature Reviews Immunology,2008,8(10):802-815.
[4]Feingold K R,Spady D K,Pollock A S,et al.Endotoxin,TNF,and IL-1 decrease cholesterol 7 alpha-hydroxylase mRNA levels and activity[J].Journal of Lipid Research,1996,37(2):223-228.
[5]Saxena S K,Crouse D A,Sharp J G.Stimulation of lipolysis in cultured fat cells by tumor necrosis factor,interleukin-1,and the interferons is blocked by inhibition of prostaglandin synthesis[J].Endocrinology,1992,130(1):10-16.
[6]Fried S K,Zechner R.Cachectin/tumor necrosis factor decreases human adipose tissue lipoprotein lipase mRNA levels,synthesis,and activity[J].Journal of Lipid Research,1989,30(12):1917-1923.
[7]Feingold K R,Serio M K,Adi S,et al.Tumor necrosis factor stimulates hepatic lipid synthesis and secretion[J].Endocrinology,1989,124(5):2336-2342.
[8]Liuzzo G.Ross,R.Atherosclerosis-An inflammatory disease.N.Engl.J.Med.340,115-126[J].Rays,1999,26(4):221-230.
[9]Thorne S A,Abbot SEStevens C R,Winyard P G,et al.Modified low density lipoprotein and cytokines mediate monocyte adhesion to smooth muscle cells[J].Atherosclerosis,1996,127(2):167-176.
[10]Zhang H,Yoonjung Park,Junxi Wu,et al.Role of TNF-α in vascular dysfunction[J].Clinical Science,2009,116(Pt 3):219-230.
[11]Terkeltaub RA.IL-10:An “immunologic scalpel” for atherosclerosis?[J].Arteriosclerosis Thrombosis & Vascular Biology,2000,19(12):2823-2825.
[12]Poll T V D,Jansen J,Levi M,et al.Regulation of interleukin 10 release by tumor necrosis factor in humans and chimpanzees[J].Journal of Experimental Medicine,1994,180(5):1985-1988.
[13]Ajuebor M N,Das A M,Virág L,et al.Role of resident peritoneal macrophages and mast cells in chemokine production and neutrophil migration in acute inflammation:evidence for an inhibitory loop involving endogenous IL-10[J].Journal of Immunology,1999,162(3):1685-1691.
[14]Yuji K,Nozomi T,Seigo I,et al.Distribution profiles of membrane Type-1 matrix metalloproteinase(MT1-MMP),matrix metalloproteinase-2(MMP-2)and cyclooxygenase-2(COX-2)in rabbit atherosclerosis:comparison with plaque instability analysis[J].Biological & Pharmaceutical Bulletin,2007,30(9):1634-1640.
[15]Rodríguez J A,Josune O,Páramo J A.Metalloproteases,vascular remodeling and atherothrombotic syndromes[J].Revista Espa De Cardiologia,2007,60(9):959-967.
[16]杨佳.不同浓度艾烟长期干预对大鼠心血管疾病易感因子影响的实验研究[D].北京:北京中医药大学,2013.
[17]崔莹雪.艾灸及艾烟对ApoE-/-小鼠动脉粥样硬化胆固醇代谢和炎性反应的影响[D].北京:北京中医药大学,2014.
(2016-06-28收稿责任编辑:洪志强)
Experimental Study of Moxibustion′s Effect on Inflammatory Factors and MMP-9 of Arteriosclerosis Mice
Ha Lue, Zhao Baixiao
(SchoolofAcupuncture-MoxibustionandTuinaofBeijingUniversityofChineseMedicine,Beijing100029,China)
Objective:To observe the effect of moxibustion on TNF-α, IL-10 and MMP-9 of arteriosclerosis mice and discuss its possible mechanism from the angle of inhibiting inflammatory factors and stabilizing plague. Methods: To establish atherosclerosis model by removing ApoE gene through high-fat diet feeding. A total of forty-eight ApoE-/-mice (8 weeks old) were randomly divided into moxibustion group, model group, and medicine control group. Additionally, sixteen same age C57BL/6 mice were used as a blank control. Mice in the blank control and model control group were handled and intervened with sham moxibustion every day. Mice in the moxibustion group were handled and treated with moxibustion on Dan Zhong (RN17) acu-point while the mice in medicine control group were intervened by gavage Simvastatin 0.28 mg/100 g. All the interventions were given 20 min/day, 6 days/week, 14 weeks totally. Then the mice were killed for examination. Elisa method was used to test the level of TNF-α, IL-10, and MMP-9 and red oil “O” stain were used to observe the plague size in the aorta. Results: 1)Compared with the model group, TNF-α, MMP-9 levels of moxibustion group and medicine control group were decreased significantly (P<0.05), and there is no significant difference between the moxibustion group and medicine control group. Compared with the model group, IL-10 levels were increased significantly (P<0.05) in medicine control group. Despite IL-10 levels in moxibustion group showed a trend of increase, no significant difference was shown. 2)The pathological changes in the thoracic aorta plaque: Compared with the blank group, plague in model group can be obviously seen in the thoracic aorta, pathological changes including intimal destruction, medium thickness, smooth muscle cell degeneration, lumen stenosis can also be seen in the model group. Compared with model group, aortic lesions in moxibustion group and medicine group were significantly reduced. Conclusion: 1)Moxibustion could alleviate atherosclerosis, inhibit the growth of plague. 2)Moxibustion could inhibit inflammation in the body, which may be one of the mechanisms of its anti-atherosclerosis effect. Besides, moxibusion also contributes to plaque stability.
Atherosclerosis; Inflammation factors; Moxibustion; Plaque stability
国家自然科学基金项目(编号:81373730);国家青年自然基金项目(编号:81403449);国家自然科学基金项目(编号:81574068);国家国际科技合作专项项目(编号:2011DFA31370)
哈略(1989.04—),2013级在读硕士研究生,研究方向:艾灸与艾燃烧生成物的效应机制,E-mail:halue@126.com
赵百孝(1963.03—),博士,教授,博士研究生导师,北京中医药大学针灸推拿学院院长,研究方向:艾灸作用与原理,Tel:(010)64286737,E-mail:baixiao100@vip.sina.com
R245.81
A
10.3969/j.issn.1673-7202.2016.08.001
