黄烷酮3-羟化酶基因表达分析及转基因大豆新种质创制
2016-09-22崔艳伟李文龙常文锁李喜焕张彩英
崔艳伟,李文龙,常文锁,李喜焕,张彩英
(河北农业大学,教育部华北作物种质资源研究与利用重点实验室,河北 保定 071001)
黄烷酮3-羟化酶基因表达分析及转基因大豆新种质创制
崔艳伟,李文龙,常文锁,李喜焕*,张彩英*
(河北农业大学,教育部华北作物种质资源研究与利用重点实验室,河北保定071001)
黄烷酮3-羟化酶(F3H)是大豆异黄酮代谢途径重要酶类。研究F3H在不同大豆品种中的表达差异,并应用转基因途径创制新种质是提高大豆异黄酮含量的重要途径。以高异黄酮含量大豆品种中豆27和低异黄酮含量大豆品种楚秀为试材,采用qPCR技术,分析F3H在大豆不同发育时期、组织部位中的表达差异;并利用花粉管通道转化技术,获得转F3H阳性植株。结果表明:F3H在2个大豆品种R1~R7期叶片中的表达模式不同,中豆27的F3H表达量在R1期最高,而后开始下降,R2~R5期维持较低水平,R6期略有上升,R7期又出现下降;楚秀F3H表达量在R1~R4期较低,R5期出现表达高峰,R6期开始下降。F3H在2个大豆品种R5~R8期籽粒中的表达模式基本相同,表达量均从R5期开始下降,且R6~R8期维持较低水平。基于此,构建F3H RNAi反义载体,并利用花粉管通道技术转入不同大豆品种,获得了5个转基因新材料。
大豆;异黄酮含量;黄烷酮3-羟化酶;基因表达;RNAi
大豆异黄酮合成代谢过程由苯丙烷途径和异黄酮合成途径共同组成,主要存在于豆科植物[1~5]。苯丙氨酸和丙二酰辅酶A在苯丙氨酸解氨酶、肉桂酸羟化酶、香豆酸辅酶A连接酶等多种酶的催化作用下,经羟基化、甲氧基化和烷基化等过程形成不同类型的异黄酮化合物[6~9]。在这些异黄酮成分中,大豆甙元、染料木素、黄豆素为该代谢途径主要分支产物,受到众多学者重视,其中,染料木素的合成与黄酮及花青素合成具有共同的前体物质——柚皮素。
柚皮素为另一重要次生代谢产物,既可在异黄酮合酶(IFS)催化下合成染料木素,又可在黄烷酮-3-羟化酶(F3H)催化下合成花青素,还可在黄酮合成酶(FNS)作用下生成黄酮。由此可见,通过降低或抑制F3H、FNS表达水平,理论上可达到提高染料木素合成能力的目的[10,11]。夏涛等[12]、马君兰等[13]提出由于柚皮素参与多个代谢途径,因而通过阻断或降低其它途径合成,可能提高大豆异黄酮含量。为分析上述途径是否可行,少数学者进行了尝试。Liu等[14]将大豆IFS转入拟南芥F3H缺失体,由于分支途径被阻断,转基因植株染料木素含量提高了5~30倍。Yu等[15]利用玉米C1和R转录因子,抑制F3H表达以阻断花青素合成途径,使大豆籽粒异黄酮含量升高。因此,进一步探讨通过抑制分支途径来提高异黄酮含量的可行性,对于选育高异黄酮大豆至关重要。
作者前期对213个黄淮海地区大豆的异黄酮含量进行分析,并从中筛选出了高异黄酮含量大豆品种中豆27和低异黄酮含量品种楚秀[16]。以中豆27和楚秀为试材,采用实时定量PCR技术分析F3H在2个品种不同发育时期及组织部位表达特性,明确F3H在高、低异黄酮含量大豆中的表达差异,并依此构建F3H的RNAi载体转化大豆,获得转基因植株,可为高异黄酮含量新品种培育提供基础材料。
1 材料与方法
1.1试验材料
试验材料为籽粒异黄酮含量差异较大的2个大豆品种,其中,中豆27为高异黄酮含量品种,楚秀为低异黄酮含量品种。
1.2试验方法
1.2.1实时定量PCR分析取样时期及部位2013年在河北农业大学作物育种中心试验场种植参试大豆品。采用随机区组试验设计,行长2 m、行距0.5 m,2行/区,3次重复,田间管理方法同一般大田。
依据大豆生育期划分标准[17],分别于始花期(R1)、盛花期(R2)、始荚期(R3)、盛荚期(R4)、始粒期(R5)、鼓粒期(R6)、成熟初期(R7)和完熟期(R8),选择相同植株部位的叶片或籽粒取样,置塑封袋后立即进行液氮冷冻,-80℃超低温冰箱保存,备用。
1.2.2大豆样品cDNA合成与相关引物设计参照RNA simple Total RNA Kit操作指南,进行大豆叶片和籽粒总RNA提取;参照Prime ScriptRT reagent Kit With gDNA Eraser操作指南,进行cDNA合成。
根据NCBI数据库中检索到的黄烷酮3-羟化酶基因F3H序列(GenBank No.AY595420),设计实时定量PCR引物,同时以组成型表达基因Actin11为内参设计引物(表1)。

表1 黄烷酮3-羟化酶基因相关引物及其序列Table 1 Primer sequences of Flavanone 3-hydroxylase gene
1.2.3F3H实时定量PCR分析采用SYBR GreenⅠ荧光染料法,参考Derveaux[18]方法进行。为保证供试基因实时定量PCR结果可靠,试验设置3次生物学重复和3次技术重复。实时定量PCR结果分析方法为:基因在不同品种叶片相对表达量=2-△△Ct,ΔΔCt=(Ct基因-CtActin11)品种1叶片-(Ct基因-CtActin11)品种2叶片;基因在不同品种籽粒相对表达量=2-△△Ct,ΔΔCt=(Ct基因-CtActin11)品种1籽粒-(Ct基因-CtActin11)品种2籽粒。
1.2.4F3H反义载体构建设计引物F3H-F2和F3H-R2(表1),并在两端引入SmaⅠ和PmlⅠ酶切位点序列,以高异黄酮大豆cDNA为模板进行扩增。回收PCR产物,并与克隆载体pMD18-T连接,转化大肠杆菌感受态细胞Top10,通过菌液PCR和酶切鉴定阳性克隆,并将阳性克隆进行测序,筛选序列正确的中间重组子。将中间重组子与植物表达载体pCambia3301分别采用SmaⅠ和PmlⅠ双酶切,回收目的片段并进行连接,连接产物转化Top10,菌液PCR与酶切鉴定筛选阳性克隆,并通过测序分析验证序列正确性。
1.2.5F3H RNAi载体转化大豆及阳性植株检测利用大豆花粉管通道遗传转化技术,将构建完成的F3H RNAi载体转化不同大豆品种(东豆99-11、农大豆2号等),并做好标记。待豆荚成熟后收获种子,然后播种于人工气候室,利用50 mg/L除草剂筛选抗性植株,提取抗性植株DNA,经PCR扩增与DNA测序,检测转基因阳性植株。
2 结果与分析
2.1F3H在不同大豆品种中的表达差异
利用高异黄酮大豆中豆27和低异黄酮大豆楚秀cDNA为模板,采用实时定量引物F3H-F1和F3H-R1分别进行PCR扩增,以检测引物扩增结果准确性,结果(图1)显示,能够扩增出162 bp目的条带,且扩增片段特异性高,没有出现非特异条带;进一步对扩增片段进行测序分析,发现其与NCBI注册基因序列一致,证明上述引物扩增结果正确。

图1 大豆F3H扩增片段琼脂糖凝胶电泳检测
在此基础上,分析F3H在高、低异黄酮含量大豆叶片中的表达差异,结果(图2)显示,该基因在中豆27的R1期叶片表达量最高,而后表达量迅速下降,在R2~R5期保持较低水平(其中在R5期表达量最低),随后在R6期出现第2个表达高峰,在R7期表达量又呈下降趋势;在楚秀叶片中,F3H表达量在
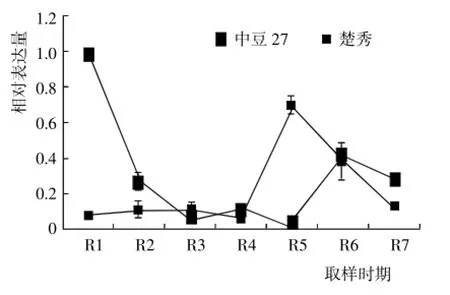
图2 F3H在不同大豆品种叶片中的表达差异Fig.2 Differential expression of F3H in different soybean varieties leaves
由此可见,由于F3H是大豆异黄酮合成过程中的一种底物竞争酶类,该基因的高效表达将会提高其竞争能力,不利于异黄酮合成与积累,故F3H在中豆27和楚秀中的表达量均较低,且由于该基因在中豆27的表达量更低,从而有利于中豆27异黄酮合成与R1~R4期较低,在R5期出现表达高峰,在R6~R7期表达量迅速下降。通过分析该基因在参试品种籽粒中的表达差异,发现F3H在2个品种籽粒中的表达趋势基本相同,在R5~R8期均表现下降趋势,没有出现表达高峰(图3)。积累。同时还发现,楚秀叶片R5期F3H表达量明显高于其它时期,而中豆27叶片在R6期出现表达高峰,说明F3H参与底物竞争的关键时期发生在大豆发育的R5~R6期,且由于中豆27的该竞争反应出现得时间较晚、竞争能力较小,而楚秀的该竞争反应出现得时间较早、竞争能力相对较强,从而使中豆27异黄酮含量较高。因此,通过降低或抑制大豆品种的F3H表达,可实现提高异黄酮含量的目的。
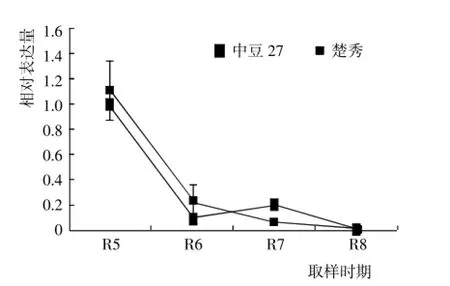
图3 F3H在不同大豆品种籽粒中的表达差异Fig.3 Differential expression of F3H in different soybean varieties seeds
2.2F3H RNAi载体构建
利用引物F3H-F2和F3H-R2扩增F3H相应序列,琼脂糖凝胶电泳检测结果显示,目的片段大小约为1 140 bp,与预期结果基本一致;回收该目的条带,与T载体进行连接,形成中间重组子pMD-F3H,将其转化大肠杆菌感受态细胞,经菌液PCR扩增获得阳性克隆;将阳性克隆进行测序分析发现,与F3H相应序列一致,可用于RNAi载体构建。
利用核酸限制性内切酶SmaⅠ和PmlⅠ,分别酶切中间重组子pMD-F3H与植物表达载体pCambia3301,获得酶切后的目的片段;回收目的片段,并进行连接、转化以及菌液PCR扩增与酶切鉴定,获得重组子pCambia3301-ASF3H(图4);将重组子进行测序分析发现序列正确无误,表明RNAi载体pCambia3301-ASF3H构建成功。
2.3F3H RNAi载体转化大豆及转基因材料获得
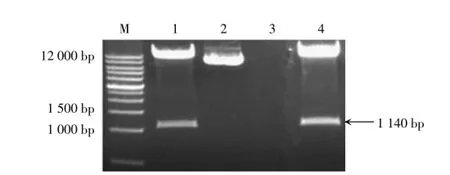
图4RNAi载体pCambia3301-ASF3H酶切产物的鉴定
利用花粉管通道转化技术,将RNAi载体pCambia3301-ASF3H转入不同大豆品种,收获转化后的T0种子,并播种于人工气候室;出苗后,喷施除草剂初步筛选阳性植株,野生型对照由于不抗除草剂出现叶片失绿现象,而转基因抗性植株叶片颜色基本不变(图5)。进一步提取抗性植株叶片DNA,进行目的基因PCR检测,结果显示,可以扩增出目的条带;回收目的条带测序证明其序列正确,说明RNAi载体pCambia3301-ASF3H已转入大豆基因组(图6);将阳性植株自交,收获种子,获得了转F3H的T1大豆新材料5个(表2)。

图5 利用除草剂鉴定技术检测转基因大豆叶片颜色变化Fig.5 Leaf colour identification results of transgenic soybean by herbicide

图6转基因阳性植株F3H测序结果
3 结论与讨论
在大豆异黄酮合成途径中涉及到的酶类有十几种,目前一般采用2种策略来提高异黄酮含量[10]:第1种策略是通过分析该途径的限速步骤,克隆或外源合成限速步骤相关酶类或基因,并导入细胞增强限速酶的表达量,打破关键步骤的合成瓶颈,进而提高异黄酮含量;第2种策略是通过分析异黄酮代谢途径中的分支途径,利用RNAi技术减少或阻塞非目标代谢物的合成,从而减少分支代谢途径的流向,为异黄酮合成提供更加充足的合成前体[19]。其中,第1种策略研究报道较多,但由于涉及的酶类或基因数量较多,故单一基因的超表达转化研究进展不尽人意,目前有学者提出采用“多基因”转化的思路来提高大豆异黄酮含量[20~22]。关于第2种提高异黄酮含量的策略,目前已有学者开始尝试并取得部分研究进展,如,张艳等[23]通过构建异黄酮代谢分支途径F3H反义载体,抑制大豆花青素合成通路,以提高异黄酮合成能力;江曼等[24]将GhF3H RNAi载体转入棉花,获得了GhF3H表达水平显著降低的棉花资源,证实通过抑制GhF3H表达水平可以改变棉花类黄酮合成;Liu等[14]研究发现,在拟南芥tt6/tt3突变体中,F3H表达受到抑制,导致该突变体异黄酮含量增加;柳青等[25]利用RNAi技术构建F3H反义载体,得到了4株转基因植株,其异黄酮含量均表现明显增加。作者通过分析F3H在高、低异黄酮含量大豆品种中的表达差异,同样发现,该基因高效表达不利于异黄酮合成与积累。基于此,构建了大豆F3H的RNAi载体,并将其转入异黄酮含量低但丰产性好、抗病的大豆品种,获得了转基因T1材料,为高异黄酮含量转基因大豆新品种培育提供了新的种质资源。
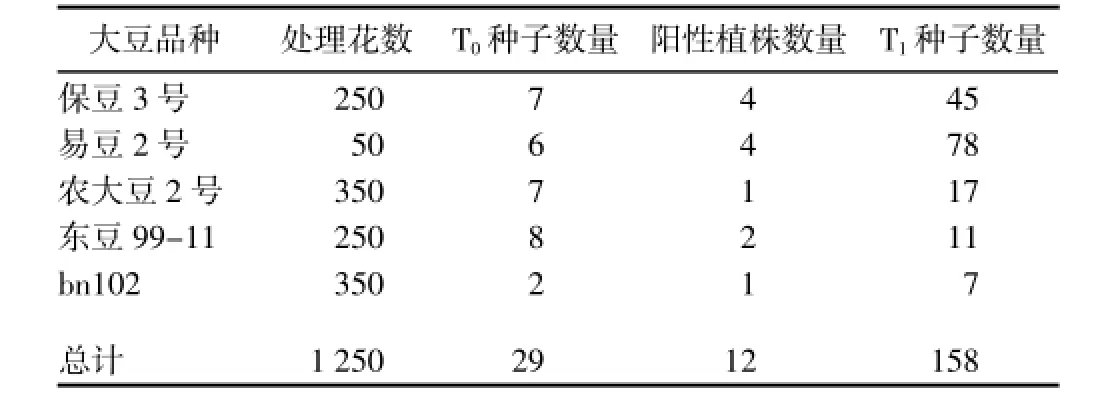
表2 转pCambia3301-ASF3H大豆新材料 (个)Table 2 Transgenic soybean germplasms with pCambia3301-ASF3H
利用高异黄酮含量大豆品种中豆27和低异黄酮含量大豆品种楚秀,分析F3H在不同大豆品种叶片和籽粒中的表达差异,证实该基因高水平表达不利于异黄酮积累。基于此,构建F3H RNAi载体并转入低异黄酮含量大豆,获得了转基因材料,为进一步选育高异黄酮含量大豆品种奠定了物质基础。Engineering,2009,11(6):355-366.
[1]Trantas Emmanouil,Panopoulos Nicklas,Ververidis Filippos.Metabolicengineeringofthecompletepathway leading to heterologous biosynthesis of various flavonoids and stilbenoids in Saccharomyces cerevisiae[J].Metabolic
[2]Richard A Dixon,Fang Chen,Dianjing Guo,Kota Parvathi.Thebiosynthesis of monolignols:a“metabolic grid”,or independent pathways to guaiacyl and syringyl units?[J].Phytochemistry,2001,57(7):1069-1084.
[3]陈宣钦,张乐,徐慧妮,陈丽梅,李昆志.大豆异黄酮生物合成关键酶及其代谢工程研究进展[J].中国生物工程杂志,2012,32(7):133-138.
[4]郭远,杨柳,王园清,薛树鹏,张娇,崔岳,陈学珍,谢皓.大豆种子发育过程中异黄酮含量的动态分析[J].农学学报,2012,2(11):1-5,36.
[5]宁海龙,金双义,王继安,孙德生,李文滨,洛育,李修平,鲁振明,朱秀清,孙树坤.大豆子粒中异黄酮含量的快速测定[J].大豆科学,2004,23(1):45-49.
[6]孙君明,韩粉霞.植物次生代谢产物异黄酮的调控机理[J].西南农业学报,2005,18(5):663-667.
[7]陈封政,王雄清,李书华.大豆异黄酮的研究进展[J].乐山师范学院学报,2002,17(4):59-61.
[8]董李平.大豆异黄酮代谢机理的研究[D].重庆:西南农业大学,2003.
[9]杨俊波,杨汉奇,李德铢,李洪涛.真双子叶基部类群十种植物的CHS基因家族成员分析[J].云南植物研究,2006,28(4):352-358.
[10]姜伊娜.大豆黄酮合成酶基因的克隆与RNA干扰调控异黄酮含量的研究[D].上海:上海交通大学,2013.
[11]Cheng H,Yang H,Zhang D,Gai JY,Yu DY.Polymorphisms of soybean isoflavone synthase and flavanone 3-hydroxylase genes are associated with soybean mosaic virus resistance[J].Molecular Breeding,2010,25(1):13-24.
[12]夏涛,高丽萍.类黄酮及茶儿茶素生物合成途径及其调控研究进展[J].中国农业科学,2009,42(8):2899-2908.
[13]马君兰,赵越.外源茉莉酸甲酯(MeJA)对大豆异黄酮合成途径的影响[J].东北农业大学学报,2011,42(5):14-18.
[14]Chang-Jun Liu,Jack W Blount,Christopher L Steele,Richard A Dixon.Bottlenecks for metabolic engineering of isoflavone glycoconjugates in Arabidopsis[J].Proceedings of the National Academy of Sciences,2002,99(22):14578-14583.
[15]Yu O,Shi J,Hession A O,Maxwell C A,McGonigle B, OdellJT.Metabolicengineeringtoincrease isoflavone biosynthesis in soybean seed[J].Phytochemistry,2003,63(7):753-763.
[16]崔艳伟,李喜焕,李文龙,常文锁,张彩英.黄淮海大豆异黄酮含量分析与特异种质遴选[J].植物遗传资源学报,2013,14(6):1167-1172.
[17]王连铮,郭庆元.现代中国大豆[M].北京:金盾出版社,2007.
[18]Derveaux S,Vandesompele J,Hellemans J.How to do successful gene expression analysis using real-time PCR[J].Methods,2010,50(4):227-230.
[19]姜伊娜.大豆黄烷酮-3-羟化酶基因(f3h)RNA干扰型载体的构建及功能验证[D].上海:上海交通大学,2009.
[20]钱丹丹,龚德顺,焦丽,翟莹,张海军,李景文,王英,王庆钰.大豆异黄酮合成关键酶基因的克隆及表达分析[J].大豆科学,2011,30(5):743-748.
[21]夏循礼,杨广笑,何光源.大豆异黄酮生物合成串联基因簇及其表达载体的构建[J].大豆科学,2009,28(1):7-10,20.
[22]郝佳,马会勤,代茹,陈尚武.大豆异黄酮代谢途径在大肠杆菌中的构建及表达[J].生物工程学报,2007,23(6):1022-1028.
[23]张艳.大豆异黄酮测定方法的优化及大豆F3H基因沉默表达载体的构建[D].吉林:吉林大学,2011.
[24]江曼.下调GhDFR和GhF3H基因对棉花生长发育的影响[D].重庆:西南大学,2013.
[25]柳青,李欣达,王玉民,孙春玉,张美萍,王义. RNAi干扰的F3H基因转化大豆的研究[J].北京农业,2010,(15):7-11.
Expression Analysis of Flavanone 3-Hydroxylase Gene and Innovation of Transgenic Elite Germplasms in Soybean
CUI Yan-wei,LI Wen-long,CHANG Wen-suo,LI Xi-huan*,ZHANG Cai-ying*
(North China Key Laboratory of Crop Germplasm Resources of Education Ministry of China,Agriculture University of Hebei,Baoding 071001,China)
Flavanone 3-hydroxylase(F3H)is an important enzyme involved in the metabolism pathway of soybean isoflavones.Analysis of the expression pattern of F3H in different soybean varieties and cultivation of the transgenic germplasms with F3H are important methods to enhance the isoflavone of soybean.In this study,the expression patterns of F3H at different developmental stages and organs in both high isoflavone content soybean variety Zhongdou 27 and low isoflavone content germplasm Chuxiu were analyzed by qPCR and transgenic elite germplasms with RNA interference vector of F3H were obtained.The results indicated that F3H showed quite different expression patterns between the two soybean varieties in the leaf.The expression level of F3H in Zhongdou 27 began falling at the R1 stage,maintained lower expression level at R2-R5 stage,increased a little bit at R6 stage and got down again at R7 stage.While in the leaf of Chuxiu,F3H showed lower expression level at R1-R4 stages,highest level at R5 stage and falling expression level at R6 stage.The expression patternsofF3Hwerealmostthesameinthe seeds of these two soybean varieties,beginning falling at stage R5 and maintaining the lower level at stages R6-R8.Based on these results,the RNA interference vector of F3H was constructed and introduced into soybean varieties through the pollentube pathway transgenic technology,and five transgenic elite germplasms were obtained by now.
Soybean;Isoflavonescontent;Flavanone 3-hydroxylase;Geneexpression;RNAinterference
S565.1
A
1008-1631(2016)02-0062-05
2015-08-11
河北省自然科学基金项目(C2013204020)
崔艳伟(1987-),女,河北衡水人,硕士,主要从事大豆分子生物学与转基因研究。E-mail:cuiyanwei07@126. com。
李喜焕(1974-),女,河北保定人,副教授,博士,主要从事大豆遗传育种与转基因研究。Tel:0312-7528122;E-mail:lixihuan@hebau.edu.cn。
通讯作者:张彩英(1960-),女,河北深泽人,研究员,博士,主要从事大豆遗传育种与转基因研究。电话:0312-7521558;E-mail:zhangcaiying@hebau.edu.cn。
