转基因鸡的染色体核型分析
2016-09-22李鹏姗雷雪芹徐廷生赵淑娟王攀林
李鹏姗,雷雪芹,2,徐廷生,2,赵淑娟,2,王攀林
(1.河南科技大学 动物科技学院,河南 洛阳 471003;2.洛阳市优质禽类种质资源与遗传繁育重点实验室,河南 洛阳 471003)
转基因鸡的染色体核型分析
李鹏姗1,雷雪芹1,2,徐廷生1,2,赵淑娟1,2,王攀林1
(1.河南科技大学 动物科技学院,河南 洛阳 471003;2.洛阳市优质禽类种质资源与遗传繁育重点实验室,河南 洛阳 471003)
为了研究外源基因p53对鸡自身染色体核型是否有影响,以含有外源基因p53的转基因公鸡为试验组,以同种非转基因公鸡作为对照组,通过外周血淋巴细胞培养法和骨髓法,制备了鸡染色体标本片。在油镜下随机选择50个染色体分散良好的细胞,测量染色体的条数、相对长度、臂比值和着丝粒指数,确定并比较转基因鸡和非转基因鸡的染色体形态。研究结果表明:试验组和对照组公鸡的染色体条数均符合2n=78条,均包括10对大染色体和29对微小染色体,且微小染色体基本为端着丝粒染色体。两组的染色体核型均由 38 对常染色体和1对同配型性染色体ZZ组成,1 号染色体、2号染色体和1对性染色体(ZZ)均为中央着丝粒(m)染色体,3号染色体均为端着丝粒(t)染色体,4号染色体均为亚中央着丝粒(sm)染色体,6~10号染色体均为端着丝粒(t)染色体。
转基因鸡;非转基因鸡;外周血淋巴细胞培养法;骨髓法;染色体核型分析
0 引言
由于禽类的生殖特点,导致转基因禽类的研究技术滞后于转基因哺乳类动物。转基因鸡作为重要的经济动物和理想的生物反应器,具有广阔的应用前景[1]。从禽蛋中收集和分离转基因蛋白质较其他方法更容易,且转基因产物不容易受到污染。在得到转基因产物的过程中,不会影响鸡自身的生长发育和健康,故可以利用转基因鸡生产大量药用蛋白。与哺乳动物生物反应器相比,鸡输卵管生物反应器因其经济、高效、稳定和周期短等多个潜在优势,被认为是具有开发前景的生产药用蛋白的技术平台之一[2]。文献[3-4]分别用不同的方法成功制备了转基因鸡。
p53基因是人体细胞中的一种抑癌基因,几乎所有的体细胞中均可检测到p53蛋白的存在[5]。此外,p53基因的成功克隆以及载体的构建为转基因动物模型的建立奠定了一定基础[6]。为了进一步确定转入的外源基因p53是否对鸡自身的染色体核型有影响,本文对体内已检测出含有外源基因p53的转基因公鸡进行核型分析,并比较转基因公鸡和非转基因公鸡的染色体形态结构,了解转基因鸡染色体形态变化特征。
1 试验材料与方法
1.1试验动物
成年转基因公鸡(经检测含有外源基因p53)和非转基因公鸡由河南科技大学试验牧场提供,品种为海兰褐壳蛋鸡。5~10日龄的转基因公鸡(经检测含有外源基因p53)和非转基因公鸡由洛阳市优质禽类遗传繁育重点实验室提供,品种为海兰褐壳蛋鸡。
1.2主要试剂与仪器
组织培养液1640,北京赛默飞世尔生物化学制品有限公司;植物血凝素(phytohemagglutinin,PHA)和秋水仙碱,北京鼎国昌盛生物技术有限责任公司;超净工作台,苏州净化设备有限公司;800-电动离心机,金坛市新航仪器厂;数显恒温水浴锅,上海博讯实业有限公司医疗设备厂;双目显微镜,上海彼爱姆光学仪器制造公司;恒温培养箱,上海贺得实验设备有限公司。
1.3试验方法
1.3.1外周血淋巴细胞培养法制备染色体标本片
将4mL组织培养液1640、0.032gNaHCO3粉末、1mL胎牛血清、1mg/mL的PHA0.833mL、500IU/mL的肝素钠0.005mL和适量双抗,一并加入培养瓶内,用质量分数为0.5%的NaHCO3溶液调节培养液pH值为7.2~7.4。用生物滤膜过滤并分装于灭过菌的培养瓶中,盖紧瓶塞。用肝素抗凝剂润湿注射器管壁,从鸡翅下静脉采血1mL,在约5mL培养基中加入全血0.3~0.5mL,置于39 ℃恒温培养箱中培养56~72h。培养结束前2~3h,加入秋水仙碱。培养结束后,经过低渗、预固定、固定、重复固定、滴片和染色等操作制备染色体标本片,通过10×100倍油镜镜检观察。
1.3.2骨髓法制备染色体标本片
取5~10日龄的转基因雏鸡,称其质量,后腹腔注射20μg/g秋水仙碱,处理2.0~2.5h。心脏压迫法猝死雏鸡,取整条鸡腿,去毛皮及其肌肉组织,取其股骨,剪去股骨两端,用10mL注射器抽取0.075mol/L的KCl溶液约5mL,反复冲洗股骨骨髓腔直至骨髓腔变白。以10mL玻璃离心管盛接细胞悬液,1 000r/min离心10min,弃上清液。标本片的制作同外周血淋巴细胞培养法。
1.3.3染色体核型分析方法
在10×100倍油镜下各随机选择50个染色体分散相良好的细胞,观察染色体的条数,最后得出转基因鸡和对照组鸡的染色体数目。再分别选择10个分散相良好的中期染色体,进行摄影,照片放大,打印,用游标卡尺直接测量前10对大染色体长度、长臂长度和短臂长度。通过文献[7]中的方法计算前10对大染色体的相对长度、臂比值和着丝粒指数,对染色体进行核型分析。
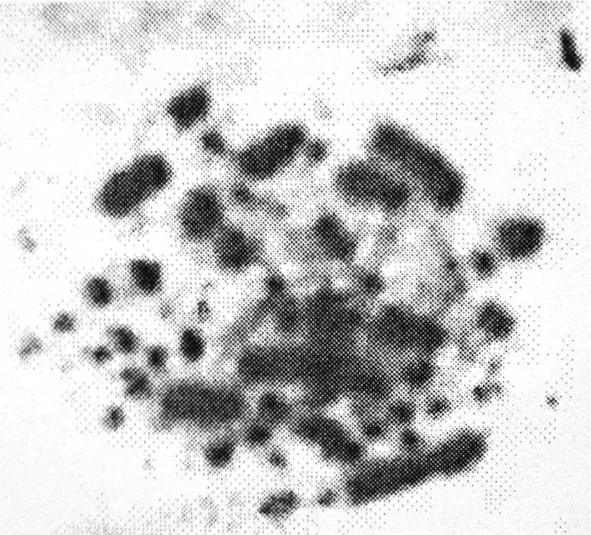
图1 外周血淋巴细胞培养法制备的转基因鸡染色体标本片
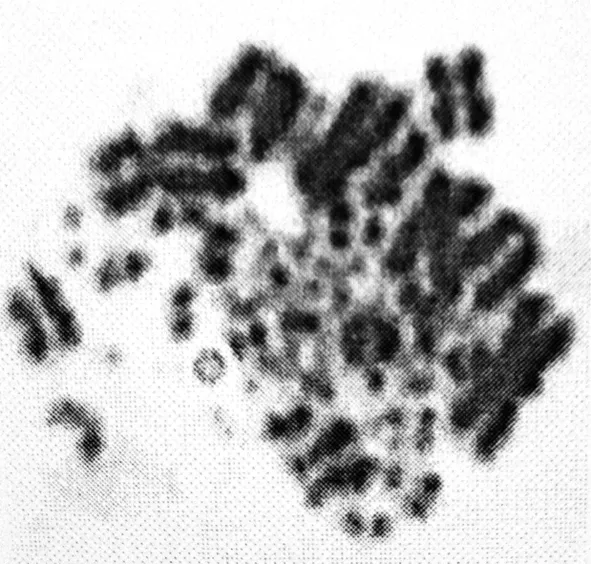
图2 骨髓法制备的转基因鸡染色体标本片
2 结果与分析
2.1染色体标本片的制备
2.1.1外周血淋巴细胞培养法制备染色体标本片
在转基因鸡外周血培养过程中,PHA的用量、秋水仙碱的用量、作用时间和温度对其淋巴细胞的增殖和分裂尤为重要。通过浓度梯度的设置,确定试验所用PHA的质量浓度为0.18mg/mL,秋水仙碱的处理时间为3h、质量浓度为0.05μg/mL,培养温度为(39.0±0.5) ℃,总培养时间为 72h,成功制备出了转基因鸡的染色体标本片,如图1所示。从图1中可以看到:转基因鸡染色体的大致形态及长度,但无法判断其着丝粒的具体位置,不能进行有效的染色体核型分析及核型图的制备。
2.1.2骨髓法制备染色体标本片
在利用骨髓法制备转基因鸡的染色体标本片中,秋水仙碱的用量和作用时间对是否能得到大量处于分裂中期的细胞有很大影响。经过浓度梯度的设置,确定秋水仙碱的用量为20μg/g,处理活体雏鸡的时间为2h,得到大量处于分裂中期的骨髓细胞,且染色体形态清晰,分散相良好,标本片如图2所示。通过图2可以清楚看到:转基因鸡的染色体形态和着丝粒的位置,可以进行后续的染色体核型分析和核型图的绘制。
采用两种不同的方法制备鸡染色体标本片,对试验步骤、试验条件和制片结果比较得出:骨髓法制备鸡染色体标本片比外周血淋巴细胞培养法制备鸡染色体标本片更有优势。
由于转基因鸡的数量有限,本试验采用骨髓法制备了转基因公鸡和非转基因公鸡的染色体标本片,并进行了染色体核型分析。
2.2二倍体(2n)细胞染色体数目
本试验随机选取转基因公鸡和非转基因公鸡的骨髓细胞各50个,观察并计算每个骨髓细胞的染色体数目,结果见表1。由表1可以看出:转基因公鸡的染色体数目2n=78;非转基因公鸡的染色体数目2n=78。
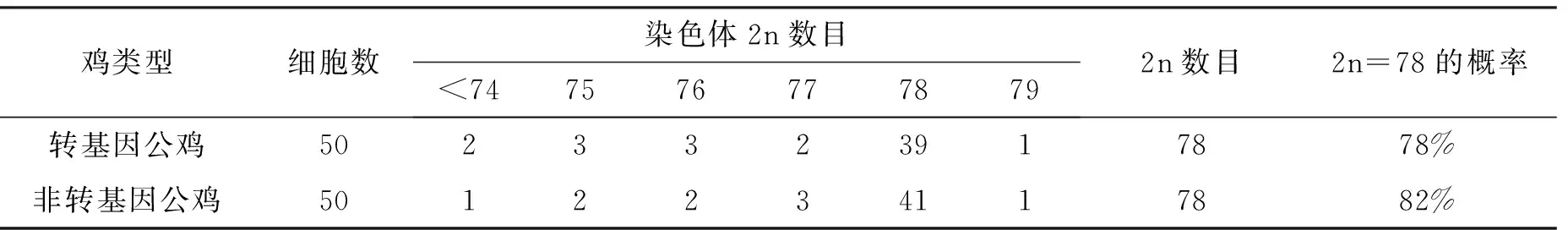
表1 转基因公鸡和非转基因公鸡骨髓细胞染色体数目
2.3染色体核型分析
对转基因公鸡和非转基因公鸡的前10对大染色体(包括1对性染色体)进行了染色体长度、长臂长度和短臂长度的测量。分别选取了10个分散相相对良好的分裂相进行测量,并求其均数和标准差,对照文献[7]的标准对转基因公鸡和非转基因公鸡的染色体核型进行分类,结果如表2和表3所示。
注:“Z”为单条性染色体;“m”为中着丝粒;“t”为端着丝粒;“sm”为亚中央着丝粒。

表3 非转基因公鸡的大染色体核型特征(均数±标准差)
注:“Z”为单条性染色体;“m”为中着丝粒;“t”为端着丝粒;“sm”为亚中央着丝粒。
由表2的结果可以确定转基因公鸡的前10对大染色体的染色体形态,其中,1 号染色体、2 号染色体和1对性染色体(ZZ)为中央着丝粒(m)染色体,3号染色体为端着丝粒(t)染色体,4号染色体为亚中央着丝粒(sm)染色体,6~10号染色体为端着丝粒(t)染色体。由表3的结果可以确定非转基因公鸡的10对大染色体的染色体形态,其中,1 号染色体、2 号染色体和1对性染色体(ZZ)为中央着丝粒(m)染色体,3号染色体为端着丝粒(t)染色体,4号染色体为亚中央着丝粒(sm)染色体,6~10号染色体为端着丝粒(t)染色体。
由表2和表3可知:转基因公鸡的单条性染色体(Z)的平均相对长度为(10.32±0.63)%,非转基因公鸡的单条性染色体(Z)的平均相对长度为(10.26±0.26)%,差异不大。其余9对常染色的平均相对长度也无明显差异。
根据表2和表3的测量结果,分别绘制了转基因公鸡和非转基因公鸡的染色体核型图,结果如图3和图4所示。通过图3和图4可以更加直观地观察到转基因公鸡和非转基因公鸡前10对大染色体的核型形态特征。
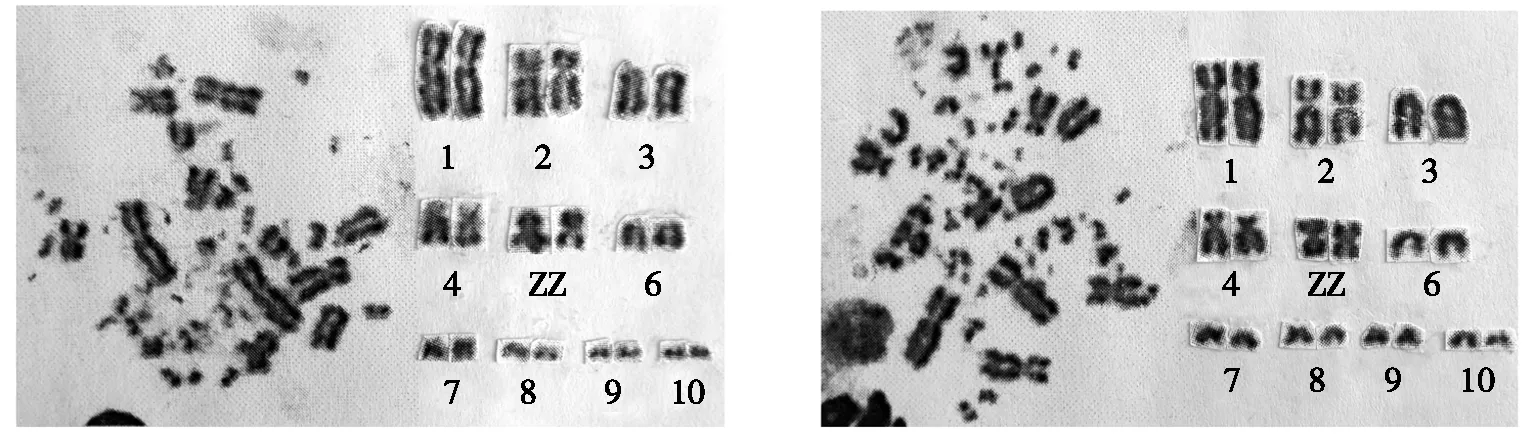
图3转基因公鸡染色体核型图图4非转基因公鸡染色体核型图
3 讨论
3.1鸡染色体标本片制备方法
在鸡外周血培养过程中,通过数次的重复培养,成功制备出了转基因鸡的染色体标本片。培养过程中各试剂的用量与处理时间参照文献[8-10]稍做改进,在其基础上探索更适合转基因鸡的培养方法。因为是不同的鸡种,对培养环境的要求会稍有不同。本文虽用外周血淋巴细胞培养法成功制备出了染色体标本片,但制片质量不佳。文献[11]曾指出在鸡染色体研究中不常采用此法,因其对设备要求严格,操作复杂,易污染。可进一步探究更加适合该转基因鸡的外周血培养方法。
在骨髓法的探索中,采用 5~10 日龄的雏鸡,秋水仙碱用量 20μg/g,秋水仙碱处理活体最佳时间为2h,与文献[12]的试验条件最接近;与文献[13]报道所用15日龄雏鸡,秋水仙碱用量3μg/g,处理活体3h不一致;与文献[14]报道所用4月龄育成鸡不一致;与文献[15-16]报道秋水仙碱用量分别为10μg/g和2μg/g不一致。造成这些差异的原因可能是不同鸡种和不同日龄的鸡所适应的最佳处理时间和秋水仙碱用量不同。
无论是外周血淋巴细胞培养法还是骨髓法,都需要经过离心、低渗、预固定、固定、重复固定、滴片和染色等过程,通过不断地探究找出同时适合两种方法的最佳处理时间。每次以1 000r/min离心10min;低渗最佳温度为 39 ℃,最佳处理时间为35min;预固定所用新配置固定液为1mL,时间为2min;固定的最佳时间为 30min。滴片的高度一定要大于30cm,才能得到大量分散良好的染色体标本,便于后续的观察与测量。染色时间为30min,染色时间过短会造成染色体着色不明显,不利于观察。
3.2染色体核型
3.2.1染色体数目
本试验所用转基因公鸡的二倍体染色体数目2n=78的细胞占所观察细胞总数的78%,所得结果与文献[17-19]研究结果接近。一般情况下认为:染色体众数的细胞占被观察细胞总数的75%以上,便可以确定试验对象的二倍体染色体数目[20]。对于染色体2n≠78的细胞,可能是由于鸡的染色体中微小染色体较多,不当的吹打和离心都会造成染色体的丢失,并且容易发生罗伯逊易位,滴片时微小染色体又极易随液体漂流而造成丢失,此外,还容易将部分未溶解的染料颗粒及其他杂质误认为是微小染色体。
3.2.2染色体形态
本试验得出该转基因公鸡与非转基因公鸡的染色体核型并无明显差异,说明外源基因p53对公鸡自身的染色体核型没有太大影响。此外,由于外源基因p53结构非常小,理论上能与鸡的染色体结合形成环状结构,因为鸡的染色体只有前10对为大染色体,其余都为微小染色体。试验结果为:该转基因公鸡的1 号染色体、2 号染色体和1对性染色体(ZZ)均为中央着丝粒(m)染色体,3号染色体为端着丝粒(t)染色体, 4号染色体为亚中央着丝粒(sm)染色体,6~10号染色体都为端着丝粒(t)染色体。这与其他文献研究结果基本相似,也存在着一些不同。文献[21]指出鸡的1 号染色体为亚中央着丝粒(sm)染色体;文献[17-18,22]指出2号染色体为亚中央着丝粒(sm)染色体;文献[12,22-23]认为7号染色体为亚中央着丝粒(sm)染色体;文献[24]指出 9 号染色体为亚中央着丝粒(sm)染色体。造成这些不同的原因可能与鸡的品种不同有关。
4 结论
(1)成功制备出了转基因公鸡和非转基因公鸡处于分裂中期且分散良好、形态清晰的染色体标本片,为含有外源基因p53的转基因鸡的进一步研究奠定了基础。
(2)含有外源基因p53转基因公鸡的染色体2n=78。染色体核型为:1 号染色体、2 号染色体和一对性染色体(ZZ)均为中央着丝粒(m)染色体,3号染色体为端着丝粒(t)染色体, 4号染色体为亚中央着丝粒(sm)染色体,6~10号染色体均为端着丝粒(t)染色体。
(3)含有外源基因p53的转基因公鸡染色体的相对长度、臂比值、着丝粒指数与非转基因公鸡基本一致,说明转基因公鸡与非转基因公鸡的染色体核型没有明显差异。
[1]王令,张涛,尹亚军.逆转录病毒载体介导的转基因鸡研究进展[J].中国家禽,2015,37(14):44-49.
[2]宋政,牛俊伟,孙晓先,等.转基因鸡输卵管生物反应器生产药用蛋白研究进展[J].中国家禽,2013,35(19):38-42.
[3]靳锴,汪怡临,左其生,等.睾丸注射Mx-NA双基因制备抗病转基因鸡的研究[J].中国家禽,2014,36(14):8-12.
[4]李林凤,浦亚斌,宫雪莲,等.鸡鸭异种间转基因嵌合体的制备[J].畜牧兽医学报,2010,41(1):10-15.
[5]SOUSSIT,CANBONFC,MAYP.Structuralaspectsofthep53proteininrelationintogeneevlution[J].Oncogene,1990,5(7):945-952.
[6]李振红,雷雪芹,徐廷生,等.早期肺癌病人血液中p53的克隆及其pEGFP-N1-p53的构建[J].河南科技大学学报(自然科学版),2011,32(2):56-59.
[7]LEVENA,FREDGEK,SANDBERGA.Nomentclatureofgreathornedowls(Bubo virginianus)[J].Cytogeneticsandcellgenetics,1964,28:79-86.
[8]孙永进,嵇宝华,韩威,等.藏鸡、茶花鸡染色体核型分析[J].中国家禽,2007,29(13):16-18.
[9]朱云芬,吴信生,徐琪,等.河南斗鸡染色体核型及G带的研究[J].中国畜牧兽医,2007,34(3):77-81.
[10]李红燕,王金富,刘凯.暗腹雪鸡染色体的核型分析[J].石河子大学学报(自然科学版),2006,24(3):294-298.
[11]王偕根,陈国宏,张学余,等.鹿苑鸡核型及其与生产性能的相关性研究[J].中国家禽,2003,25(6):7-9.
[12]赵淑娟,雷雪芹,徐廷生,等.卢氏绿壳蛋鸡染色体核型与G带分析[J].西北农林科技大学学报(自然科学版),2009,37(12):38-44.
[13]徐云龙,王嘉福,冉雪琴.珍珠鸡与家鸡的染色体核型比较分析[J].贵州农业科学,2012,40(4):159-161.
[14]郑喜邦,何宝祥.禽类染色体制备方法的比较研究[J].细胞生物学杂志,2003,25(4):254-257.
[15]黄燕,赵小平,余红,等.动物骨髓细胞染色体标本制备失败的原因分析[J].生物学通报,2006,41(1):52-53.
[16]汉丽梅,潘英树,张玉静.鸡染色体标本制备技术条件的优化[J].中国兽医杂志,2005,41(8):19-20.
[17]程光潮,吴丽城.家鸡染色体的制备及组型观察[J].遗传,1981,3(1):17-19.
[18]刘蓓一,李国祥,秦枫,等.固始鸡核型、G带的研究[J].中国家禽,2006,28(6):16-19.
[19]陈国宏,李碧春,徐琪,等.仙居鸡染色体G和Ag-NORs的研究[J].畜牧兽医学报,2004,35(2):141-145.
[20]刘友清,傅佩胜,陈艳卿.寿光鸡染色体的研究[J].山东农业科学,1993(2):13-15.
[21]李军,赵金良,刘宏赛,等.麻雀研究的新发现[J].遗传,1994,16(2):20-24.
[22]曾养志.家鸡和原鸡的染色体及G带带型比较研究[J].云南农业大学学报,1987,2(2):57-65.
[23]嵇宝华,汤道玲,卢克伦.中国地方鸡种染色体研究进展[J].上海畜牧兽医通讯,2004(5):4-5.
[24]徐琪,谢芳,李碧春.禽类染色体制备及其在育种中的应用[J].动物科学与动物医学,2003,20(2):13-15.
河南省基础与前沿技术研究计划基金项目(072300430010);洛阳市重点科技计划基金项目(1101033A)
李鹏姗(1991-),女,河南汝阳人,硕士生;雷雪芹(1962-),女,通信作者,河南洛宁人,教授,博士,硕士生导师,主要从事动物遗传资源与分子生物学方面的教学和科研.
2016-03-28
1672-6871(2016)06-0077-05
10.15926/j.cnki.issn1672-6871.2016.06.016
S831
A
