丹参在炮制大生产过程中丹酚酸B的损失情况研究
2016-09-22方欢乐陈衍斌卢新义孙宝平
方欢乐,陈衍斌,卢新义,孙宝平
(1.西安培华学院医学院,西安 710125;2.陕西步长制药有限公司,西安 710075)
丹参在炮制大生产过程中丹酚酸B的损失情况研究
方欢乐1,陈衍斌2,卢新义2,孙宝平2
(1.西安培华学院医学院,西安710125;2.陕西步长制药有限公司,西安710075)
目的考察丹参药材炮制大生产过程中指标性成分丹酚酸B的含量变化及损耗情况。方法进行10批次丹参饮片炮制生产,应用HPLC法,在生产过程各主要工艺点进行跟踪取样,测定丹酚酸B的含量并计算损耗;同时在其中一个批次药材炮制大生产过程中,检测每个工艺环节对丹酚酸B的含量的影响。结果原药材、水洗药材、润透药材和切片4个取样点丹酚酸B的平均含量分别为6.83%,4.72%,4.46%和3.55%,相对原药材的损失情况分别为30.84%,34.59%和47.99%。水洗工艺直接导致丹酚酸B损失22.11%,最终损失高达47.48%。结论严格控制(优化)水洗工艺,可有效保留丹酚酸B的含量,提高丹参的炮制效率。
丹酚酸B;丹参;炮制;损耗
丹参为唇形科植物丹参Salvia miltiorrhizaBge.的干燥根及根茎;具有活血调经、凉血消痈和养血安神的功效[1];用于胸痹心痛、脘腹胁痛、瘕瘕积聚、热痹疼痛、心烦不眠、月经不调、痛经经闭和疮疡肿痛等症状。丹参的化学成分包括脂溶性有效成分、水溶性有效成分及其他成分,丹酚酸B是主要的水溶性有效成分,被《中国药典》列为丹参含量测定指标之一。丹酚酸B是丹参治疗心血管疾病的主要药效物质基础成分之一[2],具有抗氧化、抗凝血、抗血栓形成、调血脂及细胞保护等药理作用,同时还具有保护心血管系统、肝脏、肾脏和肺等组织器官、防治糖尿病并发症及抗肿瘤等药理作用[3]。
丹参片是常用的炮制品,《中国药典》[4]规定其加工过程为:除去杂质和残茎,洗净,润透,切厚片,干燥。在饮片炮制时,存在于根皮中的水溶性有效成分丹酚酸B极易损失,李慧芬等[5]对丹参炮制前后丹酚酸B的含量变化进行了研究,陆小华[6]考察了不同炮制方法对丹参药材中丹酚酸B的影响,李懿[7]、闫东晖[8]通过不同实验研究考察了炮制对丹参有效成分含量的影响,不同炮制品中丹酚酸B的含量均明显降低,张喜锋等[9]在建立丹参饮片炮制质量标准的过程中发现,丹参片、酒丹参和醋炙丹参中水溶性成分转移率偏低。在工业化大生产过程中,受到炮制设备、炮制时间等多种因素影响,饮片中有效成分变化情况更为复杂,目前针对丹参饮片工业化大生产中丹酚酸B的含量变化情况还未见报道。本研究通过跟踪10批丹参片产业化大生产中的关键环节(水洗、浸润和切制工艺),通过大量数据测定及分析,累积多批次丹参饮片中丹酚酸B的含量变化数据,确定丹参药材炮制过程中丹酚酸B的损耗变化规律,为丹参饮片大生产提供理论依据和炮制方法改进建议。
1 仪器与试药
1.1仪器GZX-GFC.101-1-BS型电热恒温鼓风干燥箱(上海博泰实验设备有限公司);FW200A型高速万能粉碎机,HSYZ-SP型电热恒温水浴锅(北京科伟永兴仪器有限公司);MA30型快速水分测定仪(德国赛多利斯公司);AR1140型电子天平(美国梅特勒奥豪斯公司);LC-2010AHT型高效液相色谱仪(日本岛津公司);ZSX-PD-3004型切药机(江阴市奔达药化机械设备厂);010411型带式干燥机(常州市一新干燥设备有限公司)。
1.2试药丹参药材,产地山东,按照2010年版《中国药典》检验,全部合格,批号:20120202,20120203,20120204,20120205,20120206,20120301,20120302,20120303,20120304,20120305,每批5kg;丹酚酸B对照品,批号111562-201110,含量测定用,中国食品药品检定研究院;甲醇、乙腈为色谱纯;水为高纯水;其余试剂均为分析纯。
2 方法与结果
2.1丹参饮片炮制方法参照2010年版《中国药典》一部[4]丹参炮制项下方法进行操作:将丹参药材中的杂质和残茎去除,将去除了杂质和残茎的丹参药材置于洗药机中,迅速用水冲洗药材表面的泥土,冲洗过程约1min,将洗净的药材置于中转物料槽中,加盖,闷润,至药材全部润透,将润透药材用切药机ZSX-PD-3004切厚片,干燥,得丹参饮片。
2.2丹酚酸B含量测定方法
2.2.1色谱条件及系统适用性以十八烷基硅烷键合硅胶为填充剂;以甲醇-乙腈-甲酸-水(30∶10∶1∶59)为流动相;流速为1mL·min-1;检测波长为286nm。理论板数按照丹酚酸B峰计算应不低于5 000。
2.2.2对照品溶液的制备取丹酚酸B对照品74.1mg,置于50mL量瓶中,加体积分数为70%的甲醇溶解并稀释至刻度,摇匀,得质量浓度为1.482mg·mL-1的对照品储备溶液;精密吸取2mL,置于20mL量瓶中,加体积分数为70%的甲醇稀释至刻度,摇匀,得质量浓度为0.148 2mg·mL-1的对照品溶液,。
2.2.3供试品溶液的制备样品在60±5 ℃干燥后用FW200A高速万能粉碎机粉碎,过3号筛,作为供试药粉。取供试药粉0.2g,精密称定,置于具塞锥形瓶中,精密加入体积分数为75%的甲醇50mL,称定质量,加热回流1h,放冷,再称定质量,用体积分数为75%的甲醇补足减失质量,摇匀,滤过,取续滤液,即得供试品溶液。
2.2.4对照品标准曲线的制备精密吸取质量浓度为1.482mg·mL-1的丹酚酸B对照品储备溶液2,2,5,2,2和5mL,分别置于200,100,100,20,10和10mL量瓶中,配制成质量浓度分别为0.014 82,0.029 64,0.074 1,0.148 2,0.296 4和0.741mg·mL-1的丹酚酸B对照品,按照上述色谱条件,依次精密吸取对照品溶液10μL,注入液相色谱仪,测定峰面积。以对照品质量浓度为横坐标(X)、峰面积为纵坐标(Y),得回归方程:Y=12 891 035 X-19 687(r=0.999 9)。结果表明,进样量为0.148 2~7.41μg时,丹酚酸B呈良好的线性关系。
2.2.5精密度实验取丹参药材,按照2.2.3项下方法进行操作,精密吸取质量浓度为0.148 2mg·mL-1的对照品溶液和供试品溶液各10μL,分别注入液相色谱仪,供试品溶液连续进样6次,测定峰面积,计算丹酚酸B的含量,RSD值为0.52%(n=6),表明精密度良好。
2.2.6稳定性实验取丹参药材,按照2.2.3项下方法进行操作,分别在0,3,6,9,12和18h测定峰面积,计算丹酚酸B的含量,RSD值为1.02%(n=6)。表明供试品溶液在18h内稳定。
2.2.7重复性实验取丹参药材(批号20120202) 粉末6份,每份0.2g,精密称定,按照2.2.3项下方法进行操作,计算丹酚酸B的含量,结果丹酚酸B的平均含量为6.58%,RSD值为1.09%(n=6),表明重复性良好。2.2.8加样回收率实验取丹参药材(批号20120202)粉末6份,每份0.1g,精密称定,加入质量浓度为1.482mg·mL-1的丹酚酸B对照品储备液3,4和5mL各2份,按照2.2.3项下方法分别制备供试品溶液,测定丹酚酸B的含量,计算回收率。结果丹酚酸B的平均回收率为99.55%,RSD值为1.23%(n=6),表明回收率良好。结果见表1。
2.2.9样品测定分别精密吸取对照品溶液与供试品溶液各10μL,注入液相色谱仪,测定,以外标法计算丹酚酸B的含量。色谱图见图1。
2.310批丹参炮制生产丹酚酸B的损耗情况跟踪10批丹参饮片大生产,按照2.2项下方法,在4个关键点进行取样。第1个点为打开包装后取样,即原药材;第2个点为丹参药材除去杂质和残茎,快速洗净后取样,即水洗药材;第3个点为润透的丹参药材,即润透药材;第4个点为切厚片、干燥后取样,即丹参饮片。处理4个取样点的样品,测定丹酚酸B的含量,计算相对原药材的累计损失率,结果见表2。
表1加样回收率实验结果
Tab.1Resultsofrecoverytest
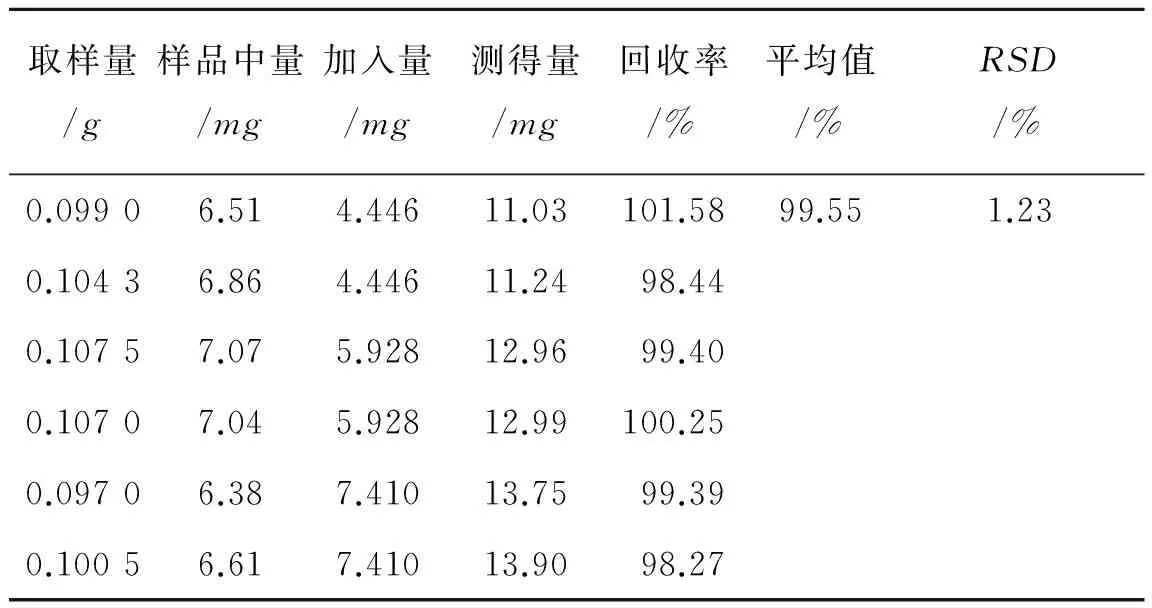
取样量/g样品中量/mg加入量/mg测得量/mg回收率/%平均值/%RSD/%0.09906.514.44611.03101.5899.551.230.10436.864.44611.2498.440.10757.075.92812.9699.400.10707.045.92812.99100.250.09706.387.41013.7599.390.10056.617.41013.9098.27
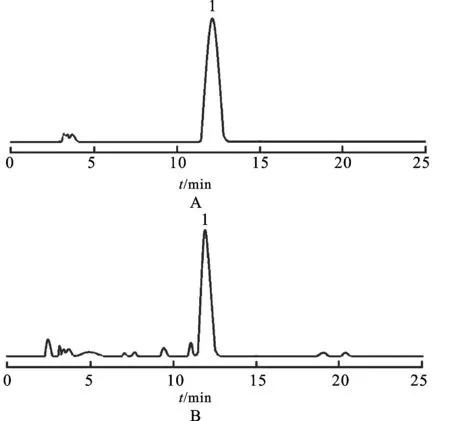
图1HPLC图
A.对照品;B.供试品;1.丹酚酸B
Fig.1HPLCchromatograms
A.referencesubstance;B.sample;1.salvianolicacidB
表2丹酚酸B的损耗实验结果
Tab.2LosstestresultsofsalvianolicacidB
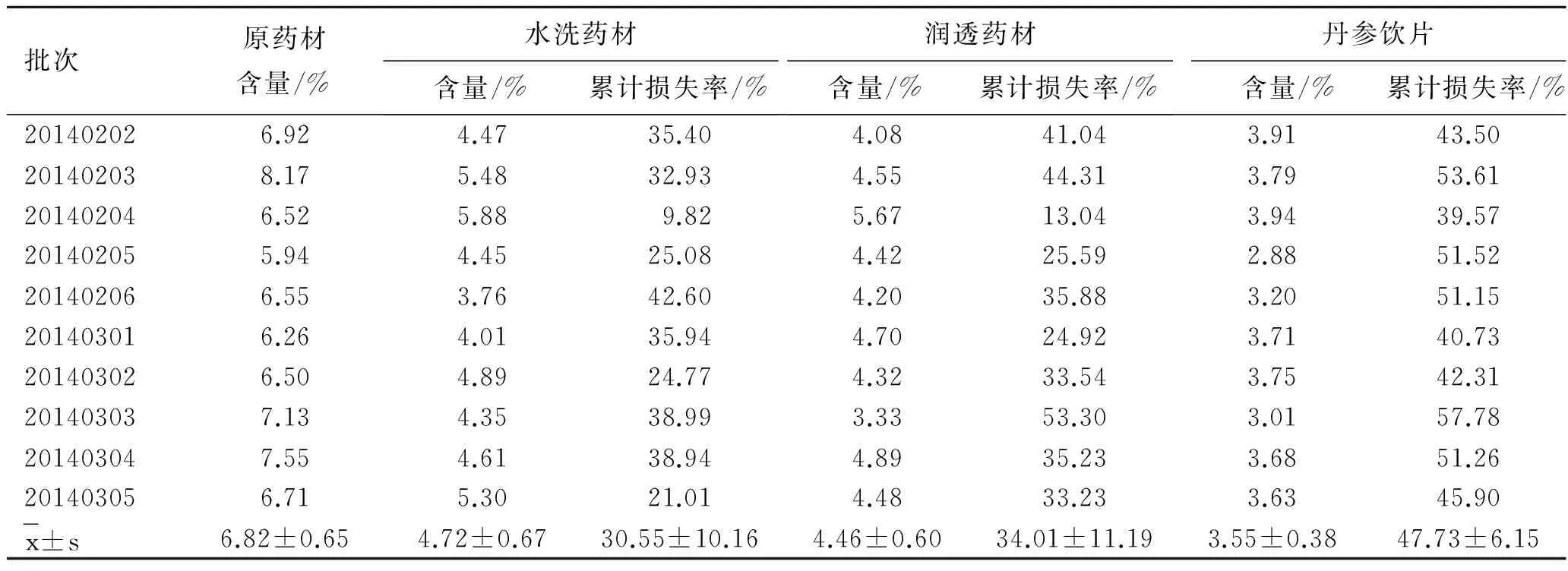
批次原药材含量/%水洗药材含量/%累计损失率/%润透药材含量/%累计损失率/%丹参饮片含量/%累计损失率/%201402026.924.4735.404.0841.043.9143.50201402038.175.4832.934.5544.313.7953.61201402046.525.889.825.6713.043.9439.57201402055.944.4525.084.4225.592.8851.52201402066.553.7642.604.2035.883.2051.15201403016.264.0135.944.7024.923.7140.73201403026.504.8924.774.3233.543.7542.31201403037.134.3538.993.3353.303.0157.78201403047.554.6138.944.8935.233.6851.26201403056.715.3021.014.4833.233.6345.90x±s6.82±0.654.72±0.6730.55±10.164.46±0.6034.01±11.193.55±0.3847.73±6.15
注:累计损失率=(原药材含量-样品含量)/原药材含量×100%。
由表2可知,在水洗、润透、切片和干燥的炮制大生产过程中,丹参原药材、水洗药材、润透药材和丹参饮片中丹酚酸B的含量呈递减趋势,同原药材相比丹酚酸B的累计损失量不断增加。由表2可知,4个取样点10批样品的平均含量分别为6.83%,4.72%,4.46%和3.55%。水洗药材、润透药材和丹参饮片与原药材比较,丹酚酸B的损失情况分别为30.84%,34.59%和47.99%。由此可见,在丹参饮片炮制大生产过程中,水洗工艺使丹酚酸B损失量最大。
2.4大生产条件下按照工艺步骤多次随机抽取样品实验跟踪20140305批药材生产过程,针对每个工艺环节进行多次取样,考察在大生产过程中,各个环节丹酚酸B的损耗情况。
打开商品包装后,按照《中国药典》取样原则直接取原药材,为1#样品;原药材拣净杂质,经洗药机清洗后取样,为2#样品;洗净药材闷润1h取样,为3#样品;洗净药材闷润2h取样,为4#样品;洗净药材闷润3h取样,为5#样品;闷润3h,药材润透,开始用切药机切厚片,经带式干燥机在70±5 ℃干燥后取样,为6#样品;闷润4h,切厚片,干燥后取样,为7#样品;闷润5h,切厚片,干燥后取样,为8#样品。每个取样点取样3份,处理各取样点的样品,测定丹酚酸B的含量,计算损耗率,其含量变化见表3。
表3按照工艺步骤多次取样测定结果
Tab.3Testresultsformultiplesamplingbyprocesssteps
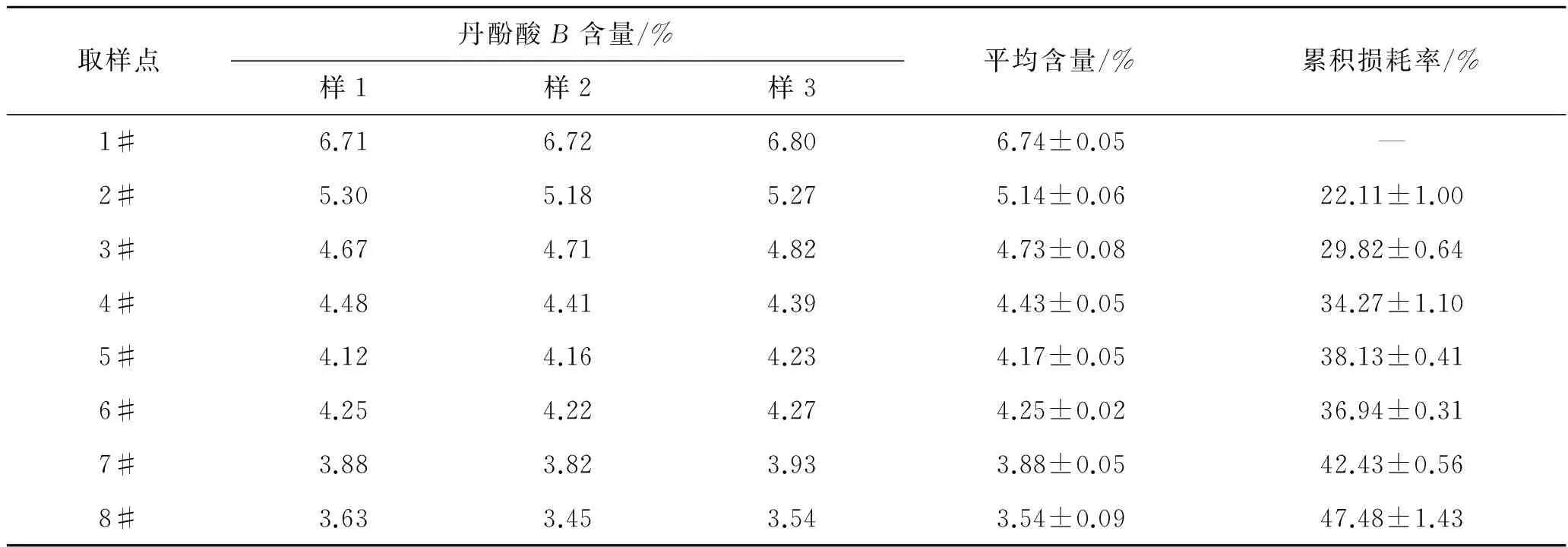
取样点丹酚酸B含量/%样1样2样3平均含量/%累积损耗率/%1#6.716.726.806.74±0.05—2#5.305.185.275.14±0.0622.11±1.003#4.674.714.824.73±0.0829.82±0.644#4.484.414.394.43±0.0534.27±1.105#4.124.164.234.17±0.0538.13±0.416#4.254.224.274.25±0.0236.94±0.317#3.883.823.933.88±0.0542.43±0.568#3.633.453.543.54±0.0947.48±1.43
由表3可知,水洗工艺直接导致22.11%的丹酚酸B损失,3#~5#为浸润工艺过程的样品、6#~8#为切制工艺过程的样品。由数据可见,在水洗过程中丹酚酸B的含量损失较大,浸润和切制工艺中丹酚酸B的含量随时间推移而不断损失,随着炮制大生产的进行,最终丹酚酸的累积损耗率高达47.48%。
3 讨论
丹参为常用中药材,饮片用量非常大,丹参饮片与丹参药材中丹酚酸B的含量有明显差异,有效成分的大量损耗导致药效降低和药材资源浪费。通过研究,掌握丹参有效成分在大生产过程中损失的规律,有益于提高丹参饮片中有效成分的含量,是一项非常有意义的课题。
丹酚酸B是丹参发挥疗效作用的主要水溶性成分之一,炮制过程中,成分损失的主要原因有:生产过程中,水洗和浸润需要大量用水,丹酚酸B溶解在水中,随洗药水的排放而流失;丹酚酸B在水中不稳定,而大生产批量大、切片时间长、未切片药材的浸润时间相对延长、含量随分解和氧化等反应发生而不断降低;切制后药材需要进一步干燥,加热过程又导致丹酚酸B的损失。
本研究显示,丹参在炮制生产过程中,水洗工艺使丹酚酸B损失量最严重,结合文献资料,对丹参饮片大生产的炮制工艺提出几条改进建议:①采用抢水洗,缩短药材与水的接触时间,同时减少用水量,以药材洁净为度,能够有效防止有效成分丹酚酸B的流失。②李智等[10]采用气相置换法进行润药,效果明显优于普通方法,此方法可以快速软化药材,软化效果良好,能够真正做到药透水尽。同时,软化后药材的水分低、易控制,有效降低了药材有效成分的损失,生产自动化大大提高了效率。③减少切制工序时间,从而减少药材与水的接触时间,快速地进入干燥工序,防止丹酚酸B的损失。④控制好干燥温度及干燥时间,朱静等[11]、张文芯等[12]研究表明,丹酚酸B对湿热不稳定,在高于70 ℃时丹酚酸B水溶液易受热分解,因此建议应用带式干燥机等快速干燥设备,温度控制在60±5 ℃,缩短干燥时间,能有效降低丹酚酸B的损耗。
掌握丹参有效成分在大生产过程中损失的规律,进行炮制工艺优化,有益于提高丹参饮片中有效成分的含量,提高丹参的炮制效率,节约企业成本,同时推动丹参的产业化大生产。
[1] 龚千峰.中药炮制学[M].北京:中国中医药出版社,2007:171.
[2] 江苏新医学院.中药大辞典[M].上海:上海人民出版社,1977:478.
[3] 赵先,王婧雯,陆杨,等.丹酚酸B药理作用的研究进展[J].西北药学杂志,2015,30(1):107-110.
[4] 国家药典委员会.中国药典2010年版[M].一部.北京:中国医药科技出版社,2013:57.
[5] 李慧芬,张学兰.丹参炮制前后丹酚酸B的含量变化[J].山东中医药大学学报,2009,33(5):434-435.
[6] 陆小华.不同炮制方法对丹参药材中丹酚酸B的影响[J].中国实验方剂学杂志,2012,18(2):103-105.
[7] 李懿.炮制对丹参有效成分含量的影响[J].科技资讯,2010,(22):221.
[8] 闫东晖.炮制对丹参有效成分含量的研究[J].当代医学,2011,17(33):150-151.
[9] 张喜锋,蒋传中,王鹏,等.丹参饮片炮制质量标准研究[J].西北药学杂志,2008,23(6):367-369.
[10]李智,刘桂萍,孙玉红.改进丹参饮片的炮制方法提高丹酚酸B含量[J].中国现代药物应用,2010,4(17):137-138.
[11]朱静,陈慧清,白鹏,等.丹酚酸B水溶液分解反应的动力学研究[J].中成药,2009,31(4):541-544.
[12]张文芯,玄律,倪健.丹酚酸B在水溶液中的稳定性研究[J].北京中医药大学学报,2009,32(12):856-858.
Salvianolic acid B losses of Salvia miltiorrhiza in processing production
FANG Huanle1,CHEN Yanbin2,LU Xinyi2,SUN Baoping2
(1.Medical College of Xi′an Peihua University,Xi′an 710125,China;2.Shannxi Buchang Pharmaceutical Limited Company,Xi′an 710075,China)
ObjectiveToinvestigatethelossesofsalvianolicacidBinSalvia miltiorrhizainprocessingprocedure.Methods10batchesofSalvia miltiorrhizaslicesprocessingprocedurewereanalyzedbyHPLCandthecontentofsalvianolicacidBlosswascalculated.ResultsThesalvianolicacidBaveragecontentoftheoriginalmedicinalherbs,watermedicinalmaterials,nourishesherbs,andthesectionfoursamplingpointswere6.83%,4.72%,4.46%and3.55%,respectively,suggestingoriginalmedicinalmateriallosseswere30.84%,34.59%and47.99%,respectively.MultiplesamplingmeasurementresultsshowedthatthewashingprocesswasthekeyprocedureofsalvianolicacidBloss.Thelosswas22.11%andthefinallosswasashighas47.48%.ConclusionTostrictlycontrol(oroptimize)thewashingprocesscaneffectivelykeepthesalvianolicacidB,andimprovetheprocessingefficiencyofSalvia miltiorrhiza.
salvianolicacidB;Salvia miltiorrhiza;processing;wastagerates
10.3969/j.issn.1004-2407.2016.05.005
R284
A
1004-2407(2016)05-0455-05
2015-11-04)
