正交实验法优选健肾Ⅰ号胶囊水煎提取工艺
2016-09-22陈梦钰牛倩倩焦海胜
陈梦钰,牛倩倩,焦海胜
(1.兰州大学药学院,兰州 730000;2.兰州大学第二医院药学部,兰州 730030)
正交实验法优选健肾Ⅰ号胶囊水煎提取工艺
陈梦钰1,2,牛倩倩1,焦海胜2*
(1.兰州大学药学院,兰州730000;2.兰州大学第二医院药学部,兰州730030)
目的优选健肾Ⅰ号胶囊水煎提取工艺。方法采用正交实验L934法,以干浸膏得率和没食子酸、红景天苷、绿原酸和咖啡酸含量的综合评分为指标,考察提取时间、液料比和提取次数对提取工艺的影响。结果影响水煎提取工艺的因素次序依次为提取时间(A)>提取次数(C)>液料比(B)。最佳提取工艺条件为A3B1C3,即处方药材加6倍量水,水煎提取3次,每次3 h。结论优选的水煎提取工艺稳定,合理可行,可用于健肾Ⅰ号胶囊的实际配制。
健肾Ⅰ号胶囊;正交实验法;水煎提取
健肾Ⅰ号胶囊(Jianshen CapsulesⅠ,JCⅠ)为兰州大学第二医院自制的中药制剂,由忍冬藤、地榆、红景天、龙葵、乌药、石韦、海金沙和益智仁8味中药制成,具有清热解毒、利湿通淋的功效,主要用于尿道炎、膀胱炎、急性肾盂肾炎和前列腺炎的治疗。为了更好地发挥其临床疗效,保证其临床疗效的稳定性,本文用HPLC法同时测定健肾Ⅰ号胶囊中没食子酸、红景天苷、绿原酸和咖啡酸的含量,采用正交实验法对其提取工艺进行了考察,为临床应用提供理论依据。
1 仪器与试药
1.1仪器Agilent 1200高效液相色谱仪,G1314B-VWD检测器,ZORBAX Eclipse XDB-C18色谱柱 (美国安捷伦公司,250 mm×4.6 mm,5 μm);ME215S型吉尼斯系列电子分析天平(德国赛多利斯仪器有限公司);CQ50超声波清洗机(上海超声波仪器厂);202A-00型恒温干燥箱(上海新正机械仪器制造有限公司);BD-11多功能紫外分析仪(北京启航博达科技有限公司)。
1.2试药方中药材均购自甘肃陇脉药材有限公司,均符合《中国药典》2010年版一部相关标准;对照品:没食子酸(批号110831-201204,供含量测定用),红景天苷(批号110818-201206,供含量测定用),绿原酸(批号110753-200413,供含量测定用),咖啡酸(批号110885-200102,供含量测定用),均购自中国药品生物制品检定研究所;甲醇、乙腈(天津市光复精细化工研究所)为色谱纯;水为蒸馏水;其余试剂均为分析纯。
2 方法与结果
2.1含量测定
2.1.1 溶液的制备
2.1.1.1 供试品溶液的制备 分别称取正交实验项下9份供试品浸膏各1.0 g,精密称定,置于具塞锥形瓶中,加甲醇20 mL,超声10 min,提取3次,合并滤液,挥干,残渣加甲醇溶解,转移至5 mL量瓶中,加甲醇定容至刻度,摇匀,过0.22 μm滤膜,取滤液作为供试品溶液。
2.1.1.2混合对照品溶液的制备精密称取没食子酸、红景天苷、绿原酸和咖啡酸对照品,加甲醇制成含没食子酸2.13 mg·mL-1、红景天苷0.60 mg·mL-1、绿原酸1.62 mg·mL-1和咖啡酸0.91 mg·mL-1的混合对照品溶液,摇匀,即得。
2.1.1.3阴性样品溶液的制备取除地榆、忍冬藤、红景天和石韦外的其他处方药材,依法制备缺少地榆、忍冬藤、红景天和石韦的水提取物阴性样品,按照2.1.1.1项下方法制得阴性样品溶液。
2.1.2色谱条件色谱柱:Agilent C18柱(4.6 mm×250 mm,5 μm);流动相[1,3]:乙腈-1 mol·L-1磷酸溶液(5∶95);流速:1.0 mL·min-1;检测波长[2-4]:0~28 min(273 nm),28~60 min(325 nm);柱温:25 ℃;进样量:5 μL。理论板数均不低于3 000,对应色谱峰的分离度均大于1.5。色谱图见图1。
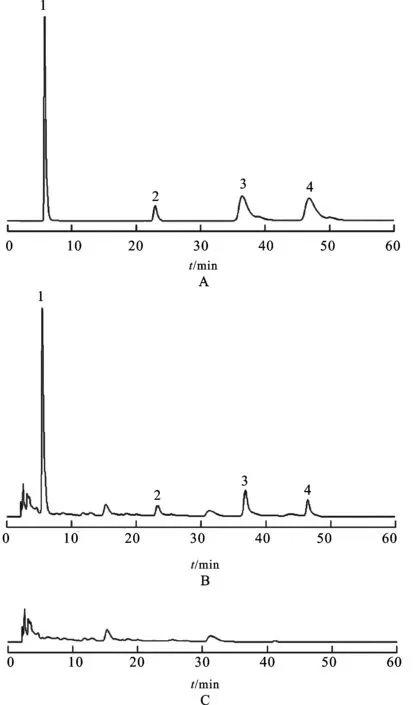
图1HPLC图
A.对照品;B.供试品;C.阴性样品;1.没食子酸;2.红景天苷;3.绿原酸;4.咖啡酸
Fig.1 HPLC chromatograms
A.reference substance;B.sample;C.negative sample;1.gallic acid;2.salidroside;3.chlorogenic acid;4.caffeic acid
2.1.3标准曲线的绘制精密量取2.1.1.2项下混合对照品溶液梯度稀释制成4份不同质量浓度的对照品溶液,分别吸取不同体积的对照品溶液进样[5-7],照2.1.2项下色谱条件,以进样量(μg)对峰面积进行线性回归,结果见表1。
表1线性关系结果
Tab.1 The results of linear relationship

成分回归方程r线性范围/μg没食子酸Y=2677.8X+129.70.99950.1078~10.65红景天苷Y=207.93X+1.94820.99990.0101~6.00绿原酸Y=2729.0X-16.8080.99970.0273~8.10咖啡酸Y=4635.3X-28.5050.99980.0154~4.55
2.1.4精密度实验精密吸取同一水提供试品溶液,按照2.1.2项下色谱条件连续进样6次,每次进样5μL。没食子酸、红景天苷、绿原酸和咖啡酸峰面积的RSD值分别为0.57%,0.65%,0.51%和0.60%(n=6)。
2.1.5重复性实验取同一批水提供试品溶液,按照2.1.2项下色谱条件,连续进样测定6次,每次进样5μL。没食子酸、红景天苷、绿原酸和咖啡酸峰面积的RSD值分别为0.92%,1.23%,1.01%和1.15%(n=6)。2.1.6稳定性实验 取同一水提供试品溶液,分别在0,2,4,8,16,24和48h进样5μL,进行测定,结果没食子酸、红景天苷、绿原酸和咖啡酸峰面积的RSD值分别为1.29%,0.96%,0.72%和0.75%。
2.1.7回收率实验称取已知含量的同一批水提供试品各0.1g,共6份,分别精密加入没食子酸、红景天苷、绿原酸和咖啡酸混合对照品溶液1mL(其中没食子酸1.12mg·mL-1、红景天苷0.13mg·mL-1、绿原酸0.12mg·mL-1和咖啡酸0.05mg·mL-1),按照供试品溶液制备方法和测定条件进行测定,记录没食子酸、红景天苷、绿原酸和咖啡酸峰面积,计算回收率,结果见表2。
表2加样回收率实验结果
Tab.2Theresultsofrecovery

成分样品中的量/mg加入量/mg测得量/mg回收率/%平均回收率/%RSD/%没食子酸0.91201.122.022398.9498.360.800.92601.122.030798.350.90351.122.016399.200.91901.122.028598.860.90431.121.999897.290.91141.122.008997.53红景天苷0.10420.130.233198.8497.601.010.10550.130.233397.910.10530.130.232297.050.10570.130.234198.490.10780.130.234697.030.10990.130.235896.27绿原酸0.10850.120.227899.3598.171.230.10770.120.224597.030.10560.120.222697.160.10620.120.223197.080.10490.120.223798.860.10890.120.228499.54咖啡酸0.04370.050.092396.8097.341.710.04490.050.093095.770.04510.050.093897.120.04620.050.094295.670.04480.050.094398.880.04310.050.093099.77
2.2正交实验设计按照处方量称取处方药材,共9份,依次按照正交实验表法进行水煎提取,合并滤液,浓缩,移至蒸发皿,置于烘箱中,60 ℃烘干至恒定质量[8]。精密称取浸膏适量,置于锥形瓶中,依法测定没食子酸、红景天苷、绿原酸和咖啡酸含量,计算浸膏得率。以干浸膏得率和没食子酸、红景天苷、绿原酸和咖啡酸含量的综合评分为指标[9],以提取时间、液料比和提取次数为考察因素,因素水平、实验结果和方差分析见表3~5。
表3健肾Ⅰ号胶囊的提取工艺正交实验因素水平
Tab.3TheextractionprocessfactorandlevelofJianshenCapsulesⅠ
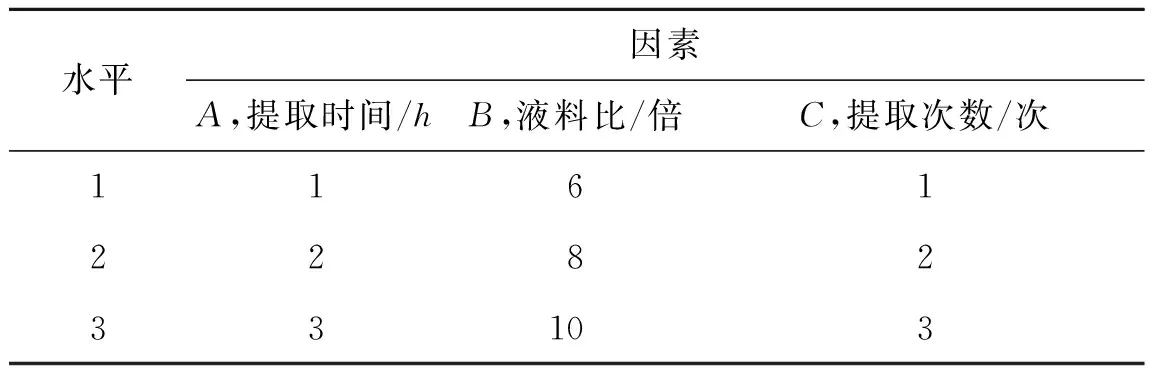
水平因素A,提取时间/hB,液料比/倍C,提取次数/次1161228233103
表4正交实验结果
Tab.4Resultsoftheorthogonaltests

编号ABCD(空白)没食子酸量/mg·g-1红景天苷量/mg·g-1绿原酸量/mg·g-1咖啡酸量/mg·g-1干浸膏得率/%综合评分111110.3810.0311.3890.21514.4116.725212227.2490.3990.9410.13420.2532.896313336.3970.4480.6580.09223.6928.949421238.9680.4412.5810.22721.2950.436522316.9540.4613.2090.10326.2746.613623127.8210.9201.1530.11916.2744.788731329.1621.0341.0840.43624.3959.191832137.1050.2291.0660.48315.6941.003933219.4480.5261.5190.29622.9648.579K126.19042.11734.17237.306K247.27940.17143.97045.625K349.59140.77244.91840.129R23.4011.94610.7468.319
注:综合评分=没食子酸量/9.448×20+红景天苷量/1.034×15+绿原酸量/3.209×20+咖啡酸量/0.443×15+干浸膏得率/26.27×30
表5方差分析结果
Tab.5Resultsofanalysisofvariance

方差来源SSfFF临界值PA997.6982167.37119.000<0.05B5.96121.00019.000>0.05C212.374235.62719.000<0.05D(误差)5.9602
由表4~5可知,各因素对提取工艺的影响顺序为A>C>B;因素A和C具有显著性影响,因素B不具有显著性影响。结合实际应用与配制,将水煎提取最佳工艺确定为A3B1C3,即加6倍量水,水煎提取3次,每次3h。
2.3验证实验称取处方药材,共3份,按照最佳工艺进行提取,结果测得干浸膏得率分别为23.90%,24.35%和24.41%;没食子酸的含量分别为9.260,9.170和9.095mg·g-1;红景天苷的含量分别为1.031,1.043和1.052mg·g-1;绿原酸的含量分别为1.082,1.079和1.057mg·g-1;咖啡酸的含量分别为0.433,0.446和0.439mg·g-1。结果表明,该提取工艺稳定可行。
3 讨论
健肾Ⅰ号胶囊组方是兰州大学第二医院在医药辨证施治原则的基础上,结合临床用药经验以及现代药理学研究成果化裁而来。为了保持中药汤剂的特点,发挥中药复方功效及其整体调理作用,结合实际中药汤剂用药情况,选取水煎提取法。健肾Ⅰ号胶囊,由忍冬藤、地榆、红景天、龙葵和乌药等8味中药组成。其中,忍冬藤为君药,其有效成分绿原酸和咖啡酸具有抗炎[10-11]、抗菌活性[12-14],具有清热解毒、通风通络功能[15];地榆、红景天为方中臣药,其中地榆的有效成分为没食子酸,具有凉血止血的功效[15];红景天的有效成分为红景天苷,具有益气活血、抗炎和增强免疫力[16-18]等作用;4种成分相辅相成发挥健肾功效。因此,选择没食子酸、绿原酸、咖啡酸和红景天苷作为筛选健肾Ⅰ号胶囊水煎提取工艺的主要指标,通过正交实验,优选健肾Ⅰ号胶囊水煎提取最佳工艺。结果显示,优选的健肾Ⅰ号胶囊水煎提取工艺稳定,合理可行,为配制该制剂提供了理论依据,可用于健肾Ⅰ号胶囊的实际配制。
没食子酸、红景天苷、绿原酸和咖啡酸均为水溶性成分,采用水煎提取工艺,既符合中药汤剂的特点,又能将药材的有效成分提取得比较完全,避免了使用其他有机溶媒可能带入的污染及毒性。符合医院制剂实际配制情况,便于患者使用和接受。综上所述,优选的健肾Ⅰ号胶囊水煎提取工艺稳定,合理可行,为配制该制剂提供了理论依据,可用于健肾Ⅰ号胶囊的实际配制。
[1]周小雅,梁光毅,刘雪梅.高效液相色谱法测定草龙中没食子酸的含量[J].西北药学杂志,2014,29(3):235-237.
[2]王曙东,苏华,陈翠,等.HPLC法测定益利康软胶囊中红景天苷的含量[J].中国药师,2012,15(8):1140-1142.
[3]陈晓鹏,鄂秀辉,夏忠庭,等.HPLC法同时定量测定养血清脑颗粒中7个主要成分[J].中成药,2013,35(9):1921-1924.
[4]樊宝娟,刘雪峰,曾爱国,等.HPLC法测定金线草不同部位没食子酸的含量[J].西北药学杂志,2014,29(6):573-575.
[5]邹盛勤,陈武.地榆中乌索酸和齐墩果酸含量的高效液相色谱测定[J].时珍国医国药,2006,17(8):1373-1374.
[6]杨静,万峰峰,蔡慧侠,等.血复生胶囊质量标准研究[J].陕西中医,2013,34(2):234-236.
[7]郭静,周春玲.口腔炎喷雾剂的质量标准研究[J].中国药师,2013,16(3):376-378.
[8]邓中银,伍振峰,艾志福,等.复方胃舒胶囊提取工艺优选及质量标准[J].中国实验方剂学杂志,2013,19(9):33-37.
[9]李军民,王娟弟,秦龙,等.正交实验法优选肝炎康胶囊的水煎提取制备工艺[J].中国药师,2014,17(10):1662-1665.
[10]杨斌,丘岳,王柳萍,等.广西山银花绿原酸体外抗炎作用及分子机制研究[J].中国药理学通报,2009,25(4):542-545.
[11]宋亚玲,王红梅,倪付勇,等.金银花中酚酸类成分及其抗炎活性研究[J].中草药,2015,46(4):490-495.
[12]TsouMF,HungCF,LuHF,etal.Effectsofcaffeicacid,chloronenicacidandferulicacidongrowthandarylamineN-acetvltransferaseactivityinShigellasonnei(groupD)[J].Microbios,2000,101(398):37-46.
[13]林学政,柳春燕,陈靠山,等.不同地域牛蒡叶绿原酸的含量比较及其抑菌实验[J].天然产物研究与开发,2004,16(4):328-330.
[14]DoqasakiC,ShindoT,FuruhataK,etal.IdentificationofchemicalstructureofantibacterialcomponentsagainstLegionellapneumophilainacoffeebeverage[J].YakuqakuZasshi,2002,122(7):487-494.
[15]国家药典委员会.中国药典2010年版[S].一部.北京:中国医药科技出版社,2010,117,179.
[16]龚舒,甘淋.红景天苷药理作用的分子机制研究进展[J].现代医药卫生,2015,31(5):696-699.
[17]丁奇,曹兵,刘熙鹏.红景天对神经系统药理作用的研究进展[J].中国临床医生,2014,42(7):23-25.
[18]张明发,沈雅琴.红景天苷及其苷元酪醇的抗炎、抗肿瘤和免疫调节作用[J].药物评价研究,2013,36(3):228-234.
Optimization of water extraction procedure for Jianshen CapsulesⅠwith orthogonal experimental design
CHEN Mengyu1,2,NIU Qianqian1,JIAO Haisheng2*
(1.College of Pharmacy,Lanzhou University,Lanzhou 730000,China;2.Department of Pharmacy,the Second Hospital of Lanzhou University,Lanzhou 730030,China)
Objective To optimize the water decocting extraction procedure for Jianshen CapsulesⅠ.Method With the comprehensive score of the yield of dry extract,gallic acid,salidroside, chlorogenic acid,and caffeic acid as index,L934orthogonal experimental design was carried out to optimize the extraction process by taking the extraction time, liquid-solid ratio and extraction times as factors. Results The influencing order of the factors was A>C>B(A: extracting time,B: liquid-solid ratio,C: extracting times). The optimal extraction conditions were A3B1C3.The optimal extraction process was as follows: the ratio of liquid-solid was 6,the extraction times were 3,the extraction time was 3 h.Conclusion This optimal water decocting extraction procedure was stable and feasible. It can be used in the real preparation for Jianshen Capsules Ⅰ.
Jianshen CapsulesⅠ;orthogonal design test;water decocting extraction
陈梦钰,女,在读硕士研究生
焦海胜,男,教授,硕士研究生导师
10.3969/j.issn.1004-2407.2016.05.004
R284
A
1004-2407(2016)05-0451-05
2015-11-23)
