一株烟草根际溶磷细菌的筛选鉴定及其培养基优化
2016-09-21刘虎侯贞易建华周东波周曙光刘凯汪城墙丁延芹杜秉海
刘虎,侯贞,易建华,周东波,周曙光,刘凯,汪城墙,丁延芹,杜秉海*
1.山东农业大学生命科学学院/山东省农业微生物重点实验室,山东泰安2710182.湖南中烟工业有限责任公司技术研发中心,湖南长沙410007
一株烟草根际溶磷细菌的筛选鉴定及其培养基优化
刘虎1,侯贞1,易建华2*,周东波2,周曙光2,刘凯1,汪城墙1,丁延芹1,杜秉海1*
1.山东农业大学生命科学学院/山东省农业微生物重点实验室,山东泰安271018
2.湖南中烟工业有限责任公司技术研发中心,湖南长沙410007
溶磷微生物可以加速土壤磷素循环,促进植物生长,具有较好的应用前景。本试验以无机磷为唯一磷源的选择性培养基从烟田土壤中筛选具有溶磷功能的细菌,同时分别运用钼锑抗显色法、Salkowski显色法对其溶磷能力、产IAA能力进行检测。通过生理生化特征和16S rRNA测序对溶磷效果较好的菌株JP6进行鉴定。通过模拟试验验证JP6对土壤中有效磷释放的影响;运用单因子试验确定最佳碳源、有机氮源、无机氮源和无机盐,并通过正交试验进行培养基配比优化。结果显示:菌株JP6具有较好的溶磷能力,发酵液中有效磷含量为50.1mg/L,同时该菌株具有产IAA能力,在R2A培养基中分泌IAA含量为128.9μg/m L,通过生理生化和16S rRNA序列比对将JP6鉴定为阴沟肠杆菌(Enterobacter cloacae),在土壤中具有较好的溶磷作用,最佳培养基配比为在10%黄豆芽基础上1.5%葡萄糖,2%豆粕,0.5%NH4Cl,0.5%CaCO3。
溶磷细菌;阴沟肠杆菌;筛选;鉴定;培养基优化
磷素是植物生长所需的重要元素,可以促进细胞分裂,提高植物的抗旱能力,同时影响植物的光合作用[1,2]以及呼吸作用。磷素在土壤中广泛存在,施用磷肥的70%~90%被固定在土壤中变成无效磷,无法被植物利用[3,4]。大量使用磷肥会增加生产成本,引起环境污染,同时会降低农产品的品质,土壤板结[5]。具有溶磷能力的植物根际促生细菌(PGPR)能够将土壤中难溶性磷转化为有效磷,为植物提供养分[6];产生长素也是PGPR直接促生机制之一[7]。细菌分泌的3-吲哚乙酸(IAA)可以增强细胞的渗透吸水能力[8],也会激发植物自身激素的分泌,从而促进植物的生长,但是也有报道单纯具有产IAA功能的菌株对作物的促生效果不明显[9]。因此利用土壤微生物的生命活动加速土壤中的磷素循环、提高植物磷素利用率,同时利用细菌产生长素共同促进植物生长具有良好的应用前景。
文献报道的溶磷细菌有芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、产碱菌属(Alcaligenes)、土壤杆菌属(Agrobacterium)、黄杆菌属(Flavobacterium)、固氮菌属(Azotobacter)、欧文氏菌属(Erwinia)、沙雷氏菌(Serratia)、硫杆菌属(Thiobacillus)、肠细菌属(Enterbacter)、微球菌属(Micrococcus)、沙门氏菌属(Salmonella)、色杆菌属(Chromabacterium)、节细菌属(Arthrobacter)、埃希氏菌属(Escherichia)、布克氏菌属(Burkholderia)、劳尔氏菌属(Ralastonia)、泛菌属(Pantoea)、不动杆菌属(Acinetobacter)[10-15]。陆瑞霞[16],李晓举[17]和李明新[18]已报道阴沟肠杆菌具有溶磷功能,但是同时具有溶磷和产生长素功能的阴沟肠杆菌少有报道。
本研究利用无机磷培养基在湖南浏阳烟科所烟田土壤中筛选出一株同时具有溶磷和产生长素功能的阴沟肠杆菌,同时对JP6进行土壤溶磷模拟试验和培养基优化试验,为该菌的工业化生产和田间应用提供参考依据。
1 材料与方法
1.1材料
1.1.1土样土样取自湖南省浏阳烟科所烟田烟草根际,存于密封袋中,4℃保存。
1.1.2培养基与试剂无机磷液体培养基:葡萄糖10 g,(NH4)2SO40.5 g,NaCl0.3 g,MgSO4·7H2O 0.3 g,FeSO40.03 g,MnSO4·H2O 0.03 g;CaCO35.0 g,KCl0.3 g,Ca3(PO4)210 g,蒸馏水定容至1000m L,pH值7.2~7.4。其中Ca3(PO4)2单独称量,每100m L分装1 g。121℃灭菌20min。
无机磷固体培养基:同上添加琼脂18~20 g。
R2A培养基:酵母粉0.5 g,胰蛋白胨0.5 g,酪蛋白氨基酸0.5 g,葡萄糖0.5 g,可溶性淀粉0.5 g,磷酸氢二钾0.3 g,MgSO4·7H2O 0.05 g,丙酮酸钠0.3 g溶于1 L水中,用K2HPO4和KH2PO4将pH调至7.2,121℃灭菌20min。
初始发酵培养基:黄豆芽100 g,蔗糖50 g,pH自然。新鲜黄豆芽100 g,加水100m L,煮沸30min,用纱布过滤。用水补足原量,再加入蔗糖50 g,煮沸溶化。121℃灭菌20m in。
LB培养基:酵母膏5 g,蛋白胨10 g,NaCl10 g,琼脂15~20 g,蒸馏水定容至1000m L pH 7.0,121℃灭菌20min。
Salkowski显色液:500m L 35%HClO4,10m L 0.5mol/L FeCl3。
1.2方法
1.2.1溶磷菌的分离纯化称新鲜土壤10 g,置于内含玻璃珠和90m L无菌水的250m L三角瓶中,170 r/min振荡30min,然后系列梯度稀释,将10-5、10-6、10-7梯度取0.1m L涂布于无机磷培养基平板上,每个梯度重复3次,置于28℃培养24~48 h。采用溶磷圈方法[19]筛选,挑取产生透明圈的分离物进行纯化。将纯化的细菌分离物点接到无机磷培养基上,28℃,培养4 d,测定溶磷圈直径D,菌落直径d,并测量溶磷比(溶磷圈直径/菌落直径),筛选出效果较好的菌株。
1.2.2溶磷菌发酵液有效磷含量测定采用钼锑抗显色方法[20]对初筛效果较好的菌株进行溶磷能力测定。具体操作如下:(1)绘制标准曲线:在6个50m L容量瓶中分别加入0m L、0.1m L、0.2m L、0.3 m L、0.4m L、0.5m L的100mg/m L的磷标准溶液,加2滴2,6-二硝基苯酚作为指示剂,加钼锑抗显色剂5m L,定容至刻度,使标准磷浓度分别为0mg/L、0.2mg/L、0.4mg/L、0.6mg/L、0.8mg/L、1.0mg/L,摇匀。在室温下反应30m in后,用紫外分光光度计在720 nm处比色,根据结果绘制标准曲线。(2)发酵液制备:将活化好的菌株接种到LB斜面培养基上,37℃培养2 d。将生长好的菌苔用无菌水进行适当稀释,制成108cfu/m L菌悬液。按1%接种量接至50m L液体溶磷培养基中,对照以无菌水代替,每处理5个平行,180 r/m in,30℃,摇床中培养4 d。(3)测定方法:将发酵液转移至离心管,超声波细胞粉碎处理20m in;4000 rpm/m in,离心20min后吸取上清液待测;吸取适量上清液于50m L容量瓶中,用水稀释至总体积约3/5处,加入2~3滴2,4-二硝基酚,并调pH至溶液刚呈微黄色,加入5m L钼锑抗试剂,摇匀,加水定容,室温放置30m in,720 nm处比色。根据标准曲线算出磷浓度,并计算发酵液中有效磷含量。
1.2.3产IAA能力测定采用Salkowski显色方法[21],计算菌浓度OD600值为1时,单位体积发酵液中IAA含量;标准曲线由100μg/m L的分析纯IAA标准液系列稀释0,0.5,1.0,5.0,10.0,15.0,20.0,25.0 μg/m L,显色方法同上,分光光度法测定OD530,以OD530为横坐标,IAA浓度为纵坐标绘制标准曲线。
1.2.4溶磷菌株的鉴定溶磷菌的16S rRNA鉴定:对纯化的菌株进行液体培养,利用细菌基因组DNA提取试剂盒(天根生化科技(北京)有限公司生产)提取细菌总DNA。采用细菌通用引物27F/1492R进行PCR扩增。PCR扩增体系为25µL体系:10×缓冲液2.5µL,Taq酶0.5µL,dNTPs2µL,引物27F 0.5µL,引物1492R 0.5µL,DNA模板1µL,ddH2O 18µL。反应程序设定为95℃预变性5m in;94℃变性50 s,56℃退火30 s,72℃延伸1.5min,循环次数30次,72℃再延伸10m in,4℃保存。将PCR扩增产物送往上海铂尚生物公司测序。测序结果使用NCBI数据库比对,并构建系统进化树。
生理生化鉴定:将菌株接种到LB固体培养基上,37℃培养24 h,对菌株进行菌落形态描述,并根据《常用细菌系统鉴定手册》[22]对菌株进行革兰氏染色以及生理生化鉴定。
1.2.5模拟条件下JP6对土壤有效磷释放的影响取250 g研磨过筛后的土于250m L三角瓶中,接种培养至对数期的JP6菌液,每瓶按18%接种量添加于上述三角瓶中混匀,调整土壤湿度为最大持水量的60%,然后用棉塞封闭三角瓶,在培养箱中25℃避光培养,每20 d取样1次,测定土壤中有效磷含量,测定方法参照《土壤农化分析》[23]。
1.2.6培养基优化将活化好的菌种接种到LB培养基,37℃,190 r/m in,摇床培养10 h,制成种子液。
(1)单因子试验:最佳碳源的筛选:在初始发酵培养基中分别加入2%蔗糖、葡萄糖、麦芽糖、乳糖、玉米粉和可溶性淀粉作为碳源替代蔗糖50 g,按0.2%的接种量向培养基中接种种子液,37℃,190 r/min,摇床培养15 h,测定OD600的吸光值。
最佳有机氮源的筛选:在发酵培养基中分别加入1%氮源(蛋白胨、酵母粉、豆饼粉作为氮源,碳源为最佳碳源,发酵条件同上。
最佳无机氮源的筛选:在发酵培养基中分别加入0.5%的尿素、(NH4)2SO4、NH4NO3、NH4Cl作为无机氮源,同时加入相应的最佳碳源和最佳有机氮源,发酵条件同上。
最佳无机盐筛选:在发酵培养基中分别加入0.3%的MgSO4、KH2PO4、K2HPO4、CaCO3作为无机盐,同时加入相应的最佳碳氮源,发酵条件同上。
(2)正交试验根据单因子试验结果,选取有利于菌体生长的碳源、有机氮源、无机氮源和无机盐进行正交试验。
确定最佳组合后,接种0.2%种子液,37℃,190 r/m in,培养24 h,采用稀释涂布平板法进行菌落计数。
2 结果与分析
2.1溶磷菌的筛选
从土壤样品中共分离得到15个具有溶磷功能的细菌分离物。选择溶磷能力较好的一株细菌分离物标记为JP6。JP6的溶磷圈直径D为13mm,菌落直径d为5.0mm,溶磷比D/d为2.6。JP6在无机磷培养基上的效果图见图1。

图1 JP6在无机磷培养基上的溶磷圈Fig.1Phosphorus solubilizing halo of JP6 on inorganic phosphorusmedium
2.2功能测定
溶磷能力测定:利用钼锑抗比色法对JP6菌株的溶磷能力进行定量测定,测得28℃培养7 d的发酵液中的有效磷含量达到50.1mg/L。
产IAA能力测定:经Salkowski显色方法测得JP6菌株28℃在R2A培养基中培养4 d的发酵液中的IAA含量达到128.9μg/m L。
2.3JP6菌株鉴定
2.3.1生理生化实验JP6的菌体为短杆状,菌体长为6.5~8.7μm。经革兰氏染色发现JP6菌株为革兰氏阴性菌。JP6在LB固体培养基上的菌落特征为:圆形,边缘整齐,表面光滑,湿润,凸起,易于挑取。JP6的部分生理生化指标见表1。JP6与阴沟肠杆菌(Enterobacter cloacae)模式种的生理生化具有相同特征,由各项生理生化推断JP6可能为阴沟肠杆菌。
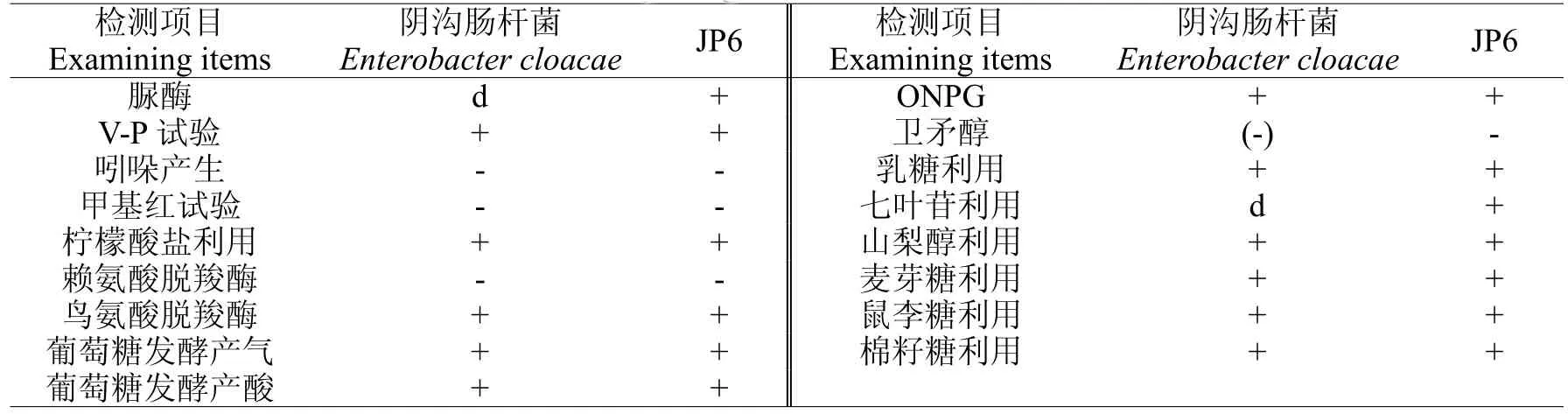
表1 生理生化检测Table 1 Physiologicaland biochem ical test
2.3.216s rRNA鉴定

图2 JP6系统发育树Fig.2 Phylogenetic tree of JP6
对16S rRNA序列进行测序后,将序列提交至GenBank中,获得序列号(KU160628),在NCBI中进行BLAST比对发现JP6菌株的16S rRNA序列与阴沟肠杆菌(Enterobacter cloacae)(JQ038222.1)相似度为99%。由图2系统发育树可以看出JP6菌株与阴沟肠杆菌(Enterobacter cloacae)(JQ038222.1)同处最小的一个分支,进化距离较近,综合生理生化指标将JP6菌株鉴定为阴沟肠杆菌(Enterobactercloacae)。
2.4模拟条件下JP6对土壤有效磷释放的影响
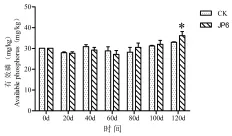
图3 有效磷含量随天数变化Fig.3 Phosphorus content changesw ith the days
对照组CK和JP6组的模拟试验结果(图3)显示:与初始土壤相比,前60 d土壤中的有效磷含量减少。60 d以后CK和JP6组的有效磷含量开始增加。其中CK组的土壤有效磷含量增加缓慢,JP6处理组在80 d时土壤有效磷含量高于CK,并且超过初始值。CK组在100 d和120 d时有效磷含量也高于初始值。与对照相比,JP6组80 d、100 d的有效磷含量分别增加2.16%、2.59%;120 d时,JP6组土壤中的有效磷含量在0.05水平上显著高于CK组,与CK相比,JP6的有效磷含量增加9.84%。
2.5培养基优化
2.5.1单因子试验

表2 碳源的优化Table 2Optim ization of carbon source
根据发酵液在600 nm处的吸光度值可以对细菌生长量做一个初步判断。表2显示不同碳源的OD600值大小为葡萄糖>乳糖>蔗糖>麦芽糖>玉米粉>可溶性淀粉,所以JP6的最佳碳源为葡萄糖。

表3 氮源优化Table 3Optim ization for nitrogen source
发酵15 h后对发酵液进行OD600的测定,3种有机氮源的OD600值大小为:酵母粉>豆粕>蛋白胨,确定JP6的最佳有机氮源为酵母粉。由于JP6在酵母粉和豆饼粉中的生长量相差不大,同时考虑到生产成本,所以选择豆粕作为最佳有机氮源。
在无机氮源的选择中发现NH4Cl的OD600值要高于(NH4)2SO4、尿素、NH4NO3,故此确定JP6的最佳无机氮源为NH4Cl。

表4 无机盐优化Table 4Optim ization of inorganic salt
在确定最佳碳源和氮源的基础上对无机盐进行优化,在豆芽汁培养基中分别加入0.3%的MgSO4、K2HPO4、KH2PO4、CaCO3。对OD600的值进行比较,发现CaCO3>KH2PO4>K2HPO4>MgSO4。由此可以看出JP6的最佳无机盐为CaCO3。
2.5.2正交试验根据单因子试验确定的最佳碳源、有机氮源、无机氮源和无机盐,选取葡萄糖(A),豆粕(B),NH4Cl(C),CaCO3(D)进行4因素3水平正交试验,试验设计如表5所示。

表5 正交试验设计Table5Orthogonalexperimentaldesign

表6 正交试验结果Table6 The resultsof orthogonalexperiment
对正交试验结果进行极差分析可以得出四种因素的极差值大小排列为RA>RD>RC>RB(见表6),可以判断影响发酵液中JP6菌体数量的主要因素是葡萄糖(A),其次为CaCO3(D)和NH4Cl(C),豆粕(B)影响最小。
根据正交试验所得的K值大小可以确定JP6的最佳培养基为在10%黄豆芽基础上添加1.5%葡萄糖,2%豆粕,0.5%NH4Cl,0.5%CaCO3。利用最佳培养基,0.2%接种量,37℃,190 r/m in,培养24 h,发酵液中JP6活菌数达到7.55×109cfu/m L,而在初始发酵培养基中活菌数为5.92×108cfu/m L,活菌数大幅度增加。
3 讨论
本试验从取自湖南官地坪烟科所烟田的烟草根际土壤中分离筛选得到JP6菌株。经形态和生理生化鉴定,以及16S rRNA测序将JP6鉴定为阴沟肠杆菌(Enterobacter cloacae)。JP6菌株发酵液中的有效磷含量达到50.1mg/L,发酵液中的IAA含量达到128.9μg/m L。固体培养时,JP6菌株的溶磷比为2.6,而李明新报道的阴沟肠杆菌C-12[18]的溶磷比为2.0。C-12发酵液中有效磷含量为210.6mg/L,而JP6的发酵液中有效磷含量为50.1mg/L,这是由接种量不同导致的,试验中C-12进行液体培养时接种量为4%,JP6进行液体培养时接种量为1%。与李晓举[17]、李明新[18]报道的阴沟肠杆菌相比,JP6还兼有产生长素功能。在土壤模拟试验中发现土壤中有效磷含量在前期出现降低的现象,可能原因是土壤进行自然风干处理,未进行彻底灭菌,当土壤的水分、培养温度适宜时土壤微生物的休眠体(如芽孢)萌发,而休眠体萌发过程需要消耗土壤中的磷素,用于合成细胞结构,前期出现下降。随着试验时间的延长,CK组的土壤有效磷含量出现增加的现象,可能是因为土壤中存在的具有溶磷作用的微生物如芽孢杆菌会发挥溶磷功能[24],能够降解土壤中的难溶磷,引起土壤中有效磷含量的增加。JP6组的土壤有效磷含量在整个试验过程中与CK组变化趋势一致,但前60 d有效磷含量低于CK组,可能原因是接种JP6菌剂后,土壤中微生物的含量短时间内大量增加,微生物为维持生命活动消耗大量可溶性磷素,因此JP6土壤中有效磷含量比CK减少幅度大。在80 d后JP6组的土壤有效磷含量高于对照,推测原因是JP6具有溶磷功能,接种JP6后,经过一段时间适应土壤环境,开始加速土壤中难溶磷的分解。在120 d时,JP6组的有效磷含量与CK在0.05水平达到显著差异,增加9.84%。
4 结论
本试验筛选出兼有溶磷和产生长素功能的阴沟肠杆菌JP6菌株,通过模拟试验验证JP6在土壤中具有较好的溶磷作用,试验中运用单因子试验和正交试验两种方法对JP6的液体摇瓶发酵培养基进行优化。优化后的最佳培养基是在10%黄豆芽基础上添加1.5%葡萄糖,2%豆粕,0.5%NH4Cl,0.5% CaCO3。利用稀释涂布平板法计数,发现优化后的培养基能有效促进阴沟肠杆菌JP6菌株的生长,为阴沟肠杆菌JP6菌株下一步的实验室培养、工业化生产以及农业生产应用提供理论依据。
[1]司辉,孙敬国,闫铁军,等.肥料对烤烟产量和品质影响的研究进展[J].安徽农业科学,2008,36(31):13713-13715,13719
[2]张岁岐,山仑,赵丽英.土壤干旱下氮磷营养对玉米气体交换的影响[J].植物营养与肥料学报,2002,8(3):271-275
[3]潘建刚,常亚,高国日,等.无机解磷菌的分离鉴定及解磷条件优化[J].广东农业科学,2015(6):56-59
[4]Behera BC,Singdevsachan SK,M ishra RR,et al.Diversity,mechanism and biotechnology of phosphate solubilising microorganism inmangrove——A review[J].Biocatalysisand Agricultural Biotechnology,2014,3(2):97-110
[5]银婷婷,王敬敬,柳影,等.高效解磷菌的筛选及其促生机制的初步研究[J].生物技术通报,2015,31(12):234-242
[6]王岳坤,于飞,唐朝荣.海南生态区植物根际解磷细菌的筛选及分子鉴定[J].微生物学报,2009,49(1):64-71
[7]郑国华,王金昌,王小红.植物根际细菌的促生机制[J].江西科学,2012,30(4):454-458
[8]占新华,蒋延惠,徐阳春,等.微生物制剂促进植物生长机理的研究进展[J].植物营养与肥料学报,1999,5(2):2-10
[9]王奎萍,郑颖,褚光耀,等.解磷、固氮、产吲哚乙酸微生物菌株的筛选及其对植物的促生效果[J].江苏农业学报,2013,29(6):1352-1359
[10]张爱民,李乃康,赵钢勇,等.土壤中解磷、解钾微生物研究进展[J].河北大学学报:自然科学版,2015,35(4):442-448
[11]黄达明,李倩,管国强,等.一株解磷细菌的筛选、鉴定及其溶磷培养条件的优化[J].生物技术通报2015,31(2):173-178
[12]黄雪娇,王晗,李振轮.解磷微生物的研究进展[J].安徽农业科学,2013,41(19):8083-8084,8087
[13]刘盼,赵华,林广修,等.解磷菌的筛选及培养基成分对解磷能力的影响[J].天津科技大学学报,2015,30(6):17-22
[14]史国英,莫燕梅,岑贞陆,等.一株高效解无机磷细菌BS06的鉴定及其解磷能力分析[J].微生物学通报,2015,42(7):1271-1278
[15]陈倩,刘善江,白杨,等.山西矿区复垦土壤中解磷细菌的筛选及鉴定[J].植物营养与肥料学报,2014,20(6):1505-1516
[16]陆瑞霞,王小利,李显刚,等.地八角根际溶磷菌溶磷能力及菌株特性研究[J].中国草地学报,2012,34(4):101-108
[17]李晓举,吴风光,王豹祥,等.一株烤烟根际解磷细菌的鉴定及其在烤烟生产中的应用[J].河南农业科学,2011,40(6):66-70
[18]李明新.土壤中溶无机磷细菌的分离、鉴定及阴沟肠杆菌溶无机磷基因的克隆[D].北京:中国农业科学院,2005
[19]金术超,杜春梅,平文祥,等.解磷微生物的研究进展[J].微生物学杂志,2006,26(2):73-78
[20]林启美,王华,赵小蓉,等.一些细菌和真菌的解磷能力及其机理初探[J].微生物学通报,2001,28(2):26-30
[21]Glickmann E,Dessaux Y.A critical exam ination of the specificity of the salkowski reagent for indolic compounds produced by phytopathogenic bacteria[J].Applied and environmentalmicrobiology,1995,61(2):793-796
[22]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001
[23]鲍士旦.土壤农化分析[M].第3版.北京:中国农业出版社,2013
[24]柯春亮,陈宇丰,周登博,等.香蕉根际土壤解磷细菌的筛选、鉴定及解磷能力[J].微生物学通报,2015,42(6):1032-1042
Isolation and Identification of Tobacco Rhizosphere Phosphate Solubilizing Bacteria and Optimization of Medium
LIU Hu1,HOU Zhen1,YIJian-hua2*,ZHOU Dong-bo2,ZHOU Shu-guang2,LIU Kai1,WANGCheng-qiang1,DINGYan-qin1,DU Bing-hai1*
1.CollegeofLifeSciences/Shandong AgriculturalUniversity;Shandong Key LaboratoryofAgriculturalMicrobiology,Taian271018,China
2.Research&DevelopmentCenterofChinaTobaccoHunan IndustrialCo.Ltd,Changsha410007,China
The phosphate-solubilizing bacterium was isolated w ith selectivemedium in this test.The strain was identified by 16S rRNA sequence analysis and biological characteristics including phosphate solubilization and IAA secretion.The capability of phosphate-solubilization and the production of IAA were detected by themethod of Mo-Sb colorimetry and Salkowski colorimetry.The effect of JP6 on available phosphorus in soil was verified by simulated experiments.The one factor test and the orthogonal testwere used for the optimization of a liquid culturemedium for Enterobacter cloacae JP6. The results showed that JP6 possessed the capacity of phosphate solubilization.The available phosphoruswas dissolved by JP6 as high as 50.1 mg/L in liquid culturemedium.IAA was secreted by JP6 as high as 128.9μg/m L in the R2A medium. With the culturalandmorphological characteristics,combined with 16s rRNA sequence analysis,the strain JP6was identified as Enterobacter cloacae.When the culturemedium containing 10%soybean sprouts,1.5%glucose,2%soybeanmeal,0.5% NH4Cl,and 0.5%CaCO3,the grow th of Enterobacter cloacae could increase significantly.It has a good role in dissolving phosphorus.Theoptimized culturemedium could promote thegrow th of JP6 effectively.
Phosphate-solubilizing bacteria;Enterobacter cloacae;isolation;identification;optimization ofmedium
S154.39
A
1000-2324(2016)04-0514-06
2016-04-19
2016-06-16
湖南中烟工业有限责任公司科技项目(2011-yc-0002);山东省重大科技专项(2015ZDXX0502B02)
刘虎(1990-),男,山东临沂人,在读硕士研究生,研究方向:环境微生物学.E-mail:liuhu20090905@163.com
Author for correspondence.E-mail:yijh0516@hngytobacco.com;du_binghai@163.com
