小麦蛋白磷酸酶2A基因TaPP2AbB″-α启动子的克隆及表达分析
2016-09-21珩李昂刘惠民景蕊莲
扆 珩李 昂刘惠民景蕊莲,*
1山西大学生物工程学院, 山西太原 030006;2农作物基因资源与基因改良国家重大科学工程 / 中国农业科学院作物科学研究所,北京 100081
小麦蛋白磷酸酶2A基因TaPP2AbB″-α启动子的克隆及表达分析
扆 珩1, 2李 昂2刘惠民1景蕊莲2,*
1山西大学生物工程学院, 山西太原 030006;2农作物基因资源与基因改良国家重大科学工程 / 中国农业科学院作物科学研究所,北京 100081
植物蛋白磷酸酶2A (protein phosphatase 2A, PP2A)由结构亚基A、调节亚基B和催化亚基C组成, 在应答逆境胁迫途径中发挥着重要作用。小麦基因TaPP2AbB″-α是调节亚基亚家族B″的成员, 过量表达该基因可以促进拟南芥的根系生长及侧根发育, 在盐胁迫和渗透胁迫条件下的作用更显著。本研究从小麦(Triticum aestivum L.)抗旱品种“旱选10号”基因组中克隆了TaPP2AbB″-α基因的启动子PB″α, 序列长度为1899 bp, 含有TATA-box和CAAT-box,以及响应干旱和渗透胁迫的顺式作用元件EECCRCAH1 (-1058 bp至-1052 bp)、GCCCORE (-1073 bp至-1068 bp)和MYCCONSE (-1179 bp至-1174 bp)。将启动子PB″α和5种5′端缺失启动子片段与报告基因GUS (β-glucuronidase)连接后转化拟南芥, 组织化学染色结果显示 PB″α在植株的叶片和根中均有表达。5′端缺失分析表明缺失片段PB″α-1545和PB″α-1389具有启动子活性, 活性区域位于-1389 bp和-946 bp之间。GUS定量分析结果显示, 在盐和渗透胁迫条件下, PB″α、PB″α-1545和PB″α-1389的活性显著上升。本研究表明PB″α具有较强的启动子基本活性, 并且在盐胁迫及渗透胁迫条件下活性显著上升, 该结果为合理选用启动子改良作物提供了依据。
小麦; 蛋白磷酸酶2A; 启动子; 顺式作用元件; GUS组织化学染色; GUS定量分析
非生物胁迫是影响植物生长发育的重要因素,为减少胁迫损伤, 植物体能调动多种基因应答逆境胁迫。这些基因分为两大类, 一类是功能基因, 例如水通道蛋白、蛋白酶、解毒酶基因等; 另一类是调节基因, 包括蛋白激酶、蛋白磷酸酶、转录因子基因等[1]。蛋白磷酸酶 2A (protein phosphatase 2A,PP2A)是一类重要的丝氨酸/苏氨酸(Ser/Thr)蛋白磷酸酶, 可以调节多种细胞活动, 例如转录、翻译、新陈代谢和细胞凋亡等[2-3], 参与多种信号转导反应,如ABA信号、油菜素内酯信号、生长素信号等[4-6],同时PP2A参与对逆境胁迫的响应并发挥重要作用。例如, 在渗透胁迫条件下, 拟南芥PP2A通过作用于生长素的重新分配正向调节植株根系建成[7]。拟南芥PP2Aa1、PP2A-C3和PP2A-C4参与生长素信号途径, pp2aa1突变体、pp2a-c3/pp2a-c4双突变体的生长发育严重受阻; PP2Ac1、PP2Ac2和PP2Ac5参与逆境、ABA和油菜素内脂信号途径[4,6]。小麦TaPP2Ac-1对于干旱胁迫有明显响应[8]。
PP2A是由结构亚基A (PP2Aa)、调节亚基B (PP2Ab)和催化亚基C (PP2Ac)构成的异三聚体蛋白磷酸酶。调节亚基PP2Ab控制底物与催化亚基活性位点的结合, 有4个家族, 分别是B (B55、PR55、PPP2R2)、B′ (B56、PR61、PPP2R5)、B″ (PR72、PPP2R3)和B′′ (PR93/PR110)[9]。对PP2Ab的研究,首先是在动物上开展的[10-11], 而在植物上的研究相对滞后。目前, 已报道拟南芥有17个PP2Ab基因, 包括2个PP2AbB基因, 9个PP2AbB′基因, 5个PP2AbB″基因和1个PP2AbB′′基因[12-13]。拟南芥TAP46的表达受低温诱导并在冷胁迫信号途径中发挥作用[14]; 在水稻、谷子和二穗短柄草中, 关于调节亚基B″-α的基因序列信息已有描述, 但这些基因的功能还不明确。小麦B″亚家族基因TaPP2AbB″-α受多种逆境胁迫上调表达, 过表达TaPP2AbB″-α转基因拟南芥在渗透胁迫下侧根数目增多, 生长情况明显优于野生型[15]。
转录水平上的调控是植物基因表达调控的重要方式之一, 由多种顺式作用元件和反式作用因子共同协调, 基因启动子区的顺式作用元件对基因转录具有关键的调控作用。作为一种重要的分子工具,启动子已广泛地应用于生物技术领域, 例如, 利用CaMV35S等组成型启动子驱动外源基因在转基因植物中过表达[16], 利用诱导型启动子驱动抗性基因在逆境条件下表达, 使作物表现出抗旱、抗寒及耐盐碱等优良性状。在高等植物中已报道了很多重要启动子, 如逆境诱导型启动子RD29A可以有效地提高矮牵牛对干旱胁迫的抗性[17]; 用启动子Oshox24调控OsNAC6过表达可以提高转基因水稻抗旱耐盐性, 并且没有明显的生长缺陷[18]。拟南芥冷调节基因cor15a和cor15b的启动子都响应低温, 5′端缺失分析表明顺式作用元件的侧翼序列影响启动子活性[19]。研究植物抗逆基因启动子活性有助于了解基因表达的调控机制, 并有效调控目标基因的表达水平[20]。然而, 迄今为止尚未见到调控PP2A基因转录表达启动子的相关报道。
为揭示小麦TaPP2AbB″-α基因启动子的功能区与活性, 本研究以小麦品种“旱选10号”为材料, 克隆TaPP2AbB″-α基因的启动子PB″α, 分析其顺式作用元件, 构建一系列5′端缺失的启动子片段, 通过转化拟南芥分析其活性区域。研究表明, 转化启动子PB″α和5′端缺失片段PB″α-1545、PB″α-1389的转基因幼苗可以被X-Gluc染色, 具有启动子活性, 盐胁迫及渗透胁迫处理后转基因幼苗GUS活性显著升高。研究结果为合理应用TaPP2AbB″-α基因提供了依据。
1 材料与方法
1.1植物材料
利用本实验室保存的小麦品种“旱选10号”克隆TaPP2AbB″-α启动子, 拟南芥(Arabidopsis thaliana,哥伦比亚3型)用于启动子重组载体质粒的转化与功能验证。将萌发的小麦种子置光照培养箱中, 23℃培养 6 d, 利用 CTAB法[21]从幼苗叶片中提取基因组DNA。
1.2TaPP2AbB″-α启动子克隆及表达载体构建
以TaPP2AbB″-α编码区序列为探针, BLAST搜索小麦A基因组供体种乌拉尔图小麦(T. urartu)基因组序列数据库(http://blast.ncbi.nlm.nih.gov/Blast.cgi),将该基因上游2 kb左右序列作为目标区域, 命名为PB″α。以旱选10号的基因组DNA为模板扩增PB″α,利用高保真酶TransStart Fast Pfu DNA polymerase (TRANSGEN, 北京)进行PCR扩增。扩增体系为5×buffer 4 μL, dNTP (2.5 μmol L-1) 2 μL, 模板DNA (50 ng μL-1) 1 μL, 引物 PB″α-F (10 μmol L-1) 1 μL,PB″α-R (10 μmol L-1) 1 μL (引物序列见表1),TransStart Fast Pfu 0.5 μL, 用ddH2O补足至20 μL。反应程序为955℃min; 9545 s, 5645 s, 7230℃℃℃s, 36个循环; 72℃10 min 。
将扩增得到的序列 PB″α与植物过表达载体pCAMBIA1391 (由本实验室保存)分别用BamH I、Hind III酶切后进行连接, 获得重组质粒 p1391-PB″α(图1)。
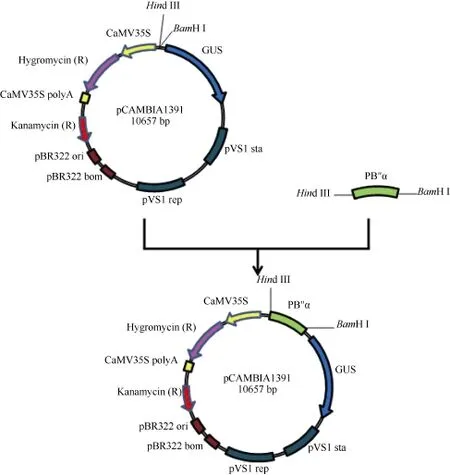
图1 p1391-PB″α表达载体构建示意图Fig. 1 Flow chart for construction of the p1391-PB″α expression vector
1.3启动子顺式作用元件分析及预测
利用在线顺式作用元件分析工具 PLACE (http://www.dna.affrc.go.jp/PLACE/signalup.htm)和PlantCARE (http://bioinformatics.psb.ugent.be/webtools/ plantcare/html/)分析启动子序列, 预测顺式作用元件。
1.45′端缺失片段的克隆及表达载体构建
根据对 PB″α启动子顺式元件的预测结果设计引物, 通过PCR扩增获得一系列5′端缺失启动子片段。正向引物分别为 PB″α-1545-F、PB″α-1389-F、PB″α-945-F、PB″α-483-F和 PB″α-150-F, 反向引物为PB″α-R; 正向引物加入Hind III酶切位点, 反向引物加入 BamH I酶切位点, 引物序列见表 1。以p1391-PB″α质粒为模板, 按上述 PB″α序列扩增程序进行PCR。扩增体系为5× buffer 4 μL, dNTP (2.5 μmol L-1) 2 μL, 模板DNA (50 ng μL-1) 1 μL, PB″α-F (10 μmol L-1) 1 μL, PB″α-R (10 μmol L-1) 1 μL,TransStart Fast Pfu 0.5 μL, 用ddH2O补足至20 μL。将扩增产物与植物过表达载体pCAMBIA1391分别用BamH I、Hind III酶切后进行连接, 获得重组载体质粒, 经测序验证后转化农杆菌GV3101菌株。
1.5拟南芥转化及阳性植株检测
采用农杆菌介导的花序侵染法转化拟南芥。经潮霉素抗性筛选后获得 T1代转基因拟南芥。取 T1代转基因植株幼苗叶片, 利用 CTAB法提取基因组DNA, 并以此为模板通过 PCR扩增检测阳性植株,扩增引物为hyg-F和hyg-R (表1), 产物大小为841 bp。选取 PCR检测呈阳性的单株收获种子并加代,再经抗性筛选得到T3代纯合转基因株系。

表1 本实验中所用引物序列Table 1 Primers used in this study
1.6GUS组织化学染色
取野生型和 T3代转基因拟南芥植株种子, 用10% NaClO溶液表面消毒后, 分别点播于MS培养基上, 4℃春化处理2 d, 然后将培养皿垂直放于人工气候室(16 h光照/8 h黑暗, 21℃/19℃)中, 培养至第8天, 选取长势一致的幼苗进行GUS组织化学染色[22-23]。用未加入X-Gluc的GUS染液(含10 mmol L-1EDTA,100 mmol L-1NaH2PO4·H2O, 0.5% Triton X-100, 1 mmol L-1K3Fe(CN)6, 1 mmol L-1K4Fe(CN)6·3H2O,20%甲醇, 0.5 mg mL-1X-Gluc)洗涤幼苗1~2次, 然后将幼苗转移到 1.5 mL离心管中, 加入适量 GUS染液浸没全部植株, 37℃保温24 h, 除去染液; 再用75%乙醇37℃脱色3~5 h, 其间更换75%乙醇2~3次,于75%乙醇中4℃保存。
1.7GUS荧光定量分析
将转入不同启动子缺失片段的 10日龄幼苗进行4种胁迫处理, 即50 mmol L-1NaCl、300 mmol L-1甘露醇、4℃低温和100 μmol L-1ABA处理。处理72 h后, 分别取叶片和根组织100 mg, 加入液氮研磨成粉, 加入1 mL粗蛋白提取缓冲液(pH 7.0的磷酸缓冲液50 mmol L-1、β-巯基乙醇10 mmol L-1、EDTA l0 mmol L-1、0.1% Triton X-100和0.1% Sodium Lauryl Sarcosine), 以涡旋振荡仪振荡混匀, 于4℃下16 200 × g离心15 min。取上清液即GUS粗蛋白50 μL, 加入37℃预热的GUS反应底物MUG (2 mmol L-1) 250 μL, 37℃保温 1 h, 以 0.2 mol L-1Na2CO31500 μL 终止反应。使用荧光仪(Hoefer DyNA Quant 200), 激发光365 nm, 发射光455 nm,参照Bradford[24]的方法测定蛋白含量。
2 结果与分析
2.1TaPP2AbB″-α启动子PB″α克隆及转化拟南芥
以旱选10号基因组DNA为模板, PCR扩增得到1899 bp的TaPP2AbB″-α启动子片段(图2), 命名为PB″α。将该扩增产物及植物表达载体pCAMBIA 1391分别用BamH I和Hind III双酶切后连接, 经酶切检测和测序验证获得正确的重组载体。通过农杆菌介导法转化拟南芥, 获得转基因植株。

图2 小麦TaPP2AbB″-α基因启动子PB″α的克隆Fig. 2 Amplified fragment of TaPP2AbB″-α gene promoter PB″α in wheat M: DMarker III.
2.2PB″α启动子顺式作用元件分析及功能预测
采用启动子顺式作用元件分析工具 PLACE (http://www.dna.affrc.go.jp/PLACE/signalup.htm)和PlantCARE (http://bioinformatics.psb.ugent.be/webtools/ plantcare/html/)分析启动子PB″α的顺式作用元件。结果显示全长 PB″α启动子包含多种顺式作用元件(图3), 基本的调控元件为TATA-box、CAAT-box, 此外还包含多种逆境响应元件, 如低温及干旱响应元件LTR, 脱水响应元件MYCCONSE, 逆境及乙烯响应元件 GCCCORE, 干旱诱导的 MYB结合元件EECCRCAH1以及ABA响应元件ABRE, 赤霉素响应元件GARE, 茉莉酸甲酯响应元件CGTCA-motif,水杨酸响应元件TCA-element等(表2)。

图3 启动子PB″α序列及预测的顺式作用元件Fig. 3 Sequence and predicted cis-acting elements of promoter PB″α
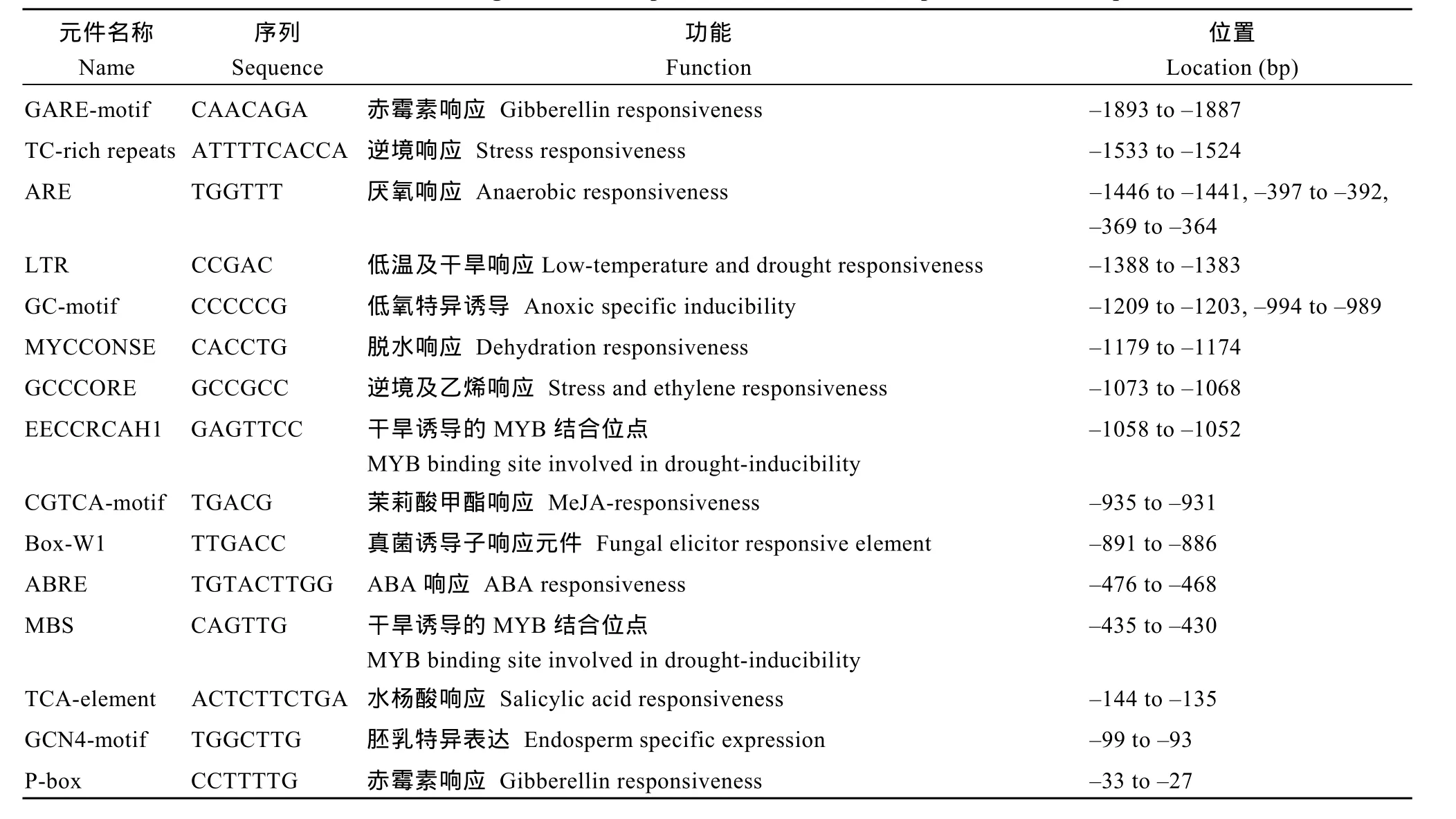
表2 启动子PB″α序列中的顺式作用元件及预测的功能Table 2 The cis-acting elements and predicted functions in the promoter PB″α sequence
根据对启动子PB″α的生物信息学分析结果, 结合不同顺式作用元件在启动子区的分布情况和功能预测, 对PB″α启动子进行5′端缺失截段, 5个缺失启动子片段所含元件见图4。以p1391-PB″α重组质粒为模板, 通过设计对应 PCR引物, 扩增得到长度为1545、1389、945、483和150 bp的5个缺失片段(图5),依次命名为PB″α-1545、PB″α-1389、PB″α-945、PB″α-483和PB″α-150。
将这5个扩增产物分别用BamH I和Hind III双酶切后, 连接表达载体pCAMBIA1391, 构建PB″α启动子5′端缺失表达载体, 并通过农杆菌转化拟南芥。
2.3拟南芥GUS组织化学染色
经潮霉素筛选和PCR检测呈阳性的单株收获种子并加代(图6), 获得T3代纯合转基因株系。分别取野生型和T3代纯合转基因植株进行GUS组织化学染色, 过量表达p1391-PB″α和 p1391-PB″α-1545、p1391-PB″α-1389的拟南芥幼苗叶片和根均被 GUS染色(图7)。可见, 在转基因拟南芥中, 启动子PB″α 和 5′端缺失片段 PB″α-1545、PB″α-1389可以驱动GUS基因表达, 具有启动子活性, 结果显示PB″α的-1389至-946 bp区段是启动子的活性区域。
2.4不同胁迫条件下的GUS定量分析
对含有不同启动子片段的拟南芥株系进行胁迫处理, 分析不同胁迫条件下各启动子片段的表达情况。与无胁迫对照相比, 经NaCl、甘露醇处理后, 转PB″α和5′端缺失片段PB″α-1545、PB″α-1389的拟南芥幼苗GUS活性显著升高, 而其他5′端缺失片段转基因拟南芥GUS活性没有显著变化。经低温(4)℃和ABA处理后的拟南芥GUS活性与对照相比均无显著差异(图8), 表明启动子PB″α的-1389至-946 bp区段是应答NaCl、甘露醇处理的活性区。
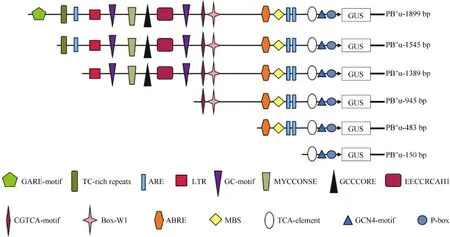
图4 PB″α启动子5′端缺失片段顺式作用元件示意图Fig. 4 Schematic show of cis-acting elements in 5′-truncated promoter PB″α
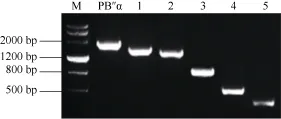
图5 启动子5′端缺失扩增片段Fig. 5 Amplified fragment of 5′-truncated promotersM: DMarker III; 1: PB"α-1545; 2: PB"α-1389; 3: PB"α-945;4: PB"α-483; 5: PB"α-150.

图6 T1代转基因拟南芥的PCR检测Fig. 6 PCR analysis of T1transgenic Arabidopsis linesM: DMarker III; 1-3: PB"α; 4-6: PB"α-1545; 7-9: PB"α-1389; 10-12: PB"α-945; 13-15: PB"α-483; 16-18: PB"α-150.

图7 野生型和T3代转基因拟南芥幼苗GUS染色Fig. 7 Histochemical GUS staining of wild-type (WT) and T3transgenic Arabidopsis plants
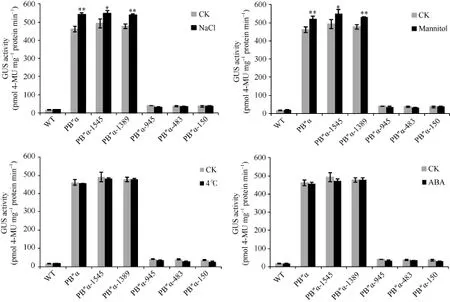
图8 胁迫条件下转基因拟南芥GUS定量分析Fig. 8 Quantification of GUS activity in transgenic Arabidopsis under different stresses*和**分别表示胁迫处理与对照(CK)在0.05和0.01概率水平的差异显著(t检验)。* and ** indicate significant difference between stress treatment and the control (CK) at the 0.05 and 0.01 probability levels, respectively (t-test).
3 讨论
目前, 研究启动子的方法主要有生物信息学分析及实验分析两种。利用生物信息学分析启动子序列, 预测其中的顺式作用元件种类、数目及位置, 可以为进一步确定启动子的功能奠定基础。实验分析主要有瞬时表达、5′端缺失分析[25]、凝胶阻滞[26]和酵母单杂交[27]等方法。本研究采用生物信息学分析和 5′端缺失分析相结合的方法, 研究 TaPP2AbB″-α基因启动子的表达特性、活性区域和重要顺式作用元件。
通过生物信息学分析发现, 在 TaPP2AbB″-α启动子区存在多种重要的非生物胁迫应答元件, 例如响应干旱、低温等逆境的元件等。通过 5′端缺失分析和转基因拟南芥 GUS组织化学染色确定,TaPP2AbB″-α启动子-1389至-946 bp区段是其活性核心区域, 同时生物信息学分析结果也表明, 该活性区域中包含了响应干旱和渗透胁迫的顺式作用元件 EECCRCAH1 (-1058至-1052 bp)、GCCCORE (-1073至-1068 bp)和MYCCONSE (-1179至-1174 bp)。而在缺失了这段活性核心区域后, 剩余启动子片段无法驱动GUS基因在植物体内表达。上述结果表明945 bp长度的启动子片段上可能有负调控元件,抑制启动子的活性; 同时由于缺少-1389至-946 bp的启动子核心活性区域, 启动子基本活性无法表达,其具体原因还有待研究。Chakravarthy等[28]对番茄转录因子Pti4的研究发现, Pti4通过结合顺式作用元件 GCC-box来调控防御基因的表达; 拟南芥AtMYC2和AtMYB2转录因子与MYC、MYB启动子识别位点特异性结合可诱导对干旱及 ABA响应基因的表达[29]; Kim 等[30]发现在拟南芥中, 顺式作用元件LTR (C/DRE)响应干旱及低温胁迫。为了验证TaPP2AbB″-α启动子活性区域内顺式作用元件的功能, 我们对转 5′端缺失片段启动子拟南芥进行四种胁迫处理, 结果发现在NaCl和甘露醇处理后, 具有活性区域启动子片段PB″α-1545、PB″α-1389拟南芥的GUS表达量显著升高, 表明启动子活性区域内的顺式作用元件响应盐胁迫和渗透胁迫, 验证了TaPP2AbB″-α基因启动子PB″α的活性区域。
通常情况下, 启动子特性与基因功能紧密相连。干旱条件下, 拟南芥RD29A与RD29B基因启动子的活性显著增强[31]; 来自水稻的WRKY71基因和硬粒小麦Cor39基因的低温诱导型启动子可以增强植物抗寒性, 减轻低温伤害[32]; 高盐条件下, 水稻胁迫诱导型启动子Wsi18在根和叶中特异表达[33]。旱选10号是小麦强抗旱品种, 本实验室从该品种基因组中克隆得到的TaPP2AbB″-α基因过量表达可增强拟南芥植株的耐盐性和抗旱性[15]。本研究不仅验证了我们前期的研究结果, 而且揭示了 TaPP2AbB″-α启动子响应盐和渗透胁迫的活性区域, 为进一步合理选用启动子对作物的抗逆性进行遗传改良提供了依据和技术支持。
4 结论
从小麦抗旱品种旱选10号基因组DNA中克隆了TaPP2AbB″-α基因的启动子PB″α, 全长1899 bp,其活性核心区位于-1389 bp至-946 bp区段, 该区域内包含了响应干旱和渗透胁迫的顺式作用元件EECCRCAH1、GCCCORE和MYCCONSE。NaCl或甘露醇处理 72 h后, 转 PB″α、PB″α-1545和PB″α-1389拟南芥的GUS活性显著升高, 验证了启动子活性区的功能。本研究结果为合理选用启动子以改良作物提供了依据。
References
[1] Shinozaki K, Yamaguchi-Shinozaki K. Gene networks involved in drought stress response and tolerance. J Exp Bot, 2007, 58:221-227
[2] Janssens V, Goris J. Protein phosphatase 2A: a highly regulated family of serine/threonine phosphatases implicated in cell growth and signalling. Biochem J, 2001, 353: 417-439
[3] Høyer-Hansen M, Bastholm L, Szyniarowski P, Campanella M,Szabadkai G, Farkas T, Bianchi K, Fehrenbacher N, Elling F,Rizzuto R, Mathiasen I S, Jäättelä M. Control of macroautophagy by calcium, calmodulin-dependent kinase kinase-beta, and Bcl-2. Mol Cell, 2007, 25: 193-205
[4] Ballesteros I, Dominguez T, Sauer M, Paredes P, Duprat A, Rojo E, Sanmartin M, Sanchez-Serrano J J. Specialized functions of the PP2A subfamily II catalytic subunits PP2A-C3 and PP2A-C4 in the distribution of auxin fluxes and development in Arabidopsis. Plant J, 2013, 73: 862-872
[5] Tang W, Yuan M, Wang R, Yang Y, Wang C, Oses-Prieto J A,Kim T W, Zhou H W, Deng Z, Gampala S S, Gendron J M, Jonassen E M, Lillo C, DeLong A, Burlingame A L, Sun Y, Wang Z Y. PP2A activates brassinosteroid-responsive gene expression and plant growth by dephosphorylating BZR1. Nat Cell Biol, 2011,13: 124-131
[6] Michniewicz M, Zago M K, Abas L, Weijers D, Schweighofer A,Meskiene I, Heisler M G, Ohno C, Zhang J, Huang F, Schwab R,Weigel D, Meyerowitz E M, Luschnig C, Offringa R, Friml J. Antagonistic regulation of PIN phosphorylation by PP2A and PINOID directs auxin flux. Cell, 2007, 130: 1044-1056
[7] Chavez-Aviles M N, Andrade-Perez C L, de la Cruz H R. PP2A mediates lateral root development under NaCl-induced osmotic stress throughout auxin redistribution in Arabidopsis thaliana. Plant & Soil, 2013, 368: 591-602
[8] Xu C, Jing R, Mao X, Jia X, Chang X. A wheat (Triticum aestivum) protein phosphatase 2A catalytic subunit gene provides enhanced drought tolerance in tobacco. Ann Bot, 2007, 99: 439-450
[9] Shi Y. Serine/threonine phosphatases: mechanism through structure. Cell, 2009, 193: 468-484
[10] Slupe A M, Merrill R A, Strack S. Determinants for substrate specificity of protein phosphatase 2A. Enzyme Res, 2011, 2011:398751
[11] Pandey S, Mahato P K, Bhattacharyya S. Metabotropic glutamate receptor 1 recycles to the cell surface in protein phosphatase 2A-dependent manner in non-neuronal and neuronal cell lines. J Neurochem, 2014, 131: 602-614
[12] Uhrig R G, Labandera A M, Moorhead G B. Arabidopsis PPP family of serine/threonine protein phosphatases: many targets but few engines. Trends Plant Sci, 2013, 18: 505-513
[13] Farkas I, Dombradi V, Miskei M, Szabados L, Koncz C. Arabidopsis PPP family of serine/threonine phosphatases. Trends Plant Sci, 2007, 12: 169-176
[14] Harris D M, Myrick T L, Rundle S J. The Arabidopsis homolog of yeast TAP42 and mammalian alpha4 binds to the catalytic subunit of protein phosphatase 2A and is induced by chilling. Plant Physiol, 1999, 121: 609-617
[15] Liu D, Li A, Mao X, Jing R. Cloning and characterization of TaPP2AbB"-alpha, a member of the PP2A regulatory subunit in wheat. PLoS One, 2014, 9: e94430
[16] Benfey P N, Chua N H. The Cauliflower mosaic virus 35S promoter: combinatorial regulation of transcription in plants. Science,1990, 250: 959-966
[17] Estrada-Melo A C, Ma C, Reid M S, Jiang C Z. Overexpressionof an ABA biosynthesis gene using a stress-inducible promoter enhances drought resistance in petunia. Hort Res, 2015, 2: 15013 [
18] Nakashima K, Jan A, Todaka D, Maruyama K, Goto S, Shinozaki K, Yamaguchi-Shinozaki K. Comparative functional analysis of six drought-responsive promoters in transgenic rice. Planta, 2014,239: 47-60
[19] Li M, Wang X, Cao Y, Liu X, Lin Y, Ou Y, Zhang H, Liu J. Strength comparison between cold-inducible promoters of Arabidopsis cor15a and cor15b genes in potato and tobacco. Plant Physiol Biochem, 2013, 71: 77-86
[20] Hernandez-Garcia C M, Finer J J. A novel cis-acting element in the GmERF3 promoter contributes to inducible gene expression in soybean and tobacco after wounding. Plant Cell Rep, 2015, 35:1-14
[21] Murray M G, Thompson W F. Rapid isolation of high molecular weight plant DNA. Nucl Acids Res, 1980, 8: 4321-4325
[22] Sieburth L E, Meyerowitz E M. Molecular dissection of the AGAMOUS control region shows that cis elements for spatial regulation are located intragenically. Plant Cell, 1997, 9: 355-365
[23] Vasil I K, Vasil V. Transformation of wheat via particle bombardment. Methods Mol Biol, 2006, 318: 273-283
[24] Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein dye binding. Anal Biochem, 1976, 72: 248-254
[25] Luo K, Zhang G, Deng W, Luo F, Qiu K, Pei Y. Functional characterization of a cotton late embryogenesis-abundant D113 gene promoter in transgenic tobacco. Plant Cell Rep, 2008, 27:707-717
[26] Singh H, Sen R, Baltimore D, Sharp P A. A nuclear factor that binds to a conserved sequence motif in transcriptional control elements of immunoglobulin genes. Nature, 1986, 319: 154-158
[27] Li J J, Herskowitz I. Isolation of ORC6, a component of the yeast origin recognition complex by a one-hybrid system. Science,1993, 262: 1870-1874
[28] Chakravarthy S, Tuori R P, D'Ascenzo M D, Fobert P R, Despres C, Martin G B. The tomato transcription factor Pti4 regulates defense-related gene expression via GCC box and non-GCC box cis elements. Plant Cell, 2003, 15: 3033-3050
[29] Abe H, Urao T, Ito T, Seki M, Shinozaki K, Yamaguchi-Shinozaki K. Arabidopsis AtMYC2 (bHLH) and AtMYB2 (MYB)function as transcriptional activators in abscisic acid signaling. Plant Cell, 2003, 15: 63-78
[30] Kim H J, Kim Y K, Park J Y, Kim J. Light signalling mediated by phytochrome plays an important role in cold-induced gene expression through the C-repeat/dehydration responsive element (C/DRE) in Arabidopsis thaliana. Plant J, 2002, 29: 693-704
[31] Bihmidine S, Lin J, Stone J M, Awada T, Specht J E, Clemente T E. Activity of the Arabidopsis RD29A and RD29B promoter elements in soybean under water stress. Planta, 2013, 237: 55-64
[32] Kovalchuk N, Jia W, Eini O, Morran S, Pyvovarenko T, Fletcher S, Bazanova N, Harris J, Beck-Oldach K, Shavrukov Y, Langridge P, Lopato S. Optimization of TaDREB3 gene expression in transgenic barley using cold-inducible promoters. Plant Biotechnol J, 2013, 11: 659-670
[33] Yi N, Oh S J, Kim Y S, Jang H J, Park S H, Jeong J S, Song S I,Choi Y D, Kim J K. Analysis of the Wsi18, a stress-inducible promoter that is active in the whole grain of transgenic rice. Transgenic Res, 2011, 20: 153-163
Cloning and Expression Analysis of Protein Phosphatase 2A Gene TaPP2AbB″-α Promoter in Wheat
YI Heng1,2, LI Ang2, LIU Hui-Min1, and JING Rui-Lian2,*1College of Bioengineering, Shanxi University, Taiyuan 030006, China;2National Key Facility for Crop Gene Resources and Genetic Improvement / Institute of Crop Science, Chinese Academy of Agricultural Sciences, Beijing 100081, China
Protein phosphatase 2A (PP2A) is a heterotrimeric protein, consisting of a scaffolding subunit (A), a catalytic subunit(C), and a member of four families of regulatory subunits (B). PP2A plays significant roles in the pathway responding to abiotic stresses in plants. TaPP2AbB″-α, a member of regulatory subunit B″ in wheat (Triticum aestivum L.), enhanced root development and could develop more lateral roots in the gene overexpressed Arabidopsis, especially under the osmotic stresses of mannitol and NaCl. In order to elucidate transcriptional regulatory mechanism of the promoter PB″α of TaPP2AbB″-α, we isolated an 1899 bp full-length sequence of promoter PB″α from a drought-tolerant wheat cultivar Hanxuan 10. The PB″α sequence contained TATA-box, CAAT-box and a series of cis-acting elements responding to drought and osmotic stresses, such as elements of EECCRCAH1 (from -1058 to -1052 bp), GCCCORE (from -1073 to -1068 bp) and MYCCONSE (from -1179 to -1174 bp). The full-length promoter PB″α and five 5′-end truncated PB″α promoters in different lengths fused with the reporter gene β-glucuronidas (GUS) were transformed into Arabidopsis, respectively. The histochemical staining results showed that the full-length promoter PB″α, and the deletion fragments of PB″α-1545 and PB″α-1389 could drive GUS gene expression in shoots and roots of transgenic Arabidopsis seedlings. As the result of quantitative fluorometric GUS assay, only the expression of PB″α,PB″α-1545 and PB″α-1389 could be up-regulated by salt and osmotic stresses in transgenic Arabidopsis lines, and the active region of PB″α promoter was located in the interval between -1389 bp and -946 bp. In conclusion, PB″α has strong basic promoteractivity which is up-regulated significantly by salt and osmotic stresses. These findings contribute to the selection of a suitable promoter for crop improvement.
Wheat; PP2A; Promoter; cis-acting Element; GUS histochemical staining; Quantitative fluorometric GUS assay
10.3724/SP.J.1006.2016.01282
本研究由国家自然科学基金项目(31201206)和中国农业科学院创新工程项目资助。
This study was supported by the National Natural Science Foundation of China (31201206) and the Agricultural Science and Technology Innovation Program (CAAS).
(Corresponding author): 景蕊莲, E-mail: jingruilian@caas.cn, Tel: 010-82105829
联系方式: E-mail: yiheng1127@126.com
Received(): 2016-02-05; Accepted(接受日期): 2016-05-09; Published online(网络出版日期): 2016-06-06.
URL: http://www.cnki.net/kcms/detail/11.1809.S.20160606.1616.008.html
