外源多胺对小麦小花退化的调控机制
2016-09-21吕晓康温晓霞廖允成
吕晓康 温晓霞 廖允成 刘 杨
西北农林科技大学农学院, 陕西杨凌 712100
外源多胺对小麦小花退化的调控机制
吕晓康 温晓霞 廖允成 刘 杨*
西北农林科技大学农学院, 陕西杨凌 712100
小麦穗粒数与小花退化密切相关, 多胺是调控小花发育的一种重要植物生长调节剂。本研究利用小麦品种(系)双大1号(大穗型)和西农538 (小穗型), 于小花退化阶段在穗部施用腐胺(Put)、亚精胺(Spd)和精胺(Spm), 分析外源多胺对小麦小花退化的影响及其与内源激素、植株碳氮的关系。结果表明, 外源Spd和Spm显著抑制小花退化、提高了可孕小花数目, 而Put加具有显著的负效应; 并且多胺的调控具有明显的位置效应, 对小穗上部弱势小花退化的调控效应显著大于下部强势小花。施用外源Spd和Spm后, 弱势小花中Spd、Spm显著增加, 同时玉米素+玉米素核苷(Z+ZR)含量及其与脱落酸(ABA)的比值也显著升高, 而内源乙烯的释放速率降低, 并且弱势小花中可溶性总糖和可溶性蛋白质含量显著提高。外源Put对弱势小花的控调效应与此相反, 施用后弱势小花中Put、ABA含量以及内源ETH释放速率显著提高, 而(Z+ZR)与ABA比值和可溶性总糖含量降低。因此认为, 多胺参与了对小麦小花退化的调控, 其对小麦小花退化的调控与内源激素、植株碳氮代谢密切相关。
多胺; 小麦; 小花退化; 激素; 可溶性总糖; 可溶性蛋白
小麦单位面积产量由单位面积穗数、每穗粒数和粒重构成, 其中穗粒数对环境及栽培措施最为敏感, 在保证穗数的基础上提高穗粒数是小麦高产的主要调控目标。小麦穗粒数是小花分化、发育、退化和结实等一系列生理过程的最终体现[1]。研究表明, 小麦所分化的小花数比较稳定, 但最终仅有20%~30%的小花能够发育成籽粒, 70%~80%的小花先后退化而成为无效小花[2]。小麦穗生成籽粒的潜在能力远远超过实际的结实粒数[3-4]。因此, 减少小花退化、增加可孕小花数量, 从而提高小花结实率是实现小麦高产的关键问题。
多胺是植物体内一类具有生物活性的低分子量脂肪族含氮碱的总称, 被认为是生长调节物质或激素的第二信使[5-6]。植物体内常见的多胺有腐胺(Put)、亚精胺(Spd)、精胺(Spm)等, 其具有刺激细胞分裂、促进生长、延缓衰老、提高抗性、调节开花、提高种子活力、促进根系吸收等作用, 能显著调节植物的生长发育及其对逆境的响应[7]。多胺参与了对禾谷类作物颖花发育的调控, 在水稻上的研究发现, 保持系幼穗中Spd和Spm含量显著高于不育系,外源施用MGBG (Spd和Spm合成抑制剂)显著降低幼穗中Spd和Spm含量, 进而抑制雄蕊发育、降低花粉育性; 氯化钴能够提高水稻幼穗中多胺含量,促进雄蕊及花粉发育[8-11]。Ma等[12]研究发现, OsARG基因通过调控多胺合成途径关键酶精氨酸合成酶影响水稻幼穗中多胺含量, 而该基因的缺失会降低幼穗中多胺含量, 进而导致穗型变小、结实率显著下降。在小麦上的研究也表明外源施用Spd能够显著促进小麦幼穗生长, 提高小麦穗粒数[13]。这些研究结果表明, 多胺显著影响禾谷类作物颖花发育。但是, 关于多胺对小麦小花退化的影响, 还缺乏相关研究。
激素在调控禾谷类作物小花发育过程中起着重要作用, 乙烯(ETH)显著提高小麦、玉米及水稻颖花退化率、降低可孕花数目和结实率进而减低穗粒数[14-16]。外源脱落酸(ABA)显著提高了水稻、小麦的不结实籽粒比例, 降低了结实小花率[17]。外源玉米素(Z)显著提高小麦小花数目, 较高的内源细胞分裂素(CTK)有利于小麦小花发育[2,4], 细胞分裂素氧化酶基因显著影响小麦和水稻等作物小花发育及穗粒数形成[18-19]。除激素外, 植物营养也显著影响小花发育及退化,有研究认为, 小麦小花退化的主要原因是对植株营养的竞争, 由于开花前茎、穗之间对有限营养资源的竞争, 造成穗部生长营养供应不足引起小花退化[2-3]。Serrago 等[3]发现, 小麦可孕小花数目与碳水化合物含量呈正相关, 在药隔期至四分体期, 保证氮素营养可减少退化小花数, 增加结实粒数。
外源多胺能显著提高植株内源生长素(IAA)和ABA含量[20-21], Spd和ETH的合成代谢间存在相互抑制的关系[22], 外源Spd和Spm能显著促进水稻弱势粒淀粉合成[22]。这表明多胺代谢与激素、植株营养之间关系密切。但是关于多胺对小麦小花退化的影响及其与激素、植株营养的关系, 目前还缺乏深入了解。本研究采用外源多胺处理, 在小麦小花两极分化及退化阶段外源向穗部位注射多胺, 分析了外源多胺对小麦小花退化的影响及其与内源激素、植株碳氮的关系, 旨在探讨多胺对冬小麦小花退化的影响及其生理机制, 为穗粒数形成提供理论依据。
1 材料与方法
1.1试验材料与处理
2012—2013和2013—2014年度, 在西北农林科技大学标本园(陕西杨凌, 34°20′ N, 108°04′ E)进行田间试验。供试土壤为壤土, 耕层(0~20 cm)土壤含有机质12.07 g kg-1、全氮1.42 g kg-1、速效氮55.56 mg kg-1、速效磷18.33 mg kg-1、速效钾112.67 mg kg-1, pH 7.11, 容重1.31 g cm-3。供试材料为双大1号(大穗型品系)和西农538 (小穗型品种), 2012年和2013年均于10月14日播种, 播量为150 kg hm-2,行距0.20 m。播种前基施375 kg hm-2尿素和375 kg hm-2磷酸二胺。小麦生长期进行常规大田管理。
参考王兆龙等[1,4]和倪英丽[2]关于小麦小花发育的研究, 并结合本课题组前期预备试验结果, 每品种设 4个处理, 在倒二叶完全抽出(旗叶露尖, 此期处于开花前 20 d, 小花分化基本结束, 小花开始两级分化)时选择长势一致的植株进行挂牌标记, 每个处理在倒二叶完全抽出期、四分体时期(叶龄余数为0.5)、小花退化期(叶龄余数为 0.2)向幼穗与叶鞘的空隙中分别注入1 mmol L-1Spd (S1)、1 mmol L-1Spm (S2)、2 mmol L-1Put (P1)和清水, 每株注入500 μL。每个注射时期均连续2 d, 于每天17:00—18:00实施。小区面积3 m × 3 m, 随机区组排列, 3次重复。
1.2测定项目与方法
1.2.1小花发育 从小麦穗分化开始定期取样观察并记载穗分化进程, 记载分化小穗数、小花数以及穗分化各阶段的特征。从开花前18 d开始至开花期每隔4 d选发育一致的主茎35个左右, 以穗中部第7~14小穗基部小花为强势小花(双大1号第1~3位小花、西农538第1~2位小花), 上部小花为弱势小花(双大1号第4~6位小花、西农538第3~5位小花), 将两部分小花在冰面上进行剥取、分装、称鲜重, 其后液氮速冻后放入-40℃冰箱中保存。于抽穗期取样, 采用 XTS2022电子光学显微镜(北京泰克)观察可孕小花分化数目, 以具有完整绿色花药和羽状柱头的小花作为可孕小花判断标准[1]。以各处理总小花数和可孕小花数相对于对照的增加率来表示各处理对小麦小花退化的影响, 增加率 = (处理测定值 - 对照测定值) / 对照测定值 × 100。
1.2.2内源游离态多胺测定 参照刘俊等[23]和Yang等[22]的方法测定游离态Spd、Spm和Put含量,5%三氯乙酸提取后采用高效液相色谱法, 用 1525二元梯度泵-2489紫外检测器(Waters)测定。色谱柱为Waters Symmery C18柱(7.5 cm × 4.6 cm × 3.5 μm),流动相为甲醇∶水(59∶41), 流速0.7 mL min-1, 柱温30℃, 检测波长230 nm。
1.2.3内源激素测定 采用酶联免疫法测定Z+ZR、ABA含量。用80%甲醇(含1 mmol L-1BHT)提取内源激素, 试剂盒购自中国农业大学, 具体步骤参照试剂盒说明书进行。使用酶标仪测定激素含量[24], 采用气相色谱法测定乙烯含量[14]。
1.2.4小花可溶性总糖和可溶性蛋白测定 采用80%乙醇提取可溶性总糖, 用蒽酮比色法测定其含量[25]。采用Tris-HCl (pH 7.0)缓冲液提取可溶性蛋白,用考马斯亮蓝法测定其含量[26]。
1.3数据分析
采用 Microsoft Excel 2010进行数据整理, 用SPSS16.0软件进行强势小花与弱势小花的t测验和处理间多重比较(LSD 0.05), Origin8.0软件绘图。2年试验数据规律基本一致, 文中所列内源多胺、激素、可溶性总糖、可溶性蛋白含量为2013—2014年度测定值, 其他指标均采用两年数据。
2 结果与分析
2.1外源多胺对小麦小花发育的影响
外源施用多胺对总小花数无显著影响, 但是其显著影响小麦可孕小花数目。与对照相比, S1和S2处理显著提高了可孕小花比例, 但是P1处理可孕小花比例显著低于对照(图1)。这表明外源Spd和Spm抑制了小麦小花退化, 而外源 Put促进了小麦小花退化(图1)。外源Spd和Spm显著提高了小麦穗粒数, 而外源Put显著降低了小麦穗粒数, 2个品种之间并未表现出明显的多胺作用差异(图2), 表明无论是大穗型还是小穗型品种, 多胺均能显著调控其小花退化及穗粒数形成。
多胺对不同小花位小花的调控效果不同。外源Spd、Spm和Put对着生在小穗下部的强势小花发育无显著影响, 但是其显著影响着生在小穗上部的弱势小花发育, 外源Spd和Spm显著提高了两品种弱势小花的可孕小花比率, 而 Put显著降低了弱势小花的可孕小花比率(图3)。
2.2外源多胺对小麦小花内源多胺含量的影响
从开花前18 d到开花期, 小花中Spd、Spm和Put含量呈明显的下降趋势(图4)。双大1号小花中Spd和 Spm含量显著高于同期西农538, 而双大1号小花中Put含量显著低于同期西农538。对于同一个品种, 强势下小花中Spd和Spm含量显著高于弱势小花, 而强势下小花中Put含量显著低于弱势小花。外源Put和Spm分别显著提高了小花中内源Put和Spm含量, 外源Spd显著提高了小花中内源Spd和Spm含量。
2.3外源多胺对小麦小花内源激素含量的影响
在小花两级分化及退化阶段, 小花中 Z+ZR含量呈先升高后下降的趋势, 在开花前18 d至开花前10 d, 小花中Z+ZR含量无显著变化, 且强势小花和弱势小花之间无显著差异(图5)。从开花前10 d开始,小花内源Z+ZR含量迅速提高, 至开花前2 d达到峰值, 其后快速下降, 此期强势小花内源 Z+ZR上升幅度较弱势小花大, 在开花前6 d和2 d, 强势小花中 Z+ZR含量显著高于弱势小花。在整个小花两级分化及退化阶段, 双大1号小花内源Z+ZR含量显著高于西农538。外源Spd和Spm显著提高了小花内源Z+ZR含量, 但是外源Put对小花内源Z+ZR含量无显著影响。
小麦强势小花和弱势小花内源 ABA含量在小花两级分化及退化阶段的变化存在显著不同, 强势小花内源ABA含量呈现先降低后升高的趋势, 从开花前18 d至开花前6 d强势小花内源ABA含量呈显著下降趋势, 其后又显著上升。与此相反, 弱势小花内源 ABA含量在小花两级分化及退化阶段呈现上升趋势。外源Spd和Spm对小花中ABA含量无显著影响, 但是外源Put显著提高了小花中ABA含量。双大1号小花ABA含量显著高于西农538。

图1 外源多胺对小麦总小花数和可孕小花增加率的影响Fig. 1 Effects of exogenous polyamines on increased rates of total and fertile florets of wheatS1: 施用1 mmol L-1Spd; S2: 施用1 mmol L-1Spm; P1: 施用2 mmol L-1Put。T: 总小花数; F: 可孕小花数。S1: exogenous 1 mmol L-1Spd applied; S2: exogenous 1 mmol L-1Spm applied; P1: exogenous 2 mmol L-1Put applied. T: number of total floret; F: number of fertile floret.

图2 外源多胺对小麦穗粒数的影响Fig. 2 Effects of exogenous polyamines on the kernel number per spike of wheatS1: 施用1 mmol L-1Spd; S2: 施用1 mmol L-1Spm; P1: 施用2 mmol L-1Put; CK: 对照(清水)。S1: 1 mmol L-1exogenous Spd applied; S2: 1 mmol L-1exogenous Spm applied; P1: 2 mmol L-1exogenous Put applied; CK: control.
2.4外源多胺对小麦小花内源激素含量的影响
在小花两级分化及退化阶段, 小花中 Z+ZR含量呈先升高后下降的趋势, 在开花前18 d至开花前10 d, 小花中Z+ZR含量无显著变化, 且强势小花和弱势小花之间无显著差异(图5)。从开花前10 d开始,小花内源Z+ZR含量迅速提高, 至开花前2 d达到峰值, 其后快速下降, 此期强势小花内源 Z+ZR上升幅度较弱势小花大, 在开花前6 d和2 d, 强势小花中 Z+ZR含量显著高于弱势小花。在整个小花两级分化及退化阶段, 双大1号小花内源Z+ZR含量显著高于西农538。外源Spd和Spm显著提高了小花内源Z+ZR含量, 但是外源Put对小花内源Z+ZR含量无显著影响。
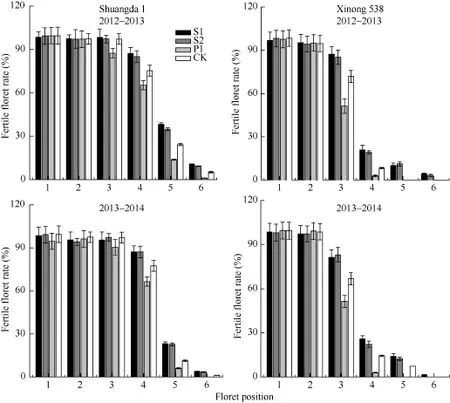
图3 外源多胺对不同花位可孕小花率的影响Fig. 3 Effect of exogenous polyamines on the fertile floret number ratio of different floret set of wheatS1: 施用1 mmol L-1Spd; S2: 施用1 mmol L-1Spm; P1: 施用2 mmol L-1Put; CK: 对照(清水)。S1: 1 mmol L-1exogenous Spd applied; S2: 1 mmol L-1exogenous Spm applied; P1: 2 mmol L-1exogenous Put applied; CK: control.
小麦强势小花和弱势小花内源 ABA含量在小花两级分化及退化阶段的变化存在显著不同, 强势小花内源ABA含量呈现先降低后升高的趋势, 从开花前18 d至开花前6 d强势小花内源ABA含量呈显著下降趋势, 其后又显著上升。与此相反, 弱势小花内源 ABA含量在小花两级分化及退化阶段呈现上升趋势。外源Spd和Spm对小花中ABA含量无显著影响, 但是外源Put显著提高了小花中ABA含量。双大1号小花ABA含量显著高于西农538。
在小花两级分化及退化过程中, 小花中ETH释放量呈降低趋势。弱势小花ETH释放量显著强势小花, 且西农538小花ETH释放量显著高于双大1号。外源Spd和Spm显著降低了弱势小花中ETH释放量, 而外源Put则显著提升了弱势小花中ETH释放量。但是外源多胺对强势小花中ETH释放量无显著影响。
2.5外源多胺对小麦小花可溶性糖和蛋白含量的影响
在小麦小花两级分化及退化过程中, 强势小花中可溶性总糖和蛋白含量显著高于弱势小花, 小花中可溶性总糖含量表现出升高-下降-升高-下降的趋势, 在花前14 d和6 d达到峰值, 而可溶性蛋白含量表现为升高-下降-升高的趋势, 在花前 6 d达到峰值(图6)。双大1号小花中可溶性总糖和蛋白含量高于同期西农538。外源Spd、Spm和Put对强势小花内源可溶性总糖和蛋白含量均无显著影响。除此之外, 外源 Put对弱势小花内源可溶性总糖和蛋白含量也无显著影响, 但是外源Spd和Spm显著提高了弱势小花中可溶性总糖和蛋白含量。
3 讨论
3.1多胺对小麦小花退化的影响
多胺是植物体内一类具有生物活性的低分子量脂肪族含氮碱的总称, 被认为是生长调节物质或激素的第二信使, 也有学者将其归为植物激素的一类[5-6]。研究表明, 多胺参与了对禾谷类作物颖花发育的调控[8-13]。外源施用MGBG显著降低了水稻幼穗中Spd 和Spm含量, 进而抑制雄蕊发育、降低花粉育性; 提高水稻幼穗中多胺含量能够促进雄蕊及花粉发育;降低水稻幼穗中多胺含量会导致穗型变小、结实率显著下降[8-11]。外源施用Spd能够显著促进小麦幼穗生长, 提高小麦穗粒数[13]。在本研究中, 小麦强势小花内源Spd和Spm含量显著高于弱势小花, 同时外源Spd和Spm显著提高了可孕小花数目。与此不同,小麦强势小花内源 Put含量显著高于弱势小花, 而外源Put显著降低了可孕小花数目。这表明3种多胺对小麦小花退化的调控效果不同, Spd和Spm能够促进小花发育, 显著提高可孕小花比率, 而Put可能参与了对小花发育的抑制。同时本研究发现 Spd 和Spm对小麦小花发育的调控存在明显的位置效应,其主要调控小穗上部的弱势小花发育, 但其对强势小花发育无显著影响。Put是Spd和Spm的合成前体, 从本试验结果推测, 强势小花和弱势小花间Put与 Spd、Spm含量相反的现象可能与两者在 Put向Spd、Spm转化、合成上的不同有关, 弱势小花可能Put向Spd、Spm转化能力较弱, 造成了小花中大量Put积累, 造成对其生长的不利影响, 此时外源施用Put加剧了这一过程, 造成弱势小花大量退化, 可孕小花比率显著下降。
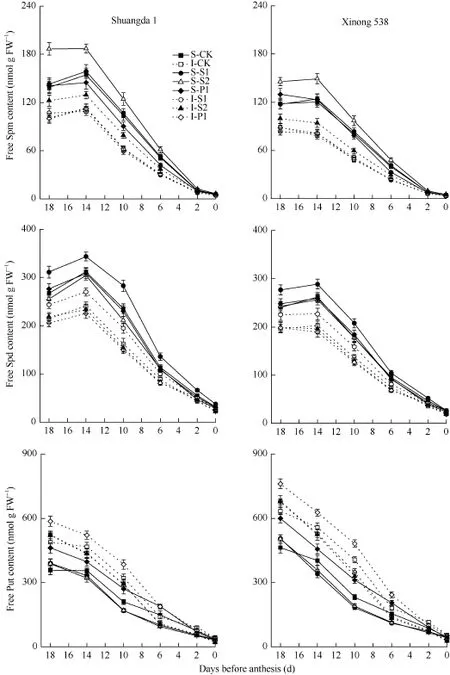
图4 外源多胺对小麦小花内源多胺含量的影响(2013-2014)Fig. 4 Effect of exogenous polyamines on endogenous PA contents in wheat floret (2013-2014)S: 强势小花; I: 弱势小花; S1: 施用1 mmol L-1Spd; S2: 施处理对不同部位枝梗上用1 mmol L-1Spm; P1: 施用2 mmol L-1Put; CK: 对照(清水)。S: superior floret; I: inferior floret; S1: 1 mmol L-1exogenous Spd applied; S2: 1 mmol L-1exogenous Spm applied; P1: 2 mmol L-1exogenous Put applied; CK: control.

图5 外源多胺对小麦小花内源激素含量的影响(2013-2014)Fig. 5 Effect of exogenous polyamines on endogenous hormone contents in wheat floret (2013-2014)S: 强势小花; I: 弱势小花; S1: 施用1 mmol L-1Spd; S2: 施用1 mmol L-1Spm; P1: 施用2 mmol L-1Put; CK: 对照(清水)。S: superior floret; I: inferior floret; S1: 1 mmol L-1exogenous Spd applied; S2: 1 mmol L-1exogenous Spm applied; P1: 2 mmol L-1exogenous Put applied; CK: control.

图6 外源多胺对小麦小花可溶性总糖和蛋白含量的影响(2013-2014)Fig. 6 Effects of exogenous polyamines on soluble sugar and protein contents in wheat floret (2013-2014)S: 强势小花; I: 弱势小花; S1: 施用1 mmol L-1Spd; S2: 施用1 mmol L-1Spm; P1: 施用2 mmol L-1Put; CK: 对照(清水)。S: superior floret; I: inferior floret; S1: 1 mmol L-1exogenous Spd applied; S2: 1 mmol L-1exogenous Spm applied; P1: 2 mmol L-1exogenous Put applied; CK: control.
3.2多胺对小麦小花退化的调控与激素的关系
多胺的合成前体为蛋氨酸, 与ETH相同, 这暗示多胺的代谢可能与ETH存在密切联系。外源施用Spd能抑制番茄或李果实中ETH的产生, 使用ACC合成酶抑制剂处理水稻植株能促进多胺合成[27]。本研究发现外源 Spd和 Spm显著降低了弱势小花中ETH释放量, 而外源 Put显著提高了弱势小花中ETH释放量, 这与本课题组在小麦籽粒灌浆中的研究结果[28]类似。ETH显著抑制禾谷类作物小花发育,在小麦、玉米及水稻的研究中均发现ETH显著降低可孕花数目和穗粒数[14-16]。这表明外源Spd和Spm对小麦弱势小花退化的抑制作用可能与其对ETH释放量的抑制作用有关, 而外源 Put可能通过促进小花中ETH释放量加剧了小麦弱势小花退化。
ABA和 CTK参与了对水稻、小麦等禾谷类作物小花退化的调控[2,4,14]。外源多胺可以提高内源ABA浓度[3]; 外源Spd和Spm可以显著提高水稻弱势籽粒 Z+ZR含量, 而 Spd和 Spm合成抑制剂MGBG能显著降低水稻弱势籽粒Z+ZR含量[22]。这表明多胺与ABA、CTK代谢间关系密切。本研究发现外源Spd、Spm和Put对强势小花中ABA和Z+ZR含量无显著影响, 但是Spd和Spm显著提高了弱势小花中 Z+ZR和 ABA含量, 而 Put对弱势小花中Z+ZR含量无显著影响, 但是其显著提高了弱势小花中ABA含量, 且P1处理小花中ABA含量显著高于S1和S2处理。这表明, 多胺对弱势小花发育的调控可能与内源Z+ZR和ABA关系密切, 但是并不是仅与某一种激素有关。通过将ABA和Z+ZR做比值发现, 外源 Spd和 Spm显著提高了弱势小花(Z+ZR)/ABA值, 而外源Put则显著降低了弱势小花(Z+ZR)/ABA值(图7), 这表明外源多胺对弱势小花退化的调控可能与其对ABA、Z+ZR之间比值的调控有关, 其通过调控 ABA、Z+ZR的平衡关系调控小麦小花退化。

图7 外源多胺对小麦弱势小花Z+ZR与ABA比值的影响(2013-2014)Fig. 7 Effects of exogenous polyamines on the ratio of Z+ZR to ABA in inferior floret of wheat (2013-2014)S1: 施用1 mmol L-1Spd; S2: 施用1 mmol L-1Spm; P1: 施用2 mmol L-1Put; CK: 对照(清水)。S1: 1 mmol L-1exogenous Spd applied; S2: 1 mmol L-1exogenous Spm applied; P1: 2 mmol L-1exogenous Put applied; CK: control.
植物生长发育过程很多是受到多种激素平衡的影响, 而不是受到某一种特定激素的调控[29]。本研究结果显示, 多胺对小麦小花退化的调控与 ETH、ABA和Z+ZR存在密切关系, 可能是多胺与这些激素间的平衡调控着小麦小花的退化, 这些激素或生长调节物质间的相互关系, 还需要进行进一步的深入研究。
3.3多胺对小麦小花退化的调控与碳氮代谢的关系
谈桂露等[30]推测内源多胺可能是通过调节籽粒蔗糖-淀粉代谢途径关键酶活性实现对籽粒灌浆的调节, Yang等[22]报道Spm和Spd能够显著提高水稻弱势粒蔗糖合成酶等碳代谢相关酶活性从而促进弱势粒淀粉合成。本课题组研究表明, 在小麦籽粒灌浆过程中, 外源Spd和Spm能显著提高小麦叶绿素含量及净光合速率, 影响植株碳氮代谢[31]。在本研究中, 外源Spd、Spm和Put对强势小花可溶性总糖和可溶性蛋白含量均无显著影响, 但是, 外源 Spd 和Spm显著提高了弱势小花中可溶性总糖和可溶性蛋白含量, 而外源 Put显著降低了弱势小花中可溶性总糖含量。有研究认为, 小麦小花退化的主要原因是对植株营养的竞争, 由于开花前茎、穗之间对有限营养资源的竞争, 造成穗部生长营养供应不足引起小花退化, 而弱势小花正因为对营养竞争的劣势造成其大量退化[1,3]。其中, 碳氮营养的供应最为重要。Serrago等[3]发现小麦可孕小花数目与碳水化合物含量呈正相关; 也有研究认为, 小花的大量退化并不受碳水化合物供给总量的限制, 而更多的与同化物在营养器官与穗中的分配比例有关[2]。氮肥可以延长穗分化的时间, 增加小穗小花的数目, 特别是药隔期至四分体期, 保证氮素营养可减少退化小花数, 增加结实粒数[2]。从这些研究我们推测, 外源多胺对小花退化的调控与其对小花碳氮营养的调控关系密切。外源Spd和Spm显著提高了弱势小花中碳氮含量, 保证了弱势小花发育过程中有比较充足的碳氮营养, 从而减少了弱势小花的退化, 而外源 Put显著降低了弱势小花中可溶性总糖含量, 这会加剧小花发育过程中营养的不足, 从而加剧小花退化。
多胺对小麦退化的调控与激素、植株碳氮营养均存在密切联系, 且多胺与激素、多胺与植株碳氮营养、激素与植株碳氮影响之间均关系密切, 表明多胺可能通过多种途径参与了对小麦小花退化的调控, 其可能是小花退化的调控因子网络中的重要一环。但是关于多胺对小麦小花退化的调控机理以及各种调控途径之间的相互关系, 还需进一步研究。
4 结论
外源多胺显著影响小麦小花退化, Spd和 Spm作用相似, 而Put作用相反, 其效应与小花穗位有关,对小穗上部弱势小花的影响明显, 而对小穗下部强势小花无显著影响。施用外源Spd和Spm后, 小麦小花退化明显被抑制, 提高了可孕小花数; 小花内源激素含量, 如 Spd、Spm、Z+ZR, 以及 Z+ZR与ABA比值显著升高, 同时降低了内源ETH释放速率;弱势小花中可溶性总糖以及可溶性蛋白质含量显著提高。Spd和Spm通过提高弱势小花内源Z+ZR与ABA的比值、改善弱势小花碳氮营养促进了小麦弱势小花发育, 抑制了弱势小花的退化从而提高了可孕小花数及穗粒数。
References
[1] 王兆龙, 曹卫星, 戴廷波, 周琴. 不同穗型小麦品种小花发育与结实特性研究. 南京农业大学学报, 2000, 23(4): 9-12 Wang Z L, Cao W X, Dai T B, Zhou Q. Characteristics of floret development and grain set in three wheat genotypes of different spike sizes. J Nanjing Agric Univ, 2000, 23(4): 9-12 (in Chinese with English abstract)
[2] 倪英丽. 小麦小花发育差异性的生理基础及栽培措施调控研究. 山东农业大学博士学位论文, 山东泰安, 2013 Ni Y L. Differences in Physiological Basis of Floret Development and Response to Cultivation Regulation in Wheat. PhD Dissertation of Shandong Agricultural University, Tai'an, China, 2013 (in Chinese with English abstract)
[3] Serrago A R, Miralles D J, Slafer G A. Floret fertility in wheat as affected by photoperiod during stem elongation and removal of spikelets at booting. Eur J Agron, 2008, 28: 301-308
[4] 王兆龙, 曹卫星, 戴廷波. 小麦小花两极分化中内源植物激素与糖氮含量的变化特征. 作物学报, 2001, 27: 447-452 Wang Z L, Cao W X, Dai T B. Changes of endogenous plant hormones and soluble sugars and proteins during floret development and degeneration in wheat. Acta Agron Sin, 2001, 27:447-452 (in Chinese with English abstract)
[5] Liu H P, Dong B H, Zhang Y Y, Liu Z P, Liu Y L. Relationship between osmotic stress and the levels of free, conjugated and bound polyamines in leaves of wheat seedlings. Plant Sci, 2004,166: 1261-1267
[6] Tomosugi M, Ichihara K, Saito K. Polyamines are essential for the synthesis of 2-ricinoleoyl phosphatidic acid in developing seeds of castor. Planta, 2006, 223: 349-358
[7] 武维华. 植物生理学(第2版). 北京: 科学出版社, 2008 Wu W H. Plant Physiology (2nd edn). Beijing: Science Press,2008 (in Chinese)
[8] 田长恩, 梁承邺, 黄毓文, 刘鸿先. 水稻细胞质雄性不育系及其保持系幼穗发育过程中的多胺代谢. 植物生理学报, 1998,24: 333-339 Tian C E, Liang C Y, Huang Y W, Liu H X. Metabolism of polyamines during the development of panicles in cytoplasmic male-sterile line and its maintainer line in Oryza sativa L. Acta Phytol Sin, 1998, 24: 333-339 (in Chinese with English abstract)
[9] 田长恩, 梁承邺. 多胺对水稻CMS系及其保持系幼穗蛋白质、核酸和活性氧代谢的影响. 植物生理学报, 1999, 25: 222-228 Tian C E, Liang C Y. Effect of polyamine on the metabolism of protein, DNA, RNA and activated oxygen in the panicles of CMS rice and its maintainer line. Acta Phytol Sin, 1999, 25: 222-228 (in Chinese with English abstract)
[10] 冯剑亚, 余炳果, 曹大铭. 光敏核不育水稻幼穗发育过程中多胺的变化. 南京农业大学学报, 1991, 14(1): 12-16 Feng J Y, Yu B G, Cao D M. Changes of polyamines in young panicles of PGMR during their development. J Nanjing Agric Univ, 1991, 14(1): 12-16 (in Chinese with English abstract)
[11] 冯剑亚, 余炳果, 曹大铭. 乙烯利和氯化钻对光敏核不育水稻育性及幼穗中多胺和乙烯含量的影响. 南京农业大学学报,1992, 15(2): 127-129 Feng J Y, Yu B G, Cao D M. Effects of ethrel and cobalt chloride of fertility and polyamine and ethylene content of young panicles in PGMR. J Nanjing Agric Univ, 1992, 15(2): 127-129 (in Chinese with English abstract)
[12] Ma R, Zhang M, Li B, Du G, Wang J, Chen J. The effects of exogenous Ca2+on endogenous polyamine levels and droughtresistant traits of spring wheat grown under arid conditions. J Arid Environ, 2005, 63: 177-190
[13] Biesaga K J, Koscielniak J, Filek M, Krekule M J, Kubon M M. The effect of plant growth regulators and their interaction with electric current on winter wheat development. Acta Physiol Plant,2010, 32: 987-995
[14] Yang J C, Zhang J H, Liu K, Wang Z Q, Liu L J. Abscisic Acid and Ethylene Interact in rice spikelets in response to water stress during meiosis. J Plant Growth Regul, 2007, 26: 318-328
[15] 王志敏, 王树安, 苏宝林. 乙烯对小麦小花发育和结实的影响.种子, 1996, (2): 13-15 Wang Z M, Wang S A, Su B L. The effect of ethylene on floret development and grain set in wheat. Seed, 1996, (2): 13-15 (in Chinese with English abstract)
[16] 王海永, 陈小文, 牛晓雪, 苏贺, 申婷婷, 董学会. 乙烯利对夏玉米果穗生长发育影响及生理机制探究. 玉米科学, 2014,22(5): 64-70 Wang H Y, Chen X W, Niu X X, Su H, Shen T T, Dong X H. Influence of ethephon on maize cluster growth and development and the physiological mechanism. J Maize Sci, 2014, 22(5):64-70 (in Chinese with English abstract)
[17] 杨建昌, 刘凯, 张慎凤, 王学明, 王志琴, 刘立军. 水稻减数分裂期颖花中激素对水分胁迫的响应. 作物学报, 2008, 34:111-118 Yang J C, Liu K, Zhang S F, Wang X M, Wang Z Q, Liu L J. Hormones in rice spikelets in responses to water stress during meiosis. Acta Agron Sin, 2008, 34: 111-118 (in Chinese with English abstract)
[18] Huang S, Cerny R E, Qi Y L, Bhat D, Aydt C M, Hanson D D,Malloy K P, Ness L A. Transgenic studies on the involvement of cytokinin and gibberellin in male development. Plant Physiol,2003, 131: 1270-1282
[19] Ashikari M, Sakakibara H, Lin S, Yamamoto T, Takashi T, Nishimura A, Angeles E R, Qian Q, Kitano H, Matsuoka M. Cytokinin oxidase regulates rice grain production. Science, 2005, 309:741-745
[20] Pieruzzi F P, Dias L L C, Balbuena T S, Santa-Catarina C, Dos S A L, Floh E I. Polyamines, IAA and ABA during germination in two recalcitrant seeds: Araucaria angustifolia (Gymnosperm) and Ocotea odorifera (Angiosperm). Ann Bot, 2011, 108: 337-345
[21] Upreti K K, Murti G S R. Response of grape rootstocks to Salinity: changes in root growth, polyamines and abscisic acid. Biol Plant, 2010, 54: 730-734
[22] Yang J C, Cao Y Y, Zhang H, Liu L, Zhang J H. Involvement of polyamines in the post-anthesis development of inferior an superior spikelets in rice. Planta, 2008, 228: 137-149
[23] 刘俊, 吉晓佳, 刘友良. 检测植物组织中多胺含量的高效液相色谱法. 植物生理学通讯, 2008, 38: 596-598 Liu J, Ji X J, Liu Y L. High performance liquid chromatographymethod for measuring polyamine content in plant tissue. Plant Physiol Commun, 2008, 38: 596-598 (in Chinese with English abstract)
[24] Yang J C, Zhang J H, Wang Z Q, Zhu Q S, Wang W. Hormonal changes in the grains of rice subjected to water stress during grain filling. Plant Physiol, 2001, 127: 315-323
[25] 张蜀秋. 植物生理学实验技术教程. 北京: 科学出版社, 2011 Zhang S Q. Techniques for Plant Physiology Experiment. Beijing Science Press, 2011 (in Chinese)
[26] Ning H F, Liu Z H, Wang Q S, Lin Z M, Chen S J, Li G H, Wang S H, Ding Y F. Effect of nitrogen fertilizer application on grain phytic acid and protein concentrations in japonica rice and its variations with genotypes. J Cereal Sci, 2009, 50: 49-55
[27] 张木清, 陈如凯. 作物抗旱分子生理与遗传改良. 北京: 科学出版社, 2005. pp 172-174 Zhang M Q, Chen R K. The Molecular Physiological Mechanism and Genetic Improvement for Drought Resistance of Crops. Beijing: Science Press, 2005. pp 172-174 (in Chinese)
[28] Liu Y, Gu D D, Wu W, Wen X X, Liao Y C. The relationship between polyamines and hormones in the regulation of wheat grain filling. PLoS One, 2013, 8: e78196
[29] Liu Y, Ding Y F, Wang Q S, Meng D X, Wang S H. Effects of nitrogen and 6-benzylaminopurine on rice tiller bud growth and changes in endogenous hormones and nitrogen. Crop Sci, 2011,51: 786-792
[30] 谈桂露, 张耗, 付景, 王志琴, 刘立军, 杨建昌. 超级稻花后强、弱势粒多胺浓度变化及其与籽粒灌浆的关系. 作物学报,2009, 35: 2225-2333 Tan G L, Zhang H, Fu J, Wang Z Q, Liu L J, Yang Y C. Post-anthesis changes in concentrations of polyamines in superior and inferior spikelets and their relation with grain filling of super rice. Acta Agron Sin, 2009, 35: 2225-2333 (in Chinese with English abstract)
[31] 刘杨, 温晓霞, 顾丹丹, 郭强, 曾爱, 李长江, 廖允成. 多胺对冬小麦籽粒灌浆的影响及其生理机制. 作物学报, 2013, 39:712-719 Liu Y, Wen X X, Gu D D, Guo Q, Zeng A, Li C J, Liao Y C. Effect of polyamine on grain filling of winter wheat and its physiological mechanism. Acta Agron Sin, 2013, 39: 712-719 (in Chinese with English abstract)
Effect of Exogenous Polyamines on Mechanism of Floret Degeneration in Wheat
LYU Xiao-Kang, WEN Xiao-Xia, LIAO Yun-Cheng, and LIU Yang*
College of Agronomy, Northwest A&F University, Yangling 712100, China
Kernel number per spike has a close relationship with floret degeneration in wheat, which is regulated greatly by polyamines (PAs), one of important plant growth regulators. In this study, we applied exogenous spermine (Spm), spermidine (Spd) and putrescine (Put) to the young spikes of cultivars Shuangda 1 (large-spike type) and Xinong 538 (small-spike type) to investigate the effects of PAs on floret degeneration, endogenous hormones, and the carbon and nitrogen changes in wheat floret. The results indicated that exogenous Spd and Spm had similar effects on floret degeneration whereas exogenous Put was in function. In the treatments with external Spd and Spm applied, the floret degeneration was inhibited and the number of fertile florets increased significantly. In the external Put treatment, floret degeneration aggravated and the fertile floret number decreased significantly. Such influence by external PAs was different in upper and lower florets of a spike and the upper florets (inferior florets)showed greater effects than the lower ones (superior florets). The concerntrations of endogenous Spd and Spm, zeatin (Z) + zeatin ridoside (ZR), and the ratio of Z+ZR-to-abscisic acid (ABA) in inferior florets increased after applying exogenous Spd and Spm. However, the evolution rate of endogenous ethylene (ETH) in inferior floret decreased. As a result, the total soluble sugar and protein contents increased significantly in inferior floret. In contrast, exogenous Put showed reverse effects compared to Spd and Spm. Our results indicate that PAs were involved in the regulation of floret degeneration by changing the endogenous hormone concerntrations and the carbon and nitrogen metabolism in wheat plants.
Polyamine; Wheat; Floret degeneration; Hormone; Total soluble sugar; Soluble protein
10.3724/SP.J.1006.2016.01391
本研究由国家自然科学基金项目(31301260), 国家科技支撑计划项目(2015BAD22B03-05)和中国博士后科学基金面上项目(2015M572604)资助。
This study was supported by the National Natural Science Foundation of China (31301260), the National Key Technology R&T Program of China (2015BAD22B03-05), and the China Postdoctoral Science Foundation (2015M572604).
(Corresponding author): 刘杨, E-mail: liuyang0328@126.com, Tel: 029-87082291
联系方式: E-mail: 1175780812@qq.com
Received(): 2015-11-29; Accepted(接受日期): 2016-05-09; Published online(网络出版日期): 2016-05-30.
URL: http://www.cnki.net/kcms/detail/11.1809.S.20160530.0905.010.html
