1株阴沟肠杆菌临床分离株对亚胺培南耐药机制的研究*
2016-09-21田鹏鹏朱丽莎
田鹏鹏,朱丽莎,艾 彪,马 青,田 甜
(长江大学附属第一医院:1.检验科;2.眼科,湖北荆州 434000)
·经验交流·
1株阴沟肠杆菌临床分离株对亚胺培南耐药机制的研究*
田鹏鹏1,朱丽莎1,艾彪1,马青1,田甜2△
(长江大学附属第一医院:1.检验科;2.眼科,湖北荆州 434000)
目的探讨阴沟肠杆菌临床分离株对亚胺培南的耐药机制。方法采用微量肉汤稀释法测定最低抑菌浓度(MIC)值,用改良Hodge试验检测碳青霉烯酶;PCR扩增检测碳青霉烯酶(blaKPC、blaIMP-1、blaIMP-2、blaVIM-1、blaVIM-2)编码基因和广谱及超广谱β-内酰胺酶(blaTEM、blaSHV、blaCTX-M-1、blaCTX-M-2、blaCTX-M-9)编码基因;耐药基因水平传播采用质粒结合试验。结果阴沟肠杆菌临床分离株除对阿米卡星、环丙沙星、加替沙星、左氧氟沙星敏感及妥布霉素中介外,对所有β-内酰胺类抗菌药物、庆大霉素、四环素、甲氧苄啶/磺胺甲恶唑等抗菌药物均耐药。改良Hodge试验为阳性。PCR扩增5种碳青霉烯酶基因和5种广谱及超广谱β-内酰胺酶基因,显示blaTEM基因扩增阳性,其余基因扩增阴性。质粒接合试验成功传递了对碳青霉烯类抗菌药物的耐药性,接合子菌株相较于阴沟肠杆菌临床株,呈现出低水平耐药。结论此分离株产碳青霉稀酶,携带TEM基因,并可以经质粒转导播散。
质粒;肠杆菌,阴沟;接合试验;碳青霉稀酶;耐药机制
由于抗菌药物的广泛使用,阴沟肠杆菌的耐药菌株也呈现逐年上升趋势。目前阴沟肠杆菌对碳青霉烯类抗菌药物耐药的主要机制有3种:(1)碳青霉烯酶的产生,包括KPC酶、IMI酶、金属酶(IMP酶、VIM酶)等;(2)外膜蛋白的缺失或数量的减少伴有质粒或染色体介导高水平β-内酰胺酶(AmpC酶、超广谱β-内酰胺酶等)的持续产生;(3)药物作用靶位的改变[1-5]。本研究主要探讨本科室内分离的1株阴沟肠杆菌对亚胺培南耐药的机制。
1 材料与方法
1.1材料
1.1.1菌株来源亚胺培南耐药的阴沟肠杆菌来源于住院患者的胸、腹腔积液。大肠埃希菌ATCC25922购自中国微生物菌种保存中心。利福平耐药的大肠埃希菌EC600用于结合试验的受体菌,以及本科室已经鉴定为亚胺培南敏感的阴沟肠杆菌。
1.1.2仪器和试剂Microscan Walkaways96SI微生物自动鉴定仪(美国德灵公司);琼脂糖凝胶电泳仪(美国Bio-Rad公司);亚胺培南药敏纸片(英国OXOID公司);PCR仪(德国Eppendorf公司);PCR引物(上海桑尼生物科技有限公司合成);PCR反应相关试剂[宝生物工程(大连)有限公司]。
1.2方法
1.2.1药敏试验采用微量肉汤稀释法测定细菌的最低抑菌浓度(minimal inhibitory concentration,MIC),亚胺培南耐药菌株经纸片扩散法进一步确证,判断标准参照美国临床实验室标准化协会(CLSI)2013。
1.2.2改良Hodge试验参照CLSI M100-S23的标准进行改良Hodge试验。
1.2.3细菌总DNA的提取从37 ℃过夜培养的血琼脂平板上,挑取单个菌落2~4个,放入到500 μL生理盐水中,100 ℃煮沸10 min,12 000 r/min,离心5 min,留取上清液即为模版。
1.2.4PCR扩增β-内酰胺酶基因PCR引物序列参照文献,引物由上海桑尼生物科技有限公司合成。引物序列见表1。
1.2.5质粒接合试验参照文献[6],稍作改动,接合试验在肉汤培养基中进行。(1)将供体菌和受体菌EC600分别划线接种于血平板上,35 ℃孵育过夜。次日,挑取单个菌落分别接种于5.0 mL MH肉汤培养基中,35 ℃震荡培养4 h。(2)取各0.5 mL的供体菌和受体菌加入到4.0 mL LB肉汤中35 ℃静置孵育过夜。(3)取0.1 mL的混合菌液涂布于含利福平(256 mg/L)和不同浓度梯度亚胺培南的MH平板上,浓度梯度为16、8、4、2、1 mg/L,35 ℃孵育过夜,同时用受体菌和供体菌做对照试验。(4)次日观察筛选平板上是否有克隆生长,筛选所得的接合子菌株用Microscan Walkaways 96SI鉴定。
2 结 果
2.1药敏试验结果阴沟肠杆菌分离株经微量肉汤稀释法测得对亚胺培南的MIC>8 μg/mL,为耐药,然后经手工KB法确证,得到其抑菌环直径为10 mm,为耐药,同时测得接合子和大肠EC600对亚胺培南的抑菌圈分别为12 mm和30 mm,见图1。阴沟肠杆菌临床分离株除对阿米卡星、环丙沙星、加替沙星、左氧氟沙星敏感及妥布霉素中介外,对所有β-内酰胺类抗菌药物、庆大霉素、四环素、甲氧苄啶/磺胺甲恶唑等抗菌药物均耐药。见表1。
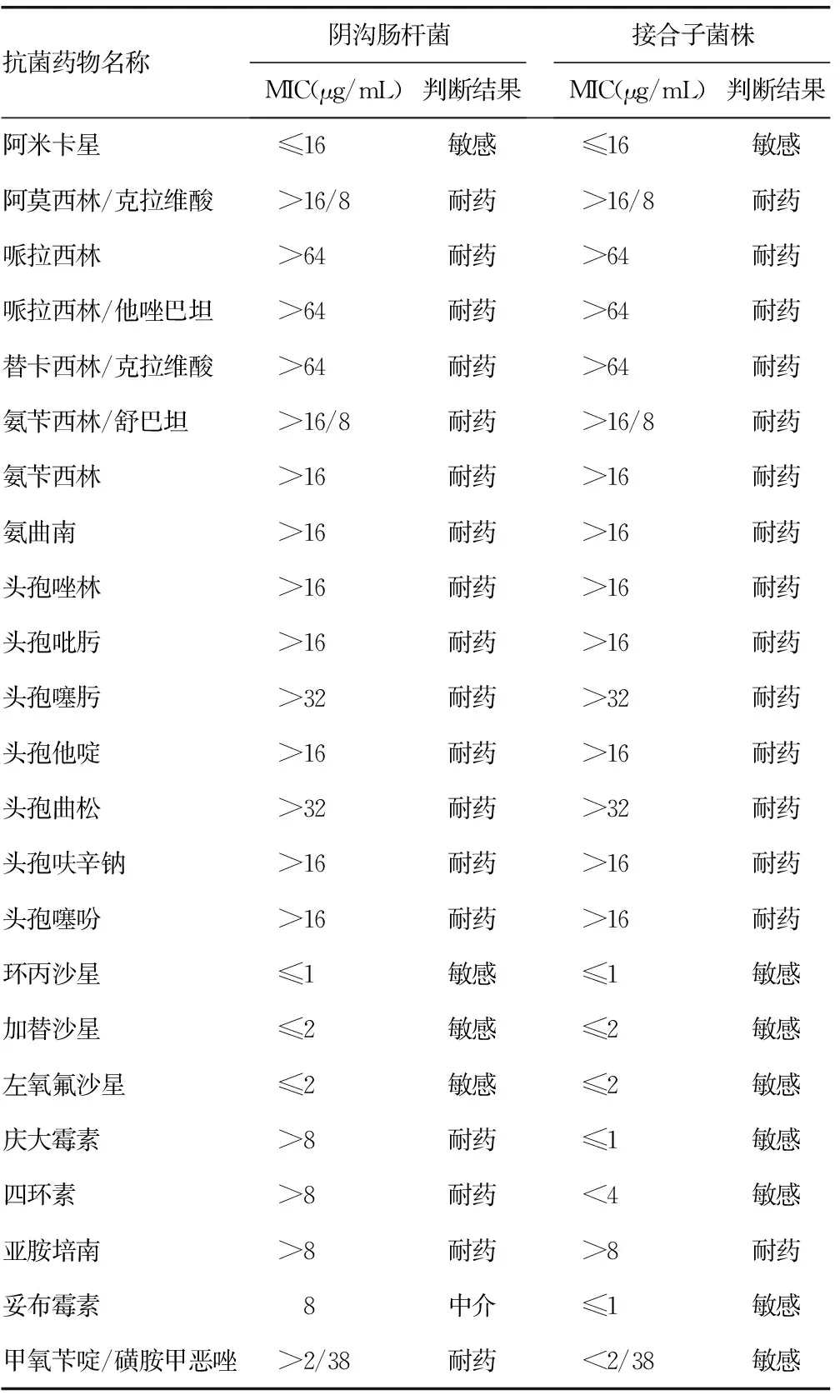
表1 阴沟肠杆菌及其接合子菌株的药敏表型
2.2改良Hodge试验结果改良Hodge试验如图2所示,1为肺炎克雷伯杆菌临床株改良Hodge试验阴性,2、3为阴沟肠杆菌分离株改良Hodge试验阳性。
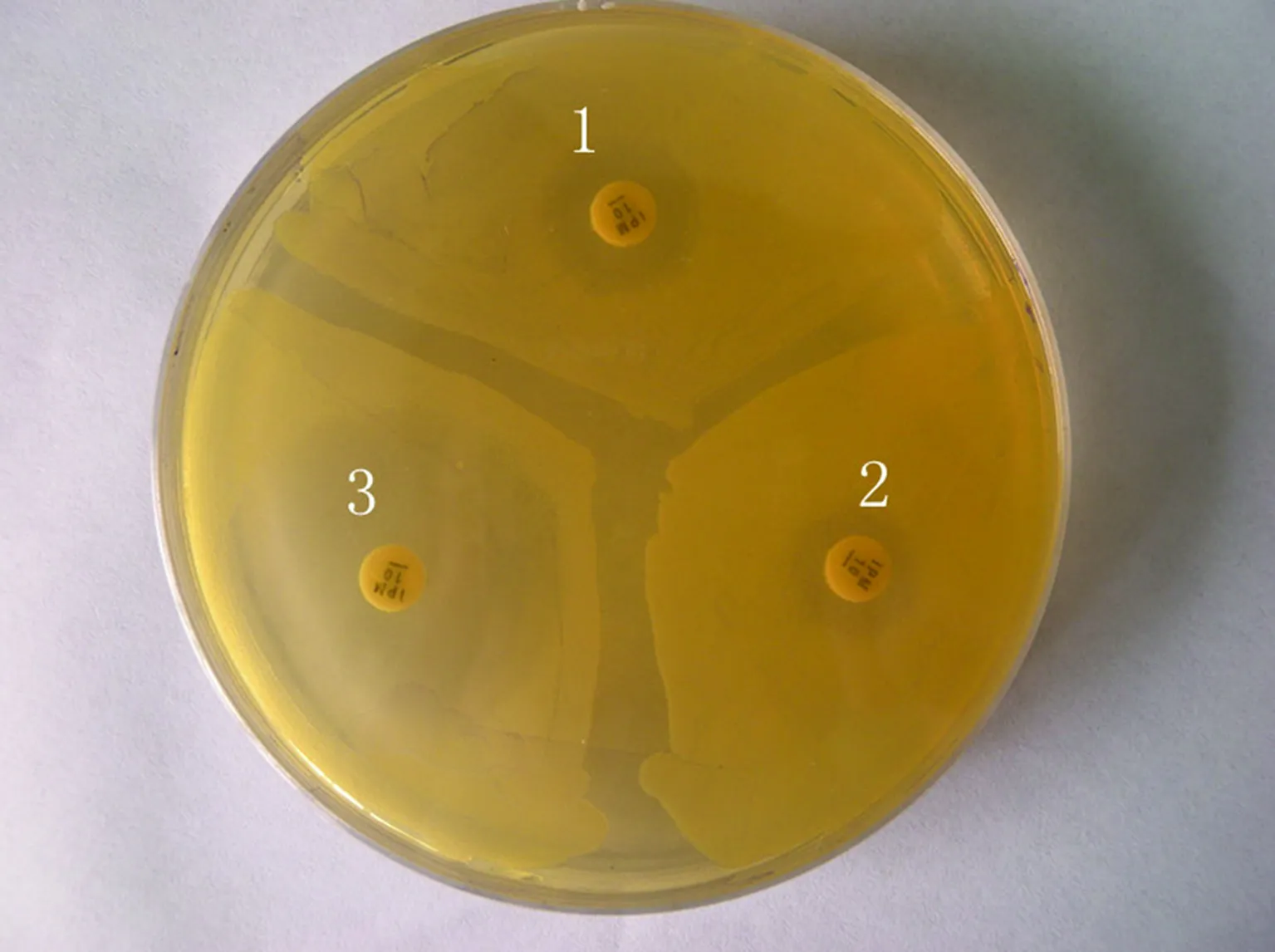
1:接合子菌株对亚胺培南的耐药情况;2:供体菌阴沟肠杆菌对亚胺培南的耐药情况;3:受体菌大肠EC600对亚胺培南的耐药情况。
图1纸片扩散法结果
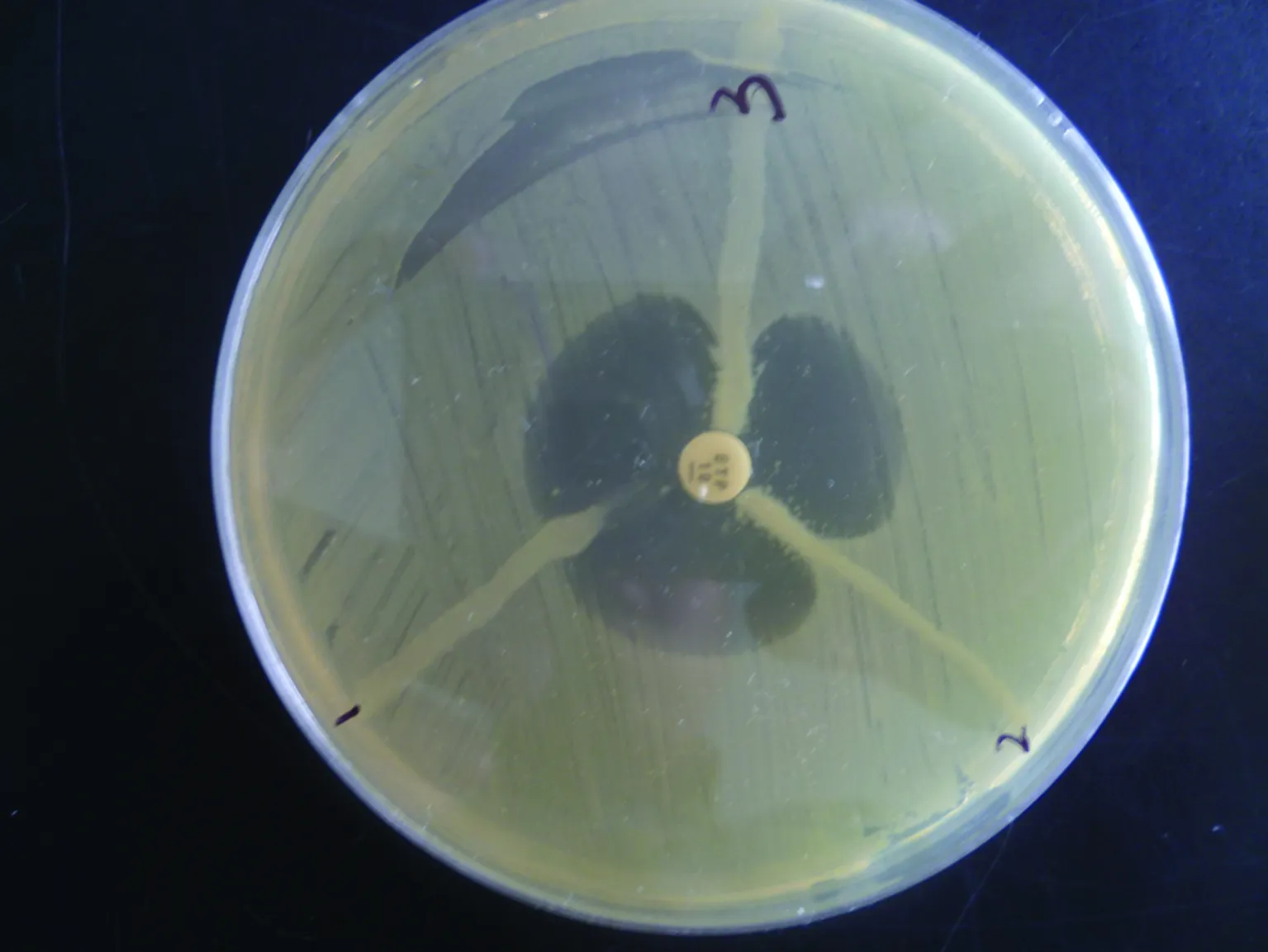
中间为厄他培南药敏纸片。1:已知对亚胺培南敏感的临床株,显示结果为阴性;2、3:均为阴沟肠杆菌临床分离株,显示结果为阳性。
图2改良Hodge试验图
2.3PCR扩增β-内酰胺酶基因结果对阴沟肠杆菌临床株进行耐药基因的扩增,包括5种碳青酶烯酶基因blaKPC、blaIMP-1、blaIMP-2、blaVIM-1、blaVIM-2和5种广谱及超广谱β-内酰胺酶基因blaTEM、blaSHV、blaCTX-M-1、blaCTX-M-2、blaCTX-M-9。发现在此株阴沟肠杆菌中仅检出blaTEM,凝胶电泳上明显可见大小为630 bp的PCR产物,扩增结果见表2、图3。

表2 PCR引物序列及产物长度

续表2 PCR引物序列及产物长度
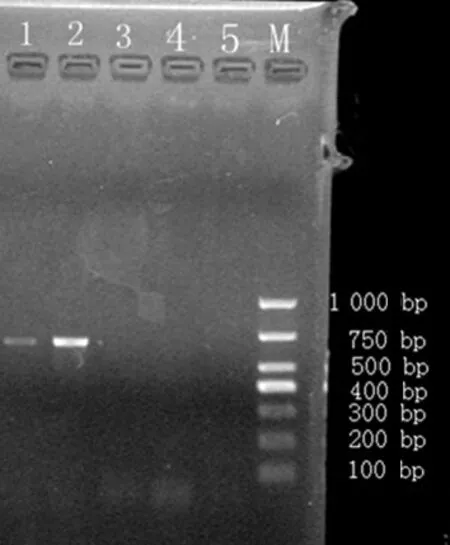
1:接合子菌株;2:阴沟肠杆菌临床株;3、4:科室内亚胺培南敏感的阴沟肠杆菌;5:大肠埃希菌EC600;M:Marker。
图3阴沟肠杆菌菌株blaTEM扩增产物电泳图
2.4接合试验阴沟肠杆菌的接合试验成功,分离出接合子菌株,接合子菌株经Microscan Walkaways 96SI鉴定为大肠埃希菌,其药敏结果见表1,相较于阴沟肠杆菌临床株,接合子菌株对庆大霉素、四环素、甲氧苄啶/磺胺、妥布霉素甲恶唑的药敏结果均变为敏感,呈现出低水平耐药。接合子菌株扩增出TEM基因,扩增结果见图3。
3 讨 论
随着抗菌药物的大量使用以至于滥用,细菌耐药现象日益加重。在社区或是医院感染中,肠杆菌科细菌都是重要的病原菌,其多重耐药菌如产超广谱β-内酰胺酶菌株常常会对常见抗菌药物耐药。碳青霉烯类抗菌药物具有抗菌谱广、杀菌活性强的特点,常常作为多重耐药的肠杆菌科细菌的最后一道防线。因此,对碳青霉烯类耐药的问题理应引起人们的高度重视。
目前碳青霉烯类抗菌药物主要包括亚胺培南、美罗培南、厄他培南等,并且对于肠杆菌科细菌而言,若对厄他培南中介或是耐药应视为对亚胺培南和美罗培南同时耐药[7]。
本研究从临床中分离到的1株阴沟肠杆菌,药敏结果显示此株阴沟肠杆菌对亚胺培南耐药,而且为多重耐药菌株,仅对阿米卡星、氟喹诺酮类敏感,对其他常见抗菌药物均耐药,因为qnrB2和blaKPC可以共同存在于一个质粒上,同时介导对碳青霉烯类药物的耐药和对喹诺酮类药物的敏感[8]。改良Hodge试验结果显示为阳性,提示分离株可能产碳青霉烯酶或产多种β-内酰胺酶合并外膜蛋白的缺失。本研究进一步扩增5种常见的碳青霉烯酶(blaKPC、blaIMP-1、blaIMP-2、blaVIM-1、blaVIM-2)基因和5种常见的广谱和超广谱β-内酰胺酶(blaTEM、blaSHV、blaCTX-M-1、blaCTX-M-2、blaCTX-M-9组超广谱β-内酰胺酶)基因,发现此株阴沟肠杆菌为产blaTEM型广谱酶,与文献[9-11]检出不尽一样,提示阴沟肠杆菌的耐药机制有地区和菌株来源的差异,有遗传和抗菌药物的选择性等方面差异。通过对阴沟肠杆菌临床株和接合子菌株的药敏结果对比发现,阴沟肠杆菌临床株成功地将对碳青霉烯类和其他β-内酰胺类抗菌药物的耐药性传递给受体菌,未传递对氨基糖苷类、四环素、甲氧苄啶/磺胺甲恶唑的耐药性,推测该质粒可能只携带介导编码β-内酰胺类抗菌药物耐药的基因,同时也不能排除接合子菌株不能表达对其他抗菌药物的耐药性。本研究对阴沟肠杆菌临床株和接合子菌株对亚胺培南的耐药性进行比较,由于仪器技术原因其在MIC上均为大于8 μg/mL,未能更加细致区分,但通过纸片扩散法测其抑菌圈大小,发现有微弱不同,前者为10 mm,后者为12 mm,以上均提示出质粒介导的接合子菌株耐药为低水平耐药。
对阴沟肠杆菌而言,与细菌耐药性相关的外膜孔道蛋白有OmpF和OmpC,据文献报道,阴沟肠杆菌对碳青霉烯类抗菌药物耐药主要表现为OmpF外膜孔道蛋白的缺失[6],本实验由于条件限制,未进行外膜蛋白的分析,有待进一步的研究来证实。
肠杆菌科细菌对碳青霉烯类抗菌药物耐药的主要原因是产碳青霉烯酶,这些酶大多是由质粒或是可移动的染色体介导,极易在不同菌属种中传播,造成对碳青霉烯类抗菌药物耐药性播散。因此,临床上需加强对耐药菌株尤其是多重耐药菌株的监测及细菌耐药机制的研究,更加清楚地了解细菌耐药性的传播和作用机制,为临床上预防多重耐药菌的播散及新型抗菌药物的研发提供基础。同时临床上要合理、正规、有效地使用抗菌药物,来减缓碳青霉烯类抗菌药物耐药性的转变。
[1]杜小幸,周志慧,俞云松,等.一种新的质粒介导的IMI-1型碳青霉烯酶[J].中华微生物学和免疫学杂志,2004,24(10):65-68.
[2]张肖,宋诗铎.2株阴沟肠杆菌临床分离株对碳青霉烯类抗生素耐药机制的研究[J].中国抗生素杂志,2011,36(4):303-306,314.
[3]Blanco VM,Rojas LJ,De La Cadena E,et al.First report of a nonmetallocarbapenemase class a carbapenemase in an enterobacter cloacae isolate from Colombia[J].Antimicrob Agents Chemother,2013,57(7):3457.
[4]Irene G,Maria S,Zoil C,et al.Characterization of a new integron containing blaVIM-1 and aac(6/)-Ⅱc in an enterobacter cloacae clinical isolate from Greece[J].J Antimicrob Chemother,2005,55(55):634-638.
[5]Queenan AM,Bush K.Carbapenemases:the versatile beta-lactamases[J].Clin Microbiol Rev,2007,20(3):440-458.
[6]蒯守刚,邵海枫,王卫萍,等.大肠埃希菌对碳青霉烯类药物的耐药机制研究[J].中华微生物学和免疫学杂志,2010,30(9):829-833.
[7]Anderson KR,Lonsway DR,Rasheed K,et al.Evaluation of methods to identify the Klebesilla pneumoniae carbapenemase in enterobaeteriaceae[J].Clin Microbiol,2007,45(8):2723-2725.
[8]Chmelnitsky I,Navon-Venezia S,Strahilevitz J,et al.Plasmid-mediated qurB2 and carbapenemase gene blaKPC-2 carried on the same plasmid in carbapenem-resistant ciprofloxacin-susceptible enterobacter cloacae isolates[J].Antimicrob Agents Chemother,2008,52(8):2962-2965.
[9]蔡加昌,周宏伟,陈功祥,等.一株耐碳青霉烯类的阴沟肠杆菌的KPC酶检测[J].中华医学杂志,2008,88(2):135-138.
[10].施德仕,邵海枫,王卫萍,等.同一标本分离的2株碳青霉烯类耐药肠杆菌科细菌耐药机制相关性分析[J].中华微生物学和免疫学杂志,2011,31(5):417-420.
[11]Zurfluh K,Hachler H,Nuesch-Inderbinen M,et al.Characteristics of extend-spectrum β-lactermase and carbapenemase-producing enterobacteriaceae isolates from rivers and lakes in Switzerland[J].Appl Environ Microbiol,2013,79(9):3021-3026.
田鹏鹏(1987-),检验师,硕士,主要从事细菌耐药机制研究。△
,E-mail:dmtt-316@163.com。
10.3969/j.issn.1671-8348.2016.07.036
R446.5
B
1671-8348(2016)07-0970-04
2015-09-18
2015-11-26)
